红葡萄酒中花色苷衍生物结构研究进展
2018-03-20韩舜愈马腾臻
张 波,韩舜愈*,马腾臻,祝 霞,李 敏
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
葡萄酒因其悠久的历史,特殊的酿造工艺、产地及品质的挑剔性早已成为全球重要的酒精性饮料之一。随着社会经济的发展和人民生活水平的提高,葡萄酒越来越多地被国内外消费者接受和认可,购买和饮用葡萄酒成为一种追求时尚和健康的选择[1]。与此同时,人们对葡萄酒的品质也提出了新的要求。颜色作为红葡萄酒重要的感官指标之一,不仅可以反映葡萄酒酿造的工艺水平,也是影响消费者评判葡萄酒质量的关键视觉因素[2]。尽管葡萄酒的历史可以追溯到公元前5 500年[3],但是直到20世纪下半叶,伴随着多功能、高灵敏色谱和光谱技术的发展,人们才开始真正意义上对红葡萄酒中呈色物质的种类和性质有了基本的认识和了解[4],并在此基础上进行系统而深入的研究。
花色苷类化合物是红葡萄酒中主要的呈色物质。研究发现,葡萄果皮中的花色苷类物质在发酵阶段被浸渍进入酒体,并在整个葡萄酒的生产和贮藏环节中逐渐转化形成以花色苷及其衍生物为主要类型的花色苷体系,其种类、状态和含量决定了酒体的色泽特征和陈酿潜能[5],而对红葡萄酒中花色苷的研究也越来越多地引起了葡萄与葡萄酒产业科研人员的兴趣与重视。因此,认识和了解红葡萄酒中花色苷及其衍生物的结构类型特点,对研究红酒在发酵和陈酿过程中的颜色变化及色泽稳定性有着十分重要的意义。本文针对红葡萄酒中花色苷的基本结构、衍生物的结构特征、形成途径和理化性质等方面的研究现状与趋势进行论述,以期为葡萄酒中花色苷衍生物的结构研究提供有益参考和帮助。
1 红葡萄酒中花色苷的基本结构
红葡萄中的花色苷多存在于葡萄的果皮组织中,但在一些染色品种,如紫北塞、小北塞、烟73等的果肉细胞中也含有花色苷类成分[6-7]。此外,最新的研究显示,在某些成熟的白色葡萄品种中也检测到少量花色苷类物质[8]。新鲜红葡萄酒中的花色苷质量浓度因品种和酿造工艺而有差异,通常在200~500 mg/L之间,有时个别红酒的质量浓度还会达到2 000 mg/L以上[9]。在红葡萄酒陈酿期间,游离态和聚合态的花色苷质量浓度会发生规律性的变化,使得红葡萄酒的颜色逐渐由紫红或宝石红色向瓦红或砖红色转变。
从化学结构上来看,花色苷主要是花色素和各种糖分子通过糖苷键结合形成的糖基衍生物。作为苷元的花色素,其基本结构为2-苯基-苯并吡喃,因其与类黄酮类物质具有相同的C6-C3-C6碳架结构和生物合成途径,也被统称为类黄酮类化合物。到目前为止,自然界中已经发现的花色素有23 种[10],其中在葡萄及葡萄酒中鉴定出的有6 种,即花葵素、花青素、花翠素、3’-甲基花青素、3’-甲基花翠素和3’,5’-二甲基花翠素(图1和表1)[11]。
自然条件下葡萄果实中游离态的花色素极其罕见,一般都与1 个或多个糖分子连接形成花色苷。按糖基位置和数量的不同,可将花色苷分为3-O-单糖类花色苷、3,5-O-双糖类花色苷和3,7-O-双糖类花色苷等。对于欧亚种酿酒葡萄来说,3’,5’-二甲基花翠素-3-O-葡萄糖苷及其衍生物则是其中主要的色素类型。Nagel等[12]利用高效液相色谱分析发现3’,5’-二甲基花翠素-3-O-葡萄糖苷含量在赤霞珠和美乐葡萄酒中约占总花色苷含量的42%左右,而在歌海娜中占总量的90%以上[13]。相比酿酒葡萄而言,美洲种葡萄(河岸葡萄、沙地葡萄)、山葡萄和圆叶葡萄中的3,5-O-双葡萄糖苷则是其重要的显色特征物质[14]。但是近期的研究表明,在某些欧亚种葡萄中也可检测到3,5-O-双葡萄糖类花色苷甚至3,7-O-双葡萄糖类花色苷[15-16]。研究认为,糖分子可以增加花色素单体的化学稳定性和水溶性,但并不影响花色素的呈色反应,其颜色差异主要取决于结构中B环R1和R2位的取代基团。一般认为,OH取代数目越多,花色苷越偏向于蓝色色调,而OCH3数目越多,表现出的红色特征越明显[17]。
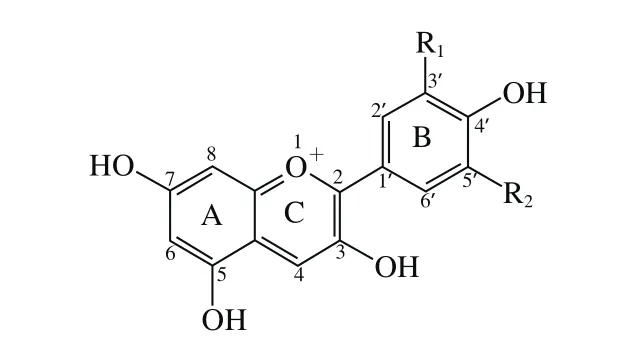
图1 花色素结构[11]Fig.1 Structure of anthocyanidins[11]
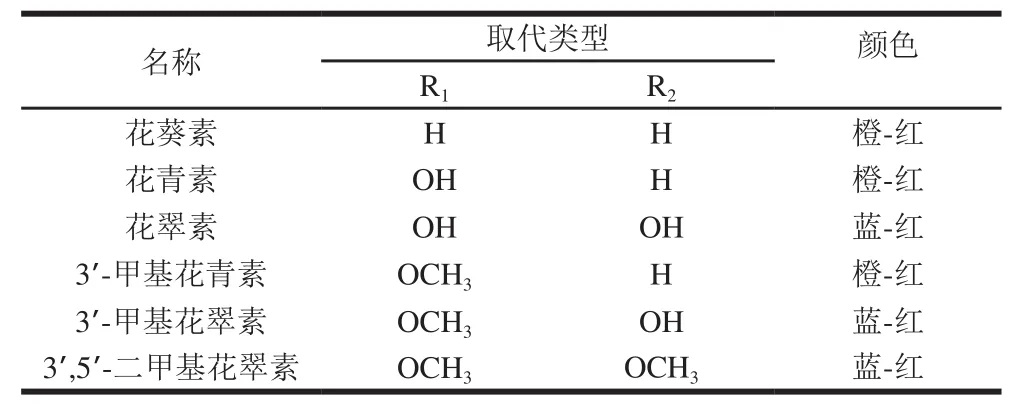
表1 花色素结构[11]Table1 Structure of anthocyanidins[11]
花色苷的糖分子上可酰化有机酸分子基团,形成较为稳定的酰基花色苷(图2)。酰化通常位于3-O-花色苷糖基的C6羟基处,但某些糖的C2、C3和C4羟基处也有发生酯化的酰化结构[18]。常见的具有酰化基团的花色苷主要为羟基肉桂酸类化合物,如对香豆酸、咖啡酸、阿魏酸和芥子酸;另外乙酸、草酸、丙二酸、苹果酸、琥珀酸也是较为常见的酰化分子[19];在酿酒葡萄中,乙酰、香豆酰和咖啡酰则是主要的酰化基团[20]。正是由于分子中羟基数目、甲氧基化程度、糖分子种类和酰基基团的性质、数量及位置的不同,才形成了数量众多和不同性质的花色苷种类;而这些基本花色苷在随后的发酵和陈酿过程中通过加成、环化或聚合等反应进一步形成了其他不同类型、不同颜色的花色苷类衍生物质[21]。
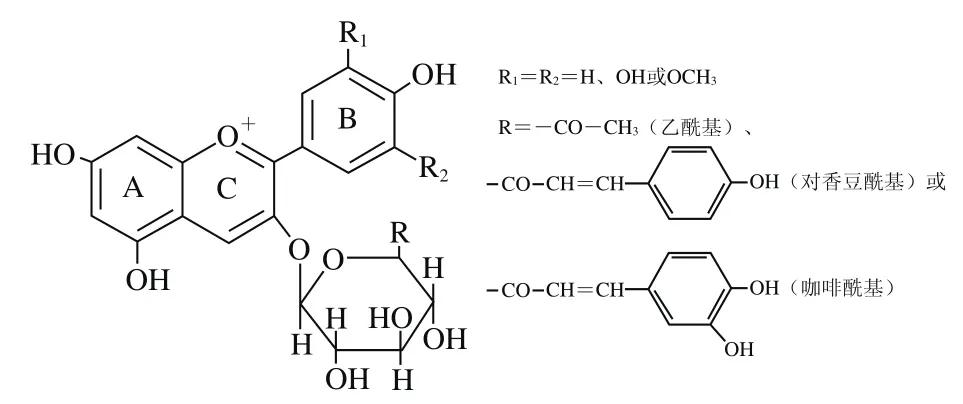
图2 酰化花色苷结构Fig.2 Structure of acylated anthocyanins
2 红葡萄酒中花色苷衍生物
随着陈酿的进行,干红葡萄酒中游离的花色苷类物质与酒中的一些多酚化合物缩合,形成分子质量较大的花色苷类衍生物。到目前为止,已发现4 种结构类型的花色苷(表2),主要包括吡喃型花色苷[22]、花色苷与黄烷醇直接连接形成的聚合花色苷(花色苷-黄烷醇(anthocyanin-flavanol,A-F)聚合物和黄烷醇-花色苷(flavanol-anthocyanin,F-A)聚合物)[23]、花色苷与酚类物质通过烷基基团连接形成的聚合花色苷(黄烷醇-烷基-花色苷(flavanol-alkyl-anthocyanin,F-alkyl-A)聚合物和花色苷-烷基-花色苷(anthocyanin-alkyl-anthocyanin polymer,A-alkyl-A)聚合物)[24],以及花色苷与鞣花单宁形成的聚合类花色苷衍生物等[25]。
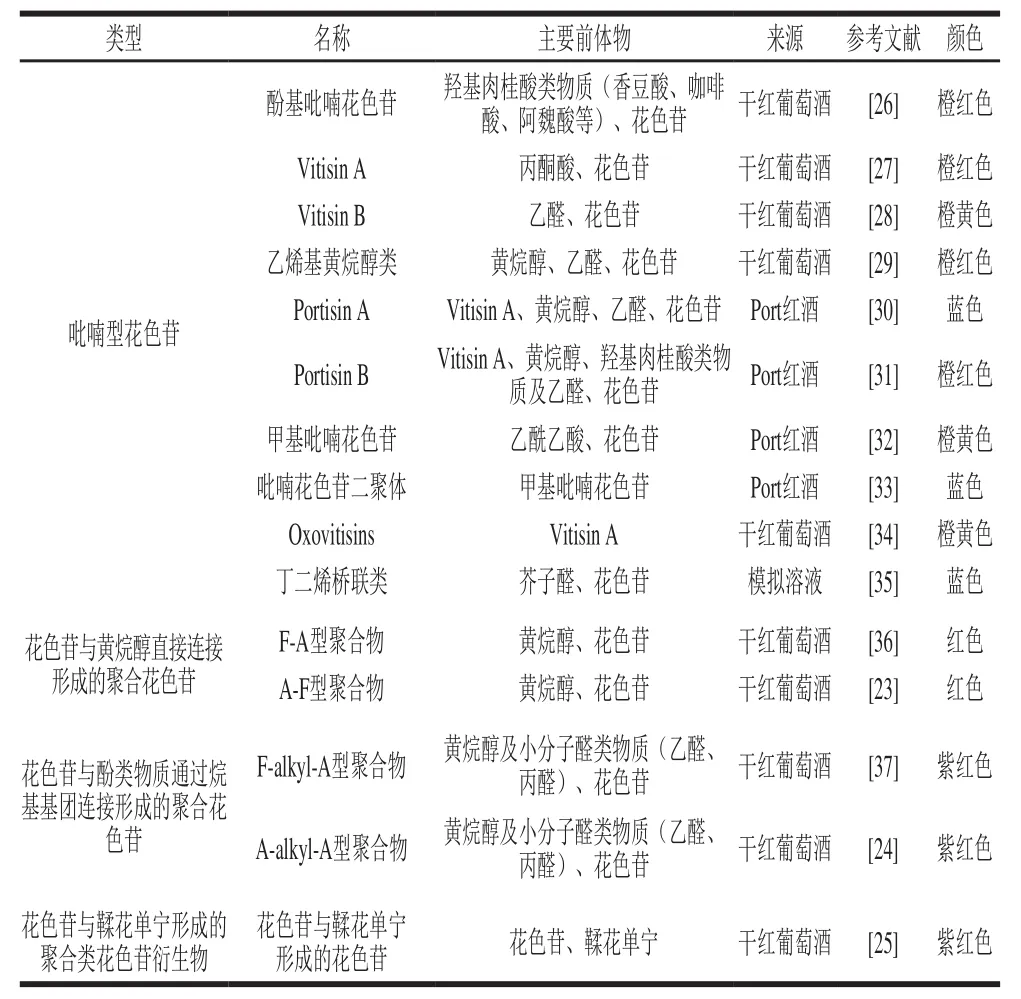
表2 红葡萄酒中常见的花色苷衍生物Table2 Anthocyanin derivatives commonly found in red wine
2.1 吡喃型花色苷
在红葡萄酒的研究过程中,人们除发现了常见的游离花色苷外,还从陈酿的干红葡萄酒中检测到几类花色苷衍生物,这些新色素由于在C6-C3-C6的基础上形成了一个吡喃环(D),因此被命名为吡喃型花色苷(图3)。
研究发现,游离花色苷吡喃化后,相应的花色苷具有更强的颜色稳定性。当pH值在1~5之间变化时,非吡喃化的游离花色苷色度可降低80%左右,而吡喃花色苷的色度却没有太大的波动[38]。自1996年Cameira-dos-Santos等[26]发现第一个吡喃型花色苷起,目前科研人员已在红葡萄酒和葡萄皮渣中鉴定出7 种类型的吡喃花色苷化合物(图4),分别是酚基吡喃型花色苷、Vitisins、乙烯基黄烷醇类吡喃型花色苷、Portisins、吡喃花色苷二聚体、Oxovitisins、丁二烯桥联的吡喃型花色苷等[34,39-40]。这些新型色素物质是葡萄酒在发酵和陈酿过程中的主要花色苷[39]。
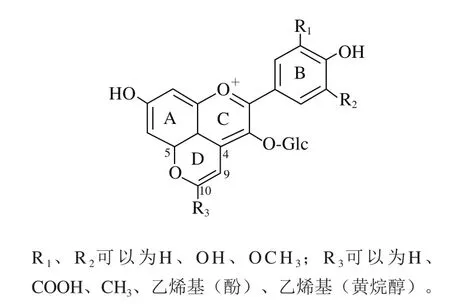
图3 吡喃型花色苷基本结构Fig.3 Basic structure of pyranoanthocyanins
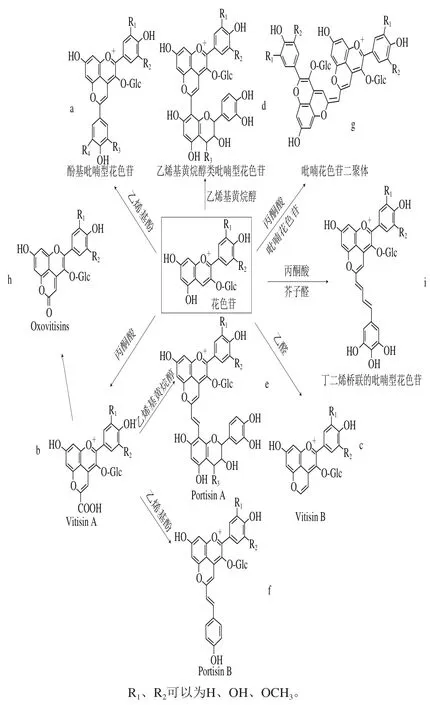
图4 吡喃型花色苷结构[41]Fig.4 Structure of pyranoanthocyanins[41]
2.1.1 酚基吡喃型花色苷
Cameira-dos-Santos等[26]在过滤红葡萄酒的微滤膜上分离出一种未知的花色苷,通过和已知游离花色苷相比,其分子质量大于后者,且可见吸收光谱发生了明显的蓝移变化。Fulcrand等[42]利用紫外-可见光谱、质谱和核磁共振对这种新物质进行了结构鉴定,证实了该物质是含有二甲基花翠素-3-O-葡萄糖苷或二甲基花翠素-3-O-(6-对香豆酰)-葡萄糖苷的吡喃衍生物,并推测这种新物质可能是肉桂酸脱羧酶作用形成的4-乙烯基酚在花色苷的C4和C5位环化加成的产物(图4a)。随后,Hayasaka等[43]在红葡萄酒中又鉴定出4-乙烯基儿茶酚、4-乙烯基愈创木酚和4-乙烯基芥子酸与二甲基花翠素-3-O-葡萄糖苷形成的酚基吡喃衍生物,大大丰富了该类型花色苷的种类。到目前为止,已从红葡萄酒中鉴定出多种花色苷,组成这些花色苷的花色素包括花翠素、甲基花青素、甲基花翠素和二甲基花翠素;而组成这些花色苷的糖基分子分别是葡萄糖、6-乙酰-葡萄糖和6-对豆香酰-葡萄糖;这些花色素和糖基分子通过3-O-糖苷键组合形成不同种类的花色苷[44-45]。
研究发现,干红葡萄酒中的酚基吡喃花色苷的含量在陈酿5~6 年后可达到峰值,相比于陈酿初期的新鲜干红葡萄酒而言,其含量约为前者的10 倍左右[4]。酚基吡喃花色苷对亚油酸过氧化反应的抑制作用要明显高于其原花色苷;对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力则与酚基吡喃花色苷的结构有关,例如通过二甲基花翠素-3-O-葡萄糖苷形成的酚基吡喃衍生物对DPPH自由基的清除能力要高于其母体,但是花青素-3-O-葡萄糖苷的酚基吡喃衍生物对自由基的清除能力明显则低于原花色苷[46]。
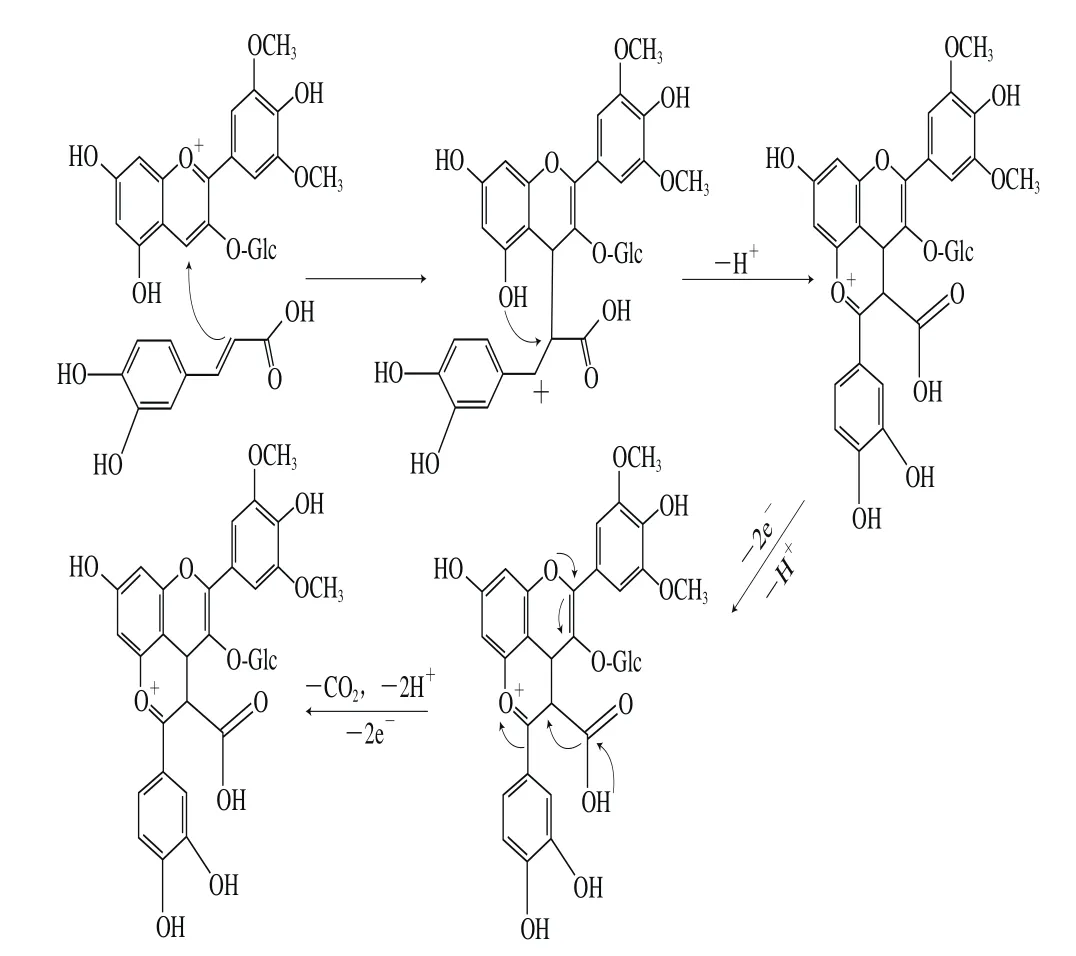
图5 酚基吡喃型花色苷形成途径[47-48]Fig.5 Formation pathway of hydroxyphenol-pyranoanthocyanins[47-48]
关于酚基吡喃型花色苷的形成机制,Schwarz等[47]提出了另一种可能的形成途径,他们认为红酒体系中的咖啡酸分子可直接利用其C2亲核部位和花色苷C4位结合形成碳正离子,并在C5羟基处环化形成吡喃环D,之后经过肉桂酸类分子取代、氧化脱羧形成该类型的花色苷分子。由于这一过程是在研究品乐(Pinotage)葡萄酒时发现的,因此通过这条途径产生的酚基吡喃型花色苷又被称为Piontins(图5)[47-48]。
2.1.2 Vitisins
丙酮酸和乙醛是葡萄酒发酵过程中由酵母菌代谢产生的2 种常见的产物。这2 种物质会和游离花色苷作用,形成一类新的吡喃型色素——Vitisins,并产生明显的蓝移现象[4]。研究表明,在酸性环境下丙酮酸的烯醇式结构会与二甲基花翠素-3-O-葡萄糖苷的C4和C5部位环化加成形成Vitisin A(图4b和图6)[28],并具有较高的水化作用常数(pKH1=4.51±0.03、pKH2=7.57±0.02)[49]、极大的色泽稳定性[50]和很强的抗氧化能力[51]。
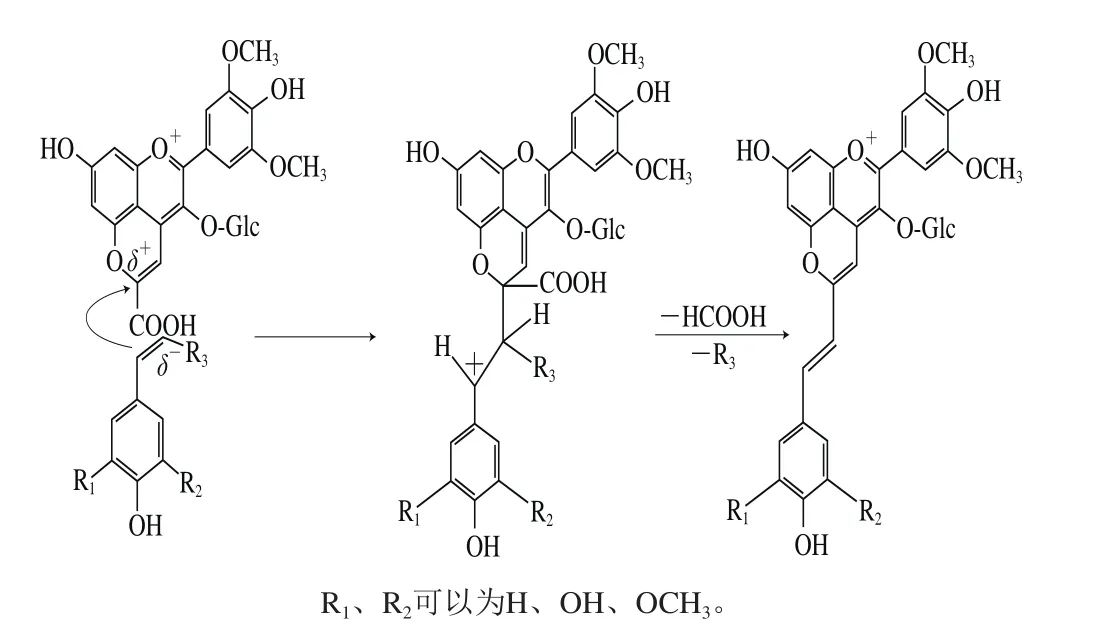
图6 Vitisin A形成途径[28]Fig.6 Formation pathway of vitisin A[28]
Vitisin A是陈酿1 年的Port酒中主要的花色苷类物质[52],通常随发酵的进行而产生,其生成受发酵体系的pH值、温度、微生物菌种(酵母菌和乳酸菌)以及花色苷、丙酮酸和SO2浓度等[53-54]的影响。利用核磁共振技术发现,Vitisin A分子C10羧基中的质子很容易在反应过程中失去,使其呈阴离子形式,同时随着pH值的逐渐升高,C7和C4’处羟基中的质子也会相继转移,导致花色苷分子出现醌式阴离子碱和醌式双阴离子碱的结构状态[55]。
相比Vitisin A而言,Vitisin B(图4c)是目前从红葡萄酒中分离出的结构最简单的一种吡喃型花色苷,主要由乙醛与花色苷环化产生,其最大吸收波长在490 nm附近,在可见光谱中表现为明显的橙黄色特征[38]。利用核磁共振和电喷雾质谱分析发现,Vitisin B分子离子峰的m/z为517,主要碎片离子(糖苷配基)的m/z为355,并且其双电荷离子(m/2z)为259,表明该物质是具有双电荷的吡喃花色苷化合物[56]。正是这种分子特性使得Vitisin B在pH值由低到高的变化过程中(pH 0~8),依次经历了3 次质子转移过程,其中具体的离子化常数(pKa1、pKa2、pKa3)已被核磁共振和紫外-可见光谱测定和证实[57-58]。
目前在干红葡萄酒中已鉴定出花青素、花翠素、甲基花青素、甲基花翠素和二甲基花翠素的3-O-葡萄糖苷及其乙酰化或香豆酰化的Vitisin A类型色素共计15 种[59-61],而在红葡萄酒中也发现有花翠素、甲基花青素、甲基花翠素和二甲基花翠素的3-O-葡萄糖苷,以及甲基花青素-3-O-(6-乙酰)-葡萄糖苷、二甲基花翠素-3-O-(6-对香豆酰)-葡萄糖苷等Vitisin B类型的花色苷[44,61]。He Jingren等[32]对陈酿3年的Port酒进行分析时检测到一种特殊的Vitisins类物质,由于其D环结构中C10含有甲基基团,因此又被称为甲基吡喃花色苷,其主要由游离花色苷和发酵过程中产生的乙酰乙酸环化形成,其合成途径类似于Vitisin A的生成。与游离花色苷相比,甲基吡喃花色苷的最大可见吸收波长发生蓝移,在溶液中呈现明显的橙黄色色调(其最大可见吸收波长在478 nm左右),并具有较高的色泽稳定性[62]。对此,Oliveira等[49]在测定了该类花色苷在不同pH值环境下相应的离子化常数值后认为,在较高电势差(12.40)的情况下,甲基吡喃花色苷将脱去质子形成相应的甲烯基吡喃花色苷结构,新生成的物质由于增加了双键的原因,对D环离域电子的平衡起到调节作用,因此表现出较强的颜色稳定性。此外,酵母菌的其他代谢产物,如丙酮、乙偶姻、草酰乙酸和双乙酰等也可与游离花色苷反应,形成类似的Vitisins化合物[41,43,63]。
由于Vitisins类型化合物在分子内形成了新的闭合环状结构,其颜色特征和抗降解、抗氧化、抗SO2漂白等特性与常见的游离花色苷比较均有明显的提高。例如Vitisin A在pH值近中性的环境下仍可表现出明显的红色色调[64]。采用电子自旋共振波谱法对Vitisin A的抗氧化活性进行测定,结果表明其对超氧阴离子自由基有很强的清除能力[65]。利用铁离子还原法的实验也同样证实Vitisins类化合物有极高的抗氧化性,特别是由二甲基花翠素-3-O-葡萄糖苷形成的Vitisin A物质,其对DPPH自由基的清除能力要超过其前体物质和其他类型花色苷的Vitisin A衍生物[66]。另外,有研究还发现,Vitisin A能抑制人体内皮细胞上的肿瘤坏死因子的活性[67],极大地拓展了Vitisins化合物在食品和医药领域的应用。
2.1.3 乙烯基黄烷醇类吡喃型花色苷
乙烯基黄烷醇吡喃型花色苷(图4d)是由二甲基花翠素-3-O-葡萄糖苷和乙烯基儿茶素、乙烯基表儿茶素以及乙烯基原花青素B2环化加成的产物[29]。其具体的反应过程包括:二甲基花翠素-3-O-葡萄糖苷和乙烯基黄烷醇分子内电荷的重排、黄烷醇分子在花色苷C4位的亲核连接,以及两分子通过氧化闭合形成最终的吡喃型分子(图7)[68]。
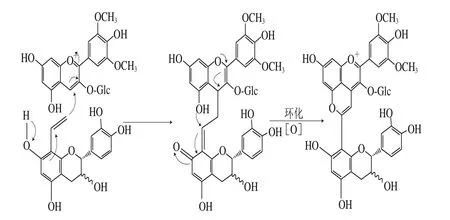
图7 乙烯基黄烷醇吡喃型花色苷形成途径[68]Fig.7 Formation pathway of vinylf l avanol-pyranoanthocyanins[68]
此外,Asenstorfer等[69]通过高效液相色谱-质谱联用技术在葡萄酒及酒渣的提取物中也检测出与上述物质相关的酰基化类似物和低聚黄烷醇(2~4聚合体)类衍生物。同酚基吡喃花色苷一样,乙烯基黄烷醇吡喃型花色苷也有蓝移现象,其最大光吸收峰在490~511 nm之间,显示出黄化的颜色特征[29]。同时,通过研究结果还推测该类型的花色苷也具有同酚基吡喃花色苷相类似的合成机制[30,70],而参与反应的乙烯基黄烷醇则可能来自黄烷醇-乙醇加成物的脱水反应或是由黄烷醇-乙基-黄烷醇寡聚体裂解产生[71-72]。He Jingren等[73]研究发现,红葡萄酒的陈酿时间会影响乙烯基黄烷醇吡喃型花色苷的含量,特别是对二聚化的乙烯基黄烷醇吡喃型花色苷含量影响最为显著;而增加乙烯基儿茶素、乙烯基表儿茶素等前体物的浓度也将会促进陈酿期间乙烯基黄烷醇吡喃型花色苷含量的增加[74]。同时,研究还发现乙烯基黄烷醇吡喃型花色苷还可发生分子内的辅色反应,使得其吸光度值在pH 3.6的红酒体系下比pH 1.0时高出30%~50%[75],这对维持酒体色泽起到重大的作用,并且由于形成了新的吡喃环,其对SO2的漂白也产生抗性。尽管乙烯基黄烷醇吡喃型花色苷具有极高的SO2抗性,但是不同种类的该物质受参与合成的黄烷醇基团影响,在颜色稳定性方面仍有差异,其强弱排序为:儿茶素型吡喃花色苷>原花青素型吡喃花色苷>表儿茶素型吡喃花色苷[76]。
2.1.4 Portisins
Mateus等[70]从Port酒中分离得到由Vitisin A和乙烯基黄烷醇反应得到的花色苷衍生物,由于是从Port酒中首次发现,因此将其命名为Portisin A(图4e)。Portisins A的最大光吸收峰在570 nm附近,结构中加成的乙烯基黄烷醇基团增大了D环离域电子的分布,使得其与游离花色苷相比,发生明显的红移,在酸性环境下呈现蓝紫色特征[70],并具有较高的摩尔消光系数(ε=829 333 L/(mol·cm)),远超于其前体物质Vitisin A(13 000 L/(mol·cm))和二甲基花翠素-3-O-葡萄糖苷(15 600 L/(mol·cm))[52,77]。通过核磁共振和电喷雾质谱分析,Mateus等[31]对Portisins A的合成机制进行了推测,认为烯醇化的乙烯基黄烷醇在Vitisin A的C10位处发生亲核取代,经脱羧和氧化后,最终形成由乙烯基桥联的Portisin A物质。相关的反应途径如图8所示[78]。
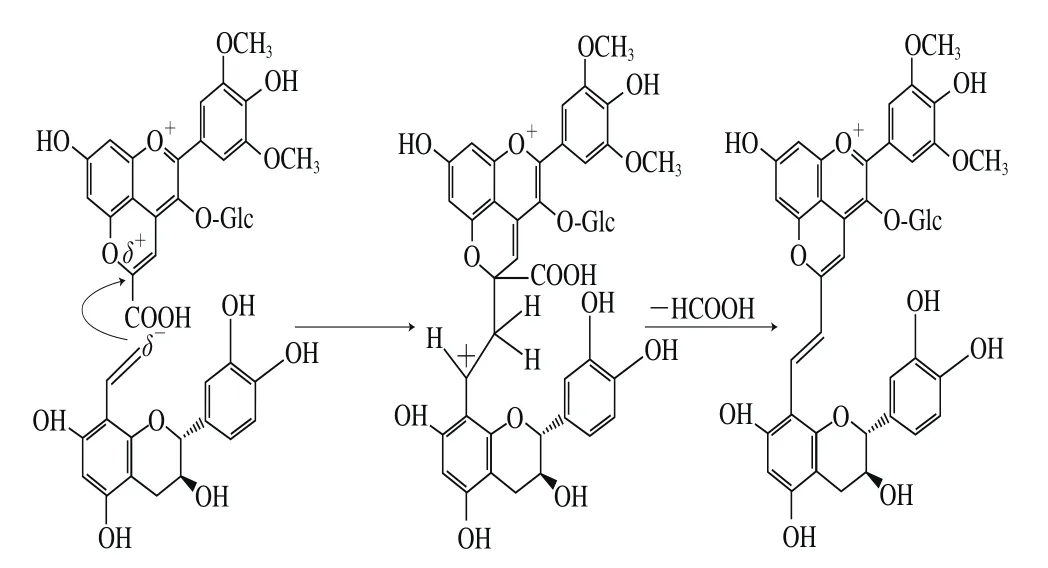
图8 Portisins A形成途径[78]Fig.8 Formation pathway of portisins A[78]
此外,从红葡萄酒中还鉴定出由乙烯基酚或肉桂酸类化合物与Vitisin A形成的Portisins物质,考虑到该类化合物的最大可见吸收波长在533~540 nm之间,呈现红紫色,并且在合成途径上与Portisin A也有差异;因此,这类吡喃花色苷被称为Portisin B(图4f)[79]。研究发现,Portisins B型物质有特殊的理化性质,在冻结状态下(酸性溶液中)颜色由红到蓝转变,这可能是其电子或分子振动特性使其发生可逆的物理化学变化的结果[74]。但其分子结构中存在的乙烯基酚类物质由于未能完全保护花色苷的C2作用位点,使得Portisin B的抗SO2能力与A类型相比相对较弱[79]。而关于Portisin B的形成过程,研究推测可能是乙烯基酚或肉桂酸类化合物与Vitisin A分子C10位点的亲核连接,通过脱羧及其脱去其他化学基团形成(图9)[80]。
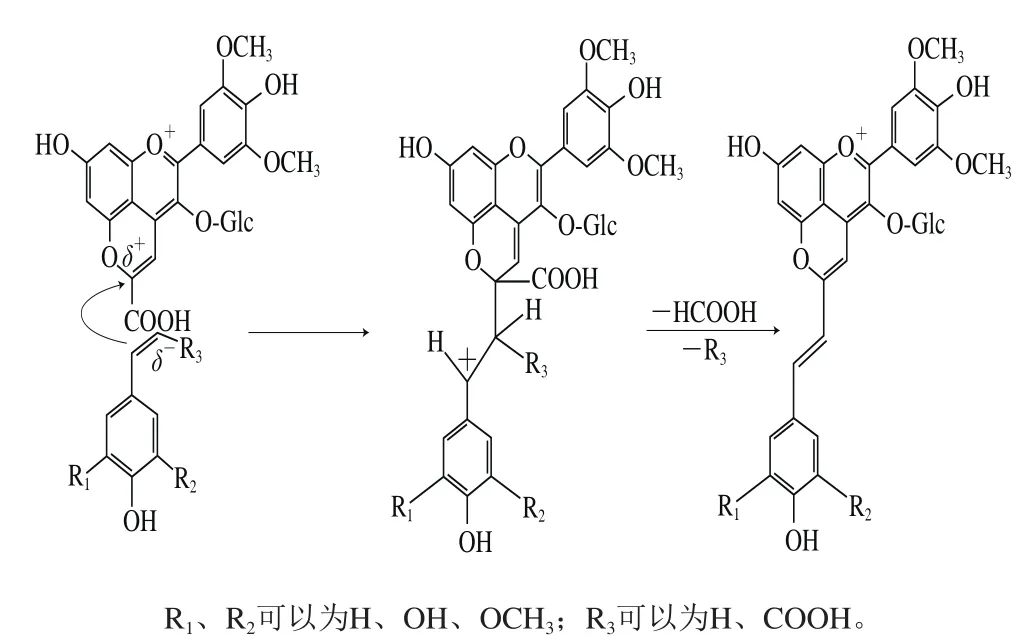
图9 Portisin B形成途径[80]Fig.9 Formation pathway of Portisin B[80]
目前,科研人员已从Port酒中鉴定出花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷和二甲基花翠素-3-O-葡萄糖苷,以及上述物质的乙酰化结构形成的Portisins类化合物。此外,还有利用甲基花青素-3-O-(6-对香豆酰)-葡萄糖苷和二甲基花翠素类-3-O-(6-对香豆酰)-葡萄糖苷合成Portisins型化合物的报道[31,81]。而比较各类型花色苷形成的Portisins化合物时发现,二甲基花翠素-3-O-葡萄糖苷形成的相应衍生物在抵抗水化反应和SO2漂白作用方面能力最强,并且在不同pH值溶液中均具有较高的色泽稳定性[82]。同时,关于Portisins生物活性的研究显示,Portisins不仅具有很强的DPPH自由基清除能力及还原铁离子的能力,而且能抑制人乳腺癌细胞增殖[83-84]。
2.1.5 吡喃花色苷二聚体
近年来,研究人员从陈酿9 年的Port酒中分离到一类二聚化的吡喃花色苷(图4g),其基本结构单元为吡喃型花色苷,通过次甲基或是甲基-次甲基-结构桥联形成[33]。这种类型的二聚体化合物相比游离花色苷而言,有较高的可见光吸收波长(分别是676 nm和730 nm),反映出蓝色色调特征。同时由于吡喃花色苷二聚体具有较低的溶解性,因此更容易在陈酿红葡萄酒的酒脚中被检测到[62]。研究认为,Vitisin A和B类花色苷衍生物可能作为吡喃花色苷二聚体的前体物质参与了该化合物的合成,其中甲基吡喃花色苷首先在其D环的C10处脱去质子,形成具有活性的亚甲基位点,并利用亲核加成与Vitisin A的C10处羧基结合,通过脱甲酸反应后,形成由次甲基连接的吡喃花色苷二聚体。此外,甲基吡喃花色苷和Vitisin A通过π电子相互作用,形成“电子转移复合体”,并进一步缩合、脱羧产生甲基连接的二聚体类物质[4]。而关于甲基-次甲基连接的吡喃花色苷二聚体,有研究认为,其可能主要是通过Vitisin A和乙基吡喃花色苷之间的电子转移和缩合反应形成的[85]。具体的反应途径如图10所示[33]。
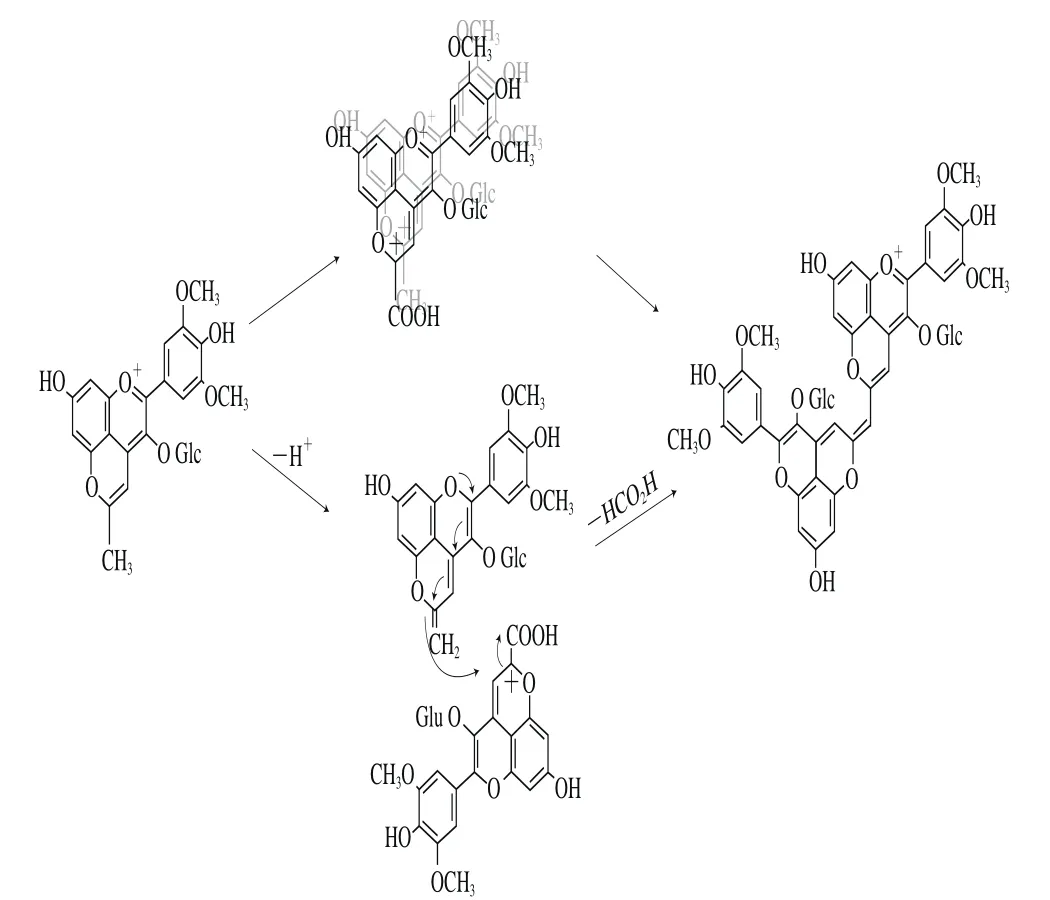
图10 吡喃花色苷二聚体形成途径[33]Fig.10 Formation pathway of pyranomalvidin-3-O-glucoside methine dimmer[33]
通过对吡喃花色苷二聚体紫外可见光谱的观察发现,在pH 1.80~11.66的变化过程中,二聚化的吡喃花色苷化合物经历了3次质子化反应过程。同时在pH 3.15~6.55范围内,反应溶液的可见光谱还被观测到有减色和蓝移的变化;而当pH值提高时(pH 6.55~8.65),吡喃花色苷二聚体溶液的颜色则出现逆转,表现出增色和红移的特征[86]。
2.1.6 Oxovitisins
He Jingren等[34]在2010年于陈酿的红葡萄酒中首次发现了一类新的吡喃花色苷衍生物,并命名为Oxovitisins(图4h)。该物质在酸性条件下(pH 2)的最大可见吸收波长为373 nm,被认为是陈酿红葡萄酒黄色色调的重要贡献者之一。通过液相色谱-二极管阵列-串联质谱以及1H和13C核磁共振对其进行结构鉴定,研究人员认为,Oxovitisins可能由Vitisin A经水合和氧化反应形成,其形成过程可能是吡喃花色苷合成的另一新的途径[34]。其中反应体系内的水分子与Vitisin A的C10位点发生亲核加成,形成半缩醛形式的Vitisins,随后该中间物经脱羧、氧化和脱水步骤,生成具有吡喃酮结构的花色苷衍生物(图11);相比A类型的Vitisins,Vitisin B由于缺少C10处的反应基团而不参与相应的反应。同时,考虑到上述亲核加成反应进程较为缓慢,所以由Vitisin A和水分子加成形成Vitisins的半缩醛结构被认为是整个反应过程中的关键步骤[34]。
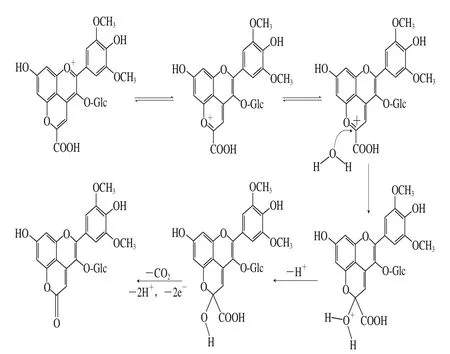
图11 Oxovitisins形成途径[34]Fig.11 Formation pathway of oxovitisins[34]
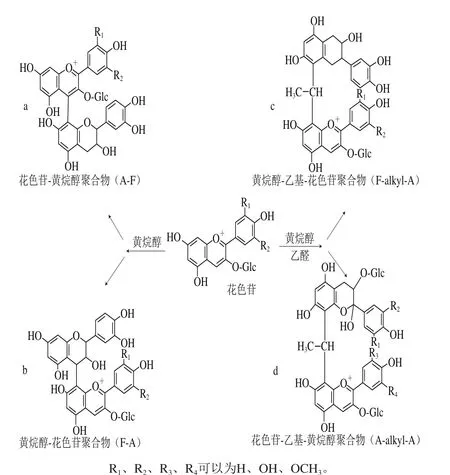
图13 聚合色素的形成途径Fig.13 Formation pathway of anthocyanin polymers
由于Oxovitisins分子结构和光谱特征与黄酮类化合物相似,因此具有较强的抗氧化活性潜能,并可显著抑制人肠癌细胞和乳腺癌细胞的增殖,在食品及医药行业具有十分广阔的应用前景[87]。
2.1.7 丁二烯桥联的吡喃型花色苷
丁二烯桥联的吡喃型花色苷是在模拟红葡萄酒的环境下,利用甲基吡喃花色苷和芥子醛为前体,人工合成的一种具有蓝色色调的吡喃型花色苷(图4i和图12)[35]。通过对丁二烯桥联的吡喃型花色苷性质的研究发现,这种新合成的色素具有类似Portisins的特点;同时其结构中存在的C7-OH、C4’-OH和C4’’-OH等脱质子位点使得该类色素在溶液中存在多种平衡形式,这又与Portisins类型的花色苷有一定的差别[79]。
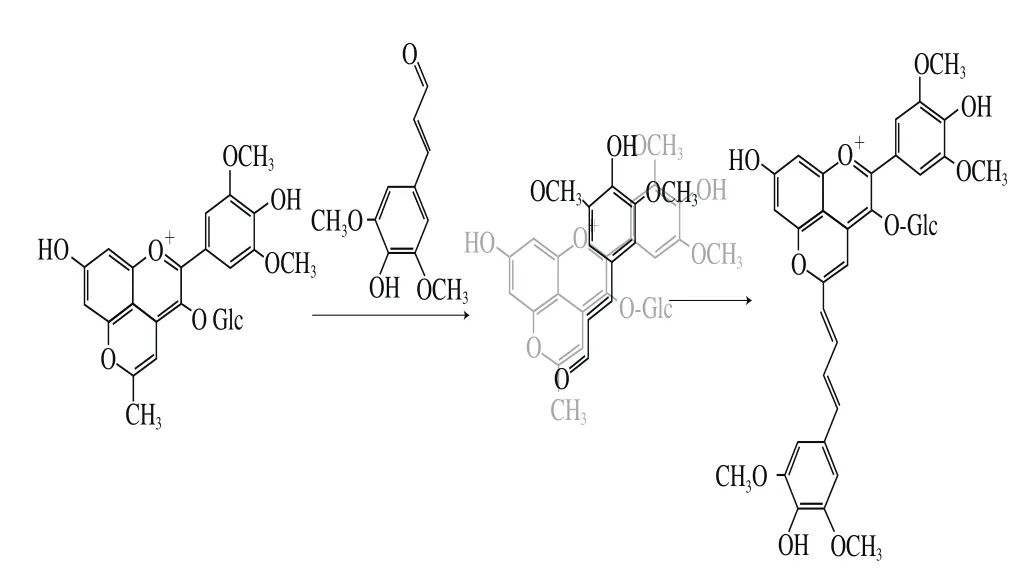
图12 丁二烯桥联的吡喃型花色苷形成途径[35]Fig.12 Formation pathway ofpyranomalvidin-3-O-glucosidebutadienylidene-sinapyl[35]
2.2 花色苷与黄烷醇直接连接形成的聚合类花色苷衍生物
目前,有关花色苷与黄烷醇直接连接形成聚合类花色苷衍生物的研究较少,虽然早在20世纪70年代就有关于它们结构的许多猜想和它们对红葡萄酒颜色影响的报道,但直到1999年,Buelga等[36]利用液相色谱-电喷雾串联质谱从红葡萄酒中第一次检测到参与反应的黄烷醇单体与花色苷分子以共价键结合形成的聚合物,并分析了该物质的结构特点。根据反应途径,可大致将花色苷与黄烷醇直接连接形成的聚合类花色苷分为2 类:A-F型聚合物和F-A型聚合物[88](图13)。前一种主要是黄烷醇的C8或是C6亲核部位同花色苷阳离子的C4亲电部位结合,形成无色的黄烷烯类物质(图13a),该物质可继续被氧化形成有色的阳离子,并最终通过脱羧反应形成具有黄色色调的呫吨鎓分子(图14)[89]。
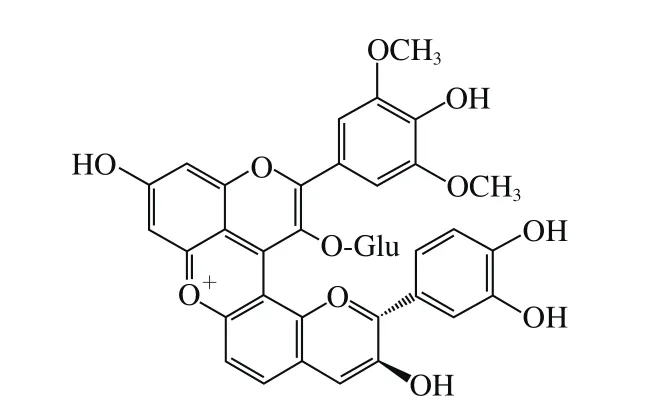
图14 呫吨鎓分子结构[89]Fig.14 Structure of xanthylium pigment[89]
此外,花色苷和黄烷醇还可以通过聚合形成双环结构,例如形成无色的二甲基花翠素-3,5-O-二葡萄糖苷-(C2-O-C7,C4-C8)-儿茶素的A-F型聚合物[90]。F-A型(图13b)聚合反应与A-F型聚合不同。F-A型聚合反应的主要过程是:原花青素分子在酸水解作用下形成碳正离子,之后此碳正离子作为亲电基团与花色苷水合结构的C6或C8处结合形成无色的二聚体化合物,而所形成的二聚体化合物还可通过脱水反应转变成为具有红色色调的阳离子[91]。
随着研究的进行,科研人员发现参与二聚化的花色苷和黄烷醇分子,不只局限于二甲基花翠素-3-O-葡萄糖苷和儿茶素,其他的花色苷分子,例如花青素、花翠素、甲基花青素和甲基花翠素的3-O-葡萄糖苷及酰化结构糖苷也可参与反应;黄烷醇分子中的表儿茶素、没食子酸儿茶素和表没食子酸儿茶素也是参与二聚化反应主要的合成前体[16,44]。一些研究还显示,聚合度不是很高的原花青素也能参与反应形成聚合色素。目前已从陈酿的红葡萄酒中检测出该类型的8聚体类物质[92]。同时,花色苷-花色苷(A-A)或是黄烷醇-黄烷醇(F-F)等的类似聚合物在文献中也有报道[93]。
Erika等[94]研究发现,花色苷和黄烷醇之间的反应特性与pH值有很大的相关性。在pH 2.0的环境条件下,表儿茶素-二甲花翠素葡萄糖苷可通过表没食子酸儿茶素-(C4-C8)-表儿茶素二聚体与二甲基花翠素葡萄糖苷化合形成;但是随着pH值的升高,二甲基花翠素葡萄糖苷和表儿茶素的降解速率加快,当pH 3.8时,F-A型聚合物很难在溶液中被检测到,说明它们的形成过程受原花青素裂解反应速率的制约。然而,在相同的pH值环境下,二甲基花翠素葡萄糖苷与原花青素二聚体B2的没食子酸酯却可发生亲核加成,生成A-F型聚合物。
2.3 花色苷与酚类物质通过烷基基团连接形成的聚合类花色苷衍生物
花色苷与酚类物质(如黄烷醇、花色苷)通过烷基基团连接的衍生物一般是由花色苷、酚类物质及小分子的醛类(如乙醛、丙醛等)反应形成的(图13c、d)[37]。研究显示,乙醛可以影响葡萄酒的色泽,这可能与乙醛和花色苷发生酸催化反应形成高分子质量的色素有关。模拟实验证实,在乙醛的作用下,花色苷与黄酮类化合物的反应速率将会提高,进而引起颜色强度的增加和吸收波长的红移,推测这可能是由花色苷和黄烷醇在C8位通过CH-CH3键形成衍生物而引起的。二甲基花翠素葡萄糖苷与儿茶素或表儿茶素形成的两种衍生物在540 nm有最大吸收波长,并且由质谱测定其m/z=809,推测这两种衍生物可能为同分异构体结构[14,95]。
2.4 花色苷与鞣花单宁形成的聚合类花色苷衍生物
在酸性环境下,花色苷可以同部分鞣花单宁如栎木单宁、栗木单宁等结合,形成所谓的“花色苷鞣花单宁”物质,具体的形成途径如图15所示[96]。由于该化合物相比游离的花色苷产生明显的红移,因此具有较深的红紫色色调特点。目前,该类物质只在模拟的实验环境下合成,尚未在干红葡萄酒中检测到,但是考虑鞣花单宁是橡木桶及其相关制品的主要酚类物质,因此这类化合物对红葡萄酒的颜色衍化应受到关注和研究[25]。
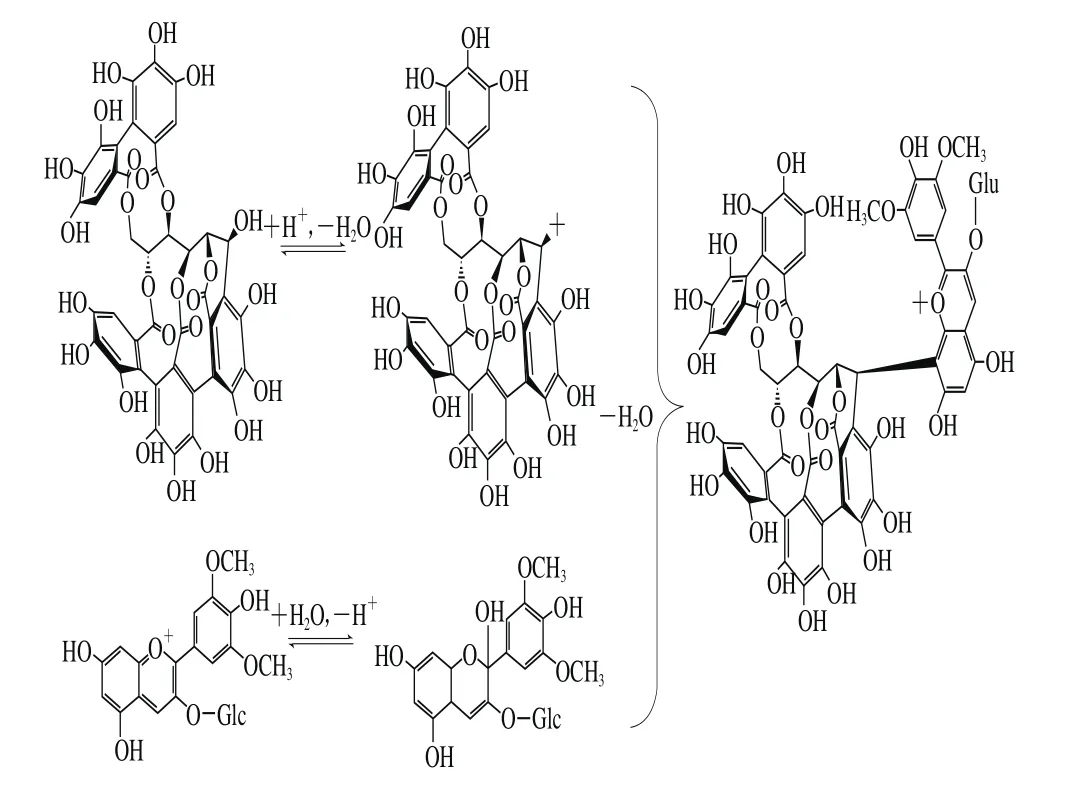
图15 花色苷鞣花单宁的形成途径[96]Fig.15 Formation pathway of anthocyano-ellagitannin[96]
3 结 语
综上所述,花色苷类物质作为红葡萄酒颜色的物质基础,对红酒的颜色及其色泽稳定性起着举足轻重的作用。同时,伴随着发酵和贮存陈酿的进行,花色苷类物质与酒中其他化合物形成的各种类型花色苷衍生物,对赋予酒体持久而稳定的颜色也表现出积极的作用。明确花色苷类物质的结构特征、形成途径、理化性质以及与酒体色泽的关系,对红葡萄酒酿造工艺技术的提升具有重要意义。纵观过去几十年来红葡萄酒花色苷的研究进展,科学家已在花色苷类物质的分离和鉴定、提取和纯化等方面取得了一批突破性的成果[97];在花色苷功能化并拓展其应用领域方面,花色苷因其天然的着色性使其成为国内外公认的优良色素资源,在食品、化妆品、纺织、印染等领域已得到了直接的应用,展示出巨大的发展前景[98]。虽然花色苷衍生物在葡萄酒中的含量比较有限,但是其结构的稳定特性使得它们对陈酿阶段红葡萄酒整体色泽的维持和展现起到十分重要的作用。而随着生物发酵以及植物培养技术的发展,花色苷的体外培养生产也越来越多地得到研究与应用[99]。同时,在模拟环境下的新型花色苷类物质的合成也为花色苷家族的扩展与延伸提供了物质保障。发酵工艺、菌种等对红葡萄酒中这些物质的形成具有极大的影响[100]。此外,花色苷作为生理活性因子,在抗氧化、抗肿瘤、抗癌及免疫治疗中的应用也为疾病的治疗提供了新的思路[101],并随着生物、化学等技术的发展,通过对花色苷类材料的不断优化和对原有花色苷类物质进行改性及功能化,可制备出更多理想的花色苷类制剂为人类生产、生活服务。因此,探究花色苷衍生物对红酒品质的影响,以及相关衍生物的化学活性和演化机理将成为红葡萄酒研究的一个主要方向。
[1] JACKSON R S. Wine Science[M]. 3rd ed. New York: Academic Press, 2008: 1-20.
[2] FANZONE M, GONZÁLEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J]. Food Chemistry, 2015, 175:166-173. DOI:10.1016/j.foodchem.2014.11.123.
[3] MCGOVERN P E, GLUSKER D L, EXNER L J, et al.Neolithic resinated wine[J]. Nature, 1996, 381: 480-481.DOI:10.1038/381480a0.
[4] DE FREITAS V, MATEUS N. Formation of pyranoanthocyanins in red wines: a new and diverse class of anthocyanin derivatives[J].Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473.DOI:10.1007/s00216-010-4479-9.
[5] GORDILLO B, RODRÍGUEZ-PULIDO F J, ESCUDERO-GILETE M L, et al. Comprehensive colorimetric study of anthocyanic copigmentation in model solutions. effects of pH and molar ratio[J].Journal of Agricultural and Food Chemistry, 2012, 60(11): 2896-2905.DOI:10.1021/jf2046202.
[6] HE J J, LIU Y X, PAN Q H, et al. Different anthocyanin prof i les of the skin and the pulp of Yan73 (Muscat Hamburg × Alicante Bouschet)grape berries[J]. Molecules, 2010, 15(3): 1141-1153. DOI:10.3390/molecules15031141.
[7] CABEZAS J A, CERVERA M T, ARROYO-GARC A R, et al.Garnacha and Garnacha Tintorera: genetic relationships and the origin of teinturier varieties cultivated in Spain[J]. American Journal of Enology and Viticulture, 2003, 54(4): 237-245.
[8] ARAPITSAS P, OLIVEIRA J, MATTIVI F. Do white grapes really exist?[J]. Food Research International, 2015, 69(3): 21-25.DOI:10.1016/j.foodres.2014.12.002.
[9] NIKFARDJAM M S P, MÁRK L, AVAR P, et al. Polyphenols,anthocyanins, and trans-resveratrol in red wines from the Hungarian Villány region[J]. Food Chemistry, 2006, 98(3): 453-462.DOI:10.1016/j.foodchem.2005.06.014.
[10] CASTAÑEDA-OVANDO A, DE LOURDES PACHECOHERNÁNDEZ M, PÁEZ-HERNÁNDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871.DOI:10.1016/j.foodchem.2008.09.001.
[11] HE F, HE J J, PAN Q H, et al. Mass-spectrometry evidence confirming the presence of pelargonidin-3-O-glucoside in the berry skins of Cabernet Sauvignon and Pinot Noir (Vitis vinifera L.)[J].Australian Journal of Grape and Wine Research, 2010, 16(3): 464-468.DOI:10.1111/j.1755-0238.2010.00107.x.
[12] NAGEL C W, WULF L W. Changes in the anthocyanins, fl avonoids and hydroxycinnamic acid esters during fermentation and aging of Merlot and Cabernet Sauvignon[J]. American Journal of Enology and Viticulture, 1979, 30(2): 111-116.
[13] CASTILLO-MUÑOZ N, FERNÁNDEZ-GONZÁLEZ M, GÓMEZALONSO S, et al. Red-color related phenolic composition of Garnacha Tintorera (Vitis vinifera L.) grapes and red wines[J]. Journal of Agricultural and Food Chemistry, 2009, 57(17): 7883-7891.DOI:10.1021/jf9002736.
[14] MAZZA G, FRANCIS F J. Anthocyanins in grapes and grape products[J]. Critical Reviews in Food Science and Nutrition, 1995,35(4): 341-371. DOI:10.1080/10408399509527704.
[15] XING R R, LI S Y, HE F, et al. Mass spectrometric and enzymatic evidence confirm the existence of anthocyanidin 3,5-O-diglucosides in Cabernet Sauvignon (Vitis vinifera L.) grape berries[J]. Journal of Agricultural and Food Chemistry, 2015, 63(12): 3251-3260.DOI:10.1021/acs.jafc.5b00053.
[16] ALCALDE-EON C, ESCRIBANO-BAILÓN M T, SANTOSBUELGA C, et al. Changes in the detailed pigment composition of red wine during maturity and ageing: a comprehensive study[J]. Analytica Chimica Acta, 2006, 563(1): 238-254. DOI:10.1016/j.aca.2005.11.028.
[17] 李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007:106-124.
[18] DE PASCUAL-TERESA S, SANCHEZ-BALLESTA M T.Anthocyanins: from plant to health[J]. Phytochemistry reviews, 2008,7(2): 281-299. DOI:10.1007/s11101-007-9074-0.
[19] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933.DOI:10.1016/S0031-9422(03)00438-2.
[20] NÚÑEZ V, MONAGAS M, GOMEZ-CORDOVÉS M C, et al. Vitis vinifera L. cv. Graciano grapes characterized by its anthocyanin prof i le[J]. Postharvest Biology and Technology, 2004, 31(1): 69-79.DOI:10.1016/S0925-5214(03)00140-6.
[21] HE J R, OLIVEIRA J, SILVA A M, et al. Oxovitisins: a new class of neutral pyranone-anthocyanin derivatives in red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8814-8819. DOI:10.1021/jf101408q.
[22] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines I. monomeric anthocyanins and their color expression[J].Molecules, 2012, 17(2): 1571-1601. DOI:10.3390/molecules17021571.
[23] SALAS E, ATANASOVA V, PONCET-LEGRAND C, et al.Demonstration of the occurrence of fl avanol-anthocyanin adducts in wine and in model solutions[J]. Analytica Chimica Acta, 2004, 513(1):325-332. DOI:10.1016/j.aca.2003.11.084.
[24] ATANASOVA V, FULCRAND H, LE GUERNEVÉ C, et al.Structure of a new dimeric acetaldehyde malvidin 3-glucoside condensation product[J]. Tetrahedron Letters, 2002, 43(35): 6151-6153. DOI:10.1016/S0040-4039(02)01294-7.
[25] QUIDEAU S, JOURDES M, LEFEUVRE D, et al. The chemistry of wine polyphenolic C-glycosidic ellagitannins targeting human topoisomerase II[J]. Chemistry, 2005, 11(22): 6503-6513.DOI:10.1002/chem.200500428.
[26] CAMEIRA-DOS-SANTOS P J, BRILLOUET J M, CHEYNIER V, et al. Detection and partial characterisation of new anthocyaninderived pigments in wine[J]. Journal of the Science of Food and Agriculture, 1996, 70(2): 204-208. DOI:10.1002/(SICI)1097-0010(199602)70:2<204::AID-JSFA484>3.0.CO;2-F.
[27] BAKKER J, TIMBERLAKE C F. Isolation, identification, and characterization of new color-stable anthocyanins occurring in some red wines[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1):35-43. DOI:10.1021/jf960252c.
[28] BAKKER J, BRIDLE P, HONDA T, et al. Identification of an anthocyanin occurring in some red wines[J]. Phytochemistry, 1997,44(7): 1375-1382. DOI:10.1016/S0031-9422(96)00707-8.
[29] FRANCIA-ARICHA E M, GUERRA M T, RIVAS-GONZALO J C, et al. New anthocyanin pigments formed after condensation with fl avanols[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6):2262-2266. DOI:10.1021/jf9609587.
[30] MATEUS N, CARVALHO E, CARVALHO A R F, et al. Isolation and structural characterization of new acylated anthocyanin-vinyl-f l avanol pigments occurring in aging red wines[J]. Journal of Agricultural and Food Chemistry, 2003, 51(1): 277-282. DOI:10.1021/jf020695i.
[31] MATEUS N, OLIVEIRA J, PISSARRA J, et al. A new vinylpyranoanthocyanin pigment occurring in aged red wine[J]. Food Chemistry, 2006, 97(4): 689-695. DOI:10.1016/j.foodchem.2005.05.051.
[32] HE Jingren, SANTOS-BUELGA C, SILVA A M S, et al. Isolation and structural characterization of new anthocyanin-derived yellow pigments in aged red wines[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9598-9603. DOI:10.1021/jf062325q.
[33] OLIVEIRA J, AZEVEDO J, SILVA A M, et al. Pyranoanthocyanin dimers: a new family of turquoise blue anthocyanin-derived pigments found in Port wine[J]. Journal of Agricultural and Food Chemistry,2010, 58(8): 5154-5159. DOI:10.1021/jf9044414.
[34] HE Jingren, SILVA A M S, MATEUS N, et al. Oxidative formation and structural characterisation of new α-pyranone (lactone) compounds of non-oxonium nature originated from fruit anthocyanins[J].Food Chemistry, 2011, 127(3): 984-992. DOI:10.1016/j.foodchem.2011.01.069.
[35] OLIVEIRA J, MATEUS N, DE FREITAS V. Synthesis of a new bluish pigment from the reaction of a methylpyranoanthocyanin with sinapaldehyde[J]. Tetrahedron Letters, 2011, 52(16): 1996-2000.DOI:10.1016/j.tetlet.2011.02.079.
[36] BUELGA C S, QUINTANA A M V, ARICHA E F, et al. Formation of anthocyanin-derived pigments in experimental red wines[J].Food Science and Technology International, 1999, 5(4): 347-352.DOI:10.1177/108201329900500407.
[37] TIMBERLAKE C F, BRIDLE P. Interactions between anthocyanins,phenolic compounds, and acetaldehyde and their significance in red wines[J]. American Journal of Enology and Viticulture, 1976, 27(3):97-105.
[38] DE FREITAS V, MATEUS N. Chemical transformations of anthocyanins yielding a variety of colours[J]. Environmental Chemistry Letters, 2006,4(3): 175-183. DOI:10.1007/s10311-006-0060-3.
[39] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines Ⅱ. anthocyanin derived pigments and their color evolution[J]. Molecules, 2012, 17(2): 1483-1519. DOI:10.3390/molecules17021483.
[40] RENTZSCH M, SCHWARZ M, WINTERHALTER P.Pyranoanthocyanins: an overview on structures, occurrence, and pathways of formation[J]. Trends in Food Science & Technology,2007, 18(10): 526-534. DOI:10.1016/j.tifs.2007.04.014.
[41] DE FREITAS V, MATEUS N. Formation of pyranoanthocyanins in red wines: a new and diverse class of anthocyanin derivatives[J].Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473.DOI:10.1007/s00216-010-4479-9.
[42] FULCRAND H, DOS SANTOS P J C, SARNI-MANCHADO P, et al.Structure of new anthocyanin-derived wine pigments[J]. Journal of the Chemical Society, Perkin Transactions 1, 1996, 7(7): 735-739.DOI:10.1039/P19960000735.
[43] HAYASAKA Y, ASENSTORFER R E. Screening for potential pigments derived from anthocyanins in red wine using nanoelectrospray tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 756-761. DOI:10.1021/jf010943v.
[44] BOIDO E, ALCALDE-EON C, CARRAU F, et al. Aging effect on the pigment composition and color of Vitis vinifera L. cv. Tannat wines. contribution of the main pigment families to wine color[J].Journal of Agricultural and Food Chemistry, 2006, 54(18): 6692-6704.DOI:10.1021/jf061240m.
[45] AGUIRRE M J, ISAACS M, MATSUHIRO B, et al. Anthocyanin composition in aged Chilean Cabernet Sauvignon red wines[J].Food Chemistry, 2011, 129(2): 514-519. DOI:10.1016/j.foodchem.2011.05.009.
[46] GOUPY P, BAUTISTAORTIN A B, FULCRAND H, et al.Antioxidant activity of wine pigments derived from anthocyanins:hydrogen transfer reactions to the dpph radical and inhibition of the heme-induced peroxidation of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5762-5770. DOI:10.1021/jf900841b.
[47] SCHWARZ M, WABNITZ T C, WINTERHALTER P. Pathway leading to the formation of anthocyanin-vinylphenol adducts and related pigments in red wines[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3682-3687. DOI:10.1021/jf0340963.
[48] HÅKANSSON A E, PARDON K, HAYASAKA Y, et al. Structures and colour properties of new red wine pigments[J]. Tetrahedron letters,2003, 44(26): 4887-4891. DOI:10.1016/S0040-4039(03)01090-6.
[49] OLIVEIRA J, MATEUS N, DE FREITAS V. Previous and recent advances in pyranoanthocyanins equilibria in aqueous solution[J]. Dyes and Pigments, 2014, 100: 190-200. DOI:10.1016/j.dyepig.2013.09.009.
[50] SÁNCHEZ-ILÁRDUYA M B, SÁNCHEZ-FERNÁNDEZ C, GARMÓN-LOBATO S, et al. Tentative identification of pyranoanthocyanins in Rioja aged red wines by high-performance liquid chromatography and tandem mass spectrometry[J].Australian Journal of Grape and Wine Research, 2014, 20(1): 31-40.DOI:10.1111/ajgw.12061.
[51] GOUPY P, BAUTISTA-ORTIN A B, FULCRAND H, et al.Antioxidant activity of wine pigments derived from anthocyanins:hydrogen transfer reactions to the DPPH radical and inhibition of the heme-induced peroxidation of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5762-5770. DOI:10.1021/jf900841b.
[52] MATEUS N, DE FREITAS V. Evolution and stability of anthocyaninderived pigments during port wine aging[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 5217-5222. DOI:10.1021/jf0106547.
[53] ASENSTORFER R E, MARKIDES A J, ILAND P G, et al. Formation of vitisin A during red wine fermentation and maturation[J]. Australian Journal of Grape and Wine Research, 2003, 9(1): 40-46. DOI:10.1111/j.1755-0238.2003.tb00230.x.
[54] MORATA A, GÓMEZ-CORDOVÉS M C, COLOMO B, et al.Pyruvic acid and acetaldehyde production by different strains of Saccharomyces cerevisiae: relationship with Vitisin A and B formation in red wines[J]. Journal of Agricultural and Food Chemistry, 2003,51(25): 7402-7409. DOI:10.1021/jf0304167.
[55] OLIVEIRA J, MATEUS N, FREITAS V D. Network of carboxypyranomalvidin-3-O-glucoside (Vitisin A) equilibrium forms in aqueous solution[J]. Tetrahedron Letters, 2013, 54(37): 5106-5110.DOI:10.1016/j.tetlet.2013.07.046.
[56] GOMEZ-ALONSO S, BLANCO-VEGA D, GOMEZ M V, et al.Synthesis, isolation, structure elucidation, and color properties of 10-acetyl-pyranoanthocyanins[J]. Journal of Agricultural and Food Chemistry, 2012, 60(49): 12210-12223. DOI:10.1021/jf303854u.
[57] FRASSINETI C, GHELLI S, GANS P, et al. Nuclear magnetic resonance as a tool for determining protonation constants of natural polyprotic bases in solution[J]. Analytical Biochemistry, 1995, 231(2):374-382. DOI:10.1006/abio.1995.9984.
[58] GANS P, SABATINI A, VACCA A. Determination of equilibrium constants from spectrophometric data obtained from solutions of know pH: the program pHab[J]. Annali Di Chimica, 1999, 89(1): 45-49.
[59] ATANASOVA V, FULCRAND H, CHEYNIER V, et al. Effect of oxygenation on polyphenol changes occurring in the course of wine-making[J]. Analytica Chimica Acta, 2002, 458(1): 15-27.DOI:10.1016/S0003-2670(01)01617-8.
[60] WANG H, RACE E J, SHRIKHANDE A J. Anthocyanin transformation in Cabernet Sauvignon wine during aging[J]. Journal of Agricultural and Food Chemistry, 2003, 51(27): 7989-7994.DOI:10.1021/jf034501q.
[61] ALCALDE-EON C, ESCRIBANO-BAILÓN M T, SANTOSBUELGA C, et al. Separation of pyranoanthocyanins from red wine by column chromatography[J]. Analytica Chimica Acta, 2004, 513(1):305-318. DOI:10.1016/j.aca.2003.10.076.
[62] MARQUEZ A, SERRATOSA M P, MERIDA J. Pyranoanthocyanin derived pigments in wine: structure and formation during winemaking[J]. Journal of Chemistry, 2013, 2013: 1-35.DOI:10.1155/2013/713028.
[63] ROMERO C, BAKKER J. Effect of acetaldehyde and several acids on the formation of vitisin A in model wine anthocyanin and colour evolution[J]. International Journal of Food Science & Technology,2000, 35(1): 129-140. DOI:10.1046/j.1365-2621.2000.00372.x.
[64] IVANOVA-PETROPULOS V, HERMOSÍN-GUTIÉRREZ I, BOROS B, et al. Phenolic compounds and antioxidant activity of Macedonian red wines[J]. Journal of Food Composition and Analysis, 2015, 41:1-14. DOI:10.1016/j.jfca.2015.01.002.
[65] GARCIA-ALONSO M, RIMBACH G, SASAI M, et al. Electron spin resonance spectroscopy studies on the free radical scavenging activity of wine anthocyanins and pyranoanthocyanins[J]. Molecular Nutrition and Food Research, 2005, 49(12): 1112-1119. DOI:10.1002/mnfr.200500100.
[66] SKREDE G, MARTINSEN B K, WOLD A B, et al. Variation in quality parameters between and within 14 Nordic tree fruit andberry species[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2012, 62(3): 193-208. DOI:10.1080/09064710.2011.598543.
[67] FERNANDES I, FARIA A, AZEVEDO J, et al. Influence of anthocyanins, derivative pigments and other catechol and pyrogalloltype phenolics on breast cancer cell proliferation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3785-3792.DOI:10.1021/jf903714z.
[68] DE FREITAS V, MATEUS N. Formation of pyranoanthocyanins in red wines: a new and diverse class of anthocyanin derivatives[J].Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473.DOI:10.1007/s00216-010-4479-9.
[69] ASENSTORFER R E, HAYASAKA Y, JONES G P. Isolation and structures of oligomeric wine pigments by bisulfite-mediated ionexchange chromatography[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5957-5963. DOI:10.1021/jf011261a.
[70] MATEUS N, SILVA A M S, RIVAS-GONZALO J C, et al. A new class of blue anthocyanin-derived pigments isolated from red wines[J].Journal of Agricultural and Food Chemistry, 2003, 51(7): 1919-1923.DOI:10.1021/jf020943a.
[71] CRUZ L, TEIXEIRA N, SILVA A M S, et al. Role of vinylcatechin in the formation of pyranomalvidin-3-glucoside-(+)-catechin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10980-10987.DOI:10.1021/jf8021496.
[72] ES-SAFI N E, FULCRAND H, CHEYNIER V, et al. Studies on the acetaldehyde-induced condensation of (-)-epicatechin and malvidin 3-O-glucoside in a model solution system[J]. Journal of Agricultural and Food Chemistry, 1999, 47(5): 2096-2102. DOI:10.1021/jf9806309.
[73] HE Jingren, SANTOS-BUELGA C, MATEUS N, et al. Isolation and quantification of oligomeric pyranoanthocyanin-flavanol pigments from red wines by combination of column chromatographic techniques[J]. Journal of Chromatography A, 2006, 1134(1/2): 215-225. DOI:10.1016/j.chroma.2006.09.011.
[74] CARVALHO A R F, OLIVEIRA J, DE FREITAS V, et al. Unusual color change of vinylpyranoanthocyanin-phenolic pigments[J].Journal of Agricultural and Food Chemistry, 2010, 58(7): 4292-4297.DOI:10.1021/jf904246g.
[75] HE Jingren, CARVALHO A R, MATEUS N, et al. Spectral features and stability of oligomeric pyranoanthocyanin-flavanol pigments isolated from red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9249-9258. DOI:10.1021/jf102085e.
[76] RENTZSCH M, SCHWARZ M, WINTERHALTER P, et al. Formation of hydroxyphenyl-pyranoanthocyanins in Grenache wines: precursor levels and evolution during aging[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4883-4888. DOI:10.1021/jf0702491.
[77] OLIVEIRA J, SANTOS-BUELGA C, SILVA A M S, et al. Chromatic and structural features of blue anthocyanin-derived pigments present in Port wine[J]. Analytica Chimica Acta, 2006, 563(1): 2-9.DOI:10.1016/j.aca.2005.11.027.
[78] CARVALHO A R F, OLIVEIRA J, DE FREITAS V, et al. A computational study of vinylpyranoanthocyanin-phenolic pigments(portisins)[J]. Journal of Molecular Structure Theochem, 2010,946(1/2/3): 113-118. DOI:10.1016/j.theochem.2009.07.034.
[79] OLIVEIRA J, DE FREITAS V, SILVA A M S, et al. Reaction between hydroxycinnamic acids and anthocyanin-pyruvic acid adducts yielding new portisins[J]. Journal of Agricultural and Food Chemistry,2007, 55(15): 6349-6356. DOI:10.1021/jf070968f.
[80] MONAGAS M, BARTOLOMÉ B. Wine Chemistry and Biochemistry[M]. New York: Springer, 2009: 439-462.
[81] MATEUS N, OLIVEIRA J, GONZÁLEZ-PARAMÁS A M, et al.Screening of portisins (vinylpyranoanthocyanin pigments) in Port wine by LC/DAD-MS[J]. Food Science and Technology International, 2005,11(5): 353-358. DOI:10.1177/1082013205057940.
[82] SANZA M D A, DOMÍNGUEZ I N. Wine aging in bottle from artificial systems (staves and chips) and oak woods: anthocyanin composition[J]. Analytica Chimica Acta, 2006, 563(1/2): 255-263.DOI:10.1016/j.aca.2005.11.030.
[83] FERRAZZANO G F, AMATO I, INGENITO A, et al.Plant polyphenols and their anti-cariogenic properties: a review[J]. Molecules, 2011, 16(2): 1486-1507. DOI:10.3390/molecules16021486.
[84] AZEVEDO J, OLIVEIRA J, CRUZ L, et al. Antioxidant features of red wine pyranoanthocyanins: experimental and theoretical approaches[J]. Journal of Agricultural and Food Chemistry, 2014,62(29): 7002-7009. DOI:10.1021/jf404735j.
[85] OLIVEIRA J, MATEUS N, RODRIGUEZ-BORGES J E, et al.Synthesis of a new pyranoanthocyanin dimer linked through a methylmethine bridge[J]. Tetrahedron Letters, 2011, 52(23): 2957-2960.DOI:10.1016/j.tetlet.2011.03.125.
[86] MAURY C. Structure and properties of wine pigments and tannins[J].American Journal of Enology and Viticulture, 2006, 57(3): 298-305.
[87] 吴闹, 王静祎, 张倩, 等. 新型花色苷衍生物oxovitisin A制备条件优化及其体外抑制癌细胞增殖活性[J]. 食品科学, 2016, 37(16): 1-7.DOI:10.7506/spkx1002-6630-201616001.
[88] REMY S, FULCRAND H, LABARBE B, et al. First confirmation in red wine of products resulting from direct anthocyanintannin reactions[J]. Journal of the Science of Food and Agriculture, 2000, 80(6): 745-751. DOI:10.1002/(SICI)1097-0010(20000501)80:6<745::AID-JSFA611>3.0.CO;2-4.
[89] ES-SAFI N E, GUERNEVÉC, FULCRAND H, et al. Xanthylium salts formation involved in wine colour changes[J]. International Journal of Food Science & Technology, 2000, 35(1): 63-74. DOI:10.1046/j.1365-2621.2000.00339.x.
[90] BISHOP P D, NAGEL C W. Characterization of the condensation product of malvidin 3,5-diglucoside and catechin[J]. Journal of Agricultural and Food Chemistry, 1984, 32(5): 1022-1026.DOI:10.1021/jf00125a019.
[91] EDWIN H. In vino veritas: oligomeric procyanidins and the ageing of red wines[J]. Phytochemistry, 1980, 19(12): 2577-2582. DOI:10.1016/S0031-9422(00)83922-9.
[92] SALAS E, DUEÑAS M, SCHWARZ M, et al. Characterization of pigments from different high speed countercurrent chromatography wine fractions[J]. Journal of Agricultural and Food Chemistry, 2005,53(11): 4536-4546. DOI:10.1021/jf0478096.
[93] PATI S, LIBERATORE M T, GAMBACORTA G, et al. Rapid screening for anthocyanins and anthocyanin dimers in crude grape extracts by high performance liquid chromatography coupled with diode array detection and tandem mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(18): 3864-3868. DOI:10.1016/j.chroma.2009.02.068.
[94] ERIKA S, HÉLÈNE F, EMMANUELLEM, et al. Reactions of anthocyanins and tannins in model solutions[J]. Journal of Agricultural and Food Chemistry, 2003, 51(27): 7951-7961. DOI:10.1021/jf0345402.
[95] SANTOS-BUELGA C, FRANCIA-ARICHA E M, DE PASCUALTERESA S, et al. Contribution to the identification of the pigments responsible for the browning of anthocyanin-flavanol solutions[J].European Food Research and Technology, 1999, 209(6): 411-415.DOI:10.1007/s002170050518.
[96] STÉPHANE Q, MICHAEL J, LEFEUVRE DOROTHÉE L, et al. The chemistry of wine polyphenolic C-glycosidic ellagitannins targeting human topoisomerase II[J]. Chemistry-A European Journal, 2005,11(22): 6503-6513. DOI:10.1002/chem.200500428.
[97] RODRIGUES S, PINTO G A S. Ultrasound extraction of phenolic compounds from coconut (Cocos nucifera) shell powder[J].Journal of Food Engineering, 2007, 80(3): 869-872. DOI:10.1016/j.jfoodeng.2006.08.009.
[98] 宋会歌, 刘美艳, 董楠, 等. 食品中花色苷降解机制研究进展[J]. 食品科学, 2011, 32(13): 355-359.
[99] BHASKARAN S, RINAT O, ADA N L, et al. Increased accumulation and decreased catabolism of anthocyanins in red grape cell suspension culture following magnesium treatment[J]. Planta, 2011, 234(1): 61-71. DOI:10.1007/s00425-011-1377-0.
[100] 何英霞, 李霁昕, 米兰, 等. 响应面分析pH值、温度、SO2对干红葡萄酒中吡喃花色苷Vitisins的影响[J]. 食品与发酵工业, 2016, 42(8):115-120.
[101] PRIOR R L, WU X L. Anthocyanins: structural characteristics that result in unique metabolic patterns and biological activities[J]. Free Radical Research, 2006, 40(10): 1014-1028.DOI:10.1080/10715760600758522.
