蛋源性活性组分对炎症性肠病的缓解作用研究进展
2018-03-20张梦雅徐明生涂勇刚
张梦雅,赵 燕,徐明生,姚 瑶,汪 雄,涂勇刚,*
(1.江西农业大学 江西省天然产物与功能食品重点实验室,江西 南昌 330045;2.南昌大学 生物质转化教育部工程研究中心,江西 南昌 330047)
人体肠道系统长期受到微生物、外来抗原和有害分子物质的侵害,并产生过量的活性氧和自由基。过量的活性氧和自由基会引起细胞内氧化-还原失衡,产生氧化应激,同时也导致分泌过量的促炎细胞因子和激活免疫反应,进而形成肠道炎症。炎症性肠病是一种典型的慢性肠道炎症性疾病,具有病程长、易反复发作且能增加患肠癌风险的特点,易对患者的生理、心理和生活质量产生不良影响[1]。
目前,常见的治疗炎症性肠病的药物主要有氨基水杨酸类、类固醇激素和免疫抑制剂,其主要是通过抑制或调节过度的炎症达到治疗效果[2]。这些药物治疗虽然可以将患者病情控制在缓解期,但是具有显著的副作用,包括增加患淋巴瘤、感染性并发症、内分泌损伤和高血压的风险,并且可能导致毒性危险因素的增加[3]。因此研究开发新的、安全的、具有治疗或辅助治疗炎症性肠病功能的天然产物及其衍生产品成为越来越多研究者关注的重点。
近年来,越来越多的蛋源性活性组分被发现具有多种生物学活性或治疗潜力。国内外许多研究已经证实了来源于禽蛋的多肽、蛋白质和脂质具有良好的抗氧化和抗肠道炎症效果,这为研究开发新型的抗肠炎药物提供了新的策略。因此,本文对禽蛋的生物活性组分在抗氧化和抗炎活性方面的相关研究进展以及这些生物活性组分对炎症性肠病的潜在治疗或辅助治疗的作用进行概述,并对其研究和应用进行展望,以期为蛋源性活性组分的进一步深入研究和开发利用提供参考。
1 炎症性肠病的发病机制
炎症性肠病是一种累及肠道的慢性非特异性炎症疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。UC是主要发生在结肠直肠伴随有全肠段的炎症,且损害基本集中在黏膜层和黏膜下层;而CD发生于所有肠段尤其是回肠组织伴随有整个肠组织,呈现纤维样变、肠道狭窄和瘘管的形成症状。
炎症性肠病发病的影响因素尚未完全明确,目前认为是环境因素作用于遗传易感人群,在肠道微生物菌群的作用下,启动了非免疫和免疫应答,抗原的持续刺激或免疫调节紊乱最终导致免疫反应和炎症。炎症性肠病发病的影响因素主要包括环境因素、遗传易感性、免疫反应、黏膜屏障受损以及肠道微生物菌群[4]。许多环境因素是诱发炎症性肠病的潜在因素,如饮食、吸烟、精神压力等。遗传易感性的本质原因是自身病原性免疫反应抵抗共生菌抗原不足,易感基因的多态性常与CD和UC相关。固有免疫和特异性免疫功能异常会导致炎症性肠病患者肠道炎症的异常反应。肠道黏膜屏障的完整性被破坏,使得肠道细菌、毒素和抗原等物质进入固有层,激活固有层免疫细胞诱发过度的黏膜免疫和肠道炎症。人类肠道微生物群起着维持肠道屏障和肠道微生物稳态的功能,肠道菌群的失衡是炎症性肠病发病的另一主要因素。
细胞因子是机体免疫细胞和非免疫细胞分泌的作用于局部或全身性炎症的具有免疫调节功能的蛋白质或小分子多肽。细胞因子可激活T细胞并使其分化,从而导致T细胞调节异常和调节型T细胞(regulatory cell,Treg)/辅助型T细胞(T helper cells,Th)1、Th2和Th17细胞在激活状态下失衡,加剧了肠道炎症疾病的发展和恶化[5]。根据细胞因子在炎症反应中的不同作用可将其分为促炎细胞因子和抗炎细胞因子[6]。促炎细胞因子包括白介素(interleukin,IL)-6、IL-12、肿瘤坏死因子(tumor necrosis factor,TNF)-α和干扰素(interferon,IFN)-γ等。IL-6是免疫细胞在IL-1、TNF或细胞内毒素刺激下分泌的,参与Th1和Th17细胞免疫应答。IL-6能够诱导Th17细胞产生IL-21并通过正反馈诱导IL-23R的表达,同时IL-21诱导信号转导及转录激活因子(signal transducer and activator of transcription,STAT)-3表达,并与IL-23系统共同诱导视黄酸受体相关孤儿受体(retinoic acid receptorrelated orphan receptor,ROR)-γt表达,促进IL-17的产生,从而参与CD的形成[7]。TNF-α是巨噬细胞或T细胞等在内毒素等作用下产生的能够诱导细胞增殖、分化和凋亡,增加其他细胞因子、趋化因子的生成以及黏附分子表达的非糖蛋白[8]。TNF-α通过与不同的受体(TNFR1和TNFR2)结合从而产生不同的效果。TNF-α与TNFR1结合后,通过激活半胱天冬酶和核转录因子(nuclear factor,NK)-κB介导细胞凋亡,诱导炎性因子、趋化因子的转录,造成急性免疫反应;TNFR2可促进T细胞增殖分化,破坏肠上皮细胞间的紧密连接,损害肠道黏膜的屏障作用,加速肠道炎症的形成[9]。IFN-γ主要由抗原和丝裂原激活的CD4+T细胞和CD8+T细胞分泌产生,主要作用是使细胞表达主要组织相容性复合物Ⅱ类抗原,改变上皮细胞膜紧密连接的膜微区中的蛋白质和脂质组成,导致慢性肠道炎症和黏膜损伤。与促炎细胞因子相对的是抗炎细胞因子如IL-4、IL-5、IL-10和转化生长因子(transforming growth factor,TGF)-β等,它们具有减缓炎症的作用。目前已有临床利用IL-10以及抗TNF单克隆抗体等治疗炎症性肠病的研究[10]。
许多研究表明,在炎症性肠病的发病过程中,CD与UC的发病机制不尽相同(图1)。许多研究已经阐明CD与Th1、Th17细胞介导的IL-6、IL-12、TNF-α、IL-17、IL-22和IL-23等促炎细胞因子的分泌有关;UC则与Th2细胞介导的IL-4、IL-5、IL-13等促炎细胞因子的分泌有关[11-12]。
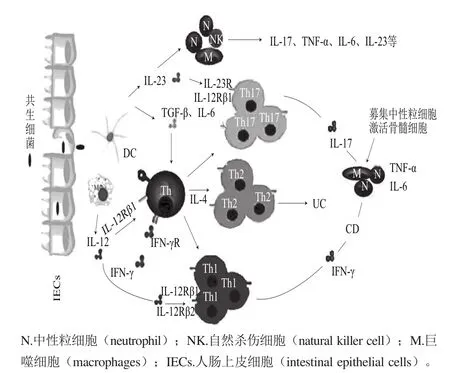
图1 炎症性肠病的发病机制示意图Fig.1 Schematic representation of the pathogenesis of inf l ammatory bowel disease
2 炎症性肠病的传统治疗方法与膳食介导策略的比较
目前炎症性肠病的传统治疗方案主要从控制活动性炎症和调节免疫紊乱两方面着手,常用的药物有水杨酸类、类固醇激素类和免疫抑制剂3 类。水杨酸类药物如美沙拉嗪是目前轻中度UC患者诱导缓解以及维持治疗的主要药物,但其作用有限,且伴有恶心、肠道不适等不良反应。同时该药物最适诱导缓解剂量仍有争议,且维持治疗的剂量也无统一标准[13]。糖皮质激素可迅速抑制炎症,但不可用于维持治疗,同时还会伴有对激素的依赖[14]。硫唑嘌呤可用于难治性CD的诱导缓解治疗,因为其代谢产物可以抑制嘌呤合成,从而起到抑制T淋巴细胞和浆细胞增殖的作用,同时可促进T细胞凋亡[15];但是该药物的使用会增加患淋巴瘤的风险,停药后患者白细胞计数减少。硫唑嘌呤不耐受或无效患者的诱导和维持缓解治疗常用甲氨蝶呤,甲氨蝶呤可阻断DNA和RNA合成,从而抑制活化的外周T细胞产生抗炎活性。甲氨蝶呤的不良反应主要有胃肠道反应、骨髓移植、皮肤黏膜反应、肝毒性、间质性肺炎和机会性感染等[16]。
由于常规医学治疗存在显著副作用和局限性,目前研究人员集中探索炎症性肠病的新型治疗策略。而膳食对肠道健康具有直接影响,研究发现各种膳食干预或营养补充剂在缓解以及恢复炎症性肠病患者的病变方面具有有益效果[17-18]。炎症性肠病患者特别是CD患者普遍存在体质量减轻、贫血等营养不良的现象,且缺乏葡萄糖、矿物质、维生素等基本营养元素,其中以蛋白质的缺失尤为明显[19];因此可以通过合理增加蛋白质的摄入从而改善其营养不良状态,从而在一定程度上缓解炎症性肠病。膳食干预虽然不能替代常规的医疗治疗,但是却能有效地促进黏膜愈合,降低炎症因子,减少手术并发症,同时还能够诱导和维持缓解CD[20]。研究发现某些天然产物如益生菌、益生元、氨基酸、多肽、蛋白质和脂质等具有缓解炎症性肠病的作用[21]。
目前已经发现许多功能性食品除具有营养功能外,还具有潜在的促进健康和治疗性质。谷胱甘肽(glutataione,GSH)可降低炎性反应,防止肠黏膜的缺血再灌注损伤,降低肠黏膜的通透性,从而维持肠黏膜屏障的完整性,缓解炎症性肠病[22]。Liu Xinxin等[23]发现给葡聚糖硫酸钠(dxtran sulfate sodium,DSS)诱导的结肠炎大鼠补充氨基酸混合物可以使其肠黏膜再生/再上皮化,促进肠黏膜愈合,同时可以上调髓过氧化物酶的活性,降低炎症性肠病的复发风险。基于氨基酸的饮食可以改善CD患者的肠道通透性,研究进一步证明了基于肽的饮食在治疗CD患者中的有效性[24]。N-3(ω-3)脂肪酸通过抑制IL-6的分泌,缓解三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)诱导的大鼠肠炎早期的黏膜炎症、溃疡和损伤,减少回肠细胞浸润和出血[25]。上述实验表明具有抗炎症和抗氧化性质的功能性成分如GSH、氨基酸、多肽和不饱和脂肪酸等在临床前结肠炎模型中可以通过调节受试者和动物的免疫系统,减少体内炎症达到缓解肠道炎症的作用。与传统炎症性肠病治疗方法相比,膳食干预对人体没有侵略性,因此可以用于炎症性肠病的预防和非药物治疗。
3 蛋源性活性组分对炎症性肠病的缓解作用
禽蛋含有丰富的营养成分如蛋白质、维生素矿物质以及不饱和脂肪酸等,已经证实这些营养素具有许多生物活性如抗菌、抗氧化以及抗炎等[26]。由于肠道中活化的炎症细胞会产生更多的活性氧,导致组织损伤以及诱导氧化应激,使得体内产生促炎细胞因子和许多氧化分解产物,加重体内炎症[27];因此有效缓解炎症性肠病的策略是通过外源性饮食提高抗氧化防御系统和抗炎症防御系统。许多蛋源性活性组分已被证明具有潜在的抗氧化、抗炎作用,因此禽蛋中产生的外源性抗氧化、抗炎剂是在慢性肠道炎症期间增强肠道系统抗氧化防御系统的潜在候选者。
3.1 蛋白质
禽蛋蛋白质已被广泛研究,如鸡蛋中的蛋清蛋白和蛋黄蛋白。蛋清蛋白包括卵转铁蛋白、卵白蛋白、卵黏蛋白、溶菌酶、抗生素蛋白、半胱氨酸蛋白酶抑制物、卵抑制剂和卵巨球蛋白等数百种蛋白质[26]。卵白蛋白是鸡蛋中含量最高的蛋白质,研究表明其具有较强的抗氧化活性,能够抑制脂质过氧化和金属螯合[26]。卵转铁蛋白的功能类似于超氧化物歧化酶,能够清除超氧阴离子自由基。研究表明结合了金属离子的卵转铁蛋白具有更好的清除活性,在结合了不同金属离子如Zn2+、Fe2+、Mn2+、Cu2+的卵转铁蛋白中,结合Cu2+的清除活性最好[28]。蛋黄蛋白主要是脂蛋白如卵黄高磷蛋白、高密度脂蛋白、低密度脂蛋白,可溶性蛋白质等数十种[26]。卵黄高磷蛋白是自然界磷酸化程度最高的糖蛋白,富含的丝氨酸使其能够螯合大量金属多价阳离子如Ca2+、Fe3+、Mg2+、Mn2+、Co2+等[29],从而有效抑制蛋黄中的脂质被金属离子氧化。这些蛋白质除本身具有抗氧化活性外,其水解或酶解产物常具有较高的抗氧化活性。
禽蛋蛋白除具有上述的抗氧化活性外,越来越多的证据显示禽蛋蛋白质具有抗炎活性,且正被用于进行治疗肠道疾病的研究,如鸡蛋白能够显著降低促炎细胞因子TNF-α、IL-6、IL-1b、IFN-C、IL-8和IL-17的局部表达,从而对DSS诱导的猪结肠炎模型具有一定的治疗效果[30];卵转铁蛋白能够显著抑制DSS诱导的结肠炎小鼠的结肠缩短以及TNF-α、IL-6、IL-1β、IFN-γ、MCP-1、IL-17A的表达,从而缓解小鼠的结肠炎进程[31]。
越来越多的研究显示,蛋白质在体内经过胃肠道一系列酶的作用下,主要是以氨基酸或多肽的形式发挥其生物学活性[32-33]。在抗炎或抗氧的分子机制方面,目前的研究多集中在通过氨基酸或小肽调节炎症信号转导的生物学机制。
3.2 多肽
禽蛋含有丰富的蛋白质资源,这些蛋白质经胃肠道消化可以产生分子大小、净电荷和溶解度各不相同的多肽。目前研究已经证明多肽具有较好的抗炎效果,而蛋源性的多肽具有潜在的抗炎效果,并且多肽更容易穿过肠腔进入黏膜与靶生物分子如膜受体相互作用,而表现出更好的生物学活性,如抗氧化和抗炎活性[34]。蛋源性多肽的抗氧化活性主要取决于具有强活性氧清除能力的氨基酸含量、分子构象和分子内键。一般来说,含有Cys、Met、Trp、Tyr、Phe、Ser、His的多肽抗氧化活性较好[35]。近期研究表明,C-末端和N-末端区域的理化性质对肽的抗氧化能力具有影响,且功能肽的抗氧化效率由C端区域的氨基酸决定[36]。鸡蛋蛋黄源的寡磷酸肽能抑制H2O2处理的Caco-2细胞中IL-8的分泌,同时通过上调GSH硫转移酶(glutathione S-transferase,GST)、过氧化氢酶和邻-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)含量提高胞内GSH浓度[37]。源于卵转铁蛋白的多肽可以抑制上皮炎性反应和缓解氧化应激[38]。Mine等[39]发现卵黄高磷蛋白磷酸肽(phosphopeptides,PPPs)及其衍生物具有一定的抗炎效果,用PPPs预处理Caco-2细胞后能抑制H2O2诱导的氧化应激释放IL-8,达到抗炎效果。此外,其水解物可通过上调GSH合成并提高抗氧化酶活性达到良好的抗氧化效果[40]。这些抗氧化肽在接近活性氧产生位点时比脂肪酸更不稳定更易氧化,从而起到保护细胞膜免受脂质氧化损伤的作用。
禽蛋蛋白源的多肽可以被传递到结肠上皮细胞中以降低炎症并调节促炎信号传递活动。Hou Yuchen等[41]研究表明用二肽丙氨酸-谷氨酰胺喂养DSS诱导的结肠炎模型小鼠,能够减少炎症介质的表达,提高黏蛋白2和热休克蛋白72的表达,从而增强小鼠黏膜的恢复。其他治疗靶位点如食源肽能够调节由IECs产生的与炎症反应相关的细胞信号活动同样引起研究人员的注意。谷氨酰肽已经被开发作为增强剂并表现出诱导钙敏感受体(calcium sensing receptor,CaSR)活化和提升细胞内钙水平的能力。谷氨酰肽包括γ-谷氨酰半胱氨酸(γ-glutamyl cysteine,γ-EC)和γ-谷氨酰缬氨酸(γ-glutamyl valine,γ-EV),都是调节CaSR介导的细胞信号传导事件的潜在变构激动剂,研究表明γ-EC和γ-EV在体外和体内炎症性肠病模型中均具有抑制炎症的作用[42]。
许多蛋源性多肽已相继被证实具有抗氧化以及抗肠炎活性,如C-末端含有强活性氧清除能力氨基酸的多肽常表现出较好的抗氧化活性。并且多肽相较于其他大分子活性组分,其更易与肠道中的靶分子结合,进而被肠道吸收并发挥抗肠道炎症的作用。
3.3 氨基酸
禽蛋中丰富的蛋白质经胃肠道消化后产生大量氨基酸,近年来许多研究已经证实某些氨基酸除作为蛋白质合成的底物外,还能通过自身及其代谢产物调节机体内环境稳态、营养物质代谢、抗氧化活性和抗炎活性。禽蛋中含有丰富的氨基酸如Asp、Leu、Ser、Lys、Phe、Val、Met、Ile、Cys、Tyr、His等,其中某些氨基酸已经在肠道系统中表现出抗氧化应激活性[43]。如Katayama等[44]发现用Cys、Val、Ile、Leu、Thr等预处理后能够抑制H2O2诱导Caco-2细胞的氧化应激。氨基酸的生物学活性主要取决于它们的侧链基团,具有含硫侧链基团的氨基酸如Met、Cys或芳香族侧链基团的氨基酸如Tyr、Phe、Trp常具有抗氧化活性。Ronchi等[45]发现,给无蛋白质喂养的小鼠投喂Met能够降低其体内活性氧水平,增加GSH含量,恢复肝脏的氧化还原平衡稳态。牛磺酸是半胱氨酸在肝脏中代谢的最终产物,其本身具有抗氧化性质。在TNBS诱导的小鼠结肠炎模型中,补充牛磺酸能够降低髓过氧化物酶活力并降低结肠组织中的活性氧生成[46]。结果表明,补充牛磺酸能够修复结肠中的氧化防御系统,从而降低肠道中的炎症。
由于色氨酸参与免疫抑制,所以一直是研究的焦点,其在活化的吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)作用下被分解代谢从而参与调节免疫系统的体内平衡[47]。研究显示Toll样受体活化和TNF-α、INF-γ等炎性介质能够诱导IDO活化、表达[48]。同时IDO的下游代谢产物可以诱导Th细胞分化为Treg细胞,并增加免疫抑制细胞因子的产生。在炎症性肠病患者中已经证实存在IDO过量表达和色氨酸减少的现象[49];由于色氨酸代谢能够诱导T细胞凋亡,DSS诱导的猪模型中色氨酸能够降低促炎因子表达,从而证明了色氨酸能够抑制Th1介导的炎症反应[50]。谷氨酰胺是肠细胞的主要能量来源,具有促进黏膜细胞增殖、修复长皮层、维持肠黏膜屏障和增强免疫应答的作用,所以被认为是改善肠道健康的潜在治疗物质。Beutheu等[51]确定谷氨酰胺和精氨酸补充剂能够通过调节应激蛋白活化激酶(c-Jun N-terminal kinase,JNK)、胞外信号调节激酶(extracellular signal-regulated kinase 1/2,ERK1/2)和激活核转录因子κB(nuclear factor-kappa B,NF-κB)活性,从而有效维持甲氨蝶呤诱导Caco-2模型肠道屏障的完整性并抑制炎症反应。
总体来看,许多氨基酸具有抗氧化活性,特别是具有含硫侧链基团以及芳香族侧链基团的氨基酸,其能够清除体内的活性氧或自由基,从而平衡体内的氧化还原状态,缓解机体氧化应激[52]。同时,某些氨基酸如色氨酸、谷氨酰胺以及精氨酸等可以通过抑制促炎因子的分泌调节炎症相关信号通路最终达到缓解炎症性肠病的作用。
3.4 脂质
禽蛋蛋黄含有丰富的脂肪酸,主要包括饱和脂肪酸(棕榈酸、硬脂酸和肉豆蔻酸)和不饱和脂肪酸(油酸、亚油酸、亚麻酸、棕榈油酸、花生四烯酸和二十二碳六烯酸),其中二十二碳六烯酸是人体内必需的ω-3多不饱和脂肪酸,其可通过影响免疫细胞和炎性细胞的功能来调节炎症。许多研究表明多不饱和脂肪酸具有一定的抗炎和抗氧化效果,这是因为这些脂肪酸对花生四烯酸衍生的前列腺素和白三烯的形成具有抑制作用。Mahmoudi等[53]研究证实通过传统方法饲养母鸡所产的鸡蛋蛋黄具有止痛抗炎的作用;黄志清等[54]发现长链ω-3多不饱和脂肪酸如二十二碳六烯酸在肠道上皮细胞中具有抗炎作用,这是由于二十二碳六烯酸在脂氧酶或阿司匹林环氧酶2作用下可以转化为具有减少炎性细胞浸润、抑制促炎细胞因子分泌和促进炎性细胞凋亡功能的化学介质消退素D和阿司匹林触发消退素。研究证实,给DSS和TNBS诱导的结肠炎小鼠喂食阿司匹林触发消退素D1和消退素D2能显著提高两种结肠炎模型中疾病活动指数,同时抑制促炎因子如TNF-α和IL-1β的分泌以及基因的表达[55]。Dona等[56]利用TNBS诱导的小鼠结肠炎模型研究细胞因子表达,结果表明喂食消退素E1可以抑制TNF-α、IL-12p40、吸入一氧化氮(inhaled nitric ocide,iNO)和环氧化酶(cyclooxygenase,COX)-2等促炎因子的表达。二十二碳六烯酸是人体内必需的ω-3多不饱和脂肪酸,其可通过影响免疫细胞和炎性细胞的功能来调节炎症。
4 蛋源性活性组分抗肠炎的作用机制
不同信号通路在炎症性肠病的发病机制中发挥着重要的作用,目前研究证明促炎因子可以改变肠黏膜屏障功能,NF-κB、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、酪氨酸激酶-信号转导转录激活因子(janus kinase-signal transduction and transcription activator,JAK-STAT)等信号通路的转导,这些通路成为潜在的炎症性肠病研究和治疗靶位点[57]。同时基于食源性活性组分的干预措施已经显示出食源性活性组分具有减轻肠道炎症的治疗作用,因此仍需要探索通过氨基酸、肽或蛋白质等调节炎症信号转导的生物学机制。
4.1 NF-κB信号通路介导的抗炎活性
NF-κB是存在于哺乳动物细胞中的转录因子,可以和多种基因的启动子序列的特定位点结合而促进基因转录和表达,从而调控细胞凋亡、细胞黏附、细胞增殖、特异和非特异性免疫应答和炎症等过程。氧化应激、促炎因子如TNF-α或细菌性化合物如脂多糖(lipopolysaccharides,LPS)等外源刺激物会诱发炎症反应,而TNF-α和LPS则是强效的免疫系统刺激剂,能够诱导kappa B抑制剂(kappa B inhibitor,IκB)磷酸化进而被蛋白酶降解,游离的NF-κB进入细胞核内与相应的调节因子结合,从而激活很多诱导促炎细胞因子的基因表达[58]。这些外源性刺激物还可以启动非特异性免疫产生更多的促炎细胞因子如TNF、IFN和IL,这些促炎细胞因子反作用于NF-κB,进一步加重炎症反应。然而具有抗炎活性的物质可以通过抑制NF-κB信号转导下调促炎细胞因子的产生[59-60]。研究表明鸡蛋膜蛋白酶解物及其超滤组分能够有效抑制TNF-α和LPS诱导的IκBα磷酸化,减少p-IκB生成,从而下调促炎细胞因子的转录和表达,抑制炎症的发展和扩大[61]。从鸡蛋卵转铁蛋白中分离的三肽Ile-Arg-Trp在浓度为50 μmol/L时可通过抑制IκBα磷酸化阻断NF-κB细胞信号通路,从而减少细胞膜上黏附分子表达,调控TNF-α诱导的细胞炎性反应[38]。研究表明,源于卵转铁蛋白的二肽Cys-Arg、Phe-Leu、His-Leu、Leu-Leu和Met-Lys通过抑制TNF-α诱导的Caco-2细胞IκB抑制剂的磷酸化,阻断了NF-κB信号通路,抑制了促炎细胞因子如IL-8的分泌以及促炎细胞因子如TNF-α、IL-8、IL-6、IL-1β和IL-12的基因表达,从而减轻了肠道炎症[62]。Katayama[44]、Son[63]等发现许多氨基酸如His、Val、Leu等可通过抑制TNF-α诱导NF-κB活化、刺激κ1/Nrf2信号通路,从而抑制IL-8的分泌,上调GSH、GST和过氧化氢酶(catalase,CAT)的活性,减少氧化应激缓解体内炎症。

表1 蛋源性活性组分对炎症性肠病缓解作用机制Table1 Mechanisms of bioactive egg components in alleviating inf l ammatory bowel disease
4.2 MAPK信号通路介导的抗炎活性
MAPK是真核细胞中高度保守的信号转导通路,通过磷酸化核转录因子、细胞骨架蛋白及酶类等调节细胞增殖、分化和凋亡,与炎症、肿瘤等多种疾病密切相关。其可以被一系列的胞外信号或刺激所激活,如细菌复合物、生长因子及促炎细胞因子等。促炎细胞因子如TNF-α、IL-6、IL-8、IL-17和IL-1β等不仅可以激活MAPK信号通路,还可以利用MAPK信号通路级联反应放大炎症反应;因此可以通过抑制促炎细胞因子激活MAPK信号通路达到缓解炎症的作用。在TNF-α诱导Caco-2炎症模型中,二肽γ-EC和γ-EV通过刺激Ca2+敏感受体CaSR磷酸化,使得CaSR-β-arrestin2与TNF-α相关受体竞争结合,下调TNF-α诱导细胞炎症信号通路中JNK磷酸化,从而阻断MAPK(JNK)通路激活,抑制由TNF-α诱导的细胞炎性反应[64]。Wang Xiong等[62]研究表明卵转铁蛋白衍生二肽CR、HC、LL,FL和MK可以抑制MAPK信号通路中的JNK和p38的磷酸化,降低促炎因子IL-8的分泌,从而发挥其抗炎活性。
蛋源性活性组分通过调控上述炎症信号通路起到缓解炎症性肠病的作用,研究表明不同的禽蛋蛋白源性活性组分调控的炎症相关信号通路多不相同(表1)。许多研究显示,这些活性组分通常通过多条信号通路共同调节机体炎症反应,同时调控信号通路中炎症相关细胞因子的表达。蛋源性活性组分通过信号通路缓解炎症性肠病是一个复杂的过程,其具体的调控机制仍需要深入研究。
5 结 语
炎症性肠病患者常伴有肠道的氧化应激和慢性炎症,目前缺乏有效针对氧化应激和慢性炎症且无副作用的医疗手段,这使得找到替代治疗策略显得至关重要。蛋源性活性组分已经显示出具有缓解甚至是辅助治疗炎症性肠病的作用,而有望成为治疗炎症性肠病的新策略;但是,蛋源性抗肠炎活性组分的分子作用机制、构效关系以及应用仍然有待进一步研究,现提出以下展望。
深入探究蛋源性各抗肠炎活性组分的分子作用机制。蛋源性活性组分可以通过调节促炎细胞因子的分泌以及相关信号通路等方面来缓解肠道炎症并恢复肠黏膜内稳态;但目前大多数研究都是集中在蛋源性氨基酸和多肽的抗炎生物活性上,对蛋源性蛋白质以及脂质的研究较少,并且多集中在对蛋源性活性组分的生物学功能的验证上,对它们的具体分子作用机制研究甚少。
解析蛋源性抗肠炎活性组分的构效关系。蛋源性活性组分如蛋白质、多肽等的分子质量大小、带电性质、侧链基团都会影响其抗氧化与抗肠炎活性,现阶段对蛋源性活性组分的构效关系研究较少,且多为理论推测,缺乏实验依据;因此研究蛋源性活性组分的结构与活性之间的关系显得尤为重要。解析蛋源性活性组分的构效关系可为其分子作用机制研究提供理论基础。
蛋源性抗炎活性组分的开发利用。我国是世界上禽蛋产量最多的国家,目前占世界禽蛋总产量的42%左右,其产业总产值在国民经济中占有重要地位。禽蛋营养丰富,其中富含蛋白质与脂质,数百种结构不同的蛋白质又可为多肽的释放提供丰富结构基础。大量研究已经证实蛋白质、脂肪、多肽等蛋源性活性组分具有抗氧化与缓解炎症性肠病的作用,本团队前期研究也发现皮蛋蛋白水解物和仿生酶酶解产物在体内外均具有一定的抗肠道炎症的作用。因此,以禽蛋为原料筛选分离出更多的活性组分并深入研究其缓解炎症性肠病的作用机制,可为构建以禽蛋为基础的缓解炎症性肠病的膳食策略与蛋源性抗肠炎产品的开发提供理论依据。
[1] 朱迎, 丁霞芬, 林征, 等. 炎症性肠病患者生活质量及影响因素调查[J].护理管理杂志, 2013, 13(4): 240-242.
[2] 陶文惠, 夏冰. 炎症性肠病传统治疗的常用药物[J]. 中国处方药,2010(2): 44-45.
[3] BAUMGART D C, SANDBORN W J. Inf l ammatory bowel disease:clinical aspects and established and evolving therapies[J]. The Lancet,2007, 369: 1641-1657. DOI:10.1016/S0140-6736(07)60751-X.
[4] GOYAL N, RANA A, AHLAWAT A, et al. Animal models of inflammatory bowel disease: a review[J]. Inflammopharmacology,2014, 22(4): 219-233. DOI:10.1007/s10787-014-0207-y.
[5] SANCHEZ M F, DOMINGUEZ L A, YAMAMOTO F J K. Role of cytokines in inflammatory bowel disease[J]. World Journal of Gastroenterology, 2008, 14(27): 4280-4288. DOI:10.3748/wjg.14.4280.
[6] ROBERT K, SUSANNE Z, TEAKE K. Cytokines and atherosclerosis:a comprehensive review of studies in mice[J]. Cardiovascular Research, 2008, 79(3): 360-376. DOI:10.1093/cvr/cvn120.
[7] IVANOV I I, MCKENZIE B S, ZHOU L, et al. The orphan nuclear receptor RORγt directs the differentiation program of proinf l ammatory IL-17+T helper cells[J]. Cell, 2006, 126(6): 1121-1133. DOI:10.1016/j.cell.2006.07.035.
[8] PAUL A T, GOHIL V M, BHUTANI K K. Modulating TNF-α signaling with natural products[J]. Drug Discovery Today, 2006,11(15/16): 725-732. DOI:10.1016/j.drudis.2006.06.002.
[9] BILLIET T, RUTGEERTS P, FERRANTE M, et al. Targeting TNF-α for the treatment of inf l ammatory bowel disease[J]. Expert Opinion on Biological Therapy, 2014, 14(1): 75-101. DOI:10.1517/14712598.201 4.858695.
[10] SCHLOTTMANN K, WACHS F P, GROSSMANN J, et al. Interferon γ downregulates IL-8 production in primary human colonic epithelial cells without induction of apoptosis[J]. International Journal of Colorectal Disease, 2004, 19(5): 421-429.
[11] 李呈贞, 陈广洁. Th17及Th17型细胞因子与炎症性肠病[J]. 免疫学杂志, 2012, 28(4): 349-352.
[12] WALLACE K L, ZHENG L B, KANAZAWA Y, et al.Immunopathology of inf l ammatory bowel disease[J]. World Journal of Gastroenterology, 2014, 20(1): 6-21. DOI:10.3748/wjg.v20.i1.6.
[13] SILVERBERG M S, SATSANGI J, AHMAD T, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology[J]. Canadian Journal of Gastroenterology, 2005, 19(Suppl A): 5A-36A.DOI:10.1155/2005/269076.
[14] KRUPOVES A, MACK D R, SEIDMAN E G, et al. Immediate and long-term outcomes of corticosteroid therapy in pediatric Crohn’s disease patients[J]. Inflammatory Bowel Diseases, 2011, 17(4):954-962. DOI:10.1002/ibd.21415.
[15] 李玥, 钱家鸣. 免疫抑制剂在炎症性肠病中的治疗新进展[J]. 中国医院用药评价与分析, 2014, 14(1): 3-4.
[16] RUTGEERTS P. A critical assessment of new therapies in inflammatory bowel disease[J]. Journal of Gastroenterology &Hepatology, 2002, 17(Suppl 1): S176-S185.
[17] ROSSI R E, WHYAND T, MURRAY C D, et al. The role of dietary supplements in inf l ammatory bowel disease: a systematic review[J].European Journal of Gastroenterology & Hepatology, 2016, 28(12):1357-1364. DOI:10.1097/MEG.0000000000000728.
[18] JAVELLI D R. Diet and nutrition in the treatment of Crohn’s disease[M]. Berlin: Springer International Publishing, 2015: 265-279.
[19] SASAKI M, JOHTATSU T, KURIHARA M, et al. Energy metabolism in Japanese patients with Crohn’s disease[J]. Journal of Clinical Biochemistry & Nutrition, 2010, 46(1): 68-72. DOI:10.3164/jcbn.09-55.
[20] 王龙, 辛毅. 炎症性肠病的营养支持治疗进展回顾[J]. 中国老年保健医学, 2015, 13(3): 60-63. DOI:10.3969/j.issn.1672-4860.2015.03.030.
[21] PARIAN A, LIMKETKAI B N. Dietary supplement therapies for inf l ammatory bowel disease: Crohn’s disease and ulcerative colitis[J].Current Pharmaceutical Design, 2015, 22(2): 180-188. DOI:10.2174/1 381612822666151112145033.
[22] QUAN Z F, YANG C, LI N, et al. Effect of glutamine on change in early postoperative intestinal permeability and its relation to systemic inf l ammatory response[J]. World Journal of Gastroenterology, 2004,10(13): 1992-1994.
[23] LIU Xinxin, BEAUMONT M, WALKER F, et al. Beneficial effects of an amino acid mixture on colonic mucosal healing in rats[J]. Inflammatory Bowel Diseases, 2013, 19(13): 2895-2905.DOI:10.1097/01.MIB.0000435849.17263.c5.
[24] TEAHON K, SMETHURST P, PEARSON M, et al. The effect of elemental diet on intestinal permeability and inf l ammation in Crohn’s disease[J]. Gastroenterology, 1991, 101(1): 84-89. DOI:10.1016/0016-5085(91)90463-U.
[25] ANDOH A, TSUJIKAWA T, ISHIZUKA I, et al. N-3 fatty acidrich diet prevents early response of interleukin-6 elevation in trinitrobenzene sulfonic acid-induced enteritis[J]. International Journal of Molecular Medicine, 2003, 12(5): 721-724. DOI:10.3892/ijmm.12.5.721.
[26] TING B, POULIOT Y, GAUTHIER S F, et al. Fractionation of egg proteins and peptides for nutraceutical applications[J]. Separation Extraction and Concentration Processes in the Food, Beverage and Nutraceutical Industries, 2013: 595-618. DOI:10.1533/9780857090751.2.595.
[27] PORTUGAL M, BARAK V, GINSBURG I, et al. Interplay among oxidants, antioxidants, and cytokines in skin disorders: present status and future considerations[J]. Biomedicine & Pharmacotherapy, 2007,61(7): 412-422. DOI:10.1016/j.biopha.2007.05.010.
[28] IBRAHIM H R, HOQ M I, AOKI T. Ovotransferrin possesses SOD-like superoxide anion scavenging activity that is promoted by copper and manganese binding[J]. International Journal of Biological Macromolecules, 2007, 41(5): 631-640. DOI:10.1016/j.ijbiomac.2007.08.005.
[29] 刘瑜, 殷涌光, 刘静波, 等. 卵黄高磷蛋白的功能性质及其制备方法研究[J]. 食品科学, 2006,27(12): 863-866.
[30] LEE M, KOVACS-NOLAN J, ARCHBOLD T, et al. Therapeutic potential of hen egg white peptides for the treatment of intestinal inflammation[J]. Journal of Functional Foods, 2009, 1(2): 161-169.DOI:10.1016/j.jff.2009.01.005.
[31] KOBAYASHI Y, RUPA P, KOVACS-NOLAN J, et al. Oral administration of hen egg white ovotransferrin attenuates the development of colitis induced by dextran sodium sulfate in mice[J].Journal of Agricultural and Food Chemistry, 2015, 63(5): 1532-1539.DOI:10.1021/jf505248n.
[32] MAJUMDER K, CHAKRABARTI S, DAVIDGE S T, et al. Structure and activity study of egg protein ovotransferrin derived peptides (IRW and IQW) on endothelial inf l ammatory responseand oxidative stress[J].Journal of Agricultural & Food Chemistry, 2013, 61(9): 2120-2129.DOI:10.1021/jf3046076.
[33] JAHANDIDEH F, MAJUMDER K, CHAKRABARTI S, et al.Benef i cial effects of simulated gastro-intestinal digests of fried egg and its fractions on blood pressure, plasma lipids and oxidative stress in spontaneously hypertensive rats[J]. PLoS ONE, 2014, 9(12): e115006.DOI:10.1371/journal.pone.0115006.
[34] ZHAO Y, YAO Y, XU M S, et al. Simulated gastrointestinal digest from preserved egg white exerts anti-inf l ammatory effects on Caco-2 cells and a mouse model of DSS-induced colitis[J]. Journal of Functional Foods, 2017, 35: 655-665. DOI:10.1016/j.jff.2017.06.028.
[35] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015: 5-6.
[36] LI Y W, LI B. Characterization of structure: antioxidant activity relationship of peptides in free radical systems using QSAR models: key sequence positions and their amino acid properties[J].Journal of Theoretical Biology, 2013, 318: 29-43. DOI:10.1016/j.jtbi.2012.10.029.
[37] K A T A Y A M A S, I S H I K A W A S, F A N M Z, e t a l.Oligophosphopeptides derived from egg yolk phosvitin up-regulate γ-glutamylcysteine synthetase and antioxidant enzymes against oxidative stress in Caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55(8): 2829-2835. DOI:10.1021/jf0628936.
[38] HUANG W, CHAKRABARTI S, MAJUMDER K, et al. Egg-derived peptide IRW inhibits TNF-α-induced inflammatory response and oxidative stress in endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 10840-10846. DOI:10.1021/jf102120c.
[39] MINE Y, KOVACS-NOLAN J. New insights in biologically active proteins and peptides derived from hen egg[J]. World’s Poultry Science Journal, 2006, 62(1): 87-96. DOI:10.1079/WPS200586.
[40] XU C, YANG C B, YIN Y G, et al. Phosphopeptides (PPPs) from hen egg yolk phosvitin exert anti-inf l ammatory activity via modulation of cytokine expression[J]. Journal of Functional Foods, 2012, 4(4): 718-726. DOI:10.1016/j.jff.2012.04.011.
[41] HOU Yuchen, CHU C C, KO T L, et al. Effects of alanyl-glutamine dipeptide on the expression of colon-inf l ammatory mediators during the recovery phase of colitis induced by dextran sulfate sodium[J].European Journal of Nutrition, 2013, 52(3): 1089-1098. DOI:10.1007/s00394-012-0416-3.
[42] ZHANG Hua. Anti-inf l ammatory effects of allosteric agonist peptides of calcium: sensing receptor in intestinal mucosal system[D]. Guelph:University of Guelph, 2013: 62-95.
[43] ELIAS R J, KELLERBY S S, DECKER E A. Antioxidant activity of proteins and peptides[J]. Critical Reviews in Food Science and Nutrition, 2008, 48(5): 430-441. DOI:10.1080/10408390701425615.
[44] KATAYAMA S, MINE Y. Antioxidative activity of amino acids on tissue oxidative stress in human intestinal epithelial cell model[J].Journal of Agricultural and Food Chemistry, 2007, 55(21): 8458-8464.DOI:10.1021/jf070866p.
[45] RONCHI V P, GIUDICI A M, MENDIETA J R, et al. Oxidative stress in mouse liver caused by dietary amino acid deprivation: protective effect of methionine[J]. Journal of Physiology and Biochemistry, 2010,66(2): 93-103. DOI:10.1007/s13105-010-0014-x.
[46] SON M, KO J I, KIM W B, et al. Taurine can ameliorate inf l ammatory bowel disease in rats[J]. Oxygen Transport to Tissue XXXIII, 1998,442: 291-298.
[47] MOFFETT J R, NAMBOODIRI M A. Tryptophan and the immune response[J]. Immunology and Cell Biology, 2003, 81(4): 247-265.DOI:10.1046/j.1440-1711.2003.t01-1-01177.x.
[48] PENBERTHY W T. Pharmacological targeting of IDO-mediated tolerance for treating autoimmune disease[J]. Current Drug Metabolism,2007, 8(3): 245-266. DOI:10.2174/138920007780362545.
[49] WOLF A M, WOLF D, RUMPOLD H, et al. Overexpression of indoleamine 2,3-dioxygenase in human inflammatory bowel disease[J]. Clinical Immunology, 2004, 113(1): 47-55. DOI:10.1016/j.clim.2004.05.004.
[50] KIM C J, KOVACS-NOLAN J A, YANG C, et al. L-tryptophan exhibits therapeutic function in a porcine model of dextran sodium sulfate (DSS)-induced colitis[J]. The Journal of Nutritional Biochemistry, 2010, 21(6): 468-475. DOI:10.1016/j.jnutbio.2009.01.019.
[51] BEUTHEU S, GHOUZALI I, GALAS L, et al. Glutamine and arginine improve permeability and tight junction protein expression in methotrexate-treated Caco-2 cells[J]. Clinical Nutrition, 2013, 32(5):863-869. DOI:10.1016/j.clnu.2013.01.014.
[52] HAN C H, LIU J C, FANG S U, et al. Antioxidant activities of the synthesized thiol-contained peptides derived from computeraided pepsin hydrolysis of yam tuber storage protein, dioscorin[J].Food Chemistry, 2013, 138(2/3): 923-930. DOI:10.1016/j.foodchem.2012.11.101.
[53] MAHMOUDI M, EBRAHIMZADEH M A, POURMORAD F, et al.Anti-inflammatory and analgesic effects of egg yolk: a comparison between organic and machine made[J]. European Review for Medical& Pharmacological Sciences, 2013, 17(4): 472-476.
[54] 黄志清, 陈小玲, 陈代文, 等. 长链n-3多不饱和脂肪酸对肠上皮细胞促炎细胞因子基因mRNA表达的影响[J]. 动物营养学报, 2012,24(7): 1384-1388. DOI:10.1969/j.issn.1006-267x.2012.07.025.
[55] BENTO A F, CLAUDINO R F, DUTRA R C, et al. ω-3 fatty acidderived mediators 17(R)-hydroxy docosahexaenoic acid, aspirintriggered resolvin D1 and resolvin D2 prevent experimental colitis in mice[J]. Journal of Immunology, 2011, 187(4): 1957-1969.DOI:10.4049/jimmunol.1101305.
[56] DONA M, FREDMAN G, SCHWAB J M, et al. Resolvin E1, an EPA-derived mediator in whole blood, selectively counterregulates leukocytes and platelets[J]. Blood, 2008, 112(3): 848-855.DOI:10.1182/blood-2007-11-122598.
[57] CHRISTOPHI G P, RONG R, HOLTZAPPLE P G, et al. Immune markers and differential signaling networks in ulcerative colitis and Crohn’s disease[J]. Inf l ammatory Bowel Diseases, 2012, 18(12): 2342-2356. DOI:10.1002/ibd.22957.
[58] TAK P P, FIRESTEIN G S. NF-kappa B: a key role in inf l ammatory diseases[J]. Journal of Clinical Investigation, 2001, 107(1): 7-11.DOI:10.1172/JCI11830.
[59] HÅVERSEN L, OHLSSON B G, HAHN-ZORIC M, et al. Lactoferrin down-regulates the LPS-induced cytokine production in monocytic cells via NF-κB[J]. Cellular Immunology, 2002, 220(2): 83-95.DOI:10.1016/S0008-8749(03)00006-6.
[60] KIM K J, LEE J S, KWAK M K, et al. Anti-inflammatory action of mollugin and its synthetic derivatives in HT-29 human colonic epithelial cells is mediated through inhibition of NF-κB activation.[J].European Journal of Pharmacology, 2009, 622(1/2/3): 52-57.DOI:10.1016/j.ejphar.2009.09.008.
[61] 史雅凝. 鸡蛋膜蛋白酶解物的制备及其对肠道氧化应激和炎症的影响[D]. 无锡: 江南大学, 2015: 47-60.
[62] WANG Xiong, ZHAO Yan, YAO Yao, et al. Anti-inflammatory activity of di-peptides derived from ovotransferrin by simulated peptide-cut in TNF-α-induced Caco-2 cells[J]. Journal of Functional Foods, 2017, 37: 424-432. DOI:10.1016/j.jff.2017.07.064.
[63] SON D O, SATSU H, SHIMIZU M. Histidine inhibits oxidative stressand TNF-α-induced interleukin 8 secretion in intestinal epithelial cells[J]. FEBS Letters, 2005, 579(21): 4671-4677. DOI:10.1016/j.febslet.2005.07.038.
[64] ZHANG H, KOVACS-NOLAN J, KODERA T, et al. γ-glutamyl cysteine and γ-glutamyl valine inhibit TNF-α signaling in intestinal epithelial cells and reduce inf l ammation in a mouse model of colitis via allosteric activation of the calcium-sensing receptor[J]. Biochimica et Biophysica Acta (BBA): Molecular Basis of Disease, 2015, 1852(5):792-804. DOI:10.1016/j.bbadis.2014.12.023.
[65] MELLOR A L, MUNN D H. IDO expression by dendritic cells:tolerance and tryptophan catabolism[J]. Nature Reviews Immunology,2004, 4(10): 762-774. DOI:10.1038/nri1457.
[66] KATAYAMA S, XU X, FAN M Z, et al. Antioxidative stress activity of oligophosphopeptides derived from hen egg yolk phosvitin in Caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 773-778. DOI:10.1021/jf052280d.
