基于食品级固体颗粒稳定的Pickering乳液研究进展
2018-03-20石爱民刘红芝
焦 博,石爱民,刘红芝,刘 丽,胡 晖,杨 颖,王 强*
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
20世纪初,Ramsden[1]发现在乳液中,可以使用固体颗粒替代传统乳化剂来实现体系的稳定,随后Pickering[2]针对此发现展开了更进一步的研究并作出了突出的贡献,这一类以固体颗粒稳定的乳液以他的姓氏命名,即Pickering乳液。与小分子表面活性剂和以天然大分子稳定的传统乳液相比,Pickering乳液中起到乳化作用的固体颗粒在水-油界面上的吸附过程不可逆,因为颗粒不仅降低了体系的总自由能,也为液滴之间的接触提供了空间上的物理屏障,赋予了Pickering乳液更强的稳定性。目前可以稳定Pickering乳液的颗粒多为SiO2、TiO2等在内的无机材料颗粒,并且它们已应用在多个领域当中,例如用于化妆品中可以提高防晒性和降低皮肤刺激性[3-4],用于油田中可以提高油基钻井液稳定性[5]或提高采油率[6];在高分子材料领域通过Pickering乳液模板法可以进一步制备各种多孔材料[7]、中空微球[8]、Janus粒子[9]等,在化工领域可应用于催化剂的分离和回收[10],在医药领域可用于药物局部释放[11]。
乳液对食品工业的发展至关重要,例如蛋白饮料、冰激凌、蛋黄酱等都是食品消费中常见的乳液体系。乳液不仅赋予产品独特的感官品质,而且在营养传递方面也有着重要的价值。乳化剂的添加是乳液制备的必要条件,然而近年来传统乳化剂中小分子表面活性剂(low molecular weight surfactants,LWSFs)的安全问题引发了消费者们的担忧[12],无LWSFs的食品乳液将更贴合消费者的实际需求。除了食品安全问题外,由于食品体系复杂多样,传统乳化剂在某些情况下常常难以满足稳定体系的需要,如植物蛋白在等电点时的絮凝问题一直以来限制着酸性植物蛋白饮料的发展,且添加LWSFs和两亲性生物大分子均无法解决这一问题。将Pickering乳液引入到食品工业领域中,将能够解决乳液体系安全性及稳定性问题,但是常见的以无机颗粒(非食品级)稳定的Pickering乳液的生物相容性、生物可降解性等问题限制了Pickering乳液在食品工业中的应用。为解决上述问题,经过食品科研工作者的不懈努力,近年来以蛋白质、多糖为原材料制备出可以稳定Pickering乳液的食品级固体颗粒的报道不断增多,并且在食品工业中的应用也逐步深入,食品级Pickering乳液的研制与开发已成为国际上研究的热点。本文基于食品级固体颗粒稳定的Pickering乳液的最新研究进展,从颗粒在Pickering乳液中的界面行为、颗粒及其稳定的乳液的制备和表征方法、Pickering乳液在食品领域中的应用等方面进行综述,以期为Pickering乳液在食品领域中的进一步应用提供理论依据。
1 颗粒的界面行为
固体颗粒稳定Pickering乳液的方式不同于由LWSFs或两亲性生物大分子稳定传统乳液,传统分散体系的稳定理论并不完全适用于Pickering乳液,因此理解颗粒在水-油界面上的行为是开展Pickering乳液研究工作的前提。
1.1 颗粒的热力学吸附行为
固体颗粒作为乳化剂的前提是能够被两相同时润湿且不完全溶于乳液任何一相。颗粒吸附在界面上的水、油、颗粒三相的接触角(θ)是反应颗粒润湿性的重要参数,也是判断乳液类型以及颗粒是否能够稳定乳液的重要条件。在界面上,颗粒使得界面朝向对颗粒吸引力较小的一面弯曲,如果颗粒更倾向于被水润湿,则形成水包油(O/W)型乳液,反之则形成油包水(W/O)型乳液,即θ小于90°时,形成O/W型乳液,θ大于90°时形成W/O型乳液[13]。
从热力学角度来说,只要θ不接近0°或180°,即可认为颗粒在界面上的吸附是不可逆的,这是因为颗粒脱离界面的解吸能远大于热能,颗粒脱离界面需要突破巨大的能量屏障[14],而这种能量屏障赋予了Pickering乳液更高的稳定性。颗粒脱离界面所需要的能量可用式(1)表示[13,15-16]。
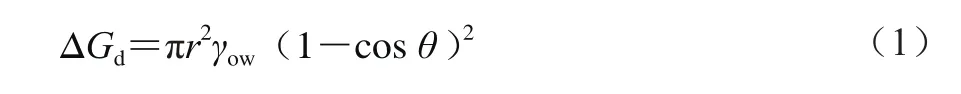
式中:ΔGd为自发解吸自由能/J;r为颗粒的半径/m;γow为油-水界面张力/(N/m);θ为颗粒的三相接触角/(°)。
从式(1)可以看出,自发解吸自由能取决于r、γow和θ,r和γow越大、θ越接近90°,颗粒的ΔGd越大,而实验表明ΔGd实际更大程度上取决于r和γow,Goebel等[17]对比了界面张力在50 mN/m(水和纯烷烃的界面张力)和25 mN/m(水和精炼植物油的界面张力)时不同大小颗粒的自发解析自由能后发现,γow对ΔGd的影响很小。
1.2 颗粒在界面上的排布及形变
颗粒吸附在界面上后,会形成一层界面膜,这种界面膜的性能取决于颗粒与颗粒之间以及颗粒与两相之间的交互作用。颗粒间的引力使得吸附层具有特殊的机械强度和刚性,为乳液抗聚结提供了独特的物理屏障。此外,两相界面因颗粒的吸附发生形变,产生了横向毛细管吸引力,进一步提高了乳液的稳定性[18-19]。如果颗粒能发生一定的形变(如酪蛋白等软颗粒),那么吸附到界面后可能会发生弯曲、变平等行为,界面的强度也随之增强[20],Capron等[21]同样发现杆状微晶纤维素纳米晶体会在界面发生弯曲,这种行为巩固了颗粒的吸附。
1.3 颗粒界面行为的调节
由于大多数天然食品级颗粒并不具有良好的两相润湿性,其在界面上的三相接触角通常不能达到稳定Pickering乳液的要求,因此需要对颗粒的界面行为进行调节。例如大多数天然淀粉颗粒拥有较强的亲水性,吸附在界面上后大部分处于水相,因此需要在吸附前对颗粒进行疏水改性,常用的方法是利用辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)对其进行酯化,在淀粉颗粒上引入疏水基团以增强其疏水性[22-25]。
2 食品级颗粒及其稳定的Pickering乳液的制备
可食用的天然多糖、蛋白质是自然界可再生的资源,其生物相容性和可降解性远优于无机材料,但由于润湿性、水溶性等问题不能直接用于稳定Pickering乳液,近年来科研工作者们通过修饰、改性、复合等多种手段,以天然多糖、蛋白质为材料制备出了食品级固体颗粒,并实现了Pickering乳液的稳定(表1)。
2.1 多糖颗粒稳定的Pickering乳液
淀粉颗粒粒径在0.5~100.0 μm之间[55],由于直链淀粉和支链淀粉比例不同,颗粒呈球形、扁平形等形状。绝大多数淀粉高度亲水,需要通过化学或物理改性方式调节颗粒的界面行为以实现Pickering乳液的稳定。化学改性中,通过OSA化学改性增强淀粉颗粒的疏水性最为常见[22-25],也有学者利用乙酸酐、邻苯二甲酸酐酯化结合纳米沉淀法[26-27]和硫酸水解法[28-29]对淀粉颗粒进行改性。物理改性方面,Villamonte等[30]通过高压处理(600 MPa、6 min)玉米淀粉水溶液制备出的颗粒对Pickering乳液具有良好的稳定效果。实际上,一部分天然的淀粉颗粒可以直接稳定Pickering乳液,Li Chen等[31]发现不经过修饰的天然大米淀粉颗粒、糯玉米淀粉颗粒和小麦淀粉颗粒均能稳定Pickering乳液,而土豆淀粉不能,其中大米淀粉的乳化性能最好。淀粉颗粒稳定的Pickering乳液一般通过高速剪切、高压均质乳化或者两者结合的方法进行制备。

表1 食品级固体颗粒及其稳定的Pickering乳液的制备及应用Table1 Preparation and application of food-grade particles for stabilizing Pickering emulsions
纤维素是自然界蕴藏丰富的可再生资源,其化学结构是由D-吡喃葡萄糖环彼此之间通过β-1,4-糖苷键以C1椅式构象连接而成的线形高分子[56]。Kargar等[32]通过将市售微晶纤维素添加到去离子水中并在45~50 ℃条件下搅拌40 min制备悬浮液,微晶纤维素颗粒在pH 3~8范围内带有大量负电荷,经高速剪切乳化后,颗粒在界面上提供的静电斥力可以有效阻止液滴的聚结。Wang Wenhang等[33]使用硫酸水解法从芦笋茎叶中制备了纤维素纳米晶体,晶体粒径在178.2~261.8 nm之间,且结晶度为72.4%~77.2%,经过超声乳化后,水解3 h制备的颗粒能够更有效地稳定水包棕榈油乳液。Wen Chunxia等[34]将玉米芯纤维素添加到1 mol/L过硫酸铵溶液中,并在60 ℃下放置16 h后获得纳米纤维素晶体悬浮液,随后对悬浮液进行多次离心水洗,直至溶液在pH 4时的电导率与去离子水(5 μS/cm)相近,经超声乳化后得到纤维素乳液,该乳液的稳定性在20~70 ℃范围内随着温度的升高而提高。
壳聚糖是自然界唯一的阳离子多糖,因其结构特殊,可制备具有pH值刺激响应特性的功能材料。Wang Xiaoyan等[35]在没有添加任何表面活性剂或者交联剂的情况下,通过高密度超声处理制备了壳聚糖稳定的Pickering乳液,其平均直径低于1.7 μm,且能在5 个月内保持稳定。超声处理能够破坏和分散壳聚糖聚集体结构,提高其乳化性,乳液的稳定性和乳液类型可以通过壳聚糖对于pH值的响应进行控制。Shah等[36]优化了壳聚糖-三聚磷酸盐纳米颗粒的制备条件,壳聚糖和三聚磷酸盐颗粒之间成功通过离子凝胶法进行结合,所得颗粒不仅可以稳定Pickering乳液,还可实现姜黄素的荷载。Ho等[37]发现超声可以诱导壳聚糖自聚集,超声使壳聚糖发生解聚并形成更小的单分散多糖颗粒,最终可以稳定高至70%油相体积分数的Pickering乳液。Mwangi等[38-39]通过调节壳聚糖醋酸溶液pH值至壳聚糖pKa值之上制备壳聚糖颗粒沉淀,并考察了内外源因素对其稳定的Pickering乳液稳定性的影响,结果表明壳聚糖颗粒稳定的Pickering乳液具有对环境刺激响应的特性,在有特殊要求的食品和医药领域有着广泛的应用前景。
2.2 蛋白质颗粒稳定的Pickering乳液
大豆分离蛋白(soybean protein isolate,SPI)主要由11S和7S球蛋白组成,球蛋白在SPI制备过程中易发生变性,通常以聚集体的形式存在并具有良好的表面活性,是制备食品级固体颗粒的优质原材料。Liu Fu等[40-43]以大豆蛋白聚集体为稳定剂制备了Pickering乳液,而SPI以及大豆球蛋白颗粒通过热诱导(95 ℃加热15 min)聚合结合NaCl静电屏蔽制备获得,热诱导聚合增强了SPI的疏水性,加之静电屏蔽处理后,促进了SPI和大豆球蛋白聚集体的形成。Guo Jian等[44]通过分散大豆凝胶的方式制备得到大豆蛋白微凝胶颗粒,该方法首先对SPI进行热处理(80 ℃、20 min),随后使用转谷氨酰胺酶对热处理后的SPI交联(20 U/g SPI、45 ℃、4 h)制备得到大豆凝胶,接着使用高速分散(10 000 r/min、2 min)结合微射流均质处理(500 bar),从而得到微凝胶颗粒,高速剪切乳化后制备的Pickering乳液可在8 周内保持稳定。
玉米醇溶蛋白、高粱醇溶蛋白等醇溶蛋白颗粒大多使用反溶剂法制备,其制备过程可简述为:首先溶解原材料于合适溶剂中,随后将有机相分散在水相中,最终再将溶剂移除。de Folter等[46]通过反溶剂法制备了玉米醇溶蛋白胶体颗粒,颗粒不需任何修饰,其三相接触角就接近90°,并且可以制备稳定的、没有任何表面活性剂存在的Pickering乳液,所得乳液的稳定性受到颗粒浓度、pH值、离子强度的影响。Xiao Jie等[47-48]同样使用反溶剂法制备了高粱醇溶蛋白颗粒,并用于稳定O/W Pickering乳液,此外还对乳液的微结构、流变学性质以及作为口服运载体系的特性进行了一系列研究。
在动物源蛋白方面,Shimoni等[49]先热处理(90 ℃、20 min)乳铁蛋白的水溶液,再调节pH值至8后制备得到乳铁蛋白颗粒,经25 000 r/min高速剪切1 min制备粗乳液,随后15 kPa高压均质处理4 次制备精制乳液,结果表明乳铁蛋白颗粒没有增加粗乳液的液滴尺寸,但却可以明显降低粗乳液的析乳速率;在精制乳液中,乳铁蛋白颗粒增加了乳液液滴的尺寸。Gao Zhiming等[50]在pH 2的条件下热处理(80 ℃、15 h)β-乳球蛋白水溶液,随后于5 ℃条件下透析48 h,最后经过冻干制备出非均一的蛋白纤丝并用于稳定Pickering乳液,制备出的乳液在室温下放置56 d后未发生聚结现象。
2.3 蛋白质-多糖复合颗粒稳定的Pickering乳液
采用天然的蛋白质-多糖复合的方法,可利用亲、疏水性互补的方式实现界面行为调节并获得两相润湿性好、适宜稳定Pickering乳液的复合颗粒。相较于单一颗粒,复合颗粒稳定的Pickering乳液避免了合成改性剂的引入,提升了乳液的安全性;同时蛋白质、多糖之间的相互作用可以使液滴间形成特殊的网络结构[51],进一步增强了乳液的稳定性;此外蛋白、多糖的同时存在增加了活性物质与颗粒结合的可能性,赋予了乳液更优异的荷载属性。Wang Lijuan等[51]报道了使用玉米醇溶蛋白-壳聚糖复合颗粒(zein-chitosan complex particles,ZCCPs)稳定Pickering乳液的方法,通过反溶剂法可制备出带有大量电荷的中等润湿性ZCCPs,乳化后ZCCPs在界面上形成了由壳聚糖网络包裹着玉米醇溶蛋白颗粒的混合网络结构,所得Pickering乳液可在9 个月的贮藏期内保持稳定。Wang Lijuan等[52]也将姜黄素作为天然抗氧化剂通过ZCCPs荷载富集到界面上,进一步提升了乳液的抗氧化性能。通过类似的静电结合的方法,Shimoni[49]与Wang Xiaoyan[54]等分别制备了乳铁蛋白-卡拉胶复合颗粒和明胶-壳聚糖复合颗粒,且均展现出良好的稳定Pickering乳液的特性。
3 食品级固体颗粒及其稳定的Pickering乳液的表征方法
随着分析测量仪器和测量方法的发展,颗粒和乳液的表征方式也在不断进步,三相接触角测量仪、共聚焦显微镜、冷冻扫描电子显微镜(cryo-scanning electron microscope,Cryo-SEM)等设备可以非常直观地帮助科研工作者们理解界面固体颗粒及其稳定的Pickering乳液的界面性质、微观结构及稳定机制。
3.1 界面性质的表征
三相接触角是判断颗粒能否稳定Pickering乳液的重要指标,然而测定接触角的方法各异。比较简单直观的方法是使用视频三相接触角测量仪直接观测接触角,但这种方法仅适用于粒径大于30 μm的颗粒。一些科研工作者对接触角测量方法进行了改进,de Folter等[46]将液滴捕获的方法应用到了玉米醇溶蛋白胶体颗粒接触角的检测当中,该方法是首先制备均一的玉米醇溶蛋白膜,然后将膜置于水相顶部,接下来使用弯形针尖将油滴附着在膜表面,随后在不同pH值水相条件下测量油滴在玉米醇溶蛋白膜的接触角(图1)。虽然膜-水-油界面的接触角不能完全等同于颗粒在水-油界面的接触角,但这种方法可以更好地预知颗粒的润湿性质。Paunov[57]使用了凝胶捕获技术测定接触角:颗粒首先分散在平整的水-油界面上,在水相中存在不会吸附到界面上的水状胶体,这些水状胶体在降低温度时胶凝;然后油被移除并由聚合非极性层取代,生成聚二甲硅氧烷聚合物(poly-dimethylsiloxane,PDMS);聚合发生后,PDMS周围的颗粒被剥落并可以通过SEM成像来测定接触角。在之后的研究中,Paunov等[58]再次证明了这种方法测定结果的稳定性。
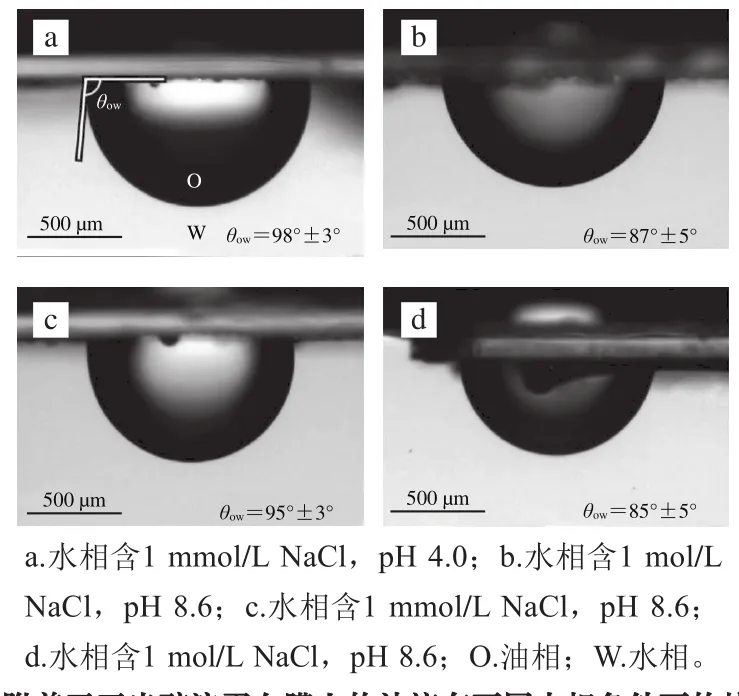
图1 附着于玉米醇溶蛋白膜上的油滴在不同水相条件下的接触角[46]Fig.1 Contact angle of oil droplet attached to zein fi lms under different aqueous conditions[46]
3.2 微观结构的表征
乳液微观结构可以使用显微镜直接观察。光学显微镜成本低、操作简便,在表征大尺寸液滴时应用较为广泛[26,42,45,47-48],但受分辨率的限制,很难观察到粒径小于1 μm的颗粒或乳液的微观结构。
共聚焦显微镜(confocal laser scanning microscopy,CLSM)具有灵敏度高、能显示乳液空间结构等优点,结合大视野拼接功能可以非常直观显示出食品级颗粒在界面上的吸附。王丽娟[59]使用CLSM观察了玉米醇溶蛋白/壳聚糖复合颗粒稳定的Pickering乳液(图2),分别采用质量分数为0.1%尼罗红和质量分数0.1%尼罗蓝对油相与蛋白相进行染色,能够清晰地观察到玉米醇溶蛋白颗粒(红色信号)包裹着油滴(绿色信号),直观地表现出玉米醇溶蛋白以颗粒的形式在界面上吸附。

图2 玉米醇溶蛋白/壳聚糖复合颗粒稳定的Pickering乳液CLSM图像[59]Fig.2 CLSM image of zein/chitosan complex stabilized Pickering emulsion[59]
光学显微镜和CLSM都不能表征粒径小于500 nm的独立颗粒的表观形貌,而通过Cryo-SEM却可以观察到平均粒径低于100 nm的颗粒表面结构,并且可以原位表征纳米级颗粒在液-液界面上的形貌[60]。Cryo-SEM的超低温快速冷冻制样技术可使水在低温状态下呈玻璃态,减少了冰晶对样品本身结构的影响,其制样过程简单快速,无需对样品进行脱水、干燥,仅需利用超低温快速冷冻对样品固态化,随后通过冷冻传输系统在低温状态下将样品转移至电子显微镜样品舱中的冷台上进行观察[61]。Xiao Jie等[48]将Cryo-SEM应用到高粱醇溶蛋白的表征,可以清晰地观察到颗粒在界面上的吸附(图3)。

图3 高粱醇溶蛋白(a)和吐温-80(b)稳定乳液油滴局部Cryo-SEM扫描图像[48]Fig.3 Cryo-SEM images of ka fi rin (a) and Tween-80 (b) stabilized emulsion with inserted pictures under higher magni fi cation[48]
3.3 乳液稳定性的表征
3.3.1 抗分层稳定性
分层是乳液中常见的失稳现象,其可用Stokes定律(式(2))解释。

式中:U为重力分离速率/(m/s);r为液滴半径/m;ρ1、ρ2分别为连续相和分散相的密度/(kg/m3);η为连续相的黏度/(kg/(m·s);g为重力加速度/(m/s2)。
从式(2)中可以看出,在没有增稠剂存在的情况下,当液滴尺寸增大时,乳液会很容易发生分层。通过记录乳析指数(creaming index,CI)和乳化相的体积比是筛选食品级Pickering颗粒的常规手段,其方法是将新配制的乳液放置在一个透明的玻璃管中,在常温下放置,乳液分为两层,上层为乳析层,下层为清液层,在一段时间内记录乳析界面的高度变化,CI的计算如式(3)所示[51,62]。

式中:Hs为下层清液的高度/cm;Ht为整体乳液的高度/cm。
3.3.2 抗聚结稳定性
由于颗粒在界面上的吸附不可逆,颗粒包裹的乳液界面层可作为一种物理屏障将相邻的水-油界面阻隔,有效防止了液滴的聚结;而对于颗粒覆盖率较低的液滴界面,当相邻液滴接触时将会形成公用颗粒层以最大限度地保证液滴的完整性,防止聚结的发生,这种现象称之为“桥联絮凝”。对于一些食品级颗粒,如蛋白质-多糖复合聚集体、纤维素颗粒等,在吸附到界面上后,只有小部分会与界面接触,绝大部分会伸展至连续相中,形成刚性空间位阻或网络。观察Pickering乳液的微观结构是表征其抗聚结稳定性的主要手段,Li Chen等[31]通过光学显微镜观察到淀粉颗粒稳定的Pickering乳液中淀粉颗粒层紧密包裹的油滴有效阻止了乳液液滴在贮存过程中的聚结。
4 在食品中的应用
目前Pickering乳液在食品领域中的应用报道较少,大都集中在增强乳液的氧化稳定性以及荷载功能活性物质等方面,相对于传统乳液,主要利用了固体颗粒特有的物理结构性质以及荷载、缓释特性。
4.1 增强乳液氧化稳定性
食品乳液中油脂的氧化不仅破坏了食品的感官品质和营养价值,还会产生有毒物质[63],而O/W Pickering乳液中的水-油界面由致密的颗粒层覆盖,降低了氧气、助氧化剂(金属离子)、光等促氧化因子与油相接触的几率,从而达到了增强油脂氧化稳定性的目的;除此之外,颗粒可利用其荷载特性携带抗氧化剂到乳液表面,进一步增强了乳液的抗氧化性质。Wang Lijuan等[51]通过反溶剂法和高速剪切乳化分别制备了玉米醇溶蛋白颗粒和玉米醇溶蛋白/壳聚糖复合颗粒Pickering乳液,通过对颗粒界面行为进行探究发现,玉米醇溶蛋白颗粒的三相接触角为112.73°±1.29°,而通过壳聚糖进行界面行为调节后,复合颗粒的三相接触角约为82°,接近90°的理想状态;经过热加速贮藏实验可知,以复合颗粒稳定的乳液具有良好的抗氧化稳定性,通过复合颗粒荷载姜黄素,可以使油滴表面形成一层抗氧化层,进一步提高了乳液的抗氧化性。Xiao Jie等[47]通过常温贮藏实验对比了由高粱醇溶蛋白稳定的Pickering乳液和吐温-80稳定的传统乳液在1~15 d内的抗氧化稳定性,并使用单一油相作对照,发现Pickering乳液被氧化的速率显著低于传统乳液,可能是Pickering乳液具有较大的液滴粒径、液滴周围存在物理屏障层、阳离子颗粒层静电排斥金属离子等因素所导致。
4.2 稳定具有荷载功能的活性物质
随着营养与健康的理念日渐被消费者关注,大量功能活性物质被用于食品体系当中,然而一部功能活性物质如姜黄素、β-胡萝卜素不但水溶性差,在一般食品体系中添加效率低,而且进入到人体后其生物半衰期短、生物利用度低,功效大大折扣。而Pickering乳液作为一种特殊的乳液荷载系统,除了可以荷载疏水性功能活性物质外,还具有传统乳液不可比拟的优势:Pickering乳液的抗聚结稳定性为荷载系统的稳定提供了基础,吸附在水-油界面上的颗粒层为分散相中的载体提供了一层物理阻隔屏障,阻隔了外界光源,保证了一些易发生光降解、紫外降解荷载物的稳定性;此外利用某些食品级颗粒特有的性质制备出的刺激响应型Pickering乳液可以实现功能活性物质的缓释和靶向运输。
Shah等[36]使用壳聚糖-三聚磷酸盐纳米颗粒稳定的Pickering乳液对姜黄素进行荷载,24 h避光保存后仅有约质量分数14%的姜黄素降解,该体系对姜黄素的保护作用显著高于Leung等[64]使用十二烷基硫酸钠胶束荷载体系(20 h降解40%的姜黄素)。Liu Fu等[43]利用大豆球蛋白颗粒稳定的Pickering乳液荷载β-胡萝卜素,且β-胡萝卜素的缓释行为主要取决于液滴尺寸,在热处理大豆球蛋白稳定的凝胶状乳液中,凝胶网络的形成能够大大降低β-胡萝卜素的释放速率。
5 结 语
食品级固体颗粒稳定的Pickering乳液具有原材料成本低、稳定性好、生物相容性强、应用前景广等诸多优势。虽然近年来相关研究逐渐深入,但是在稳定机理、制备和应用方面仍存在一定的问题,下一步研究中要深入探究食品级颗粒与无机颗粒稳定Pickering乳液的机制异同,寻求更多绿色高效的制备Pickering乳液的方法,同时尽快推进其在实际生产中的应用;另外对于Pickering乳液应用在活性物质荷载方面的研究,需进一步开展相关的体内实验,明确其实际作用效果。相信通过科研工作者们的不懈努力,在基于食品级固体颗粒稳定的Pickering乳液领域终将实现理论与应用的双突破。
[1] RAMSDEN W. Separation of solids in the surface-layers of solutions and ‘suspensions’ (observations on surface-membranes, bubbles,emulsions, and mechanical coagulation): preliminary account[J].Proceedings of the Royal Society of London, 1903, 72: 156-164.
[2] PICKERING S U. CXCVI: emulsions[J]. Journal of the Chemical Society, Transactions, 1907, 91: 2001-2021.
[3] CANDAU D, PISSON A M. Emulsifier-free UV-photoprotecting emulsions comprising micronized insoluble screening agents:US6416748[P]. (2002-09-07)[2016-10-05]. http://www.freepatentsonline.com/6416748.html.
[4] BRAUN M C. Emulsif i er-free hand and body lotion: US5035890[P]. (1991-07-30)[2016-10-05]. http://www.freepatentsonline.com/5035890.html.
[5] MCCOSH K, KAPILA M, DIXIT R, et al. Continuous improvement in slop mud treatment technology[J]. SPE Drilling and Completion,2007, 24(3): 418-423. DOI:10.2118/110878-PA.
[6] TELETZKE G F, WATTENBARGER R C, WILKINSON J R.Enhanced oil recovery pilot testing best practices[J]. SPE Reservoir Evaluation & Engineering, 2010, 13(1): 143-154.
[7] AKARTUNA I, STUDART A R, TERVOORT E, et al. Macroporous ceramics from particle-stabilized emulsions[J]. Advanced Materials,2008, 20(24): 4714-4718. DOI:10.1002/adma.200801888.
[8] DUAN L, CHEN M, ZHOU S, et al. Synthesis and characterization of poly(N-isopropylacrylamide)/silica composite microspheres via inverse pickering suspension polymerization[J]. Langmuir, 2009,25(6): 3467-3472. DOI:10.1021/la8041617.
[9] BON S A F, CHEN T. Pickering stabilization as a tool in the fabrication of complex nanopatterned silica microcapsules[J].Langmuir, 2007, 23(19): 9527-9530. DOI:10.1021/la7016769.
[10] YANG H, ZHOU T, ZHANG W. A strategy for separating and recycling solid catalysts based on the pH-triggered Pickering-emulsion inversion[J]. Angewandte Chemie International Edition, 2013, 52(29):7455-7459. DOI:10.1002/anie.201300534.
[11] FRELICHOWSKA J, BOLZINGER M A, VALOUR J P, et al.Pickering W/O emulsions: drug release and topical delivery[J].International Journal of Pharmaceutics, 2009, 368(1/2): 7-15.DOI:10.1016/j.ijpharm.2008.09.057.
[12] CHASSAING B, KOREN O, GOODRICH J K, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J]. Nature, 2015, 519: 92-96. DOI:10.1038/nature14232.
[13] AVEYARD R, BINKS B P, CLINT J H. Emulsions stabilised solely by colloidal particles[J]. Advances in Colloid and Interface Science,2003, 100/102: 503-546. DOI:10.1016/s0001-8686(02)00069-6.
[14] KAZ D M, MCGORTY R, MANI M, et al. Physical ageing of the contact line on colloidal particles at liquid interfaces[J]. Nature Materials, 2012, 11(2): 138-142. DOI:10.1038/nmat3190.
[15] BINKS B P. Particles as surfactants: similarities and differences[J].Current Opinion in Colloid & Interface Science, 2002, 7(1/2): 21-41.DOI:10.1016/S1359-0294(02)00008-0.
[16] CHEVALIER Y, BOLZINGER M A. Emulsions stabilized with solid nanoparticles: Pickering emulsions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 439: 23-34.DOI:10.1016/j.colsurfa.2013.02.054.
[17] GOEBEL A, LUNKENHEIMER K. Interfacial tension of the water/n-alkane interface[J]. Langmuir, 1997, 13(2): 369-372. DOI:10.1021/la960800g.
[18] BINKS B P, HOROZOV T S. Aqueous foams stabilized solely by silica nanoparticles[J]. Angewandte Chemie-International Edition,2005, 44(24): 3722-3725. DOI:10.1002/anie.200462470.
[19] HUNTER T N, PUGH R J, FRANKS G V, et al. The role of particles in stabilising foams and emulsions[J]. Advances in Colloid and Interface Science, 2008, 137(2): 57-81. DOI:10.1016/j.cis.2007.07.007.
[20] YE A, ZHU X, SINGH H. Oil-in-water emulsion system stabilized by protein-coated nanoemulsion droplets[J]. Langmuir, 2013, 29(47):14403-14410. DOI:10.1021/la403493y.
[21] CAPRON I, CATHALA B. Surfactant-free high internal phase emulsions stabilized by cellulose nanocrystals[J]. Biomacromolecules,2013, 14(2): 291-296. DOI:10.1021/bm301871k.
[22] MURRAY B S, DURGA K, YUSOFF A, et al. Stabilization of foams and emulsions by mixtures of surface active food-grade particles and proteins[J]. Food Hydrocolloids, 2011, 25(4): 627-638. DOI:10.1016/j.foodhyd.2010.07.025.
[23] MAREFATI A, RAYNER M, TIMGREN A, et al. Freezing and freeze-drying of Pickering emulsions stabilized by starch granules[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2013, 436: 512-520. DOI:10.1016/j.colsurfa.2013.07.015.
[24] TIMGREN A, RAYNER M, SJÖÖ M, et al. Starch particles for food based Pickering emulsions[J]. Procedia Food Science, 2011, 1(1):95-103. DOI:10.1016/j.profoo.2011.09.016.
[25] MARKU D, WAHLGREN M, RAYNER M, et al. Characterization of starch Pickering emulsions for potential applications in topical formulations[J]. International Journal of Pharmaceutics, 2012,428(1/2): 1-7. DOI:10.1016/j.ijpharm.2012.01.031.
[26] TAN Y, XU K, NIU C, et al. Triglyceride-water emulsions stabilised by starch-based nanoparticles[J]. Food Hydrocolloids, 2014, 36: 70-75. DOI:10.1016/j.foodhyd.2013.08.032.
[27] TAN Y, XU K, LIU C, et al. Fabrication of starch-based nanospheres to stabilize pickering emulsion[J]. Carbohydrate Polymers, 2012,88(4): 1358-1363. DOI:10.1016/j.carbpol.2012.02.018.
[28] LI C, SUN P, YANG C. Emulsion stabilized by starch nanocrystals[J].Starch-Stärke, 2012, 64(6): 497-502. DOI:10.1002/star.201100178.
[29] LI C, LI Y, SUN P, et al. Starch nanocrystals as particle stabilisers of oil-in-water emulsions[J]. Journal of the Science of Food and Agriculture, 2014, 94(9): 1802-1807. DOI:10.1002/jsfa.6495.
[30] VILLAMONTE G, JURY V, DE LAMBALLERIE M.Stabilizing emulsions using high-pressure-treated corn starch[J].Food Hydrocolloids, 2016, 52: 581-589. DOI:10.1016/j.foodhyd.2015.07.031.
[31] LI Chen, LI Yunxing, SUN Peidong, et al. Pickering emulsions stabilized by native starch granules[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 431: 142-149.DOI:10.1016/j.colsurfa.2013.04.025.
[32] KARGAR M, FAYAZMANESH K, ALAVI M, et al. Investigation into the potential ability of Pickering emulsions (food-grade particles)to enhance the oxidative stability of oil-in-water emulsions[J]. Journal of Colloid & Interface Science, 2012, 366(1): 209-215. DOI:10.1016/j.jcis.2011.09.
[33] WANG Wenhang, DU Guanhua, LI Cong, et al. Preparation of cellulose nanocrystals from asparagus (Asparagus officinalis L.)and their applications to palm oil/water Pickering emulsion[J].Carbohydrate Polymers, 2016, 151: 1-8. DOI:10.1016/j.carbpol.2016.05.052.
[34] WEN Chunxia, YUAN Qipeng, LIANG Hao, et al. Preparation and stabilization of d-limonene Pickering emulsions by cellulose nanocrystals[J]. Carbohydrate Polymers, 2014, 112(2): 695-700.DOI:10.1016/j.carbpol.2014.06.051.
[35] WANG Xiaoyan, HEUZEY M C. Chitosan-based conventional and Pickering emulsions with long-term stability[J]. Langmuir, 2016,32(4): 929-936. DOI:10.1021/acs.langmuir.5b03556.
[36] SHAH B R, LI Y, JIN W P, et al. Preparation and optimization of Pickering emulsion stabilized by chitosan-tripolyphosphate nanoparticles for curcumin encapsulation[J]. Food Hydrocolloids,2016, 52: 369-377. DOI:10.1016/j.foodhyd.2015.07.015.
[37] HO K W, OOI C W, MWANGI W W, et al. Comparison of selfaggregated chitosan particles prepared with and without ultrasonication pretreatment as Pickering emulsif i er[J]. Food Hydrocolloids, 2016, 52:827-837. DOI:10.1016/j.foodhyd.2015.08.019.
[38] MWANGI W W, HO K W, TEY B T, et al. Effects of environmental factors on the physical stability of pickering-emulsions stabilized by chitosan particles[J]. Food Hydrocolloids, 2016, 60: 543-550.DOI:10.1016/j.foodhyd.2016.04.023.
[39] MWANGI W W, HO K W, OOI C W, et al. Facile method for forming ionically cross-linked chitosan microcapsules from Pickering emulsion templates[J]. Food Hydrocolloids, 2016, 55: 26-33. DOI:10.1016/j.foodhyd.2015.10.022.
[40] LIU Fu, TANG Chuanhe. Soy protein nanoparticle aggregates as Pickering stabilizers for oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2013, 61(37): 8888-8898.DOI:10.1021/jf401859y.
[41] LIU Fu, TANG Chuanhe. Soy glycinin as food-grade Pickering stabilizers: part. I. structural characteristics, emulsifying properties and adsorption/arrangement at interface[J]. Food Hydrocolloids, 2016, 60:606-619. DOI:10.1016/j.foodhyd.2015.04.025.
[42] LIU Fu, TANG Chuanhe. Soy glycinin as food-grade Pickering stabilizers: part. II. improvement of emulsification and interfacial adsorption by electrostatic screening[J]. Food Hydrocolloids, 2016, 60:620-630. DOI:10.1016/j.foodhyd.2015.10.024.
[43] LIU Fu, TANG Chuanhe. Soy glycinin as food-grade Pickering stabilizers: part. III. fabrication of gel-like emulsions and their potential as sustained-release delivery systems for β-carotene[J].Food Hydrocolloids, 2016, 60: 631-640. DOI:10.1016/j.foodhyd.2016.05.004.
[44] GUO Jian, ZHOU Qian, LIU Yongchuang, et al. Preparation of soy protein-based microgel particles using a hydrogel homogenizing strategy and their interfacial properties[J]. Food Hydrocolloids, 2016,58: 324-334. DOI:10.1016/j.foodhyd.2016.03.008.
[45] LIANG H N, TANG C H. Pea protein exhibits a novel Pickering stabilization for oil-in-water emulsions at pH 3.0[J]. LWT-Food Science and Technology, 2014, 58(2): 463-469. DOI:10.1016/j.lwt.2014.03.023.
[46] DE FOLTER J W J, VAN RUIJVEN M W M, VELIKOV K P. Oil-inwater Pickering emulsions stabilized by colloidal particles from the water-insoluble protein zein[J]. Soft Matter, 2012, 8(25): 6807-6815.DOI:10.1039/c2sm07417f.
[47] XIAO Jie, LI Chao, HUANG Qingrong. Kaf i rin nanoparticle-stabilized pickering emulsions as oral delivery vehicles: physicochemical stability and in vitro digestion prof i le[J]. Journal of Agricultural and Food Chemistry, 2015, 63(47): 10263-10270. DOI:10.1021/acs.jafc.5b04385.
[48] XIAO Jie, WANG Xiangan, PEREZ G A J, et al. Kaf i rin nanoparticlesstabilized Pickering emulsions: microstructure and rheological behavior[J]. Food Hydrocolloids, 2016, 54: 30-39. DOI:10.1016/j.foodhyd.2015.09.008.
[49] SHIMONI G, LEVI C S, TAL S L, et al. Emulsions stabilization by lactoferrin nano-particles under in vitro digestion conditions[J].Food Hydrocolloids, 2013, 33(2): 264-272. DOI:10.1016/j.foodhyd.2013.03.017.
[50] GAO Zhiming, ZHAO Junjun, HUANG Yin, et al. Edible Pickering emulsion stabilized by protein fi brils. part 1: effects of pH and fi brils concentration[J]. LWT-Food Science and Technology, 2017, 76: 1-8.DOI:10.1016/j.lwt.2016.10.038.
[51] WANG Lijuan, HU Yaqiong, YIN Shouwei, et al. Fabrication and characterization of antioxidant pickering emulsions stabilized by zein/chitosan complex particles (ZCPs)[J]. Journal of Agricultural and Food Chemistry, 2015, 63(9): 2514-2524. DOI:10.1021/jf505227a.
[52] WANG Lijuan, YIN Shouwei, WU Leiyan, et al. Fabrication and characterization of Pickering emulsions and oil gels stabilized by highly charged zein/chitosan complex particles (ZCCPs)[J]. Food Chemistry, 2016, 213: 462-469. DOI:10.1016/j.foodchem.2016.06.119.
[53] SHI W J, TANG C H, YIN S W, et al. Development and characterization of novel chitosan emulsion films via pickering emulsions incorporation approach[J]. Food Hydrocolloids, 2016, 52:253-264. DOI:10.1016/j.foodhyd.2015.07.008.
[54] WANG Xiaoyan, HEUZEY M C. Pickering emulsion gels based on insoluble chitosan/gelatin electrostatic complexes[J]. RSC Advances,2016, 6(92): 89776-89784. DOI:10.1039/c6ra10378b.
[55] JANE J L, KASEMSUWAN T, LEAS S, et al. Anthology of starch granule morphology by scanning electron microscopy[J]. Starch-Stärke, 1994, 46(4): 121-129. DOI:10.1002/star.19940460402.
[56] KLEMM D, HEUBLEIN B, FINK H P, et al. Cellulose: fascinating biopolymer and sustainable raw material[J]. Angewandte Chemie International Edition, 2005, 44(22): 3358-3393. DOI:10.1002/chin.200536238.
[57] PAUNOV V N. Novel method for determining the three-phase contact angle of colloid particles adsorbed at air-water and oil-water interfaces[J]. Langmuir, 2003, 19(19): 7970-7976. DOI:10.1021/la0347509.
[58] PAUNOV V N, CAYRE O J, NOBLE P F, et al. Emulsions stabilised by food colloid particles: role of particle adsorption and wettability at the liquid interface[J]. Journal of Colloid & Interface Science, 2007,312(2): 381-389. DOI:10.1016/j.jcis.2007.03.031.
[59] 王丽娟. 玉米醇溶蛋白胶体颗粒的制备及应用研究[D]. 广州: 华南理工大学, 2014: 57-58.
[60] ISA L, LUCAS F, WEPF R, et al. Measuring single-nanoparticle wetting properties by freeze-fracture shadow-casting cryo-scanning electron microscopy[J]. Nature Communications, 2011, 2(1): 73-86.DOI:10.1038/ncomms1441.
[61] 肖媛, 李婷婷, 周芳, 等. 冷冻扫描电镜及其在生命科学研究中的应用[J]. 电子显微学报, 2015, 34(5): 447-451. DOI:10.3969/j.issn.1000-6281.2015.05.016.
[62] KEOWMANEECHAI E, MCCLEMENTS D J. Influence of EDTA and citrate on physicochemical properties of whey protein-stabilized oil-in-water emulsions containing CaCl2[J]. Journal of Agricultural &Food Chemistry, 2002, 50(24): 7145-7153. DOI:10.1021/jf020489a.
[63] SERINI S, FASANO E, PICCIONI E, et al. Dietary n-3 polyunsaturated fatty acids and the paradox of their health benef i ts and potential harmful effects[J]. Chemical Research in Toxicology, 2011,24(12): 2093-2105. DOI:10.1021/tx200314p.
[64] LEUNG M H M, COLANGELO H, KEE T W. Encapsulation of curcumin in cationic micelles suppresses alkaline hydrolysis[J].Langmuir, 2008, 24(11): 5672-5675. DOI:10.1021/la800780w.
