岛叶低级别胶质瘤的生物学特性及预后评估
2018-03-17马晓东
朱 巍,崔 萌,马晓东
解放军总医院 神经外科,北京 100853
岛叶胶质瘤在颅内肿瘤中相当常见,并且多以低级别胶质瘤为主[1]。岛叶的解剖位置极其特殊,位于大脑外侧裂深部,毗邻大脑中动脉、基底核等重要结构[2-3]。而位于岛叶的胶质瘤与其他部位的肿瘤相比,具有生长缓慢、侵袭性低的特点。研究表明肿瘤的发生部位与肿瘤的基因异质性有关[4-5],不同部位的肿瘤具有不同侵袭性[6],会带来不同的预后[7-8]。近年来IDH1突变、MGMT启动子甲基化、1p/19q联合缺失等分子病理学特征的发现提高了临床医生对胶质瘤的肿瘤异质性及生物学特性的认知。大量研究表明具有相似组织病理学特征和级别的胶质瘤往往有着不同的分子病理特性,而这些分子病理学指标往往能够预示着肿瘤的预后与放化疗的敏感性。本文通过对我院收治的低级别胶质瘤患者的临床特征、组织病理、分子病理结果进行回顾分析,再结合患者临床预后资料,对岛叶低级别胶质瘤的生物学特性及预后进行探究。
对象和方法
1 对象 2015年1月- 2017年6月于我院就诊的病理证实为WHOⅡ级的低级别胶质瘤患者61例,根据肿瘤的发生部位分为肿瘤累及岛叶组(21例)和累及其他脑叶组(40例,包括累及其他单一脑叶或累及两个脑叶以上病例)。两组患者年龄、性别、手术方式、术后放疗、化疗、KPS评分等基本资料无统计学差异(表1)。纳入标准:1)肿瘤累及幕上各脑叶;2)术后肿瘤全切并接受规范放疗及辅助化疗;3)进行分子病理指标检测。
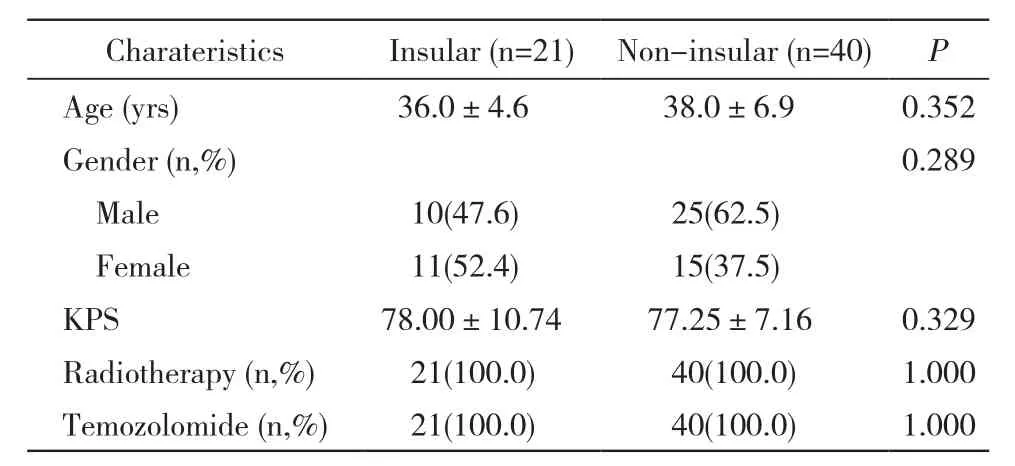
表1 低级别胶质瘤患者临床特征Tab. 1 Clinical characteristic of low grade glioma patients
2 方法 回顾性分析患者的临床资料,包括术前KPS评分、组织病理、分子标记物、影像学证实肿瘤进展日期、死亡日期、最后一次随访日期。IDH1 R132基因突变采用直接测序法检测,MGMT分子甲基化采用甲基化特异性PCR检测法,具体检测方法见参考文献[9-10]。无进展生存期(progression-free survival,PFS)定义为患者接受手术到复发的时间;总体生存期(overall survival,OS)定义为患者接受手术到死亡的时间。根据患者的分子病理学特征、PFS、OS,对岛叶胶质瘤的生物学特性与预后的关系进行初步探究。
3 影像学检查及随访 患者均在我院行磁共振检查(术前以及术后每3个月随访影像资料),每3个月在我院胶质瘤门诊对患者进行随访,包括影像学分析及身体状况检查,并将资料录入我科胶质瘤数据库。
4 统计学处理 数据统计采用SPSS20.0,计量资料以±s表示,组间比较采用t检验;计数资料以例数、百分比表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier生存曲线,组间比较采用Log-rank法检验,P<0.05为差异有统计学意义。
结 果
1 低级别胶质瘤组织病理学 岛叶胶质瘤患者21例中,弥漫性星形细胞瘤10例,少突胶质细胞瘤8例,少突-星形细胞瘤3例。其他脑叶起源的胶质40例瘤中,弥漫性星形细胞瘤14例,少突胶质细胞瘤16例,少突-星形细胞瘤10例。组间各型组织病理无统计学差异。见表2。
2 IDH1突变的检测 本研究的61例患者中IDH1基因存在突变共43例,IDH1野生型共18例。21例岛叶胶质瘤患者中,19例患者存在IDH1基因突变(90%)。40例肿瘤累及其他脑叶的患者中,24例患者存在IDH1基因突变(60%)。各组间差异有统计学意义(P=0.045)。
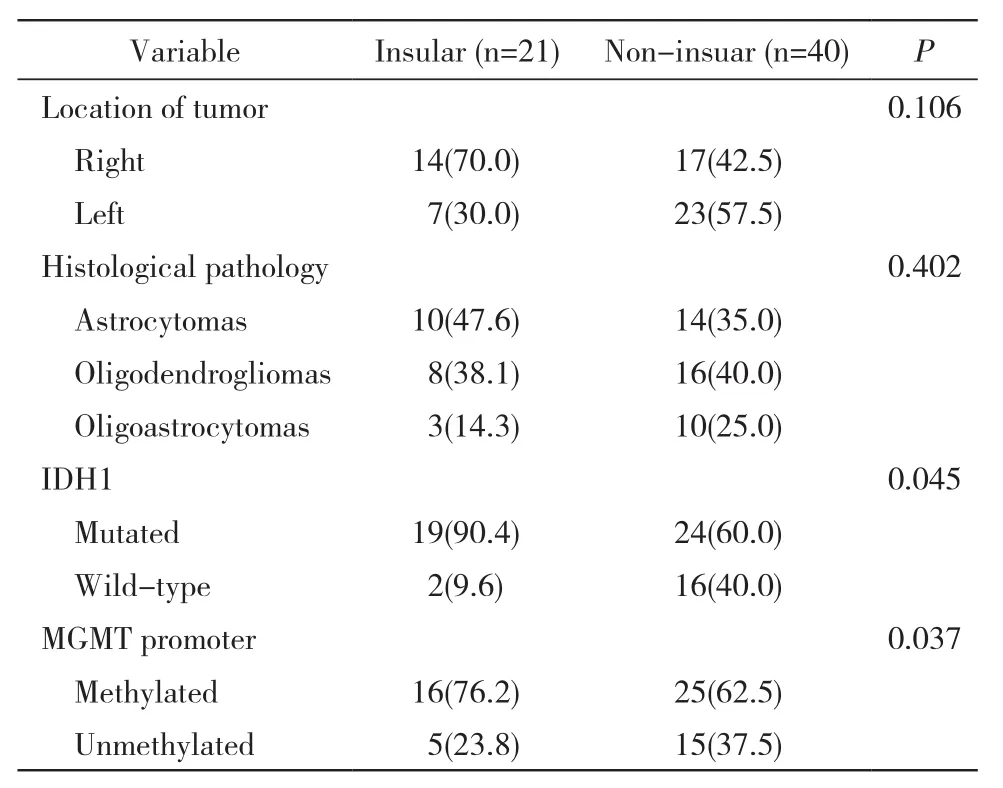
表2 低级别胶质瘤患者组织及分子病理特征Tab. 2 Histological and molecular pathology of low grade glioma patients (n, %)
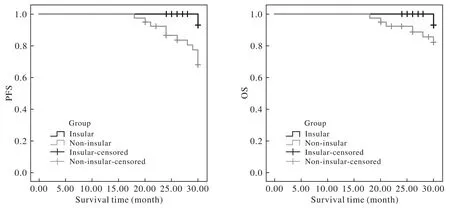
图 1 低级别胶质瘤患者的无进展生存期与总生存期Fig. 1 PFS and OS of low grade glioma patients
3 MGMT启动子甲基化 61例患者中MGMT启动子甲基化共41例。其中岛叶胶质瘤组的21例患者中有16例(76%)MGMT启动子甲基化;胶质瘤位于其他脑叶的40例患者中有25例(62.5%)MGMT启动子甲基化。各组间差异有统计学意义(P=0.037)。
4 低级别胶质瘤患者的生存及预后 通过对入组的61例低级别胶质瘤的生存分析,发现岛叶胶质瘤组的21例患者较累及其他脑叶组的患者具有更长的PFS (30.0个月vs 28.1个月,P=0.037)和OS(30.0个月vs 29.0个月,P=0.216)。两组间PFS差异有统计学意义而OS差异无统计学意义(图1)。
讨 论
研究显示岛叶胶质瘤占颅内胶质瘤的25%[1],这个部位的肿瘤以低级别胶质瘤最常见[11]。起源于岛叶的胶质瘤与其他部位相同组织病理级别的肿瘤相比,生长更为缓慢,侵袭性也更低[12]。由于岛叶低级别胶质瘤这种较良性的生物学特性,而肿瘤手术的并发症风险极高[13-14],岛叶胶质瘤手术切除的必要性充满争议[15-16]。2016年起最新版的WHO中枢神经系统肿瘤分型中强调了分子病理指标对肿瘤诊治的意义,尤其是IDH1、MGMT等明星分子指标对肿瘤预后及治疗敏感性的参考价值。而本次临床实验就是基于上述的分子病理指标IDH1及MGMT启动子甲基化的检测来分析岛叶胶质瘤的生物学特性及预后。
IDH1是参与体内糖代谢三羧酸循环的一种酶[17]。IDH1基因突变见于多种WHOⅡ级和WHOⅢ级的星形细胞肿瘤、少突胶质细胞肿瘤及继发性胶质母细胞瘤[18]。临床上,IDH1基因突变的胶质瘤患者较IDH1野生型的胶质瘤患者有更好的预后[19-22]。分子病理学显示岛叶低级别胶质瘤与其他部位起源的低级别胶质瘤相比具有更高的IDH1突变率,这预示岛叶胶质瘤患者的预后更好。这种高IDH1阳性率结果与之前Tang等[23]研究结果一致。已经有研究证实位于额叶的胶质瘤有着较高的IDH1阳性率[5,7,24]。而岛叶与额叶在室管膜下区毗邻甚至重叠(subventricular zone,SVZ),这个部位存在神经前体细胞,说明起源于岛叶的胶质瘤与起源于额叶的胶质瘤可能是来自于共同的肿瘤前体细胞,而该部位起源的肿瘤细胞具有IDH1阳性率高的特性。这或许可以解释岛叶部位起源胶质瘤较其他部位胶质瘤有更高的IDH1突变率。
MGMT是细胞内的一种DNA修复蛋白,它可保护肿瘤细胞免受诸如替莫唑胺等烷化剂的杀伤[25-28]。当MGMT基因发生甲基化后该基因表达沉默,肿瘤对化疗药替莫唑胺的敏感性提高,所以MGMT甲基化胶质瘤患者的预后理论上会好于MGMT未甲基化胶质瘤患者[26-28]。MGMT启动子甲基化是另一个可判断预后的分子指标。本次研究结果显示岛叶组MGMT甲基化患者明显多于肿瘤位于其他脑叶组。该结果表明岛叶肿瘤患者对化疗药替莫唑胺敏感,在接受常规手术治疗后,积极使用化疗药应可以获得更好的预后。
本文中岛叶胶质瘤组较其他脑叶组具有更长的PFS(30.0个月 vs 28.1个月)和OS(30.0个月 vs 29.0个月),但总生存期的差异无统计学意义。考虑为本实验各组均为低级别胶质瘤患者,且均接受了规范的手术肿瘤全切及术后放化疗,所以治疗后普遍生存期较长,30个月的随访时间相对较短而未能体现出总体生存期的差异。岛叶胶质瘤组患者的高IDH1突变率及MGMT启动子甲基化发生率均提示患者预后较好及治疗敏感,而该生存分析结果也印证了上述结论。
综上,岛叶低级别胶质瘤与幕上大脑半球其他部位的低级别胶质瘤相比具有更显著的IDH1突变率和MGMT甲基化发生率,这些经典分子指标提示该类肿瘤患者术后对放化疗敏感,预后好,并且两组生存分析结果也印证了上述结论。以上结果说明岛叶低级别胶质瘤的生物学特性与其他部位胶质瘤不同,接受手术切除、放化疗为辅的综合治疗后,患者可获得较好的预后。
1 Duffau H, Capelle L. Preferential brain locations of low-grade gliomas[J]. Cancer, 2004, 100(12): 2622-2626.
2 刘嘉霖, 马晓东, 郭胜利, 等. 不同手术策略治疗岛叶胶质瘤的效果分析[J]. 中华保健医学杂志, 2012, 14(3): 227-229.
3 张猛, 马晓东, 余新光, 等. 术中磁共振技术辅助手术治疗脑深部胶质瘤的疗效分析[J]. 解放军医学院学报, 2015(7):691-693.
4 Denicolaï E, Tabouret E, Colin C, et al. Molecular heterogeneity of glioblastomas: does location matter[J]. Oncotarget, 2016, 7(1):902-913.
5 Wang Y, Zhang T, Li S, et al. Anatomical localization of isocitrate dehydrogenase 1 mutation: a voxel-based radiographic study of 146 low-grade gliomas[J]. Eur J Neurol, 2015, 22(2): 348-354.
6 Beiko J, Suki D, Hess KR, et al. IDH1 mutant malignant astrocytomas are more amenable to surgical resection and have a survival benefit associated with maximal surgical resection[J].Neuro-oncology, 2014, 16(1): 81-91.
7 Lai A, Kharbanda S, Pope WB, et al. Evidence for sequenced molecular evolution of IDH1 mutant glioblastoma from a distinct cell of origin[J]. J Clin Oncol, 2011, 29(34): 4482-4490.
8 Curran WJ Jr, Scott CB, Horton J, et al. Does extent of surgery influence outcome for astrocytoma with atypical or anaplastic foci(AAF)? A report from three Radiation Therapy Oncology Group(RTOG) trials[J]. J Neurooncol, 1992, 12(3): 219-227.
9 Pan Y, Qi XL, Wang LM, et al. Mutation of isocitrate dehydrogenase gene in Chinese patients with glioma[J]. Zhonghua Bing Li Xue Za Zhi, 2013, 42(5): 292-298.
10 李培栋, 王新军, 单峤, 等. 脑胶质瘤细胞MGMT甲基化状态与细胞对烷化剂耐药性的关系[J]. 中国老年学杂志, 2015, 35(16): 4463-4464.
11 王磊, 张懋植, 赵继宗, 等. 岛叶病变的临床特征及其微创手术治疗(附30例报告)[J]. 中国微侵袭神经外科杂志, 2003, 8(2): 70-72.
12 Sanai N, Polley MY, Berger MS. Insular glioma resection:assessment of patient morbidity, survival, and tumor progression[J].J Neurosurg, 2010, 112(1): 1-9.
13 张猛, 马晓东, 初晨, 等. 岛叶相关胶质瘤术后远期脑梗塞特征及因素分析并文献回顾[J]. 国际神经病学神经外科学杂志,2015, 42(2): 129-134.
14 吴东东, 陈晓雷, 耿杰峰, 等. 术中高场强磁共振联合锥体束导航在丘脑胶质瘤切除手术中的应用[J]. 解放军医学院学报,2015, 36(7): 694-698.
15 Wu AS, Witgert ME, Lang FF, et al. Neurocognitive function before and after surgery for insular gliomas[J]. J Neurosurg, 2011, 115(6):1115-1125.
16 Duffau H, Taillandier L, Gatignol P, et al. The insular lobe and brain plasticity : Lessons from tumor surgery[J]. Clin Neurol Neurosurg,2006, 108(6): 543-548.
17 Hodges TR, Choi BD, Bigner DD, et al. Isocitrate dehydrogenase 1 : what it means to the neurosurgeon : a review[J]. J Neurosurg,2013, 118(6): 1176-1180.
18 Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme[J]. Science, 2008, 321(5897):1807-1812.
19 Yang P, Zhang W, Wang Y, et al. IDH mutation and MGMT promoter methylation in glioblastoma: results of a prospective registry[J]. Oncotarget, 2015, 6(38): 40896-40906.
20 Amelot A, De Cremoux P, Quillien V, et al. IDH-Mutation Is a Weak Predictor of Long-Term Survival in Glioblastoma Patients[J].PLoS ONE, 2015, 10(7): e0130596.
21 Polivka J, Polivka J, Jr., Rohan V, et al. Isocitrate dehydrogenase-1 mutations as prognostic biomarker in glioblastoma multiforme patients in West Bohemia[J/OL]. https://www.hindawi.com/journals/bmri/2014/735659.
22 Eckel-Passow JE, Lachance DH, Molinaro AM, et al. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors[J].N Engl J Med, 2015, 372(26): 2499-2508.
23 Tang C, Zhang ZY, Chen LC, et al. Subgroup characteristics of insular low-grade glioma based on clinical and molecular analysis of 42 cases[J]. J Neurooncol, 2016, 126(3): 499-507.
24 Paldor I, Pearce FC, Drummond KJ, et al. Frontal glioblastoma multiforme may be biologically distinct from non-frontal and multilobar tumors[J]. J Clin Neurosci, 2016, 34 : 128-132.
25 Brandner S, von Deimling A. Diagnostic, prognostic and predictive relevance of molecular markers in gliomas[J]. Neuropathol Appl Neurobiol, 2015, 41(6): 694-720.
26 Wick W, Weller M, van den Bent M, et al. MGMT testing--the challenges for biomarker-based glioma treatment[J]. Nat Rev Neurol, 2014, 10(7): 372-385.
27 Jansen M, Yip S, Louis DN. Molecular pathology in adult gliomas:diagnostic, prognostic, and predictive markers[J]. Lancet Neurol,2010, 9(7): 717-726.
28 Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med,2005, 352(10): 997-1003.
