不同病因行脾切除术后血小板变化趋势探讨
2018-03-17范顺利吕少诚
张 涛,范顺利,吕少诚,潘 飞,贺 强,郎 韧
首都医科大学附属北京朝阳医院 肝胆外科,北京 100020
脾是人体内具有储血、造血、免疫等功能的重要脏器,在各种原因如胰腺癌、脾破裂、脾亢等情况下则不得不进行脾切除术。脾切除后将导致人体免疫功能下降、血小板升高、血液黏稠度增加等不良反应[1]。本研究拟通过对比观察不同病因行脾切除术后患者血小板的变化情况,探讨其变化趋势及规律。
资料和方法
1 资料 选择首都医科大学附属北京朝阳医院2011年1月- 2016年12月肝胆胰脾外科收治的74例行脾切除术的患者。其中男性47例,女性27例。年龄16 ~ 79(53.2±16.0)岁。纳入标准:1)患者术前无血液病史;2)患者均完整切除脾;3)患者非围术期死亡;4)依据分组标准排除因其他病因切除脾;5)所有治疗策略均未涉及伦理问题。
2 分组 依据病因分为胰腺癌组42例,脾破裂组18例,脾亢组14例。其中胰腺癌组诊断标准以术后病理为准,42例均术后病理证实为胰体尾癌,术中同时切除脾。脾破裂的诊断标准以美国创伤外科学会(AAST)在1989年公布的器官损伤分级标准急诊行脾切除术[2]。脾亢的定义为各种原因造成的伴随脾大及血细胞过度消耗的临床综合征,14例均切除肿大脾[3]。
3 脾切除术后抗血小板治疗 胰腺癌组男性23例,女性19例,年龄 24 ~ 79(61.8±12.4)岁;脾破裂组男性13例,女性5例,年龄16 ~ 57(36.5±13.2)岁;脾亢组男性11例,女性3例,年龄29 ~61(48.9±9.5)岁。胰腺癌组和脾亢组年龄明显大于脾破裂组,考虑主要与疾病本身特点有关。三组患者术后未见明显血性引流液,依据我们中心经验,常规行抗凝祛聚治疗。
4 统计学方法 应用SPSS14.0软件进行统计学分析。正态分布数据以-x±s表示,计数资料采用重复测量方差分析,事后检验采用SNK法。P<0.05为差异有统计学意义。
结 果
1 三组脾切除患者术后血小板的变化趋势 三组患者术后短期内血小板计数均明显升高,后逐渐降至正常范围内。其中因胰腺癌和脾破裂行脾切除术的患者术后血小板逐渐升高,于术后2周左右达到峰值,分别为(602.23±180.86)×109/L、(637.44±188.34)×109/L,术后2个月左右降至正常范围内;因脾亢行脾切除术的患者血小板于术后1个月左右达到峰值,为(581.78±227.52)×109/L,术后2个月降至正常范围内。三组之间血小板数值在术后21 d和术后2个月时差异无统计学意义。在术前、术后1 d、术后3 d、术后5 d、术后7 d、术后14 d和术后28 d,脾亢组和胰腺癌组和脾破裂组比较差异均有统计学意义。见图1。
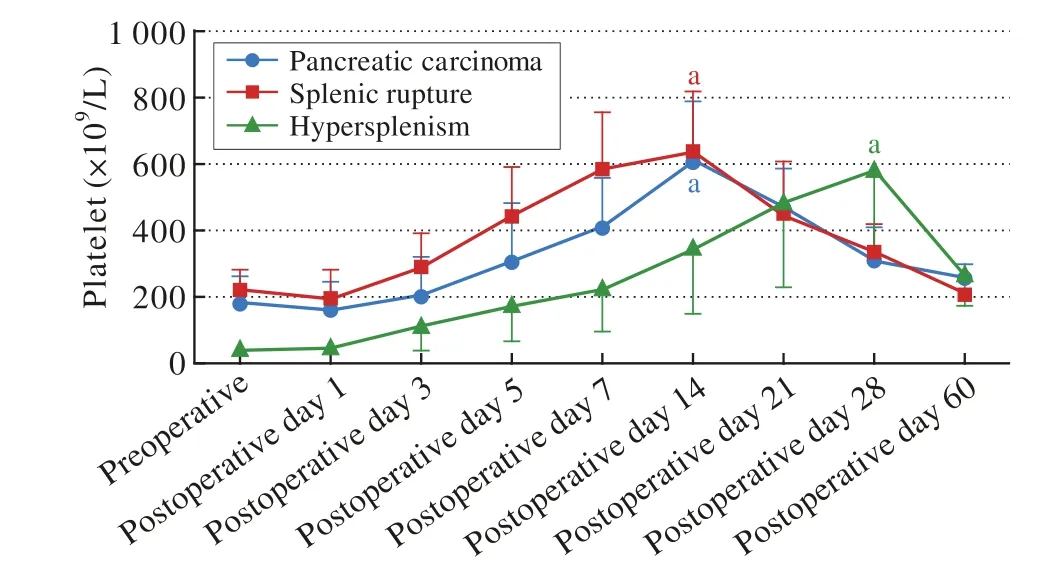
图 1 不同病因脾切除术患者术后血小板的变化趋势Fig. 1 Trend in changes of platelet after splenectomy by different reasons (aP<0.05, vs other time points)
2 三组脾切除术后血小板比较 三组之间血小板数值在术后21 d和术后2个月时差异无统计学意义。在术前、术后1 d、术后3 d、术后5 d、术后7 d、术后14 d和术后28 d,脾亢组与胰腺癌组和脾破裂组比较差异均有统计学意义。脾亢组血小板计数在术前、术后1 d、术后3 d、术后5 d、术后7 d和术后14 d均小于胰腺癌组和脾破裂组,在术后28 d大于胰腺癌组和脾破裂组,提示脾亢组血小板上升较胰腺癌组和脾破裂组缓慢,于术后1个月左右达到峰值。见表1。
讨 论
脾在胚胎发育早中期是造血器官[4]。出生后脾转变为免疫器官[5]。在某些病理情况下仍有造血现象,产生各种血细胞;其具有储血功能,把血液尤其是红细胞和血小板储存起来,在机体需要时将其释放[6]。血小板经正常生存期后亦在脾内被清除。在各种原因如胰腺癌、脾破裂、脾亢等情况下不得不行脾切除术。术后血小板失去了滞留破坏的场所,周围血液中血细胞和血小板在数小时内升高[7]。这种现象有学者认为是由于脾有控制血细胞从骨髓进入血液循环功能[8]。同时骨髓增生活跃,血小板巨细胞增多,血小板产生良好,可见成簇血小板。此外脾内产生的体液调节因子减少而引起血小板生成增多[9]。初兆毅等[10]收治的138例外伤性脾破裂行脾切除患者,术后通过监测血小板变化,发现所有病例术后均血小板计数升高。本研究表明胰腺癌及脾破裂组患者术后2周血小板达峰值,术后2个月左右降至正常水平。
脾功能亢进患者术前血小板计数较正常人低,可能与肿大的脾清除血小板能力增加有关。脾亢行脾切除术后,肿大的脾对血小板的清除作用消失,使得血小板呈现上升趋势[11]。由于术前脾功能亢进,骨髓出现代偿性增生,使血小板产生增加。脾切除术后此种因素消失,而代偿增生的骨髓造血不会立即停止,故脾亢患者术后血小板升高持续时间较长。阮永军[12]收治40例脾亢患者行脾切除术后血小板计数多为(300 ~ 600)×109/L。本研究表明脾亢患者术后1个月血小板达峰值,术后2个月左右恢复正常。
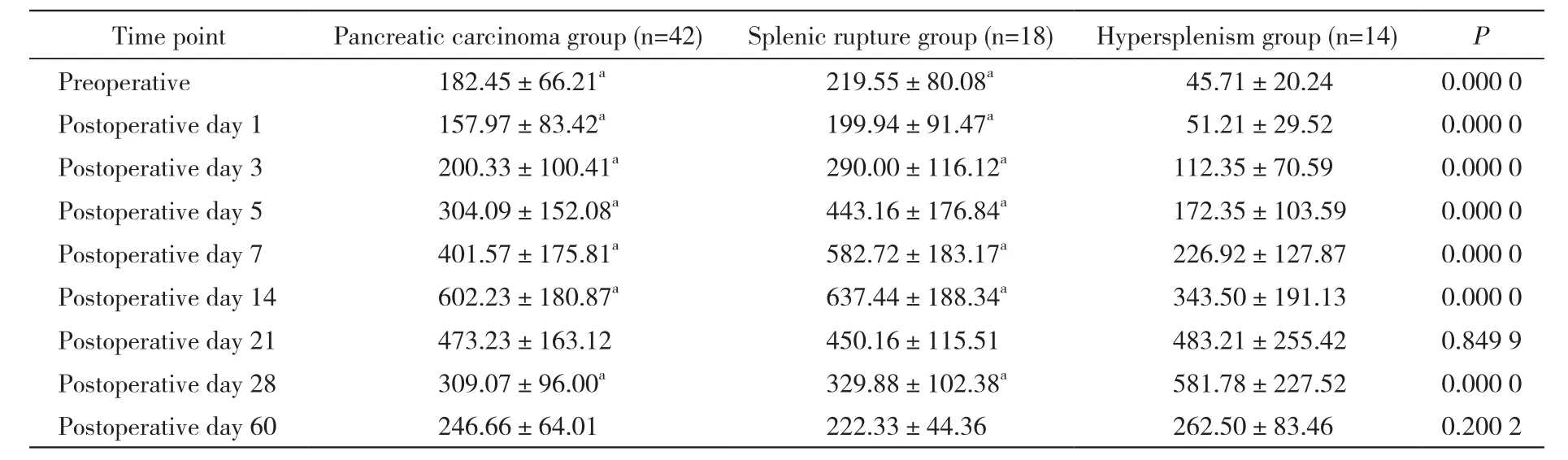
表1 不同病因脾切除术患者术后血小板比较 (×109/L)Tab. 1 Comparison of platelet counts after splenectomy between three groups (×109/L)
本研究结果显示脾切除术后3 ~ 5 d即可见血小板增高,并常在14 d及28 d内达到高峰,之后又逐渐下降,在术后2个月左右恢复正常。在术后14 d及28 d血小板达高峰时数量达到了600×109/L左右。这种情况下易形成静脉血栓。脾切除术后静脉血栓形成与术后血小板升高、门静脉系统血流动力学改变、血液高凝状态及血管内膜损伤有关[13-14]。分析脾切除术后静脉血栓形成的可能原因:1)脾切除后脾静脉呈一盲端,血流速度缓慢,术中可能有胃壁周围小静脉内血栓形成[15];2)手术时导致血管内膜损伤,胶原纤维暴露,进而激活凝血系统,促进血栓形成[16]。3)脾切除术手术创面较大,术后使用止血剂止血等。血栓蔓延至门静脉主干,导致门脉压力增高,严重者可出现腹水,甚至消化道出血等症状[17-18]。若下肢深静脉血栓形成,血栓脱落,随血液流动,可致肺栓塞最终导致死亡。我们中心经验,当血小板>400×109/L,活化部分凝血活酶时间超过正常的2倍,腹腔引流管未见明显出血时即考虑常规采用抗凝、祛聚治疗,开始口服阿司匹林、皮下注射低分子肝素直至血小板逐步恢复至正常范围[19]。在此过程中,严密监测患者血常规及凝血功能变化[20]。必要时行腹部及下肢静脉超声检查,及时调整治疗方案。
综上所述,脾切除术后患者血小板在短期内呈明显上升趋势,后逐渐降至正常水平。不同病因切除脾后血小板的变化各有其特点。胰腺癌及脾破裂组患者术后2周血小板达峰值,术后2个月左右降至正常水平;而脾亢患者术后1个月血小板达峰值,术后2个月左右恢复正常。本研究观察了不同病因行脾切除术后患者血小板的变化情况,以期指导临床的后期治疗。
1 许守平, 姜洪池. 脾脏外科进展[J]. 中国中西医结合外科杂志,2010, 16(2): 134-137.
2 Moore EE, Moore FA. American Association for the Surgery of Trauma Organ Injury Scaling: 50th anniversary review article of the Journal of Trauma[J]. J Trauma, 2010, 69(6): 1600-1601.
3 刘雪莲, 杨见权. 脾功能亢进症治疗进展[J]. 实用肝脏病杂志,2013, 16(4): 382-384.
4 吴阶平, 裘法祖, 黄家驷. 外科学[M]. 6版. 北京: 人民卫生出版社, 2000 : 321-324.
5 夏穗生, 张伟杰. 脾脏外科的沿革与展望[J]. 中华肝胆外科杂志, 2011, 17(4): 273-278.
6 张澍, 李宗芳. 脾脏功能与脾脏外科研究现状与展望[J]. 中华实验外科杂志, 2014, 31(2): 231-233.
7 邹俊, 李学明, 陈海鸣. 门静脉高压症脾切除贲门周围血管离断术后门静脉血栓形成的相关因素分析[J]. 实用医学杂志,2013, 29(4): 581-583.
8 Grozovsky R, Giannini S, Falet H, et al. Novel mechanisms of platelet clearance and thrombopoietin regulation[J]. Curr Opin Hematol, 2015, 22(5): 445-451.
9 Grozovsky R, Giannini S, Falet F, et al. Molecular mechanisms regulating platelet clearance and thrombopoietin production[J].ISBT Science Series, 2015, 10(1): 309-316.
10 初兆毅, 唐镇, 胡少宏, 等. 外伤性脾切除术后血小板变化的临床治疗[J]. 中国医药指南, 2011, 9(15): 89-90.
11 潘飞, 郎韧, 俞亮, 等. 腹腔镜脾部分切除术(附八例报告)[J].腹部外科, 2015, 28(6): 415-418.
12 阮永军. 不同病因脾切除术后血小板变化的研究[J]. 临床医学,2013, 33(5): 51-52.
13 Danno K, Ikeda M, Sekimoto M, et al. Diameter of splenic vein is a risk factor for portal or splenic vein thrombosis after laparoscopic splenectomy[J]. Surgery, 2009, 145(5): 457-464 ; discussion 465-456.
14 陈国富, 范国华. 脾切除术后门静脉系统血栓形成的临床分析[J]. 中国普外基础与临床杂志, 2012, 19(6): 649-652.
15 魏云海, 慎华平, 张国雷, 等. 监测P-选择素、血栓前体蛋白、D-二聚体对门脉高压脾切除术后门静脉血栓形成的早期预测价值[J]. 中华肝胆外科杂志, 2013, 19(7): 526-529.
16 范铁艳, 程留芳. 肝硬化门静脉高压脾切除术后门静脉血栓形成多因素分析[J]. 中国医师杂志, 2007, 9(7): 912-914.
17 陈炜. 脾切除断流术后脾静脉和门静脉血栓形成的发生率为多少?是什么原因?能否预防?[J]. 外科理论与实践, 2009, 14(1): 90-91.
18 Pietrabissa A, Moretto C, Antonelli G, et al. Thrombosis in the portal venous system after elective laparoscopic splenectomy[J]. Surg Endosc, 2004, 18(7): 1140-1143.
19 Vecchio R, Cacciola E, Cacciola RR, et al. Portal vein thrombosis after laparoscopic and open splenectomy[J]. J Laparoendosc Adv Surg Tech A, 2011, 21(1): 71-75.
20 Lee S, Kim DJ, Kim IG, et al. Use of pericholedochal plexus for portal flow reconstruction in diffuse portal vein thrombosis: case report[J]. Transplant Proc, 2014, 46(3): 977-979.
