CuO/TiO2异质多孔纳米结构的制备及其光催化性能
2018-03-15,,,
,,,
(四川理工学院 材料科学与工程学院,四川 自贡 643000)
1 前 言
近年来,半导体光催化引起了人们广泛的研究兴趣[1-5]。与其它的半导体光催化剂相比,TiO2无毒,化学性质稳定,其价带与导带之间的带隙能高达3.2eV,使得光生电子和空穴具有较长的寿命(大约为250ns),这就有足够的时间让电子和空穴转移到晶体的表面,在TiO2表面形成不同自由基,可有效地降解水中的污染物,光催化效果好,从而受到了极大关注,成为光催化反应中最常用的催化剂[6-8]。然而,单一的TiO2吸收阈值小于400nm,它仅在紫外光照射下具有较好的光催化效率,对太阳光的利用率不高,影响了它多相光催化反应产业化的进程。为了提高纳米TiO2的光催化活性和发展新型高效的光催化功能材料,对纳米TiO2表面的修饰引起了广泛的关注[9-10]。
将窄带隙半导体与宽带隙半导体TiO2复合,不仅可以提高材料的吸收阈值,使其在可见光区有光吸收,还可以减缓光生电子-空穴对的复合,因此,复合纳米材料的研究及使用日益受到了重视。CuO 是禁带宽度较窄的半导体(禁带宽度为1.2eV),能吸收近紫外线,也可以被400~800nm可见光激发[11-12]。如果将窄禁带半导体CuO与宽禁带半导体TiO2复合,制备CuO/TiO2异质复合纳米结构,当紫外光照射到材料表面时,从TiO2价带上跃迁的激发电子易于与TiO2导带(CB)接近的CuO的空穴结合,而具有强还原性的激发电子和强氧化性的空穴分别保持在CuO的导带(CB)和TiO2的价带(VB)上,实现光生电子和空穴的有效分离,减小电子-空穴复合率,从而提高TiO2的光催化降解效果[13]。而在可见光作用下,CuO价带上的电子激发跃迁到导带上,在电位差的作用下转移到TiO2的导带上,空穴留在CuO的价带上,从而实现光生电子-空穴的分离,提高TiO2的光催化降解效果[14]。另一方面,由于CuO导带比TiO2的要高出很多,与TiO2复合将主要引起TiO2表面Ti3+的增加,即TiO2晶格氧缺位增加,这会提高催化剂对氧的吸附能力,吸附的氧气分子是非常有效的电子捕获剂,捕获电子生成超氧化物自由基参与氧化还原反应从而能提高光催化反应的效率[15-20]。
目前报道的CuO/TiO2异质结构的制备方法主要有水热-吸附煅烧法,化学沉积法,浸渍法等。例如E. Vigil等人采用短时间光化学沉积法在多孔纳米TiO2薄膜表面沉积CuO,得到CuO/TiO2复合纳米粒子组成的薄膜[21];Huang等釆用沉积沉淀法制备了 CuO/TiO2异质结构纳米粉末,并研究了产物对CO的催化氧化性能[22];Manivel等利用TiO2在CuSO4水溶液中浸渍搅拌48h,然后经过干燥和煅烧制得CuO/TiO2复合催化剂,并研究了产物对酸性品红的光催化降解性能,结果表明[23],复合材料具有更好的光催化降解性能;Luo等采用TiO2纳米管阵列为模板,在TiO2纳米管上沉积金属Cu纳米粒子,然后经过高温氧化制得CuO/TiO2复合纳米管阵列,并研究了产物对葡萄糖氧化过程的催化作用[24]。可以看出,目前报道的CuO/TiO2异质结构纳米材料的制备方法大多是在TiO2纳米结构表面沉积CuO纳米粒子,采用其他物质的纳米结构为模板制备CuO/TiO2异质结构纳米材料还少有报道。
本论文采用自制的Cu(OH)2纳米棒阵列结构为模板,巧妙的设计实验方案,以钛酸四丁酯为钛源,采用外向包覆模板法,利用Cu(OH)2自身热分解产生的微量水分子与负载在其表面的钛酸四丁酯缓慢反应,制备了CuO/TiO2异质多孔纳米结构,并研究了材料对模拟有机染料废水RhB的光催化降解性能。该方法可以有效地避免钛酸四丁酯水解过快造成团聚等问题,使产物的制备具备可控性。
2 试 验
2.1 前驱物Cu(OH)2纳米棒阵列的制备
在60mL磨口瓶中依次加入10.0mL蒸馏水,2.0mL NaOH溶液(10.0mol/L),1.0mL NH3·H2O(25%)和1.0mL (NH4)2S2O8溶液(1.0mol/L),然后将清洗干净的铜箔(15×15×0.25mm3)放入其中,在室温(15~25℃)下反应50min,取出样品,用蒸馏水和无水乙醇分别冲洗三次,在空气中晾干,样品呈天蓝色。
2.2 CuO/TiO2异质多孔纳米结构的制备
将3mL钛酸四丁酯和37mL苯加入高压反应釜的聚四氟乙烯内胆中,然后将制备的Cu(OH)2纳米棒阵列放入到溶液中,将高压釜密封,在170℃的条件下反应12h。样品用蒸馏水和无水乙醇分别洗涤三次,在空气中晾干,样品呈黑色。
2.3 TiO2纳米结构的制备
将上述制备的CuO/TiO2异质多孔纳米结构浸渍于40.0mL NH3·H2O溶液(12%)中反应24h,再取出样品,用蒸馏水和无水乙醇分别洗涤三次,在空气中晾干。
2.4 样品的表征
产物的物相和成分用Bruker D2 Phaser型X射线衍射仪(XRD)进行分析,以Cu Κα 为衍射射线源(λ=0.15406nm)。采用Tescan Viga 3SBU 型扫描电子显微镜(SEM),Tescan Mira 3 GMU/GMH型场发射扫描电子显微镜(FESEM)对产物的形貌和微观结构进行分析。采用PerkinElmer LS55型荧光分光光度计测定RhB的室温荧光光谱(PL),激发光波长为350nm。
2.5 产物的光催化性能研究
本文采用所制备的样品为光催化剂,以有机染料RhB为模拟污染物,在室温、紫外光照下测试样品的光催化活性。以紫外灯为光源(Cnlight UVC220-2H,15W,主波长365nm),3mL的石英比色皿为光催化反应容器,控制光源与比色皿的距离为10cm;以荧光分光光度计测试样品光催化降解RhB性能。将制备的光催化剂薄膜置于1.5mL RhB(4mg/L)溶液中,在黑暗的条件下吸附2h,然后开启紫外灯,每隔30min将催化剂取出,用荧光分光光度计测试溶液的荧光光谱,测试结束后将催化剂放回溶液中,继续在紫外光的照射下进行光催化反应,控制每次测试时间少于1min。在激发波长为350nm的条件下,RhB溶液在586nm处有一个明显的荧光发光峰。在低浓度范围内,RhB的浓度与其在586nm处荧光峰的强度成线性关系,因此通过溶液荧光峰强度的变化可以计算出RhB溶液浓度的变化。降解率计算公式如下:

3 结果与分析
产物的的晶体结构和成分用XRD进行表征。
图1是制备的前驱体的XRD图谱。除了标有“#”号的衍射峰来自铜箔基底外(JCPDF 04-0836),其它所有的衍射峰都可指标化为正交相的Cu(OH)2(JCPDF 13-0420),说明制备的前驱体为纯相的Cu(OH)2。图2是前驱体Cu(OH)2的SEM照片。可以看出,前驱体Cu(OH)2是由整齐有序的Cu(OH)2纳米棒阵列组成的,纳米棒的直径约为200~400nm,纳米棒的表面非常光滑。
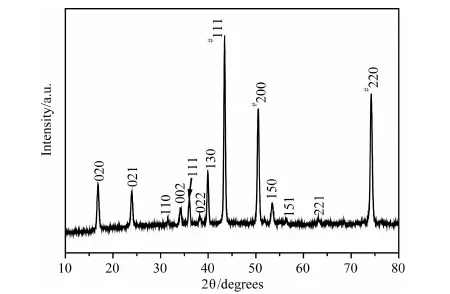
图1 生长在铜箔上的前驱Cu(OH)2的XRD图谱Fig.1 XRD pattern of the Cu(OH)2 precursors on copper foil

图2 生长在铜箔上的Cu(OH)2纳米棒阵列的FESEM照片Fig.2 FESEM images of the Cu(OH)2 precursors on copper foil
图3是终产物CuO/TiO2异质纳米结构的XRD图谱,图中以“#”标记的衍射峰来自Cu基底,以“*”标记的衍射峰可以指标化为正交相TiO2(JCPDF 29-1360),其余的衍射峰可以指标化为单斜晶系的CuO(JCPDF 65-2309),没有Cu(OH)2的衍射峰出现,说明产物是由CuO与TiO2组成的,前驱体Cu(OH)2纳米棒在溶剂热反应过程中已全部分解为CuO。TiO2是由钛酸四丁酯水解形成的。可以推断,产物CuO/TiO2异质纳米结构的形成主要有以下几个步骤:①微量的钛酸四丁酯分子被吸附在Cu(OH)2纳米棒的表面;②Cu(OH)2纳米棒在170℃的条件下发生分解,生成CuO和H2O;③吸附在Cu(OH)2纳米棒表面的钛酸四丁酯与生成的微量水分子发生水解反应,生成TiO2。
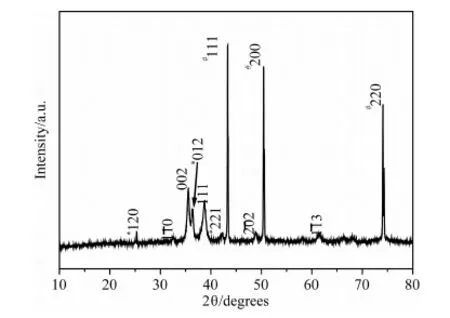
图3 产物CuO/TiO2异质纳米结构的XRD图谱Fig.3 XRD pattern of the CuO/TiO2 heterogeneous nanostructures
产物的形貌和结构用场发射扫描电镜(FESEM)进行表征。图4是产物CuO/TiO2异质纳米结构的FESEM照片,从低倍的FESEM照片可以看出,产物薄膜呈现均匀的多孔结构,微孔的直径约为2~4μm。图4(c)是两个典型的孔状结构的FESEM照片,可以看出,微孔的孔壁是由许多纳米棒自组装形成的;孔壁上的纳米棒的FESEM照片(图4(d))显示,纳米棒直径大约为500nm,纳米棒的表面是由纳米颗粒组装形成的。与前驱体纳米棒相比,产物中微孔孔壁上的纳米棒长度明显变短,且不再呈现阵列结构,这种变化可能是反应中前驱体纳米棒在高温下发生弯曲和断裂引起的。孔状结构的形成可能是因为反应体系中产生相分离所致[25]。由于钛酸四丁酯水解的产物在极性上与溶剂苯存在较大差别,从而相容性较低,可能导致相分离的发生。
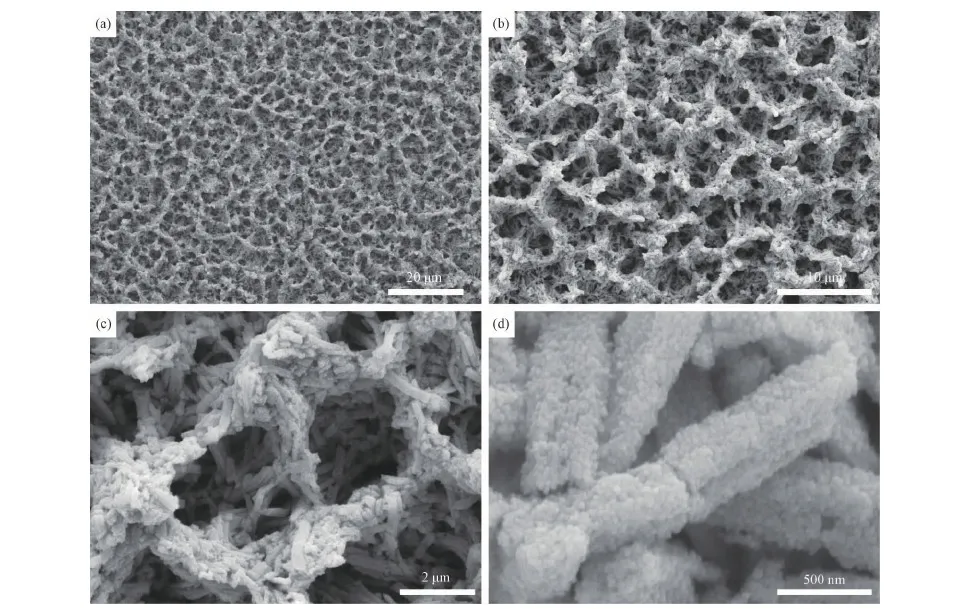
图4 产物CuO/TiO2异质多孔纳米结构的FESEM照片Fig.4 FESEM images of the CuO/TiO2 heterogeneous porous nanostructures
图5(a)和(b)分别是以CuO/TiO2异质多孔纳米结构和纯TiO2纳米结构作为光催化剂,对4 ppm的RhB溶液光催化降解不同时间后溶液的荧光光致发光谱图。由图5(a)可以看出,随着光催化反应时间的延长,溶液的光致发光峰强度迅速减弱,经过2h的光催化降解,RhB溶液的降解率约为75%。由图5(b)可见,当光催化反应时间达到2h时,RhB溶液的降解率约为60%。可见,CuO/TiO2异质多孔纳米结构比纯TiO2纳米结构对罗丹明B具有更好的光催化降解性能。
图6是在不同光催化剂条件下RhB溶液的光催化降解曲线。从中可以很清楚地观察到,当不加光催化剂时,光照2h后,RhB溶液的降解率仅为10%左右。从图6也可看到CuO/TiO2异质多孔纳米结构对RhB具有更好的光催化降解性能。
相对于纯相的TiO2纳米结构,CuO/TiO2异质多孔纳米结构对RhB具有更好的光催化降解性能,这主要归因于以下两个方面。一方面, 产物CuO/TiO2异质多孔纳米结构是由直径约为2~4μm的微孔组成的多孔结构,微孔的孔壁是由纳米棒组装成的,并且纳米棒的表面是由许多纳米粒子组装而成的。这种层层组状结构和多孔状结构使得产物具有较大的比表面积和较强的吸附能力,所以产物与染料分子有较大的接触面积,从而可加快光催化反应的进行。另一方面,CuO 是禁带宽度较窄的半导体(禁带宽度为1.2eV),当其与宽禁带半导体TiO2复合时,在两种物质的界面会形成异质结,可以大大提高其光催化降解反应的效率,这主要基于以下两方面的原因:(1)由于CuO导带比TiO2的要高出很多,与TiO2复合将主要引起TiO2表面Ti3+的增加,即TiO2晶格氧缺位增加,这会提
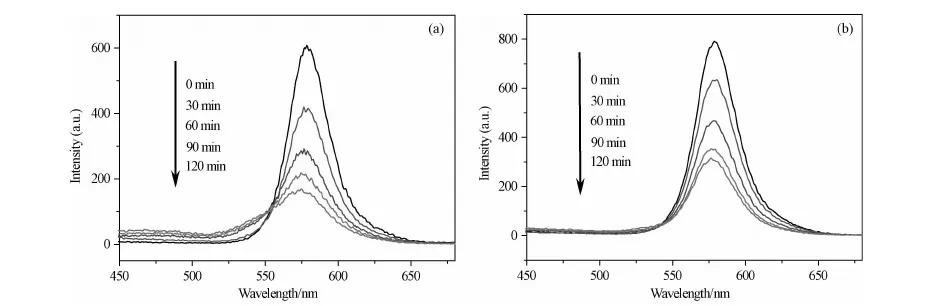
图5 采用两种不同的光催化剂,对4 ppm的罗丹明B溶液光催化降解不同时间后溶液的荧光光致发光谱图 (a) CuO/TiO2异质多孔纳米结构; (b) TiO2纳米结构Fig.5 Photoluminescence spectra of the RhB solutions with an initial concentration of 4mg/L after different irradiation time during the photocatalytic degradation process in the presence of the as-prepared CuO/TiO2 heterogeneous porous nanostructures (a) and TiO2 nanostructures (b)
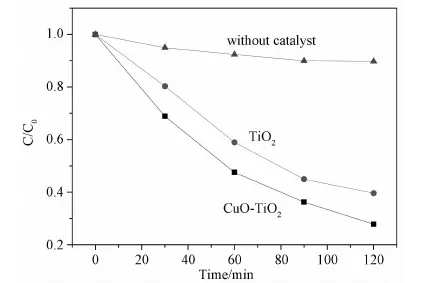
图6 不同光催化剂条件下RhB溶液的光催化降解曲线Fig.6 Rhodamine B photodegradation curves of C/C0 versus time for different photocatalysts
高催化剂对氧的吸附能力,吸附的氧气分子是非常有效的电子捕获剂,捕获电子生成超氧化物自由基参与氧化还原反应;(2)光生电子(e-)可传递给Ti3+,再传递给吸附氧,加速电子向分子氧的转移这一控制步骤,有效地降低纳米粒子表面的光生电子(e-)和光生空穴(h+)的复合率,使光生空穴更多地生成羟基自由基参与氧化反应,从而能提高光催化反应的效率。
4 结 论
采用外向包覆模板法,以Cu(OH)2纳米棒阵列为前驱体,利用Cu(OH)2自身热分解产生的微量水分子与负载在其表面的钛酸四丁酯缓慢反应,制备了CuO/TiO2异质多孔纳米结构,并研究了产物对RhB的光催化降解性能。结果表明,得到的产物为直径2~4μm的微孔组成的多孔纳米结构,微孔的孔壁是由直径500nm左右的纳米棒组装而成的。产物CuO/TiO2异质多孔纳米结构比纯TiO2纳米结构对RhB有更好的光催化降解性能,这主要是因为CuO/TiO2异质多孔纳米结构具有更好的吸附性能和更大的比表面积;另一方面,产物CuO/TiO2异质多孔纳米结构中异质结的存在能有效地降低光生电子空穴对的复合,从而提高产物的光催化降解效果。
[ 1] S. P. Albu,A. Ghicov,J. M. Macak,R. Hahn,P. Schmuki. Self-organized, Free-standing TiO2Nanotube Membrane for Flow-through Photocatalytic Applications[J]. Nano Lett., 2007, 7: 1286~1289.
[ 2] S. L. Chen, A. J. Wang, C. T. Hu, et al. Enhanced Photocatalytic Performance of Nanocrystalline TiO2Membrane by Both Slow Photons and Stop-band Reection of Photonic Crystals[J]. Alche J., 2012, 58(2):568~572.
[ 3] G. K. Prasad, T. H. Mahato, B. Singh, et al. Decontamination of Sulfur Mustard and Sarin on Titania Nanotubes[J]. Alche J., 2011, 54:2957~2963.
[ 4] J. Moon, C. Y. Yun, K. W. Chung, et al. Photocatalytic Activation of TiO2under Visible Light Using Acid Red 44[J]. Catal. Today, 2003, 87: 77~86.
[ 5] H. Yoneyama, T. Torimoto. Titanium Dioxide/ Adsorbent Hybrid Photocatalysts for Photodestruction of Organic Substances of Dilute Concentrations[J]. Catal. Today, 2000, 58: 133~140
[ 6] A. Fujishima, T. N. Rao, D. A. Tryk. Titanium Dioxide Photocatalysis][J]. J. Photochem. Photobiol (C: Photochem. Rev), 2000, 1(1): 1~21.
[ 7] W. X. Zhang, G. D. Chen, et al. A Novel Approach to Well-Aligned TiO2Nanotube Arrays and Their Enhanced Photocatalytic Performances[J]. Aiche J., 2013, 59(6): 2134~2144.
[ 8] 赖彭亮,朱燕舞,王均胜,等. 氮掺杂 TiO2的制备及其在不同光源下的光催化性能[J]. 材料科学与工程学报, 2015, 33(4): 542~548.
[ 9] T. Wu,A. G. Liu,J. Zhao,H. Hidaka,N. Serpone. Photoassisted Degradation of Dye Pollutants.V. Self-photosensitized Oxidative Transformation of Rhodamine B Under Visible Light Irradiation in Aqueous TiO2Dispersions[J]. J. Phys. Chem. B, 1998, 102(30): 5845~5851.
[10] A. A. Khodja,T. Sehili,J. F. Pilichowski,P. Boule. Photocatalytic Degradation of 2-Phenylphenol on TiO2and Zno in Aqueous Suspensions[J]. J. Photochem. Photobio. A: Chem, 2001, 141: 231~239.
[11] 吴欢文,张宁,钟金莲,洪三国. P-N复合半导体光催化剂研究进展[J]. 化工进展,2007, 26(12): 1669~1674.
[12] S. In, D. D. Vaughn, R. E. Schaak. Hybrid Cuo-TiO2*XNxHollow Nanocubes for Photocatalytic Conversion of CO2into Methane under Solar Irradiation[J]. Angew. Chem., 2012, 51(16): 3915~3918.
[13] S. Qin,F. Xin,Y. Liu,et al. Photocatalytic Reduction of CO2in Methanol to Methyl Formate over CuO-TiO2Composite Catalysts [J]. J. Colloid Interface Sci., 2011, 356: 257~261.
[14] G. Li,N. M. Dimitrijevic,L. Chen,et al. Role of Surface/Interfacial Cu2+Sites in the Photocatalytic Activity of Coupled CuO-TiO2Nanocomposites[J]. J. Phys. Chem. C, 2008, 112: 19040~19044.
[15] C. Lu, L. Qi, J. Yang, et al. One-pot Synthesis of Octahedral Cu2O Nanocages Via a Catalytic Solution Route[J]. Adv. Mater., 2005, 17(21): 2562~2567.
[16] W. Wunderlich, L. Miao, M. Tanemura, et al. AB-Initio Calculations of the Optical Band Gap of TiO2Thin Films[J]. Int. J. Nanosci., 2004, 3(4): 439~445.
[17] J. Li, L. Liu, Y. Yu, et al. Preparation of Highly Photocatalytic Active Nano-size TiO2-Cu2O Particle Composites with a Novel Electrochemical Method [J]. Electrochem. Commun. 2004, 6(9): 940~943.
[18] M. Miyauchi, A. Nakajima, K. Hashimoto, T. Watanabe. A Highly Hydrophilic Thin Film Under 1 ΜW/cm2UV Illumination[J]. Adv. Mater, 2000, 12(24):1923~1927.
[19] 李芳柏,古国榜,李新军,万洪富. 纳米复合Sbo/TiO2的光催化性能研究[J]. 无机化学学报, 2001, 17(1): 37~42.
[20] G. Q. Lu, A. Linsebigler, J. T. Yates. Ti3+Defect Sites on TiO2(110): Production and Chemical Detection of Active Sites[J]. J. Phys. Chem., 1947, 98(45): 11733~11738.
[21] E. Vigil, F. A. Fernandez-Lima, J. A. Ayllon, et al. TiO2-CuO Three- Dimensional Heterostructure Obtained Using Short Time Photochemical Deposition of Copper Oxide Inside a Porous Nanocrystalline TiO2Layer[J]. Microporous Mesoporous Mater., 2008, 109: 560~566.
[22] J. Huang, S. Wang, Y. Zhao, et al. Synthesis and Characterization of Cuo/TiO2Catalysts for Low-temperature CO Oxidation[J]. Catal. Commun., 2006, 7: 1029~1034.
[23] A. Manivel,S. Naveenraj,P. S. S. Kumar,S. Anandan. CuO-TiO2Nanocatalyst for Photodegradation of Acid Red 88 in Aqueous Solution[J]. Sci. Adv. Mater., 2010, 2: 51~57.
[24] S. Luo, F. Su, C. Liu, et al. A New Method for Fabricating a CuO/TiO2Nanotube Arrays Electrode and its Application as a Sensitive Nonenzymatic Glucose Sensor[J]. Talanta, 2011, 86(1): 157~163.
[25] 黄伟欣. 超亲水多孔TiO2薄膜的制备及超亲水机理研究[D].华南理工大学硕士学位论文,黄洪, 广州, 2010, 6.
