薏苡仁油对喉癌细胞侵袭迁移能力的影响
2018-03-13熊美华谌建平操润琴万金华
熊美华,谌建平,操润琴,万金华,操 建
(1.南昌市中西医结合医院耳鼻喉科,江西 南昌 330000;2.南昌市洪都中医院,江西 南昌 330008)
喉癌是头颈部肿瘤中最常见的恶性肿瘤之一,以鳞状细胞癌为主,约占95%,其发生发展是一个复杂的多步骤过程[1]。近年来其发病率呈逐步上升趋势,常造成患者发音及吞咽困难。常用的治疗手段包括:外科手术方法、化疗药物、放射治疗和生物治疗[2]。一般认为,喉癌具有侵袭力强、易复发和转移以及预后差的特点。因此提高患者生存率需要增加对喉鳞癌发病及侵袭转移机制的研究。
薏苡仁为禾本科植物薏苡的干燥成熟种仁,俗称米仁,又名薏米、苡仁等。现代研究表明,薏苡仁含有多种活性成分,如脂类、多糖类、木脂素类、酚类和腺苷等化合物。薏苡
仁在中医被用作利水渗湿药,现代研究发现其具有镇痛、抗炎、免疫调节、抗溃疡、降血糖和抗肿瘤等药理作用。目前对薏苡仁油的研究主要集中在其对肿瘤细胞的增殖与凋亡作用[3-4],然而薏苡仁油对肿瘤细胞的侵袭与迁移的作用报告较少,尤其对喉鳞癌细胞的侵袭与迁移作用尚未见报道。因此,本研究通过探讨薏苡仁油对喉癌细胞株Hep-2侵袭和迁移能力的影响,为薏苡仁油调控喉鳞癌的侵袭迁移机制提供研究基础。
1 材料与方法
1.1 细胞与试剂 喉癌细胞株Hep-2购自中国科学院上海细胞研究所,DMEM/F12、胰蛋白酶培养基购自美国Gibco公司,胎牛血清(FBS)购自美国Hyclone公司,CCK8试剂盒购自日本同仁化学研究所,Transwell小室(8.0μm孔径PC膜)购自美国Corning公司,Transwell Kit购自美国BD Biosciences公司,E-cad、Vimentin、Slug、pERK1/2、ERK1/2、GAPDH抗体购自美国Cell Signaling Technology公司,薏苡仁油购自浙江豪森药物股份有限公司。
1.2 细胞培养 选用喉癌细胞株Hep-2,用含10%FBS的DMEM/F12培养基培养,置于37℃恒温、5%CO2的饱和湿度培养箱中培养。所有细胞株从液氮中取出后进行复苏,置入培养箱中进行培养,待细胞铺满培养瓶约80%时进行传代,所有细胞常规传代2次,取生长状态良好无污染的细胞株进行后续实验。
1.3 CCK8实验 取状态良好的Hep-2细胞,胰酶消化后,离心,重悬,细胞计数板计数,调整细胞浓度至1×103个细胞/ml,在96孔板中按100 μl/孔加入细胞悬液,混合均匀,所有组均设3个复孔,另设无细胞组的空白孔。置于细胞培养箱中培养8 h。去除原培养基,加入含有不同浓度薏苡仁油(0、25、50、100、200、400、800、1 600 μM)的新鲜培养基,分别培养24、48、72、96 h,去除原培养基,PBS清洗3遍,每孔分别加入10 μl的CCK-8溶液,于细胞培养箱中培养2 h,取出96孔板,酶标仪检测各孔的吸光度值(波长设置为450 nm)。数据处理:根据吸光度值计算各组细胞的吸光值均数和标准差。使用Graphpad Prism软件绘图。抑制率=[1-(Atreated-Ablank)/(Acontrol-Ablank)]×100%。
1.4 划痕实验 细胞长至80%左右,加入不同浓度薏苡仁油处理24 h后,用1 ml枪头在6孔板各孔中央位置,划1道划痕,尽量使各孔的细胞划痕宽度一致。PBS漂洗3次,去除划下的细胞碎片。每孔加入1%血清的DMEM/F12培养基2 ml,放于细胞培养箱中继续培养。观察24 h后细胞迁移情况并拍照记录,迁移距离测量采用Image J软件。
1.5 Transwell侵袭实验 取经过不同浓度薏苡仁油处理24小时后细胞,消化离心后用无血清的 DMEM/F12培养基重悬细胞,调整细胞的密度为5×105个细胞/ml,小室上部加入200 μl细胞悬液,小室下部加入750 μl含10%FBS的DMEM/F12培养基。培养24 h后,去除上下室培养基,PBS清洗小室,将小室置入4%多聚甲醛中固定细胞10 min,室温下晾干小室,用棉签轻轻擦去小室内未迁移的细胞,避光,DAPI染色10 min,去离子水洗涤后风干,置于倒置荧光显微镜下观察,随机取五个视野计数穿过小室的细胞数,每组细胞重复3次实验。
1.6 Western blot实验 取经过不同浓度薏苡仁油处理24 h后细胞,加入细胞裂解液,低温高速离心后收集上清液,BCA法测蛋白浓度。将已配制好的蛋白样品与上样缓冲液充分混合,每个孔上样体积为20 μl,两侧加入Marker,在Bio-Rad凝胶电泳槽中进行电泳,将蛋白转移到PVDF膜上;室温下脱脂奶粉封闭1 h后,加入一抗孵育过夜,二抗室温孵育2 h,ECL免疫印迹底物进行发光显影、扫描。
1.7 统计学方法 采用SPSS 17.0统计软件分析结果,所有数据采用“x±s”表示。采用单因素方差分析(One-Way ANOVA);两组数据采用两独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 薏苡仁油抑制喉癌细胞株Hep-2的增殖 从图1可以看出,薏苡仁油抑制喉癌细胞株Hep-2的增殖,其抑制效应呈剂量-时间依赖性。薏苡仁油作用于同一时间点,与对照组相比(0 μM),随着薏苡仁油浓度的升高(25~1 600 μM),Hep-2生长抑制率显著增加,差异具有统计学意义(P<0.05);薏苡仁油对喉癌细胞株Hep-2的半数抑制浓度(IC50)为:165.2~650.2 μM,见表1。基于以上的结果,我们选择作用24 h的100,200 μM薏苡仁油浓度作为后续实验浓度。
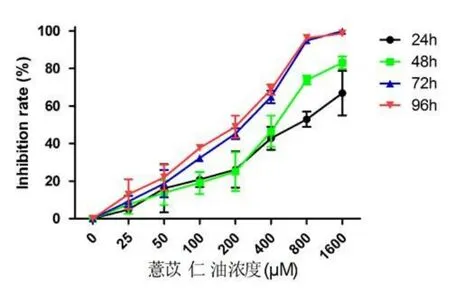
图1 薏苡仁油抑制喉癌细胞株Hep-2的增殖Figure1 Coix seed oil inhibited the proliferation of Hep-2 cells

表1 薏苡仁油作用后Hep-2的IC50值Table1 The IC50 values of Hep-2 after added the Coix seed oil
2.2 薏苡仁油抑制喉癌细胞株Hep-2的侵袭和迁移 我们采用划痕实验检测薏苡仁油对喉癌细胞株Hep-2迁移能力的影响,从图2A-B可以看出,采用不同浓度薏苡仁油(100,200μM)处理细胞24 h后,薏苡仁油组划痕区变窄,对照组组划痕依然明显,差异具有统计学意义(P<0.05)。
采用含基质胶的Transwell小室检测薏苡仁油对喉癌细胞株Hep-2侵袭能力的影响,采用不同浓度薏苡仁油(100,200 μM)处理细胞24 h后,薏苡仁油组穿膜细胞数目显著下降,即其侵袭能力明显受抑制(图2C-D),差异均具有统计学意义(P<0.05)。
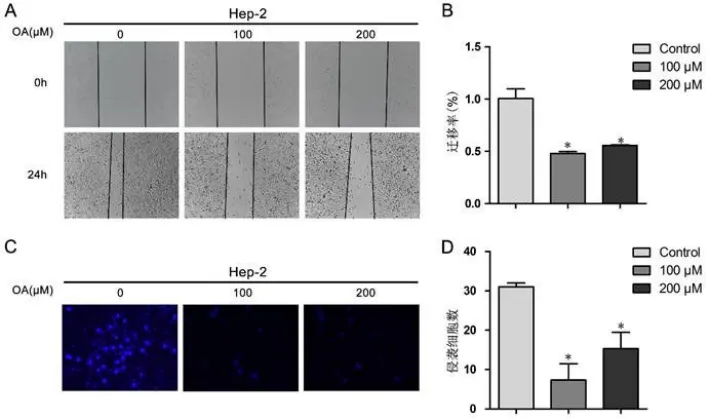
图2 薏苡仁油抑制喉癌细胞株Hep-2的侵袭和迁移Figure2 Coix seed oil inhibited the invasive and migrative ability on Hep-2 cells
2.3 薏苡仁油对喉癌细胞株Hep-2侵袭、转移相关因子的表达 Western bolt免疫印迹检测结果显示:采用不同浓度薏苡仁油(100,200 μM)处理细胞 24 h后,Vimentin、Slug、pERK1/2表达下调;E-cad表达升高;ERK1/2表达不变,见图3。

图3 薏苡仁油对喉癌细胞株Hep-2侵袭、转移相关因子的表达Figure3 The protein levels of EMT related genes after added the different concentrations of Coix seed oil
3 讨论
喉癌是喉部最常见的恶性肿瘤,我国(2003~2007年)喉癌发病率为2.04/10万,占全部恶性肿瘤新发病例的0.77%[5]。虽然喉癌的治疗主要以手术及放疗为主,但是近年来,术后化疗或者术前诱导化疗可以减低喉癌局部复发或远处转移的风险,尤其是术前诱导化疗可以改善患者的生活质量[5-6]。
薏苡仁含有多种活性成分,如脂类、多糖类、木脂素类、酚类和腺苷等化合物。薏苡仁在中医被用作利水渗湿药,现代研究发现其具有镇痛、抗炎、免疫调节、抗溃疡、降血糖和抗肿瘤等药理作用。目前对薏苡仁油的研究主要集中在增殖和凋亡方面。车晓玲等[4]研究发现,薏苡仁油可协同奥沙利铂抑制人结直肠癌SW480细胞的增殖,并促进其凋亡。有学者研究表明薏苡仁注射液抗肿瘤的可能机制有:抑制细胞周期,使细胞周期阻滞于G2+M期,减少进入G0、G1时相细胞,使DNA合成期(S期)比例减少,从而减少有丝分裂,抑制肿瘤细胞增殖[7];谷满仓等[8]在胰腺癌细胞系BXPC3中发现薏苡仁脂可能通过逆转吉西他滨诱导的抗凋亡蛋白Bcl-2、Survivin表达上调,并增加Bax/Bcl-2比值,从而进一步激活Caspase-3蛋白介导的细胞凋亡,增强吉西他滨对胰腺癌细胞株BXPC3的生长抑制作用和诱导凋亡作用。沈飞琼等[9]通过对抑瘤率及 MVD、VEGF、KDR蛋白及mRNA的检测,发现并证实康莱特(薏苡仁油)及吉非替尼单药均能产生一定的抗肿瘤作用,而康莱特联合吉非替尼具有协同增效作用,且能够显著降低肿瘤组织血管生成数目。国内对与薏苡仁油的研究较多,而国外的研究较少,Liu等[10]采用不同浓度康莱特注射液对小鼠皮下胰腺癌细胞成瘤实验表明:薏苡仁油能够抑制肿瘤的生长,诱导肿瘤的凋亡,并且可以下调p-AKT及p-mTOR的表达来影响PI3K/Akt/mTOR信号通路。Zhan等[11]通过对胃癌化疗患者分组对比研究显示,采用薏苡仁油联合化疗药物组患者的疗效,生活质量,毒副作用,胃肠道反应和骨髓抑制作用明显比只采用化疗药物组低。
在本研究中,我们发现,薏苡仁油抑制喉癌细胞株Hep-2的增殖,其抑制效应呈剂量-时间依赖性;薏苡仁油对喉癌细胞株Hep-2的半数抑制浓度(IC50)为:165.2~650.2 μM;经薏苡仁油作用后Hep-2细胞的侵袭和迁移能力降低,差异具有统计学意义(P<0.05);薏苡仁油(100,200 μM)作用后,与对照组相比,Vimentin、Slug、pERK1/2的表达下调;E-cad的表达升高;ERK1/2的表达不变。
综上所述,薏苡仁油可以抑制喉鳞癌的侵袭和迁移,并初步阐明了可以通过调控上皮-间充质转化(EMT)来抑制喉鳞癌的侵袭迁移,上述研究为薏苡仁油抑制喉鳞癌的侵袭转移提供了可靠的实验依据。
[1] 王蓓蕾,徐立红,袁晖,等.喉癌相关基因的研究进展[J].中国细胞生物学学报,2014(9):1323-1330.
[2] 刘家锋.不同手术方式治疗喉癌的预后研究[J].当代医学,2017,23(28):59-60.
[3] 胡静,马力天,闫平,等.康莱特联合顺铂对宫颈癌SiHa细胞增殖和凋亡的影响[J].现代生物医学进展,2014,14(10):1865-1870.
[4] 车晓玲,李进,何敬东,等.康莱特注射液联合奥沙利铂对SW480细胞株增殖和凋亡的影响[J].肿瘤,2011,31(4):321-325.
[5] 张树荣,房居高.诱导化疗在局部晚期喉癌治疗中的应用进展[J].中华临床医师杂志(电子版),2015,9(4):655-659.
[6] 赵舒薇.喉癌治疗进展[J].肿瘤学杂志,2012,18(9):644-647.
[7] 李大鹏.康莱特注射液抗癌作用机理研究进展[J].中药新药与临床药理,2001,12(2):122-124.
[8] 谷满仓,钱亚芳,孙悦,等.薏苡仁脂调控凋亡相关蛋白Bax、Bcl-2及Survivin增强胰腺癌细胞对吉西他滨敏感性的研究[J].中国药理学通报,2013,29(4):491-495.
[9] 沈飞琼,魏素菊,洪雷,等.康莱特联合吉非替尼对Lewis肺癌小鼠血管生成的影响[J].肿瘤,2013,33(12):1047-1053.
[10]Liu Y,Zhang W,Wang XJ,et al.Antitumor effect of Kanglaite(R)injectioninhumanpancreatic cancer xenografts[J].BMC Complement Altern Med,2014,14:228.
[11]Zhan YP,Huang XE,Cao J,et al.Clinical safety and efficacy of Kanglaite(R)(Coix Seed Oil)injection combined with chemotherapy in treating patients with gastric cancer[J].Asian Pac J Cancer Prev,2012,13(10):5319-5321.
