曲霉菌临床分离株的分子鉴定及体外抗真菌药物敏感性分析
2018-03-13张莉莉王强兄沈亮亮冀燕芬邓淑文赵敬军
张莉莉, 王强兄, 沈亮亮, 冀燕芬, 邓淑文, 赵敬军
(1. 同济大学附属同济医院皮肤科,上海 200065; 2. 上海长征医院皮肤病与真菌病研究所-上海市医学真菌重点分子生物学实验室,上海 200003)
曲霉菌是环境中广泛存在的机会性致病真菌,可引起肺、眼、鼻、外耳道、皮肤等的感染。侵袭性曲霉病是曲霉菌感染最严重的一种类型,主要累及免疫功能严重受损患者,临床治疗诊断及困难,死亡率高达90%[1-2]。近年来,随着骨髓、器官移植的广泛开展,广谱抗生素及免疫抑制剂的大量使用,侵袭性曲霉病的发生率明显增高,在免疫抑制患者中已仅次于白念珠菌感染。烟曲霉是曲霉病最常见的致病菌,约占80%[3],其次为黄曲霉、土曲霉、黑曲霉[4]。由于不同曲霉菌之间药物敏感性存在差异,因此将曲霉菌鉴定到种可以更有针对性地选择抗真菌药物[5]。此外,鉴定到种的水平还可以确定感染性疾病的病因,进行流行病学分析,有助于医院感染控制。使用分子生物学方法如ITS及β-tubulin基因测序可以将曲霉菌准确地鉴定到种水平[6]。目前,临床上治疗曲霉病的一线药物为伊曲康唑、伏利康唑、泊沙康唑等,随着曲霉菌抗真菌药物的耐药现象日益严重,抗真菌药敏试验日趋重要。本研究采用ITS及β-tubulin基因测序对53株曲霉菌临床分离株进行分子鉴定,将菌株准确鉴定到种及以下水平,并按照CLSI M38-A2方案测定伊曲康唑、伏立康唑、泊沙康唑、两性霉素B、米卡芬净、阿尼芬净、卡泊芬净对这些菌株的MIC值,分析不同抗真菌药物对曲霉菌的体外敏感性特点,从而为临床治疗曲霉菌感染提供药敏依据。
1 资料与方法
1.1 菌株来源
菌株来自于新疆医科大学第一附属医院2015—2016年从镜检阳性的临床标本中分离的53株经形态学初步鉴定为曲霉菌的菌株,其中16株分离自疑似肺曲霉感染患者痰液,其余37株分离自外耳道曲霉菌感染患者的耳道分泌物。
1.2 抗真菌药物
伊曲康唑、伏立康唑、泊沙康唑、卡泊芬净、两性霉素B购自Sigma公司;米卡芬净、阿尼芬净购自多伦多化学品研究公司;米卡芬净和卡泊芬净用灭菌蒸馏水溶解,其余药物用二甲基亚砜(DMSO)溶解,分装后-80℃保存备用。
1.3 培养基
马铃薯葡萄糖琼脂培养基购自美国BD-Difco公司;RPMI-1640液体培养基购自Gibco公司。
1.4 菌种鉴定
将分离纯化的菌株接种于PDA培养基,按照之前的方法对所有菌株提取DNA并进行ITS基因扩增测序及β-tubulin基因扩增测序将菌株鉴定到种水平[7-9]。
1.5 体外药敏试验
根据CLSI M38-A2方案进行药物敏感性测定。棘白菌素类药物浓度梯度设置为0.008~4μg/mL,其余药物均为0.031~16μg/mL。棘白菌素类药物24h后观察结果,其余药物48h后观察结果。选用标准株ATCC 22019及ATCC MYA 3627作为质控菌株。
1.6 结果判定
唑类药物(伊曲康唑、伏立康唑、泊沙康唑)和两性霉素B最低抑菌浓度(minimum inhibitory concentration, MIC)定义为肉眼直接观察到的无真菌生长的最低药物浓度;棘白菌素类药物(米卡芬净、卡泊芬净、阿尼芬净)最低有效浓度(minimum effective concentration, MEC)定义为出现短而异常分支的菌丝时的最低药物浓度。由于M38-A2方案中尚未制定曲霉属药物敏感性的判读折点,根据CLSI M38-A2方案及多中心推荐的曲霉菌流行病学临界值(ECV)来评估药物的敏感性[9-10],MIC>ECV即为非野生株。伊曲康唑、伏立康唑对烟曲霉、土曲霉、黄曲霉ECV值为1μg/mL,对黑曲霉ECV值为2μg/mL;泊沙康唑对烟曲霉、土曲霉、黑曲霉ECV值为0.5μg/mL,对黄曲霉为0.25μg/mL;两性霉素B对烟曲霉、黄曲霉、黑曲霉ECV值为2μg/mL,土曲霉为4μg/mL。塔宾曲霉和百岁兰曲霉的ECV值尚未制定,按黑曲霉的ECV值进行评估。
1.7 统计学处理
通过药敏分析软件Whonet 5.4计算7种药物对不同曲霉菌株的MIC50、MIC90、MIC范围等参数。采用SPSS 20.0对药敏结果进行统计分析。用Kruskal-Wallis秩和检验比较不同药物及不同曲霉菌的药物敏感性差异。P<0.05为差异有统计学意义。
2 结 果
2.1 菌株鉴定结果
53株曲霉菌分子鉴定结果见表1。其中烟曲霉复合体22株(烟曲霉21株和仑图卢斯曲霉1株),黑曲霉复合体23株(塔宾曲霉16株、黑曲霉5株、百岁兰曲霉2株)及土曲霉和黄曲霉各4株。

表1 53株曲霉临床菌株分子鉴定结果及标本来源Tab.1 Source and molecular identification results of 53 clinical Aspergillus strains
2.2 药敏结果
米卡芬净、阿尼芬净、卡泊芬净、泊沙康唑、伏立康唑、伊曲康唑、两性霉素B对曲霉菌株的MIC90由低到高依次为0.031、0.031、0.25、0.5、0.5、1、2μg/mL,见图1。7种药物对两性霉素B、伊曲康唑、伏立康唑、泊沙康唑、阿尼芬净、米卡芬净、卡泊芬净的MIC范围/MIC50/GM分别为:0.5~4/1/0.94μg/mL、0.063~16/0.5/0.62、0.063~2/0.5/0.43、0.031~0.5/0.25/0.18、0.008~0.031/0.015/0.015、0.008~0.031/0.015/0.018、0.125~0.25/0.25/0.2μg/mL。根据ECV值,1株烟曲霉对伊曲康唑(MIC≥16μg/mL)、伏立康唑(MIC为2μg/mL)判定为耐药。仅有的1株仑图卢斯曲霉对两性霉素B耐药(MIC为8μg/mL)。不同种曲霉菌对7种药物的MIC范围/MIC50/MIC90/GM见表2。棘白菌素类药物阿尼芬和净米卡芬净对几种曲霉菌的MIC50及MIC90最低。米卡芬净和阿尼芬净对曲霉菌的体外抑菌活性相当(P>0.05),均高于卡泊芬净的体外抑菌活性(P<0.05)。阿尼芬净对烟曲霉、黑曲霉、黄曲霉的MIC90均为0.015μg/mL,对塔宾曲霉和土曲霉均为0.031μg/mL。米卡芬净对于黑曲霉和塔宾曲霉的MIC90高于阿尼芬净,分别为0.031、0.063μg/mL,对其他3种曲霉菌的MIC90与阿尼芬净相同。两性霉素B对土曲霉MIC90最高,为4μg/mL,对黑曲霉和塔宾曲霉的MIC90相对较低,为1μg/mL,对烟曲霉和黄曲霉MIC90为2μg/mL。对于塔宾曲霉,3种唑类药物(伊曲康唑、伏立康唑、泊沙康唑)的MIC值的GM均较其他曲霉高,而两性霉素B的MIC值GM低于其他几种曲霉菌。4种曲霉复合体对7种抗真菌药物的敏感性差异有统计学意义(P<0.05)。
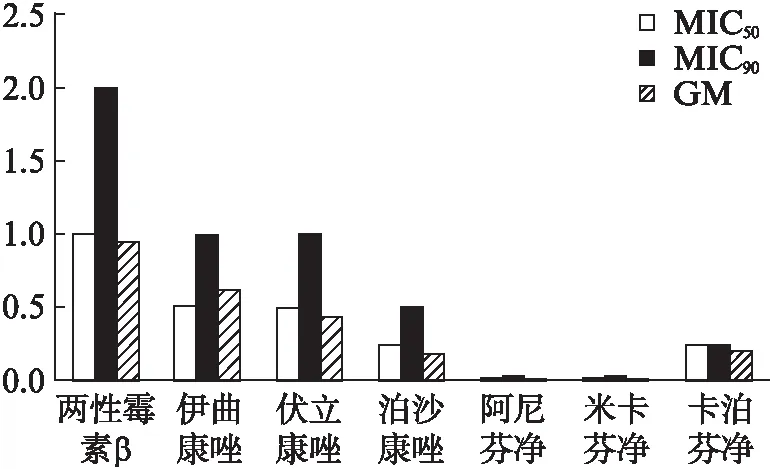
图1 7种药物对53株曲霉菌的MIC50/MIC90/GMFig.1 MIC50/MIC90/GM distribution of 7 antifungal agents against 53 Aspergillus strains

(μg/mL)
3 讨 论
曲霉菌是临床上最常见的致病丝状真菌,可引起一系列的临床表现[11-12]。烟曲霉、黄曲霉、黑曲霉、土曲霉为最常见的4种致病曲霉。近年来,随着分子工具的不断应用,更新了曲霉的分类[13-14]。除4种常见曲霉外,本研究还发现了少见的仑图卢斯曲霉、塔宾曲霉及百岁兰曲霉。仑图卢斯曲霉为烟曲霉复合体中的一员,产孢能力较烟曲霉弱,常对一种或多种抗真菌药物耐药[15]。百岁兰曲霉引起的感染在临床上较为罕见。23株黑曲霉复合体中塔宾曲霉最多,而黑曲霉只占21.7%。临床分离的鉴定为黑曲霉的菌株很大一部分为其他曲霉如塔宾曲霉等,这些曲霉与黑曲霉在形态学上难以区分,常被错误鉴定为黑曲霉[16]。
本研究结果显示,棘白菌素类药物对曲霉菌临床分离株显示了很高的体外抗菌活性,与之前的研究[17-18]结果相似。米卡芬净和阿尼芬净对曲霉菌的体外抑菌活性相当,高于卡泊芬净的体外抑菌活性(P<0.05)。米卡芬净、阿尼芬净MEC均为0.063μg/mL时能有效抑制全部菌株生长,卡泊芬净MEC为0.25μg/mL时能有效抑制全部菌株生长。
唑类药物的体外抗曲霉菌活性优于两性霉素B,这与其他文献[19,22]报道的结果一致。近年来,对唑类耐药的烟曲霉报道不断增多,本实验21株中有1株对伊曲康唑、伏立康唑耐药,占所有烟曲霉菌株的4.76%。对于唑类药物,塔宾曲霉的敏感性最低,烟曲霉的敏感性最高。3种唑类药物对曲霉菌的体外抑菌活性由高到低依次为: 泊沙康唑、伏立康唑、伊曲康唑。泊沙康唑与卡泊芬净体外抗曲霉活性活性相当(P>0.05),但对于土曲霉,泊沙康唑的抗真菌活性优于卡泊芬净。
与其他几种药物相比,两性霉素B体外抗曲霉菌活性最低。两性霉素B对烟曲霉、黄曲霉、土曲霉的抑菌活性较低(尤其是土曲霉),对于这些曲霉菌引起的感染,两性霉素B不是好的选择。但对于塔宾曲霉,两性霉素B较伊曲康唑敏感(P<0.05),这与其他研究[23-24]结果一致。
总的来说,棘白菌素药物米卡芬净和阿尼芬净对曲霉的MECs最低,体外抗菌活性最高,两性霉素B的MICs最高,体外抗菌活性最低,唑类药物介于两者之间。阿尼芬净和米卡芬净对几种曲霉均具有很好的抗菌活性。对于抗真菌药物活性的研究,需要大样本菌株的调查及药效学和药动学的实验[25];体外药物试验的结果与临床疗效的关系,需要临床医生参与和对病例进行回顾性分析。
[1] CHOWDHARY A, KATHURIA S, XU J, et al. Emergence of Azole-Resistant Aspergillus fumigatus Strains due to Agricultural Azole Use Creates an Increasing Threat to Human Health[J]. PLoS Pathog, 2013,9(10): e1003633.
[2] KOSMIDIS C, DENNING D W. The clinical spectrum of pulmonary aspergillosis[J]. Thorax, 2015,70(3): 270-277.
[3] MESSER S A, JONES R N, FRITSCHE T R. International surveillance of Candida spp. and Aspergillus spp.: report from the SENTRY Antimicrobial Surveillance Program(2003)[J]. J Clin Microbiol, 2006,44(5): 1782-1787.
[4] BALAJEE S A, KANO R, BADDLEY J W, et al. Molecular identification of Aspergillus species collected for the Transplant-Associated Infection Surveillance Network[J]. J Clin Microbiol, 2009,47(10): 3138-3141.
[5] ALASTRUEY-IZQUIERDO A, MELLADO E, CUE-NCA-ESTRELLA M. Current section and species complex concepts in Aspergillus: recommendations for routine daily practice[J]. Ann N Y Acad Sci, 2012,1273(1): 18-24.
[6] LI Y, WAN Z, LIU W, et al. Identification and susceptibility ofspergillus section Nigri in China: prevalence of species andaradoxical growth in response to Echinocandins[J]. J Clin Microbiol, 2015,53(2): 702-705.
[7] 冀燕芬,张莉莉,邓淑文等.烟曲霉临床菌株对体外抗真菌药物的敏感性研究[J].同济大学学报(医学版),2017,38(1): 74-79.
[8] KIM M N, SHIN J H, SUNG H, et al. Candida haemulonii and closely related species at 5 university hospitals in Korea: identification,antifungal susceptibility,and clinical features[J]. Clin Infect Dis, 2009,48(6): e57-61.
[9] AL-WATHIQI F, AHMAD S, KHAN Z. Molecular identification and antifungalsusceptibility profile of Aspergillus flavus isolates recovered from clinicalspecimens in Kuwait[J]. BMC Infect Dis, 2013,13: 126.
[10] ESPINEL-INGROFF A, DIEKEMA D J, FOTHERGI-LL A, et al. Wild-type MIC distributions and epidemiological cutoff values for the triazoles and six Aspergillus spp. for the CLSI broth microdilution method (M38-A2 document)[J]. J Clin Microbiol, 2010,48(9): 3251-3257.
[11] ESPINEL-INGROFF A, CUENCA-ESTRELLA M, FO-THERGILL A, et al. Wild-Type MIC Distributions and Epidemiological Cutoff Valuesfor Amphotericin B and Aspergillus spp. for the CLSI BrothMicrodilution Method (M38-A2 Document)[J].Antimicrob Agents Chemother, 2011,55(11): 5150-5154.
[12] ALASTRUEY-IZQUIERDO A, MELLADO E, PEL-EZ T, et al. Population-based survey of filamentous fungi and antifungal resistance in Spain(FILPOP Study)[J]. Antimicrob Agents Chemother, 2013,57(7): 3380-3387.
[13] LASS-FLÖRL C. The changing face of epidemiology of invasive fungal disease in Europe[J]. Mycoses, 2009,52(3): 197-205.
[14] BALAJEE S A, GRIBSKOV J L, HANLEY E, et al.Aspergillus lentulus sp. nov., a new sibling species of A. fumigatus[J]. Eukaryot Cell, 2005,4(3): 625-632.
[15] ALCAZAR-FUOLI L, MELLADO E, ALASTRUEY-IZQUIERDO A, et al. Species identification andntifungal susceptibility patterns of species belonging to Aspergillus section Nigri[J]. Antimicrob Agents Chemother, 2009,53(10): 4514-4517.
[16] VARGA J, HOUBRAKEN J, VAN DER LEE H A, et al. Aspergillus calidoustus sp. nov., causativegent of human infections previously assigned to Aspergillus ustus[J]. Eukaryot Cell, 2008,7(4): 630-638.
[17] MESSER S A,MOET G J,KIRBY J T, et al. Activity of contemporary antifungal agents, including the novel echinocandinanidulafungin, tested against Candida spp., Cryptococcus spp., and Aspergillus spp.: report from the SENTRY Antimicrobial Surveillance Program (2006 to 2007)[J]. J Clin Microbiol, 2009,47(6): 1942-1946.
[18] PFALLER M A, BOYKEN L, HOLLIS R J, et al. In vitro susceptibility of clinical isolates of Aspergillus spp. to anidulafungin, caspofungin, and micafungin: a head-to-head comparison using the CLSI M38-A2 broth microdilutionmethod[J]. J Clin Microbiol, 2009,47(10): 3323-3325.
[19] SHI J Y, XU Y C, SHI Y, et al. In vitro susceptibility testing of Aspergillusspp. against voriconazole, itraconazole, posaconazole, amphotericinB and caspofungin[J]. Chin Med J(Engl), 2010,123(19): 2706-2709.
[20] PFALLER J B, MESSER S A, HOLLIS R J, et al. In vitro susceptibility testing of Aspergillus spp.: comparison of Etest and reference microdilution methods for determining voriconazole and itraconazole MICs[J]. J Clin Microbiol, 2003,41(3): 1126-1129.
[21] SERRANO M C, MORILLA D, VALVERDE A, et al. Comparison of Etest with modified broth microdilution method for testing susceptibility of Aspergillus spp. to voriconazole[J]. J Clin Microbiol, 2003,41(11): 5270-5272.
[22] PFALLER M A, MESSER S A, BOYKEN L, et al. In vitro susceptibility testing of filamentous fungi: comparison of Etest and reference M38-A microdilution methods for determining posaconazole MICs[J]. Diagn Microbiol Infect Dis, 2003,45(4): 241-244.
[23] ALCAZAR-FUOLI L, MELLADO E, ALASTRUEY-IZQUIERDO A, et al. Species Identification and Antifungal Susceptibility Patterns of Species Belonging to Aspergillus Section Nigri[J]. Antimicrob Agents Chemother, 2009,53(10): 4514-4517.
[24] GAUTIER M, NORMAND A C, L’OLLIVIER C, et al. Aspergillustubingensis: a major filamentous fungus found in the airways of patients with lung disease[J]. Med Mycol, 2016,54(5): 459-470.
[25] 潘奕欣,马宁宁,赵婧,等.4种病原菌体外培养对抗菌药物持留形成特征[J].兰州大学学报(医学版), 2017,43(4): 6-10.
