心肺运动试验参数预测特发性肺动脉高压患者肺血管阻力升高的性别差异
2018-03-13杨国玲刘锦铭
杨国玲, 袁 平, 郭 健, 刘锦铭,
(1. 同济大学附属肺科医院肺循环科,上海 200433; 2. 同济大学医学院,上海 200092;3. 同济大学附属肺科医院肺功能室,上海 200433)
特发性肺动脉高压(idiopathic pulmonary arterial hypertension, IPAH)是由一系列因素引起肺循环阻力增高,右心负荷增加,进而导致右心衰竭甚至死亡的肺血管疾病[1]。近年来,流行病学调查研究发现在IPAH患者中女性患者发病率明显高于男性[2],是男性发病率的1.9~10倍[3]。法国和美国的注册登记研究发现男性IPAH患者预后更差[4-5]。右心导管检查(right heart catheterization, RHC)是确诊IPAH的金标准,其检测的多项血流动力学指标如PVR肺血管阻力(pulmonary vascular resistance, PVR)是评价预后的重要因素。近年来,心肺运动试验(cardiopulmonary exercise testing, CPET)也逐渐成为评价预后的检查手段,在监测IPAH患者运动耐力、机体代谢和气体交换异常等方面具有重要价值[6]。而关于CPET参数的性别差异及其对预后影响的研究较为少见。本研究分析IPAH患者CPET参数与血流动力学指标的相关性,并探讨CPET参数预测IPAH患者预后的性别差异。
1 资料与方法
1.1 一般资料
选择从2010年5月至2016年2月入住同济大学附属肺科医院的IPAH患者,共90例,女性IPAH患者55例,平均年龄(37.82±12.68)岁,BMI为(22.23±2.96) kg/m2;男性IPAH患者35例,平均年龄(38.71±16.38)岁,BMI(23.16±3.16) kg/m2。所有患者均经右心导管明确诊断,入选标准根据文献[7]: 静息状态下,肺动脉平均圧(mean pulmonary artery pressure, mPAP)≥25mmHg(1mmHg=0.133kPa),肺小动脉楔压(pulmonary artery wedge pressure, PAWP)≤15mmHg。排除标准: 排除其他类型的肺动脉高压;排除合并有肺部疾病(根据患者的临床表现、CT及肺功能结果进行鉴别);排除影响激素代谢的慢性或急性疾病;排除正在使用或既往使用过激素药物及影响激素的药物;排除不能配合CPET的神经-骨骼-肌肉性、精神性疾病的患者;排除对于CPET有禁忌证的患者。
1.2 方法
1.2.1 基线资料检测 记录患者的年龄、性别、身高、体质量,计算BMI,同时收集患者的相关临床参数,包括: 世界卫生组织肺动脉高压功能分级(World Health Organization functional class, WHO-FC)、6min步行距离(6min walk distance, 6MWD)、氨基末端脑利钠肽前体(n-terminal natriuretic peptide type-B, NT-pro BNP)等。
1.2.2 主要检测参数 右心导管参数包括平均右房压(mean right atrial pressure, mRAP)、平均肺动脉压(mean pulmonary artery pressure, mPAP)、肺小动脉楔压(pulmonary artery wedge pressure, PAWP)、心输出量(cardiac output, CO)、肺血管阻力(pulmonary vascular resistance, PVR)等。CPET主要参数有: 运动负荷(Workload)、二氧化碳排出量(carbon dioxide output, VCO2)、摄氧量(oxygen uptake, VO2)、每分钟通气量(minute ventilation, VE)、呼气末二氧化碳分压(end-tidal PCO2, PETCO2)、氧脉搏(oxygen pulse, O2pulse)等。无氧阈期用AT表示,峰值期用Peak表示。采用V-slop法确定AT点[6]。VE/VCO2slope为从运动开始到通气补偿点间的VE/VCO2斜率[8]。OUES是通过对VE进行对数转换后与VO2的线性关系得出,公式: VO2=OUES×lgVE+b(b为常数);OUEP采用连续90s的VO2/VE的最大平均值[9]。
1.3 统计学处理
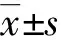
2 结 果
2.1 患者基线资料比较
女性IPAH患者平均年龄(37.82±12.68)岁,男性IPAH患者的平均年龄(38.71±16.38)岁。两组间的BMI、WHO-FC分级、6MWD、NT-pro BNP及血流动力学参数mRAP、mPAP、PAWP、PVR、CO差异均无统计学意义(P>0.05),见表1。
2.2 CPET参数比较
男性患者的运动耐力参数Peak Workload,机体代谢参数Peak VO2、AT。通气功能参数Peak VE、Peak VCO2、OUES及反应心功能的参数Peak O2pulse均明显高于女性患者(P<0.05);两组中其余CPET参数差异未见统计学意义(P>0.05),见表2。
2.3 CPET参数与血流动力学参数的相关性
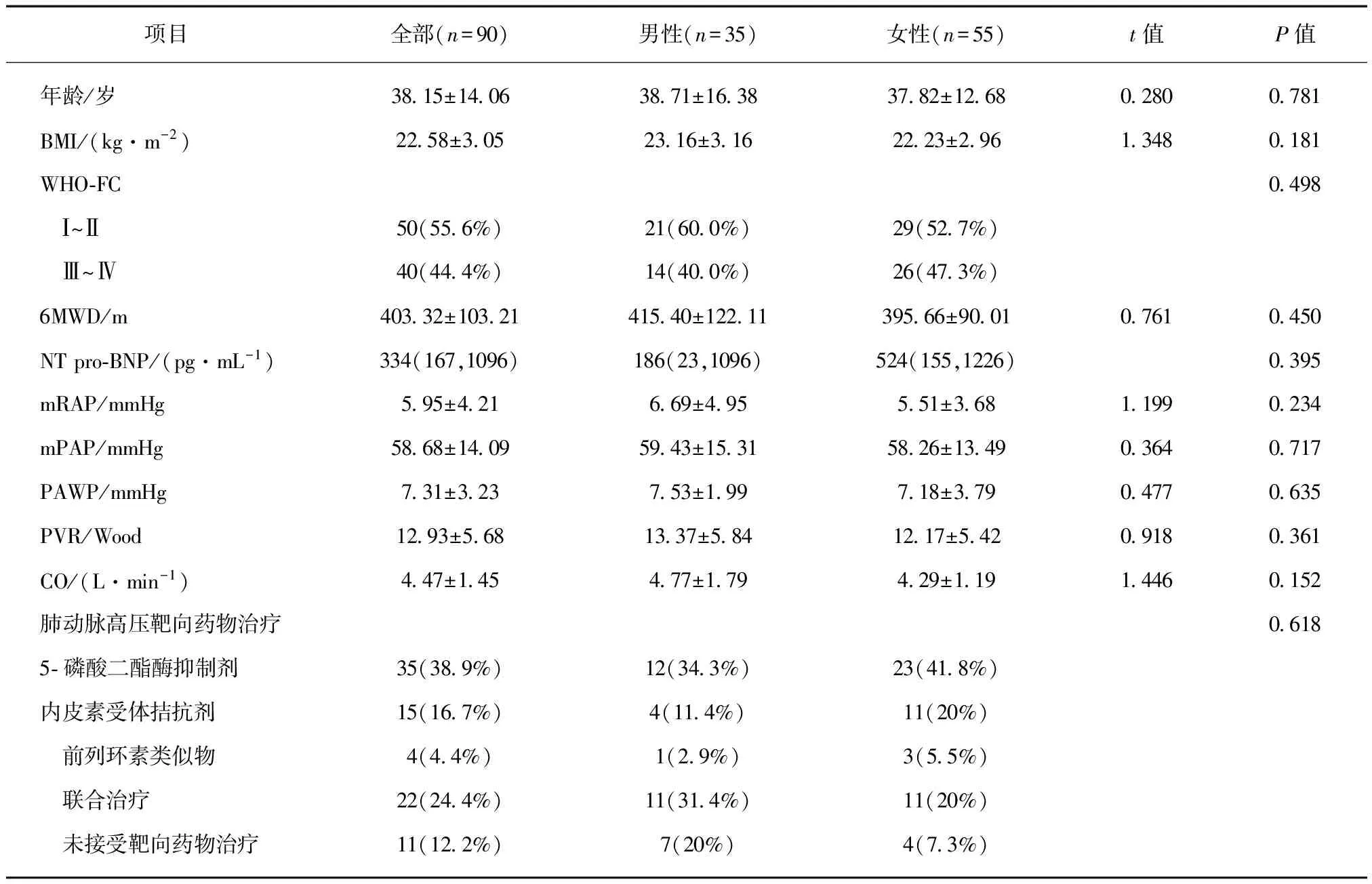
表1 IPAH患者的基线资料
NT-pro BNP以四分位数间距表示;1mmHg=0.133kPa

表2 IPAH患者的CPET资料比较
AT表示无氧阈期,Peak表示峰值;1mmHg=0.133kPa

表3 CPET参数与血流动力学参数PVR的相关性
AT表示无氧阈期,Peak表示峰值
2.4 预测PVR的CPET参数
将上述与PVR相关的参数作为自变量,PVR作为因变量,采用线性回归及逐步多重线性回归分析。结果显示: 在所有IPAH患者中,校正了年龄、性别、BMI和WHO-FC分级后,Peak O2pulse、Peak PETCO2可作为PVR的独立预测因子(β=-0.449,95%CI: -1.736~-0.651;β=-0.259,95%CI: -0.399~-0.030,均P<0.05)。在男性IPAH患者中,校正了年龄、BMI和WHO-FC分级后,Peak PETCO2可作为PVR的独立预测因子(β=-0.524,95%CI: -0.619~-0.135,P<0.01);而在女性IPAH患者中,校正了年龄、BMI和WHO-FC分级后,Peak O2pulse可作为PVR的独立预测因子(β=-0.497,95%CI: -2.329~-0.762,P<0.001),见表4。

表4 CPET预测IPAH患者PVR的性别差异
Peak表示峰值
3 讨 论
CPET作为一项综合检测呼吸循环系统功能的技术,可全面、客观的评价心肺储备功能和运动耐力,并且其逐渐成为评价IPAH药物疗效及预后的一项可靠检查手段。本研究证实IPAH患者的CPET参数具有显著的性别差异,并首次发现在不同性别IPAH患者中有不同的CPET参数是预测PVR升高的独立预测因子。
本研究发现,6MWD、NT-pro BNP、WHO-FC、血流动力学及特殊药物治疗在性别之间没有统计学差异,但是男性患者的mRAP、mPAP、PAWP、PVR、6MWD有高于女性患者的趋势,并且男性患者Peak Workload、Peak O2pulse明显高于女性患者,这提示男性患者的肺血管损伤似乎更加严重,但是运动耐力及心功能明显好于女性患者。既往有研究[10]报道男性PAH患者的mRAP、mPAP、6MWD明显高于女性,这与本研究结果并不完全一致。原因之一可能是由于本研究样本量太小,国外的研究纳入了2696例的患者,而本研究仅有90例患者;另一个原因可能是因为本研究只纳入了IPAH患者,而国外的研究纳入FPAH及CTD-PAH等,并且CTD-PAH中又纳入了许多亚组分类。
Jarvis等[11]发现不同性别正常人的肌肉重量、肌纤维类型及释放能量的区域是不同的。在本研究中,男性患者反应机体代谢、通气功能、心功能及运动耐力的CPET参数明显高于女性患者,这或许是因为男性患者有更大的肌肉重量,从而使其运动耐力及心功能更好。由于性别差异导致这些参数不同的另一个因素可能是性激素的不同,在心血管系统中,雌二醇的代谢可能会影响信号转导和表观遗传学,如某些代谢酶[12-13]。
PVR是反映PAH患者疾病严重程度的重要指标,受PAWP、mPAP及CO的影响[PVR=(mPAP-PAWP)/CO][14],PVR升高会限制右心室射血入肺动脉,从而影响肺血流的灌注和全身血液的供应。本研究多重线性回归模型提示PETCO2和Peak O2pulse是所有IPAH患者PVR升高的独立预测指标。PETCO2是评价通气效率的重要参数,受乳酸酸中毒、低氧血症的影响[6,15]。PETCO2又是男性患者PVR升高的独立预测指标,此结果说明男性患者通气功能受损更加严重,通气效率更差。动脉-静脉血氧含量差由混合静脉血氧含量决定,混合静脉血氧含量又取决于外周组织对氧的摄取利用,IPAH患者外周组织氧利用障碍的情况几乎不存在,所以O2pulse主要反映患者的每搏量情况[16],因此Peak O2pulse可以作为反映心功能的一个良好参数。Peak O2pulse是女性IPAH患者PVR升高的独立预测因子,这表明女性患者心功能受损更加严重。性别差异产生上述不同结果的具体机制还不是很明确,是否与性激素有关有待进一步考证。
综上所述,IPAH患者中CPET参数存在显著差异,并且预测PVR升高的指标也存在显著性别差异,PETCO2是预测男性患者PVR升高的良好指标,而Peak O2pulse是女性患者PVR升高的独立预测因子。因此,在以后的临床工作中可以用不同CPET参数更加准确的分别预测男性及女性IPAH患者疾病严重程度。
[1] FREEMAN M L, LANDOLFO C, SAFFORD R E, et al. Noninvasive assessment of right heart function and hemodynamics during exercise in patients with pulmonary arterial hypertension[J]. South Med J, 2013,106(2): 141-146.
[2] BADESCH D B, RASKOB G E, ELLIOTT C G, et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry[J]. Chest, 2010,137(2): 376-387.
[3] PUGH M E, HEMNES A R. Development of pulmonary arterial hypertension in women: interplay of sex hormones and pulmonary vascular disease[J]. Womens Health (Lond), 2010,6(2): 285-296.
[4] BENZA R L, MILLER D P, GOMBERG-MAITLAND M, et al. Predicting Survival in Pulmonary Arterial Hypertension Insights From the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL)[J]. Circulation, 2010,122(2): 164-172.
[5] MATHAI S C, HASSOUN P M, PUHAN M A, et al. Sex Differences in Response to Tadalafil in Pulmonary Arterial Hypertension[J]. Chest, 2015,147(1): 188-197.
[6] AMERICAN THORACIC S, AMERICAN COLLEGE OF CHEST P. ATS/ACCP Statement on cardiopulmonary exercise testing[J]. Am J Respir Crit Care Med, 2003,167(2): 211-77.
[8] SUN X G, HANSEN J E, OUDIZ R J, et al. Exercise pathophysiology in patients with primary pulmonary hypertension[J]. Circulation, 2001, 104(4): 429-435.
[9] SUN X G, HANSEN J E, STRINGER W W. Oxygen uptake efficiency plateau: physiology and reference values[J]. Eur J Appl Physiol, 2012,112(3): 919-928.
[10] SHAPIRO S, TRAIGER G L, TURNER M, et al. Sex differences in the diagnosis, treatment, and outcome of patients with pulmonary arterial hypertension enrolled in the registry to evaluate early and long-term pulmonary arterial hypertension disease management[J]. Chest, 2012,141(2): 363-373.
[11] JARVIS S S, VANGUNDY T B, GALBREATH M M, et al. Sex differences in the modulation of vasomotor sympathetic outflow during static handgrip exercise in healthy young humans[J]. Am J Physiol Regul Integr Comp Physiol, 2011,301(1): R193-200.
[12] KANDHI S, QIN J, FROOGH G, et al. EET-dependent potentiation of pulmonary arterial pressure: sex-different regulation of soluble epoxide hydrolase[J]. Am J Physiol Lung Cell Mol Physiol, 2015,309(12): L1478-1486.
[13] MAIR K M, YANG X D, LONG L, et al. Sex affects bone morphogenetic protein type II receptor signaling in pulmonary artery smooth muscle cells[J]. Am J Respir Crit Care Med, 2015,191(6): 693-703
[14] LAHM T, TUDER R M, PETRACHE I. Progress in solving the sex hormone paradox in pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2014,307(1): L7-26
[15] YASUNOBU Y, OUDIZ R J, SUN X G, et al. End-tidal PCO2 abnormality and exercise limitation in patients with primary pulmonary hypertension[J]. Chest, 2005,127(5): 1637-1646.
[16] VALOIS F M, NERY L E, RAMOS R P, et al. Contrasting cardiopulmonary responses to incremental exercise in patients with schistosomiasis-associated and idiopathic pulmonary arterial hypertension with similar resting hemodynamic impairment[J]. PLoS One, 2014,9(2): e87699.
