油菜花粉甾醇的制备、分析及抗氧化活性研究
2018-03-10王玏萦徐梦婷孙培龙
杨 开 王玏萦 徐梦婷 孙培龙
(浙江工业大学海洋学院,杭州 310014)
油菜(BrassicacampestrisL.)为十字花科(Brassicacea),芸苔属(Brassica)植物,油菜花粉是我国来源最多的蜜源蜂花粉[1]。油菜花粉中的主要植物化学成分是脂肪酸、类黄酮、含氮化合物以及植物甾醇[2-3]。其主要的植物甾醇如β-谷甾醇、豆甾醇和菜油甾醇,是一类广泛存在于自然界的甾体化合物,为环戊全氢菲的3-羟基化合物,C-5上有双键的称甾醇,C-5饱和的称甾烷醇[4]。研究表明,植物甾醇具有抗氧化[5]、抗癌[6]、防止心血管疾病[7]、促进胆固醇降解代谢[8]等多种生理活性,被国际生命科学学会大力推荐为十大功能性食品配料之一[9],对人体非常有益。目前我国卫生部正式批准植物甾醇、甾醇酯为新资源食品[10],并且被广泛应用于食品、制药、保健品等行业[11-14]。油菜花粉中的甾醇因其天然并具有一系列生理功能而逐渐受到国内外学者的重视,但国内外至今对油菜花粉中甾醇的研究较少,尤其缺乏关于其生物活性的研究。

1 材料与方法
1.1 材料与试剂
油菜(BrassicacampestrisL.)花粉:采自青海门源,经浙江中药与天然药物研究院品种鉴定,4 ℃冷藏备用;柱层层析硅胶(200~300目):青岛海洋化工厂分厂;硅胶板CF254:青岛鼎康硅胶有限公司;DPPH、ABTS、二丁基羟基甲苯(BHT):美国Sigma公司;5α-胆甾烷、豆甾醇:东京化成工业株式会社;新鲜猪油:市购;正己烷、无水乙醇、氯仿、甲醇、邻苯三酚、硫代硫酸钠等均为分析纯。
1.2 仪器与设备
SFP-Prime超临界CO2萃取仪:美国Applied Separation有限公司;TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;Nicolet 6700傅里叶变换红外光谱仪,Nicolet Continuμm红外显微系统:美国热尼高力公司;ISQ单四极杆气相色谱质谱联用仪:美国Thermo Fisher Scientific公司;DRP-9002电热恒温培养箱:上海森信实验仪器有限公司;PGC12玻璃层析柱:北京满仓科技有限公司。
1.3 方法
1.3.1 油菜花粉甾醇提取工艺
油菜花粉→机械粉碎过30目筛→50 ℃干燥→称取150 g→放入萃取釜,CO2超临界萃取,萃取压力为30 MPa,时间2 h,温度50 ℃,CO2流速为15 g/min→收集分离釜中棕色油状萃取物→80 ℃皂化1 h→正己烷萃取3次→水洗至中性→40 ℃旋转蒸发→氮吹仪吹干→油菜花粉甾醇粗提取物。
1.3.2 油菜花粉甾醇的纯化工艺
1.3.2.1 静态吸附单因素实验
以吸附时间、吸附温度、吸附液浓度为考查因素进行静态吸附单因素实验,确定纯化的最佳条件,采用磷硫铁显色法[15]测总甾醇的含量。
吸附率的测定[16]:称取一定量的硅胶装入三角瓶中,加入甾醇标准溶液中,置于恒温水浴震荡器上震荡,吸附一定时间后减压抽滤,测定滤液中甾醇的浓度,吸附率公式如下所示:

1.3.2.2 洗脱剂(展开剂)比例的确定
以氯仿和甲醇为展开剂,在硅胶板底端1 cm左右点样,以10%硫酸-乙醇为显色剂,在小板上喷上显色剂,置于110 ℃烘箱中3~5 min,观察在不同比例的洗脱剂中的分离情况,计算比移值(Rf),Rf公式如下所示:
1.3.3 动态分离
皂化后的粗制甾醇采用湿法装柱,根据静态吸附单因素实验的最佳工艺将粗制甾醇加入硅胶柱中,上样比例为1:40,用洗脱剂进行洗脱,每段洗脱液5.0 mL分管收集,薄层色谱跟踪检测,合并收集相同Rf值组分,在最优纯化条件下将样品浓缩后再进行第二次硅胶柱层析重复分离,旋转蒸发(40 ℃)后得到高纯度油菜花粉甾醇,并用氮吹仪吹干。
1.3.4 紫外可见吸收光谱法(UV-VIS)分析
配制一定浓度的油菜花粉甾醇溶液,使用紫外可见分光光度计进行扫描,扫描范围为190~500 nm。多种甾醇标准品溶液进行扫描,不同种类的甾醇最大吸收波长相同,因此选择其中一种甾醇(豆甾醇)作为对照。
1.3.5 傅里叶-红外光谱法(FTIR)分析
采用KBr压片法分别对甾醇类物质粉体进行FTIR谱图的测试,在4 000~400 cm-1波段进行扫描。
1.3.6 气相色谱-质谱(GC-MS)测定
气相色谱条件:毛细管柱:TG-5MS柱(30 m×0.25 mm,0.32 μm);升温程序:起始温度150 ℃,保持4 min,以4 ℃/min升至240 ℃,保持2 min,然后以5 ℃/min升至310 ℃,保持13 min。进样口温度310 ℃;载气流速1.0 mL/min;分流比20:1。
质谱条件:电子轰击离子源(EI);电子能量70 eV;离子源温度230 ℃;接口温度300 ℃;扫描质量范围20~510 amu。各组分经过与标准品对照及NIST 2.0标准谱库检索相匹配,确定相应的物质结构。
油菜花粉中的甾醇含量采用内标法,以5α-胆甾烷为内标,豆甾醇为标准品建立标准曲线(y=0.006 2x-0.174,x为标样浓度,y为标样峰面积与内标峰面积之比,相关系数R2=0.999 6,甾醇含量以豆甾醇含量计。
1.3.7 油菜花粉甾醇的体外抗氧化活性分析
1.3.7.1 清除DPPH·的能力

1.3.7.2 清除ABTS+·的能力
参照Ozgen等[18]的ABTS法,3 mL ABTS溶液和1 mL样品液混合避光反应1 h,于λ 734 nm测定吸光度,用BHT做阳性对照。
采用邻苯三酚自氧化法[19],4.5 mL的Tris-HCl缓冲液(0.05 mol/L),于25 ℃水浴加热25 min,分别加入0.1 mL样品溶液和0.4 mL邻苯三酚溶液(0.5 mmol/L),25 ℃水浴中反应4.0 min,加入2滴8.0 mol/L的HCl滴终止反应,在λ 320 nm处测定吸光度,用BHT做阳性对照。
1.3.7.4 还原力的测定
采用普鲁士蓝法[20]测定样品的还原能力。0.5 mL样品溶液中加入2.5 mL磷酸盐缓冲液(pH 6.6)和质量分数为1%的铁氰化钾2.5 mL,混匀后在50 ℃水浴中保温20 min,冷却后加入2.5 mL 10%三氯乙酸溶液,3 000 r/min离心10 min,取2.5 mL上清液加2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁,5 min后在λ 700 nm处测吸光度,BHT做阳性对照。
1.3.7.5 猪油体系抗氧化活性研究
将新鲜猪油切成小块,文火湿法熬炼,双层纱布过滤除去残渣,冷却密封后保存在-20 ℃冰箱中保存[21]。过氧化值(POV)测定实验均按照GB/T 5538—2005《动植物油脂过氧化值测定》[22]进行,用Na2S2O3滴定氧化析出的碘,计算POV值。
采用Schaal烘箱法[23],将油菜花粉甾醇按照猪油质量的0.05%、0.10%、0.15%、0.20%、0.25%、0.30%分别加入到30.0 g猪油中,并将其进行编号,空白油样作为对照。将配制好的猪油油样放入电热恒温培养箱中,温度调整为(60±1)℃,每隔24 h充分搅拌1次,并交换其在培养箱中的位置,测定其第2、4、6、8、10、20天的POV值。
1.3.8 数据处理
实验数据均以origin 8.5软件处理,以SPSS 13.0软件进行统计分析,每组实验重复3次,取其平均值。
2 结果与分析
2.1 油菜花粉甾醇纯化工艺实验结果
2.1.1 吸附时间对吸附效果的影响
吸附时间与吸附率的关系如图1所示,由图可见,随着吸附时间的增加,吸附率增加,当吸附时间为2 h时,吸附率达到最大,随后增长缓慢并逐渐趋于平衡,综合经济节能考虑,最佳的吸附时间选择为2 h为宜。

图1 吸附时间、吸附温度、吸附液浓度与吸附率的关系
2.1.2 吸附温度对吸附效果的影响
由图1可见,随着温度的增加,吸附率逐渐增高,当温度为30 ℃时吸附率达到最高,为(82.2±1.51)%,之后随着温度的增加,吸附率降低。由于温度低时分子运动慢,吸附时间慢,但温度高时有利于解吸,不利于吸附,因此综合考虑选择30 ℃为最佳吸附温度。
2.1.3 吸附液浓度对吸附效果的影响
由图1可见,随着吸附液浓度的升高,吸附率增加,当吸附液质量浓度达到0.35 mg/mL时吸附率达到最高,当质量浓度大于0.35 mg/mL时吸附率达到饱和并趋于平衡,因此吸附液质量浓度选择0.35 mg/mL。
2.1.4 洗脱剂比例的确定
薄层色谱使各组分在固定相与流动相之间借助毛细作用发生多次吸附-溶解作用使不同极性的物质分离[24]。粗制甾醇在展开剂中分离成3个组分,其中组分2与标准甾醇溶液对照Rf值基本一致,由于不同种类的甾醇极性相近,Rf值也相近,因此组分2为甾醇类物质。
由表1可知,当氯仿和甲醇的体积比为20:1时,各组分的Rf在0.3~0.8,且Rf值相差较大,分离效果较好,因此采用氯仿和甲醇比例为20:1的溶液作为洗脱剂。
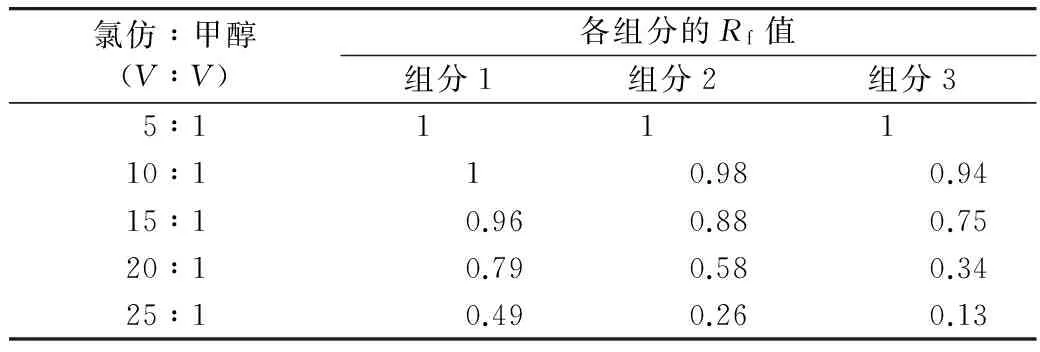
表1 不同比例的洗脱剂中各组分的Rf值
综上,根据静态吸附单因素实验的最佳工艺将粗制甾醇加入到硅胶柱中,吸附时间为2 h,吸附温度为30 ℃,吸附液质量浓度为0.35 mg/mL,用体积比为20:1的氯仿和甲醇溶液进行洗脱并富集相同Rf组分,进行第2次硅胶柱层析重复分离实验。
2.2 UV-VIS测定结果分析
经测定,制得的油菜花粉甾醇纯度为(93.73±1.06)%,将油菜花粉甾醇溶液与豆甾醇标准溶液(用无水乙醇作溶剂)的紫外可见光扫描,油菜花粉甾醇的紫外吸收曲线如图2所示,由图2可得,油菜花粉甾醇与豆甾醇标准溶液的最大吸收峰处的波长相近,豆甾醇标准溶液的最大吸收峰为波长204 nm处,油菜花粉甾醇溶液为205 nm,这与文献[25]报道的205 nm处为植物甾醇特征吸收峰一致。
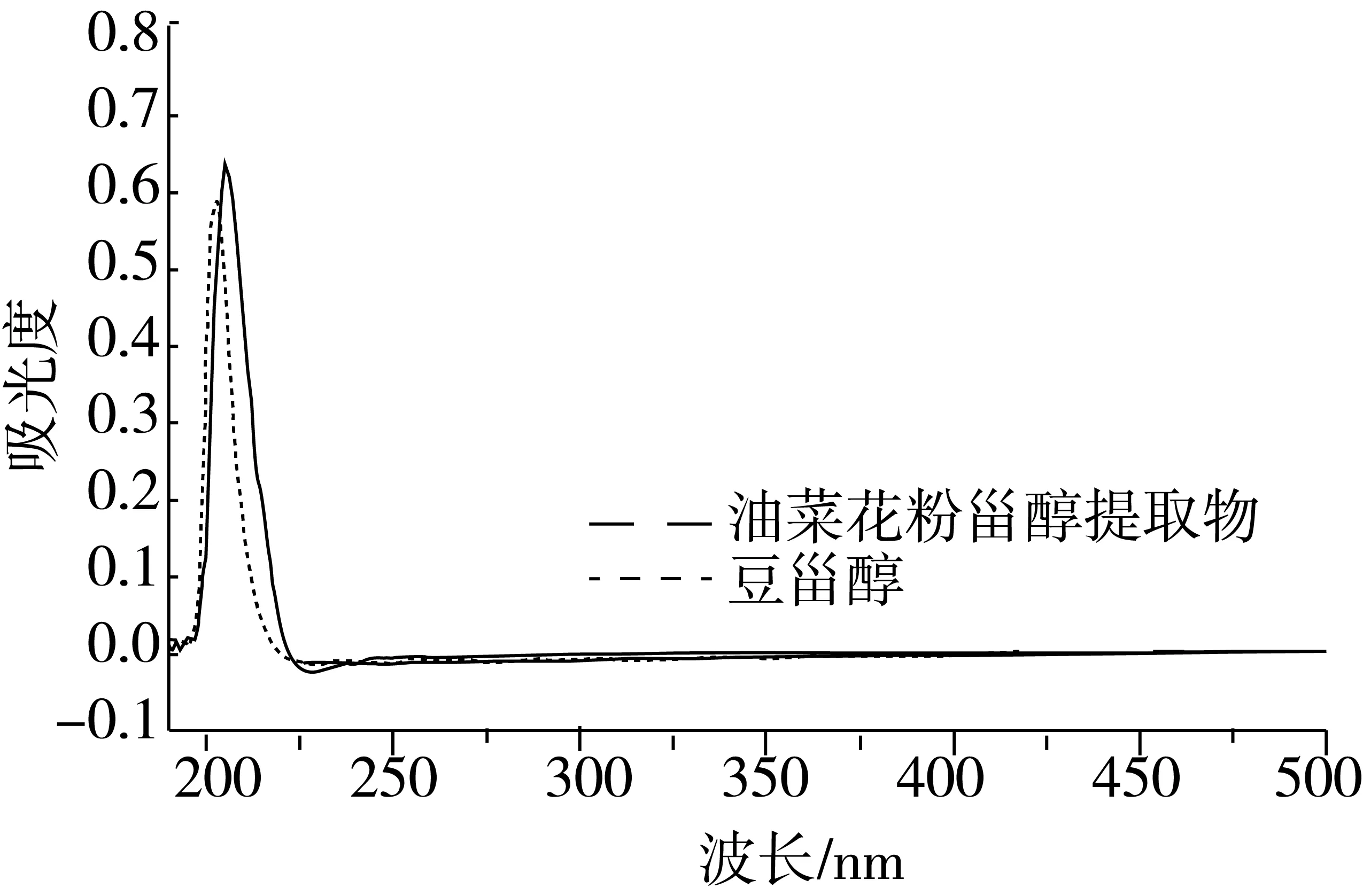
图2 油菜花粉甾醇的紫外吸收曲线
2.3 FTIR结果分析
图3 油菜花粉甾醇的红外分析图谱
2.4 油菜花粉甾醇GC-MS结果分析
气相色谱-质谱条件下对油菜花粉甾醇进行分析,油菜花粉甾醇GC-MS总离子色谱图如图4所示。其中保留时间为39.94、40.59、41.47、42.62 min的峰能在质谱库中找到相应的甾醇标准物对照质谱,分别为24-亚甲基胆甾醇、β-谷甾醇、菜油甾醇和豆甾醇,且匹配度均超过90%。油菜花粉甾醇结构式如图5所示。
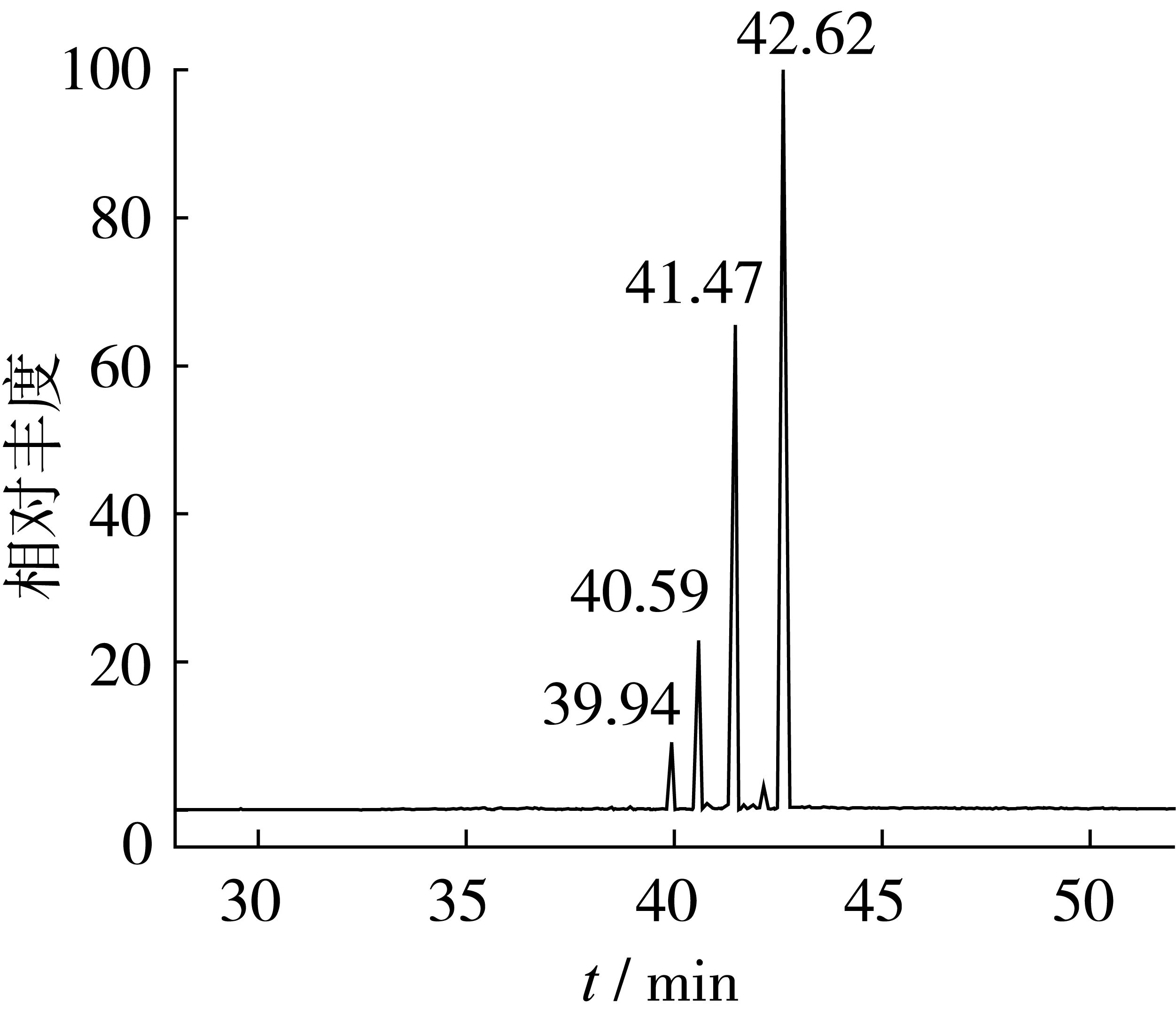
图4 油菜花粉甾醇GC-MS总离子色谱图



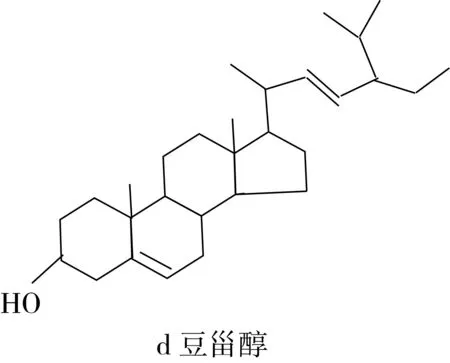
图5 油菜花粉甾醇质谱图及结构式
由表2可知,油菜花粉甾醇中豆甾醇的含量最多,相对质量分数为47.35%;24-亚甲基胆甾醇、β-谷甾醇和菜油甾醇的相对质量分数分别为5.11%、15.18%和32.36%。

表2 油菜花粉中甾醇的保留时间、成分、含量
2.5 抗氧化实验结果与分析
2.5.1 清除DPPH·的结果与分析
DPPH在有机溶剂中呈现深紫色,可以通过测定颜色的褪色程度来评价油菜花粉甾醇对DPPH·的清除效果,油菜花粉甾醇对DPPH·的清除能力如图6所示,油菜花粉甾醇具有清除DPPH·的能力,且其清除能力随着甾醇质量浓度的不断增大而增强,在质量浓度为3.0 mg/mL时,其清除率达(80.75±2.50)%,自由基的半清除率IC50=1.18 mg/mL,增长趋势较BHT明显。但在同等浓度时,油菜花粉甾醇的清除率低于BHT,当BHT溶液的质量浓度为3.0 mg/mL时,对DPPH·的清除率达(98.72±0.48)%。
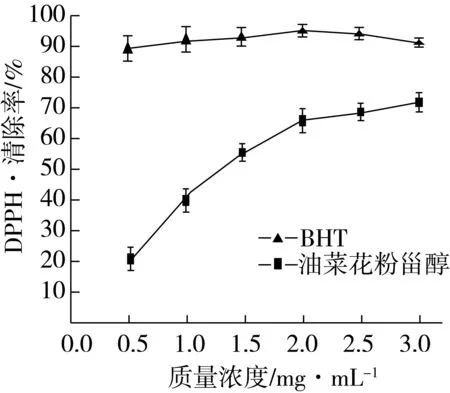
图6 油菜花粉甾醇对DPPH·的清除能力
2.5.2 清除ABTS+·的结果与分析
通过添加油菜花粉甾醇,能与反应体系中的单电子配对,使其褪色,从而使形成的ABTS+·得到清除[26]。油菜花粉甾醇对ABTS+·的清除能力如图7所示,ABTS+·清除率与油菜花粉甾醇浓度之间呈现良好的剂量关系,随着甾醇浓度的增加,对ABTS+·的清除能力增强,在质量浓度3.0 mg/mL时,其清除率达(72.22±2.85)%,IC50=1.76 mg/mL。与BHT相比,在同等浓度下,油菜花粉甾醇清除ABTS+·的能力相对较低,当BHT溶液的质量浓度为3.0 mg/mL时,对ABTS+·的清除率达(97.54±2.43)%。
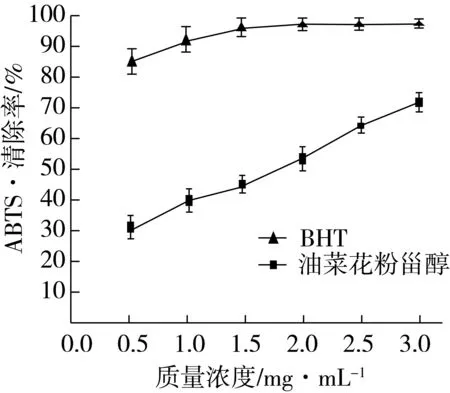
图7 油菜花粉甾醇对ABTS+·的清除能力
2.5.3 清除超氧阴离子的结果与分析



图8 油菜花粉甾醇对的清除能力
2.5.4 还原力实验结果与分析
物质的抗氧化能力与其还原能力呈正相关,当一种物质具有较好的供电子能力时,可将Fe3+还原成Fe2+,并与自由基反应从而中断自由基反应链,因此在700 nm处吸光值越大表示还原力越强[28]。油菜花粉甾醇的还原力如图9所示,随着油菜花粉甾醇质量分数浓度的不断增加,其还原力逐渐提高,当油菜花粉甾醇质量浓度为3.0 mg/mL时,还原力吸光度达1.55±0.05,相同质量浓度时BHT的还原力吸光度为2.33±0.07。

图9 油菜花粉甾醇的还原力
2.5.5 油菜花粉甾醇对猪油体系抗氧化活性研究结果
不同浓度的油菜花粉甾醇在猪油中的抗氧化活性如图10所示。添加不同浓度的甾醇到猪油中,经过不同天数的高温强氧化,猪油的氧化程度逐渐加深,用不同剂量处理的猪油的POV值的差异逐渐增大,空白样品组的氧化程度最大。比较POV值的变化趋势,得出随着剂量的增大,猪油的POV值上升趋势变小,表明油菜花粉甾醇在高温下对猪油有一定得抗氧化能力,且油菜花粉甾醇对猪油的抗氧化能力有剂量效应关系,即油菜花粉甾醇的剂量越大,对猪油的抗氧化性越好。
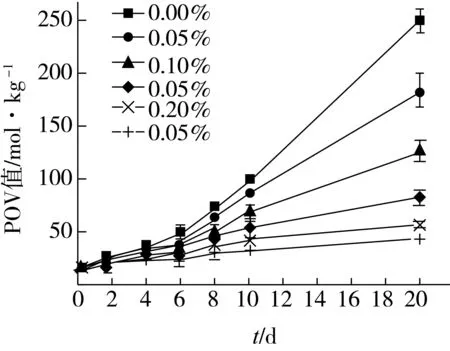
图10 不同浓度的油菜花粉甾醇在猪油中的抗氧化性
3 结论

[1]杨开,叶兴乾,刘东红,等.油菜花粉中黄酮苷类的制备分离和鉴定[J].中国粮油学报,2010,25(8):91-97
YANG K,YE X Q,LIU D H,et al.Separation and identification of flavonoid glycosides fromBrassicanapusL.Pollen[J].Journal of the Chinese Cereals and Oils Association,2010,25(8):91-97
[2]杨必成,杨义芳.花粉治疗前列腺疾病的物质基础研究进展[J].中草药,2009,40(1):144-149
YANG B C,YANG Y F.Advances in studies on material basis of pollen used for treatment of prostatic diseases[J].Chinese Traditional and Herbal Drugs,2009,40(1):144-149
[3]WANG R,KOBAYASHI Y,LIN Y,et al.A phytosterol enriched refined extract ofBrassicacampestris,L.pollen significantly improves benign prostatic hyperplasia(BPH)in a rat model as compared to the classical TCM pollen preparation Qianlie Kang Pule’an Tablets[J].Phytomedicine,2015,22(1):145-152
[4]杨春英,刘学铭,陈智毅,等.气相色谱-质谱联用法测定14种食用植物油中的植物甾醇[J].中国粮油学报,2013,28(2):123-128
YANG C Y,LIU X M,CHEN Z Y,et al.Determination of phytosterols of fourteen edible vegetable oils by gas chromatography-mass spectrometry[J].Journal of the Chinese Cereals and Oils Association,2013,28(2):123-128
[6]XIE X,XIAO N,HE J.Physiological function of phytosterol and its application[J].Animal Husbandry and Feed Science,2015(2):67-69
[7]GYLLING H,PLAT J,TURLEY S,et al.Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease[J].Atherosclerosis,2014,232(2):346-360
[8]VARADY K A,STPIERRE A C,LAMARCHE B,et al.Effect of plant sterols and endurance training on LDL particle size and distribution in previously sedentary hypercholesterolemic adults[J].European Journal of Clinical Nutrition,2005,59(4):518-25
[9]HOVENKAMP E,DEMONTY I,PLAT J,et al.Biological effects of oxidized phytosterols:A review of the current knowledge[J].Progress in Lipid Research,2008,47(1):37-49
[10]庞敏,姜绍通,潘丽军,等.不同加热方式对脂质基质中甾醇稳定性及其抗氧化性能的影响[J].食品科学,2012,33(21):39-42
PANG M,JIANG S T,PAN L J,et al.Effect of different heating methods on the stability and antioxidant activity of phytosterol in lipid matrix[J].Food Science,2012,33(21):39-42
[11]DAGUST.Phytosterol:highly promising compounds[J].Lipid Technology,2000,12:77-80
[12]SRIGLEYC T,HAILE E A.Quantification of plant sterols/stanols in foods and dietary supplements containing added phytosterols[J].Journal of Food Composition and Analysis,2015,40:163-176
[13]ROSENBLAT,VOLAOVA N,AVIRAM M.Pomegranate phytosterol(β-sitosterol)and polyphenolic antioxidant(punicalagin)addition to statin,significantly protected against macrophage foam cells formation[J].Atherosclerosis,2013,226(1):110-7
[14]KRITCHEVSKY D,CHEN S C.Phytosterols-health benefits and potential concerns:a review[J].Nutrition Research,2005,25(5):413-428
[15]徐小军,余国珍,陈鉴东.硫磷铁法测定大豆甾醇提取物中总甾醇含量[J].中国药业,2010,19(8):35-36
XU X J,YU G Z,CHEN J D.Determination of total sterol in soybean sterol by sulfate-phosphate-ferric method[J].China Pharmaceuticals,2010,19(8):35-36
[16]高丽.中华秋海棠甾醇类化合物的提取、纯化及微胶囊化研究[D].武汉:华中农业大学,2010
GAO L.Studies on sterols ofbegoniasinensis extraction,purification and microencapsulation[D].Wuhan:Huazhong Agricultural University,2010
[18]OZGEN M,REESE R N,TUILO A Z,et al.Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power(FRAP)and 2,2’-diphenyl-1-picrylhydrazyl(DPPH)methods[J].Journal of Agricultural and Food Chemistry,2006,54(4):1151-1157
[19]冮洁,麦海美,解彬,等.羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究[J].食品与发酵工业,2016,42(9):120-123
JIANG J,MAI H M,XIE B,et al.Optimization of Se-rich culture conditions and antioxidant activities of polysaccharides fromMorchellaesculentamycelium[J].Food and Fermentation Industries,2016,42(9):120-123
[20]OYAIZU M.Studies on products of browning reaction:Antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307-316
[21]邱智军,原江锋,张国庆,等.连翘叶中连翘苷和连翘酯苷A对食用油脂的抗氧化活性[J].食品科学,2015,36(17):39-42
QIU Z J,YUAN J F,ZHANG G Q,et al.Antioxidant activity of forsythin and forsythiaside fromforsythiasuspensaleaves on edible oils[J].Food Science,2015,36(17):39-42
[22]GB/T 5538—2005.动植物油脂过氧化值测定[S]
GB/T 5538—2005.Animal and vegetable fats and oils-Determination of peroxide value[S]
[23]罗家星,张彬,邓丹雯,等.番茄籽油不皂化物成分分析与分离[J].中国粮油学报,2015,30(11):125-128
LUO J X,ZHANG B,DENG D W,et al.Separation and analysis of unsaponifiable matters in tomato seed oil[J].Journal of the Chinese Cereals and Oils Association,2015,30(11):125-128
[24]李静,姚茂君,李俊,等.几种天然抗氧化剂对牡丹籽油氧化稳定性的影响[J].食品与发酵工业,2013,39(8):133-137
LI J,YAO M J,LI J,et al.Effects of nature antioxidants on the stability of paeonia seed oil[J].Food and Fermentation Industries,2013,39(8):133-137
[25]高政.菜籽植物甾醇的提取、纯化及抗氧化活性研究[D].武汉:华中农业大学,2009
GAO Z.Study on extraction,purification and anti-oxidation activity of rapeseed phytosterol[D].Wuhan:Huazhong Agricultural University,2009
[26]CHOO W S,BIRCH E J.Radical scavenging activity of lipophilized products from lipase-catalyzed transesterification of triolein with cinnamic and ferulic acids[J].Lipids,2008,44(2):145-52
[27]侯留鑫,王华清,郑铁松,等.一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性[J].食品科学,2013,34(21):115-120
HOU L X,WANG H Q,ZHENG T S,et al.Iolation and identification of a new flavonoid from tea(Camelliasinensis)seeds and its antioxidant activity[J].Food Science,2013,34(21):115-120
[28]沈军卫,樊金玲,朱文学,等.模式美拉德反应产物的抗氧化性与反应进程的关系研究[J].食品科技,2010,35(3):253-257
SHEN J W,FAN J L,ZHU W X,et al.Antioxidant activity of maillard reaction products as related to the processing of maillard reaction[J].Food Science and Technology,2010,35(3):253-257.
