肿瘤抗原特异性TCR基因筛选①
2018-03-07龚晨雨邵红伟张文峰
陈 昭 龚晨雨 邵红伟 张文峰
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广州 510006)
近年来,肿瘤的免疫治疗取得了巨大进展,其旨在激活人体免疫系统,希望依靠自身免疫机能杀灭癌细胞和肿瘤组织[1]。过继性免疫细胞治疗(Adoptive cellular therapy,ACT)属于肿瘤免疫治疗的重要组成部分,其通过向患者回输在体外扩增的自身或同种(特异性或非特异性)免疫细胞,从而达到抗肿瘤目的[2]。
1 肿瘤的TCR-T细胞治疗
T细胞受体(T cell receptor,TCR)是T细胞表面的一种受体分子,它特异性识别抗原提呈细胞上的抗原肽-MHC复合物,进而触发T细胞免疫应答。由于TCR分子决定着T细胞的抗原识别特异性,如果将肿瘤抗原特异性的TCR基因转入普通T细胞中,能够赋予该T细胞肿瘤抗原的识别能力,经体外活化增殖后再转输入患者体内,可以发挥抗肿瘤功效[3]。因此利用TCR基因导入的方法可以方便地获得大量识别特定抗原的T细胞,经TCR基因修饰的T细胞被称为TCR-T,近年来TCR-T已经成为肿瘤免疫治疗中的研究热点,在临床实验中显示了良好的治疗效果。
利用TCR基因修饰T细胞的研究兴起于上世纪90年代末,其大致发展历程如图1所示。1999年,Clay等[4]首先在黑色素瘤模型上进行了相关的研究,表明利用外源TCR基因改造T细胞用于肿瘤的过继性移植治疗是可行的。2001年,Kessels等[5]通过肿瘤抗原识别的TCR基因修饰T细胞后回输小鼠体内,观察到明显的肿瘤消退,同时并未出现明显的自身免疫反应。2006年,Rosenberg等领导的研究团队在《科学》杂志发表了他们在黑色素瘤患者中进行的Ⅰ期临床试验结果[6],在对17例患者进行TCR-T细胞过继性回输治疗之后,有2例患者的瘤体发生了明显消退,有15例患者体内TCR-T细胞的比例在2个月后仍达10%以上,这是关于TCR-T疗法的首次临床试验。2009年,Johnson等[7]针对黑色素瘤患者进行了第二次临床试验,分离自患者的外周血T细胞经特异性识别黑色素瘤抗原MART-1的TCR基因修饰并回输后,响应率达到了30%,并且较第一次临床试验,此次T细胞表面TCR分子的表达强度及回输后TCR-T细胞的体内存活时间明显增加。
嵌合抗原受体修饰的T细胞治疗(Chimeric antigen receptor T-cell immunotherapy,CAR-T)和TCR-T细胞治疗是当前过继性细胞治疗中两种重要的治疗方法。与传统的CIK和DC-CIK细胞治疗相比,CAR-T 和TCR-T细胞治疗都具有肿瘤识别特异性,属精准免疫细胞治疗范畴。与CAR-T相比,TCR-T可以借助于MHC分子的提呈从而识别胞内抗原,识别的靶点范围更广,信号活化受到较为严密的调控,不易诱发细胞因子风暴,具有良好的开发前景与应用价值[8,9]。
2 肿瘤特异性TCR 基因的筛选
TCR 分子主要由α和β两条链组成,其编码基因V,(D)J,C 在T 细胞发育过程中经过胚系重排,在胸腺中经过阳性选择和阴性选择过程,成为具有MHC识别限制性。机体成熟T细胞所产生的TCRαβ组成了一个能与成千万种抗原结合的抗原识别受体库(Repertoire),从理论上估计,TCRαβ受体库的容量在1015以上[10]。成功获得肿瘤抗原特异性的TCR基因是肿瘤TCR-T细胞治疗的重要前提,目前肿瘤特异性TCR基因的筛选主要通过获得肿瘤抗原特异性识别的T细胞,然后克隆其TCR基因。
2.1基于多细胞RT-PCR的扩增技术 MHC-肽五聚体(Pentamer)流式细胞技术是一种简便、灵敏的抗原表位特异性检测方法[11],荧光标记的MHC-肽五聚体与T细胞孵育后,特异性识别MHC-肽五聚体的T细胞即可被激发荧光并通过流式分选,因此可以用来分离抗原特异性的单个T细胞克隆。大致流程为从肿瘤患者外周血分离出单核细胞,其中贴壁细胞利用集落刺激因子和IL-4刺激后,得到树突状细胞(Dendritic cells,DC),然后将合成的肿瘤抗原肽与其孵育获得负载抗原的成熟DC;上述非贴壁的T细胞经负载抗原DC多次刺激,诱导细胞毒性的T淋巴细胞(Cytotoxic lymphocyte,CTL);根据肿瘤患者的HLA类型,制备出相应的肿瘤抗原肽-MHC五聚体,然后利用流式细胞技术筛选出单个特异性的CTL。最后通过体外扩增单个特异性CTL获得一定数量的T细胞,然后通过RT-PCR扩增获得其特异性TCR基因。
特异性识别肿瘤抗原的单个T细胞,在体外增殖的周期较长且条件较为严格(需要钴60照射的滋养层细胞),因此不易获得足够数量的细胞用来进行PCR扩增,目前只有少数实验室成功通过此法获得肿瘤特异性的TCR基因。
2.2利用单细胞RT-PCR扩增技术 目前基于单细胞RT-PCR扩增技术取得了极大进展且日趋成熟,因此分离得到肿瘤抗原特异性T细胞单克隆后,针对该单细胞克隆进行反转录,并通过PCR克隆其TCR基因,该方法避免了单个T细胞克隆复杂繁琐的体外增殖培养过程。根据PCR过程中使用引物的不同,又可以分为基于5′RACE扩增和基于多重引物的PCR扩增两种方法。
2.2.1基于5′RACE扩增 根据序列的同源性,人Vα可分为32个亚家族,人Vβ可分为24个亚家族[12]。分离得到的特异性T细胞单克隆的TCR基因,虽然其Vα和Vβ属于哪个亚家族是未知的,但是可以通过基于5′RACE的PCR扩增,利用通用引物将其扩增得到,其流程如图2 所示。该方法利用Oligo dT为引物,将所有mRNA进行反转录,并利用反转录酶的特性在cDNA链的3′端加入一段寡核苷酸序列,然后利用长通用引物(其含有与寡核苷酸序列互补的序列,其余序列为短通用引物)与TCR基因C区特异性引物进行前两轮PCR扩增,最后利用短通用引物和特异性引物完成剩下PCR反应,通过此法可得到肿瘤抗原特异性识别的TCRα和TCRβ基因。Rosenberg团队利用该方法成功筛选到针对黑色素瘤相关抗原MART-1的高亲和力TCR基因[13]。Kobayashi等[14]研究者基于该方法,从肿瘤患者外周血中成功筛选得到210个肿瘤抗原反应性的TCR分子,从反应性TCR分子的获得到TCR分子识别肿瘤抗原肽的验证,整个过程只需要10 d即可完成。2017年,Parkhurst等[15]利用肿瘤相关抗原的突变肽从肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocytes,TIL)中分离到反应性CD8+CD137+细胞,利用单细胞5′RACE从6个患者中成功分离到27个TCR分子,为从TIL中分离特异性TCR分子提供了良好借鉴。但是该方法对操作者的实验水平要求较高,并且依赖于价钱不菲的试剂盒。
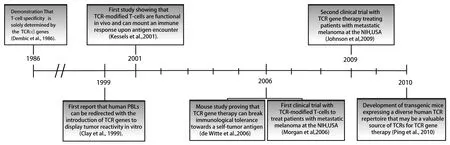
图1 TCR基因治疗的大致发展历程[3]Fig.1 Milestones in development of TCR gene therapy[3]
2.2.2基于多重引物的PCR扩增 Kim等[16]对基于多重PCR扩增的方法进行了探索,大致流程如图3所示。其通过设计9条简并引物覆盖Vβ的24个亚家族序列,24条引物覆盖Vα的32个亚家族序列。因此利用TCRα和TCRβ的C区特异性引物完成反转录步骤后,分别利用24条Vα引物、9条Vβ引物和C区引物进行PCR扩增;将上述PCR产物作为模板,继续进行α链和β链的扩增;其中β链扩增采用锚定PCR的方法,利用上述9条简并引物(5′端均含有22个碱基的通用序列)进行延伸反应,获得5′端带有通用序列的DNA并作为模板,利用通用引物和C区引物继续进行PCR扩增,然后通过测序获得TCRβ基因。α链的扩增采用巢式PCR的方法,将上述24条Vα引物分为5管,分别和C区引物进行PCR扩增,从而获得TCRα基因。2016年,Hamana等[17]进一步创新将PCR与5′RACE结合,在分离到单个反应性T细胞后,首先进行5′RACE扩增,然后进行PCR,最后通过Gibson组装方法获得携带特异性TCR分子的表达盒进行功能验证,建立了一个从筛选到功能验证的简单、有效系统。
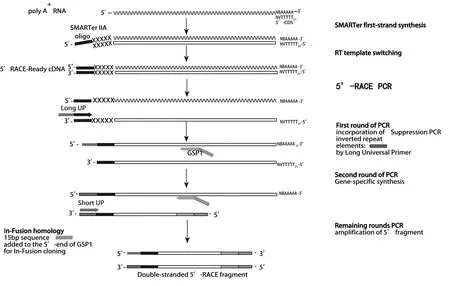
图2 基于单细胞5′RACE的PCR扩增流程图Fig.2 Strategy to identify paired TCR α- and β-chains based on 5′-RACE reactions from single T cells
成功分离单个T细胞是利用单细胞RT-PCR扩增TCR基因过程中的关键步骤之一。常规分离单个细胞方法有激光显微切割技术、显微操作、流式细胞术及有限稀释法等。激光显微切割技术、流式细胞仪和显微操作虽然能够保证分离到单个细胞,但需要较为昂贵复杂的仪器,有限稀释法难以保证精确分离单细胞。为了摸索简单、有效、经济的单细胞分离操作方法,我们利用自制毛细玻璃吸管挑取单个T细胞。该方法所需器材十分简单,在倒置显微镜下,操作者利用嘴的吹吸能力控制毛细玻璃吸管将细胞转移到含有 RNA 酶抑制剂的 PCR 管中,并进行后续单细胞反转录过程。
2.3基于CDR3片段长度多态性分析筛选TCR基因 TCR基因的重排为一随机过程,不同T细胞经过基因重排,可表达不同特异性的TCR,在克隆水平每个T细胞识别各自特异性的抗原,在个体水平则呈现丰富的多样性。TCR的多样性由α链和β链的V区决定,Vα和Vβ各有三个互补决定区(Complementarity determining region,CDR),CDR1、CDR2仅由V基因片段编码,只有CDR3直接和抗原相互作用,TCR的多样性主要由CDR3决定[18]。
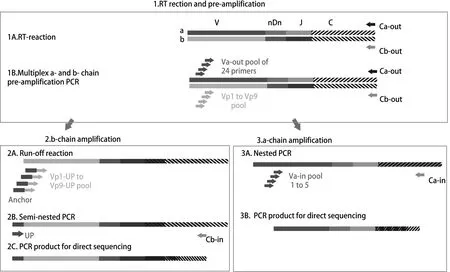
图3 基于单细胞的多重PCR扩增流程图[16]Fig.3 Strategy to identify paired TCR α-and β-chains based on multiplex PCR from single T cells[16]
设计针对每个亚家族的引物并进行RT-PCR扩增,然后利用免疫扫描谱型分析技术可得出每个亚家族的CDR3谱型情况[19,20]。正常情况下,健康人外周血TCR基因CDR3长度具有多样性,每个Vα亚家族和每个Vβ亚家族均呈多峰谱型的高斯分布[21]。当TCR分子与抗原特异性识别后,特异性识别的T细胞克隆迅速增殖,此时Vα和Vβ某些特定亚家族可能出现单峰谱系,利用该特定亚家族特异性引物进行RT-PCR扩增可获得该单峰谱系Vα和Vβ亚家族的CDR3区序列,结合该亚家族CDR1和CDR2序列便可获得特异性的全长TCR基因序列。
本实验室基于TCR基因CDR3片段长度多态性分析,从健康人外周血中成功筛选到识别肿瘤相关抗原Survivin点突变抗原肽的特异性TCRVα4和TCRVβ7基因,并验证了其对抗原肽的特异性识别作用,以及该特异性TCR基因修饰T细胞的肿瘤杀伤功能[22]。需要指出的是,经肿瘤抗原肽刺激后Vα和Vβ的某些亚家族能够出现单峰谱系,是利用此方法筛选肿瘤特异性TCR基因的一个前提条件。因此,该方法在具体实施中会受到一些限制。
3 存在问题及展望
高亲和力肿瘤特异性TCR 基因的获得是TCR-T细胞治疗的前提。由于大部分肿瘤抗原均为自身抗原,外周T细胞经历了阴性选择,其TCR分子对自身抗原肽/MHC复合物的亲和力低下,难以有效活化和形成克隆,表现为一种无反应性状态[23,24]。因此从外周血中获得反应性T细胞克隆的难度极大,也就难以获得高亲和力的肿瘤特异性TCR基因。为了解决该难题,Blankenstein团队构建了一个特别的转基因小鼠模型,其拥有人TCR基因座位(小鼠的TCR基因已被破坏)以及人的MHC基因;利用肿瘤抗原免疫该转基因小鼠,可以用来筛选针对肿瘤抗原高亲和力的TCR基因[25]。但是构建如此的转基因小鼠并非易事,难以推广。
近年来,肿瘤基因组高通量测序结果显示,肿瘤在发生发展过程中会发生大量的突变,发生在编码区的非同义突变会造成蛋白序列的改变,从而导致肿瘤细胞表达出在正常细胞中不存在的突变蛋白,这些突变蛋白在细胞内被降解成短肽,被MHC分子提呈在细胞表面,作为外源抗原被T细胞的TCR分子所识别,导致T细胞活化,进而攻击清除肿瘤细胞。由非同义突变所导致的异常蛋白被称为新抗原,属于肿瘤特异性抗原。由于是新抗原,因此人体内存在识别他们的高亲和力TCR,并且新抗原在正常细胞内不存在,因此以其为治疗靶点不太可能引起自身免疫毒性[26]。
随着高通量测序的普及以及肿瘤基因组项目和肿瘤基因组图谱计划等的实施,肿瘤的突变信息被越来越多地揭示出来,同时表位预测工具日益成熟可靠,这为寻找肿瘤新抗原提供了便捷的资源和有力的工具。另外,随着在TCR基因结构域改造、减少杂合TCR分子产生等方面的研究日益深入,TCR-T的抗肿瘤效果不断提高,这些都为深入开展靶向新抗原的TCR-T研究奠定了良好的基础,势必会更好地促进抗肿瘤免疫治疗的发展。
[1] Lehman JM,Gwin ME,Massion PP.Immunotherapy and targeted therapy for small cell lung cancer:there is hope [J].Curr Oncol Rep,2017,19(7):49.
[2] Bethune MT,Joglekar AV.Personalized T cell-mediated cancer immunotherapy:progress and challenges [J].Curr Opin Biotechnol,2017,8(48):142-152.
[3] Linnemann C,Schumacher TN,Bendle GM.T-cell receptor gene therapy:cirtical parameters for clinical success[J].J Invest Dermatol,2011,131(9):1806-1816.
[4] Clay TM,Custer MC,Sachs J,etal.Efficient transfer of a tumor antigen-reactive TCR to human peripheral blood lymphocytes confers anti-tumor reactivity [J].J Immunol,1999,163(1):507-513.
[5] Kessels HW,Wolkers MC,van den Boom MD,etal.Immunotherapy through TCR gene transfer [J].Nat Immunol,2001,2(10):957-961.
[6] Morgan RA,Dudley ME,Wunderlich JR,etal.Cancer regression in patients after transfer of genetically engineered lymphocytes [J].Science,2006,314(5796):126-129.
[7] Johnson LA,Morgan RA,Dudley ME,etal.Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen [J].Blood,2009,114(3):535-546.
[8] Hinrichs CS.Molecular pathways:breaking the epithelial cancer barrier for chimeric antigen receptor and T-cell receptor gene therapy [J].Clin Cancer Res,2016,22(7):1559-1564.
[9] Bonini C,Mondino A.Adoptive T-cell therapy for cancer:The era of engineered T cells [J].Eur J Immunol,2015,45(9):2457-2469.
[10] Fujiwara H.Adoptive T-cell therapy for hematological malignancies using T cells gene-modified to express tumor antigen-specific receptors [J].Int J Hematol,2014,99(2):123-131.
[11] Liu A,Hu J,Wu W,etal.Preliminary exploration of HLA-A 1101-restricted human cytomegalovirus glycoprotein B-specific CD8+T cells in allogeneic stem-cell transplant recipients [J].Virus Res,2014,8(188):38-44.
[12] Mariani S,Hwang SY,Foglietta M,etal.Comprehensive assessment of the TCRBV repertoire in small T-cell samples by means of an improved and convenient multiplex PCR method [J].Exp Hematol,2009,37(6):728-738.
[13] Hughes MS,Yu YY,Dudley ME,etal.Transfer of a TCR gene derived from a patient with a marked antitumor response conveys highly active T-cell effector functions [J].Hum Gene Ther,2005,16(4):457-472.
[14] Kobayashi E,Mizukoshi E,Kishi H,etal.A new cloning and expression system yields and validates TCRs from blood lymphocytes of patients with cancer within 10 days [J].Nat Med,2013,19(11):1542-1546.
[15] Parkhurst M,Gros A,Pasetto A,etal.Isolation of T-cell receptors specifically reactive with mutated tumor-associated antigens from tumor-infiltrating lymphocytes based on CD137 expression [J].Clin Cancer Res,2017,23(10):2491-2505.
[16] Kim SM,Bhonsle L,Besgen P,etal.Analysis of the paired TCR α-and β-chains of single human T cells [J].PLoS One,2012,7(5):e37338.
[17] Hamana H,Shitaoka K,Kishi H,etal.A novel,rapid and efficient method of cloning functional antigen-specific T-cell receptors from single human and mouse T-cells [J].Biochem Biophys Res Commun,2016,474(4):709-714.
[18] Yoshida K,Cologne JB,Cordova K,etal.Aging-related changes in human T-cell repertoire over 20 years delineated by deep sequencing of peripheral T-cell receptors [J].Exp Gerontol,2017,96:29-37.
[19] Wang CY,Fang YX,Chen GH,etal.Analysis of the CDR3 length repertoire and the diversity of T cell receptor α and β chains in swine CD4+and CD8+T lymphocytes [J].Mol Med Rep,2017,16(1):75-86.
[20] 潘宗琴,吕 红,庄勤建,等.乙型肝炎患者治疗前后外周血 CD4+CD25+Tregs TCR CDR3 谱系漂移特征分析[J].中国免疫学杂志,2017,33(6):889-894,899.
Pan ZQ,Lu H,Zhuang QJ,etal.Spetrum drift characteristics of CD4+CD25+Tregs TCR CPR3 in hepatitis B patients before and treatment[J].Chin J Immunol,2017,33(6):889-894,899.
[21] Zhou J,Ma R,Luo R,etal.Primary exploration of CDR3 spectratyping and molecular features of TCR β chain in the peripheral blood and tissue of patients with colorectal carcinoma [J].Cancer Epidemiol,2010,34(6):733-740.
[22] Shao H,Lin Y,Wang T,etal.Identification of peptide-specific TCR genes by in vitro peptide stimulation and CDR3 length polymorphism analysis [J].Cancer Lett,2015,363(1):83-91.
[23] Wang RF,Wang HY.Immune targets and neoantigens for cancer immunotherapy and precision medicine [J].Cell Res,2017,27(1):11-37.
[24] Morris EC,Stauss HJ.Optimizing T-cell receptor gene therapy for hematologic malignancies [J].Blood,2016,127(26):3305-3311.
[25] Li LP,Lampert JC,Chen X,etal.Transgenic mice with a diverse human T cell antigen receptor repertoire [J].Nat Med,2010,16(9):1029-1034.
[26] Yarchoan M,Johnson BA 3rd,Lutz ER,etal.Targeting neoantigens to augment antitumour immunity [J].Nat Rev Cancer,2017,17(4):209-222.