抗铜绿假单胞菌PcrV蛋白单克隆抗体的筛选和功能验证①
2018-03-07管章春刘方杰刘成华高亚萍沈倍奋
管章春 刘方杰 刘成华 高亚萍 沈倍奋 杨 光
(广西医科大学,南宁 530000)
铜绿假单胞菌(Pseudomonas aeruginosa,PA)又称绿脓杆菌,是自然界广泛存在的革兰氏阴性致病菌,也是院内感染最主要的病原体之一。其能引起各类急慢性感染,是囊性纤维化患者致死的重要原因。另外,PA常常在机械性气道损伤、免疫抑制或患有艾滋病、肿瘤的患者体内引发急性肺炎[1-5]。目前临床上主要采用抗生素治疗PA引起的各种感染。然而随着抗生素的广泛使用,PA耐药菌株被分离的报道不断增加[6],开发基于针对PA感染新的抗感染策略极为重要。抗体药物可以通过中和毒素、吞噬调理作用等消除病原体,并且抗体具有特异性高、副作用小等优点,在抗感染领域受到越来越多的关注。
PA的致病机制包括细菌表面的毒力因子和细菌的外分泌毒素。其分泌毒素主要是经Ⅰ、Ⅱ、Ⅲ型分泌系统分泌[7]。PcrV蛋白为Ⅲ型分泌系统的转运体蛋白,通过将细菌产生的毒力蛋白分子直接输送到宿主细胞内,干扰宿主细胞的正常功能,引发宿主细胞的死亡。基因突变研究证实,PcrV缺失后,细菌Ⅲ型分泌系统不能与宿主细胞膜结合,从而不能够损伤宿主细胞[8,9]。目前,PcrV已经成为新的抗铜绿假单胞菌感染的药物研发靶点。
本研究从PA菌株PAO1基因组中调取PcrV基因,并构建其重组表达载体,成功获得了PcrV蛋白。利用噬菌体抗体库技术筛选出抗PcrV蛋白的全人源单克隆抗体YG5,小鼠肺炎模型的实验结果表明YG5能够明显抑制PA对机体的感染,具有很好的保护作用。
1 材料与方法
1.1材料
1.1.1实验材料 PA菌株PAO1(中国科学院上海药物研究所蓝乐夫教授赠送),原核表达载体pET-28a、全人源naive Fab抗体库、M13KO7(本室保存);无特定病原体级BALB/c纯系雌性小鼠,鼠龄8周(购自北京维通利华实验动物技术有限公司);感受态细胞DH5α和BL21(DE3)、HiFiTaq聚合酶、dNTP(北京康润诚业生物技术公司);限制性内切酶NheⅠ和EcoRⅠ(TaKaRa公司);质粒提取试剂盒、胶回收试剂盒[生工生物工程(上海)股份有限公司];细菌基因组DNA提取试剂盒、T4 DNA 连接酶、Trans2K DNA标志物、低分子量蛋白标准(北京全式金生物科技公司);anti-M13抗体(北京义翘神州生物技术有限公司);PEG8000(Sigma);其他试剂为国产分析纯。
1.1.2PCR引物设计 引物由生工生物工程(上海)股份有限公司合成,PcrV正向引物5′-GAC-TGCTAGCATGGAAGTCAGAAACCTTAATG-3′反向引物5′-AGTCGAATTCCTAGATCGCGCTGAGAATGTC-GCG-3′,下划线部分为酶切位点。
1.2实验方法
1.2.1pET-28a-PcrV重组质粒的构建 以PAO1菌株基因组为模板,利用PcrV基因特异性上下游引物进行PCR扩增,PCR条件如下:94℃、5 min;94℃、30 s;55℃、30 s;72℃、90 s;30个循环,72℃,10 min;扩增片段大小为885 bp。将 PCR扩增得到的PcrV基因片段,利用限制性内切酶NheⅠ和EcoRⅠ酶切,回收目的片段亚克隆至pET-28a载体,转化连接产物至BL21(DE3)感受态细胞中,经菌落PCR和提取质粒酶切鉴定获得阳性克隆,并进一步送交测序鉴定。
1.2.2PcrV蛋白在大肠杆菌中诱导表达及纯化 使用LB(Kana+)培养基过夜培养测序正确阳性单克隆菌落,次日按照1∶100转接至新鲜LB(Kana+)培养基中,37℃扩大培养至OD600约为0.7,加入诱导剂IPTG至终浓度为0.1 mmol/L,继续室温培养6 h 后,4℃,8 000 r/min离心15 min收集菌体。使用结合缓冲液(20 mmol/L Na3PO4,0.5 mol/L NaCl,20 mmol/L咪唑,pH7.4)重悬菌体,超声破碎(每次10 s,间隔10 s,共30 min)后,4℃,12 000 r/min离心15 min分别收集沉淀和上清,通过SDS-PAGE电泳检测后将超声所获上清与Ni2+螯和树脂孵育,利用含20 mmol/L咪唑的洗涤液洗涤Ni2+柱,最后用含500 mmol/L咪唑的洗脱液洗脱目的蛋白,利用BCA法定量所获目的蛋白浓度并利用SDS-PAGE检测其纯度。
1.2.3噬菌体抗体库的制备 取30 μl naive Fab抗体库甘油菌接种到50 ml 的2YTAG培养基中,初始细胞密度OD600=0.1左右。37℃、220 r/min,培养至OD600=0.6~0.8之间。向50 ml培养液中加入100 μl的M13KO7,37℃静置30 min。4 000 r/min,25℃,离心15 min。弃上清,将沉淀重悬至250 ml 2YTAK培养基中,28℃培养过夜。将过夜菌7 000 r/min,4℃,离心15 min;上清转入新的离心管中,并加入1/4体积的PEG/NaCl沉淀噬菌体,冰浴1 h。7 000 r/min,4℃,离心15 min,弃上清。噬菌体沉淀重悬于20 ml PBS中。10 000 r/min,4℃,再次离心15 min,除去残留的细胞碎片。上清移入新的50 ml离心管中,加入1/4体积的上述PEG/NaCl溶液,冰浴20 min。7 000 r/min,4℃,离心15 min,弃上清。噬菌体沉淀重悬于5 ml 含20%甘油的PBS中,即得到纯净的噬菌体悬液。取10 μl噬菌体悬液重新感染对数生长期的TG1进行滴度测定。
1.2.4噬菌体抗体库的亲和淘选 用无菌PBS稀释抗原PcrV至终浓度为10 μg/ml,吸取500 μl溶液包被免疫管,4℃过夜。同时设置只包被PBS的阴性对照。无菌PBS洗涤免疫管3次,之后用4%的脱脂奶粉/PBST室温封闭1 h。同时用4%的脱脂奶粉封闭噬菌体抗体库,室温1 h。无菌PBS洗涤免疫管3次,将封闭好的抗体库加入到免疫管中,每管500 μl,噬菌体的投入量约为1.2×1012,室温静置1 h。PBST洗涤15次,PBS洗涤15次,3 min/次。每管加入500 μl Glycine-HCl(0.1 mol/L,pH2.2)洗脱噬菌体,室温放置10 min。倒出洗脱液,迅速用1.5 mol/L的Tris-HCL(pH8.8)中和至pH7.4。将500 μl的上述洗脱液感染10 ml对数生长期的TG1菌液,37℃静置30 min。取200 μl、100 μl等不同体积的菌液分别涂布于2YTAG固体平板上,用于计算产量和挑取单克隆。剩下的菌液4 000 r/min,离心15 min后,弃去上清,将菌体涂布于2YTAG固体平板上,37℃培养过夜,为第二轮筛选做准备。观察克隆生长情况,统计克隆数。将菌落从2YTAG平板上刮下,重悬于含20%甘油的2YTAG培养基中,冻存于-70℃。按如上步骤进行第二轮和第三轮亲和淘选。
1.2.5ELISA实验筛选阳性克隆 挑取经过三轮筛选后获得的单克隆菌落,接种于1 ml 2YTAG培养基中(采用96孔深孔板),37℃,220 r/min培养过夜。分别吸取30 μl的过夜菌接种于900 μl的2YTAG培养基中,37℃,220 r/min,培养至OD600=0.6~0.8,每孔加入5×1010的辅助噬菌体M13KO7,37℃静止感染30 min。1 800 r/min,4℃离心15 min,弃去上清,用1 ml 2YTAK重悬沉淀,28℃,220 r/min培养过夜。收取噬菌体上清,利用ELISA实验鉴定阳性克隆,并将阳性克隆送交测序。
1.2.6pIgH和pIgL重组质粒的构建 以测序正确的阳性克隆质粒为模板,利用抗体重链和轻链特异性上下游引物进行PCR扩增,PCR扩增条件如下:94℃、5 min;94℃、30 s;60℃、30 s;72℃、30 s;30个循环,72℃、10 min;扩增片段大小为360 bp和321 bp。将 PCR扩增得到的VH和VL基因片段,利用限制性内切酶NheⅠ和SalⅠ酶切,回收目的片段亚克隆至pIgH和pIgL载体,连接产物转化至DH5α感受态细胞中,经菌落PCR和提取质粒酶切鉴定获得阳性克隆(分别命名为pIgH-YG5VH和pIgL-YG5VL),并进一步送交测序鉴定。
1.2.7Anti-PcrV抗体YG5的表达及纯化 将测序正确的阳性单克隆pIgH-YG5VH和pIgL-YG5VL分别接种至100 ml 2YTA培养基中,37℃,220 r/min培养过夜。8 000 r/min,4℃,离心15 min收菌。然后采用无内毒素质粒大提试剂盒提取pIgH-YG5VH和pIgL-YG5VL质粒备用;75 μg质粒(pIgH-YG5VH和pIgL-YG5VL比例为1∶1)重悬于2.5 ml FreeStyle F17细胞培养基中,225 μg转染试剂PEI也重悬在2.5 ml FreeStyle F17细胞培养基中;将PEI缓慢的加入到质粒中,充分混合,室温放置约15 min;将上述混合液加入到45 ml 293E细胞中(细胞密度为1×106ml-1),37℃细胞摇床培养7 d。3 000 r/min,离心15 min收取培养细胞上清。采用装有Protein A填料的树脂亲和纯化抗体。使用0.2 mol/L pH2.2的Glycine-HCl洗脱抗体,然后使用1.5 mol/L的Tris-HCL(pH9.1)将洗脱液中和至pH7.4。将纯化后抗体超滤浓缩,使用PBS(pH7.4)重悬后利用SDS-PAGE检测抗体纯度。
1.2.8ELISA实验检测全人源抗体YG5亲和力 使用包被液稀释PcrV至终浓度10 μg/ml,加入至ELISA板孔中,4℃包被过夜。PBST洗涤后,使用4%脱脂奶粉封闭,37℃、1 h。PBST洗涤5次,200 μl/孔,2 min/次。将样品加入ELISA板孔中,100 μl/孔,37℃孵育1 h。PBST洗涤5次,200 μl/孔,2 min/次。将HRP标记的山羊抗人IgG按1∶40 000稀释于4%奶粉中,100 μl/孔,37℃孵育1 h。TMB显色液显色,100 μl/孔,室温显色2~5 min。用2% H2SO4终止显色,50 μl/孔。读取450 nm吸光值,使用GraphPad 软件分析数据。
1.2.9急性肺炎模型验证YG5抗体活性 将雌性BALB/c 小鼠21只随机分为3组,每组7只。分别腹腔注射0.5 mg/ml的抗体、对照抗体或无菌PBS 200 μl。其中,对照抗体为抗金黄色葡萄球菌外分泌蛋白的全人源单克隆抗体。4 h后使用1%戊巴比妥纳麻醉小鼠后固定于专用手术台,75%乙醇消毒后自颈部正中切开皮肤,钝性分离直至暴露气管,用 1 ml注射器将铜绿假单胞菌(1×106CFU)悬液经气管缓慢注入两肺。观察记录小鼠48 h内的死亡情况。
1.3统计学处理 采用 Graph Pad Prism 5.0 软件进行作图,Log-rank(Mantel-Cox)Test分析不同数据间统计学差异。
2 结果
2.1PcrV重组蛋白的表达
2.1.1表达载体pET-28a-PcrV的构建 以PAO1基因组DNA为模板,利用PcrV基因上下游特异性引物进行PCR扩增。琼脂糖凝胶电泳检测显示,扩增得到约885 bp大小的单一条带(图1A),使用NheⅠ和EcoRⅠ酶切获得PcrV基因片段,再克隆至表达载体pET-28a。菌落PCR鉴定结果显示成功构建pET-28a-PcrV重组表达载体(图1B)。
2.1.2PcrV蛋白的表达和纯化 挑取测序正确的阳性菌落,IPTG诱导后收集菌体并超声处理分别收取超声上清及沉淀,SDS-PAGE电泳结果显示,在相对分子质量30 kD处检测到目的条带,且其以可溶性形式表达。进一步利用Ni2+螯合树脂纯亲和化获得纯度较高的目的蛋白PcrV(图2)。
2.2特异性抗体YG5的表达
2.2.1与PcrV特异性结合的阳性噬菌体克隆的筛选与鉴定 包被PcrV蛋白,利用naive Fab抗体库筛选PcrV蛋白特异结合噬菌体克隆。经过三轮筛选,与PcrV结合的噬菌体克隆得到明显富集。将第三轮筛选后洗脱的噬菌体感染TG1,从中随机挑取84个克隆,加入辅助噬菌体,获得展示单一Fab的噬菌体克隆(phage-Ab),利用ELISA检测phage-Ab与PcrV结合能力。图3所示,根据吸光值(OD450 nm)不同,我们将挑选的克隆分为2组(OD450 nm<1∶23个克隆和OD450 nm≥1∶61个克隆),挑选阳性克隆(OD450 nm≥1)进行序列测定,结果发现所有克隆中的质粒所编码的抗体可变区序列完全相同,我们将该抗体命名为YG5。

图1 表达载体pET-28a-PcrV的构建Fig.1 Construction of expression vector pET-28a-PcrVNote: A.PCR amplification of PcrV gene;B.Identification of recombinant vector of pET-28a-PcrV;M.Trans2K DNA marker.

图2 PcrV蛋白的表达和纯化Fig.2 Expression and purification of PcrV proteinNote: M.Protein marker;1.Whole bacteria cleavage products;2.Whole bacteria cleavage supernatant;3.Whole bacteria cleavage precipitation;4.Purification of PcrV protein.
2.2.2pIgH-YG5VH和pIgL-YG5VL重组质粒的构建 我们以包含YG5重链和轻链可变区(YG5VH和YG5VL)的质粒为模板,利用抗体重链和轻链上下游特异性引物进行PCR扩增。琼脂糖凝胶电泳检测显示,扩增得到约360 bp和321 bp的条带(图4)。利用NheⅠ和SalⅠ酶切YG5VH和YG5VL片段,克隆至表达载体pIgH和pIgL。经酶切鉴定和序列测定,重组表达载体(pIgH-YG5VH和pIgL-YG5VL)构建成功。
2.2.3特异性抗体YG5的表达及纯化 我们将培养测序正确的pIgH-YG5VH和pIgL-YG5VL阳性克隆细菌,提取pIgH-YG5VH和pIgL-YG5VL质粒,并共转染至293E细胞。使用ProteinA树脂从细胞培养上清亲和纯化YG5抗体,并通过SDS-PAGE电泳检测抗体纯度。结果显示,在还原条件下,在相对分子量约55和25 kD处可检测到目的条带,在非还原电泳条件下,在相对分子量约150 kD处可检测到目的条带(图5)。

图3 ELISA检测阳性克隆Fig.3 Detection of positive clones by ELISA

图4 YG5抗体VH和VL片段的扩增Fig.4 Amplification of VH and VL fragments of YG5 antibodiesNote: M.Trans2K DNA marker;1.VL fragments of YG5 antibodies;2.VH fragments of YG5 antibodies.
2.2.4利用ELISA实验检测YG5抗体与PcrV蛋白亲和力 我们将纯化后的YG5抗体稀释至不同的浓度,利用ELISA实验检测其与PcrV蛋白结合能力。采用GraphPad软件做图并分析数据,结果显示,YG5与PcrV结合的EC50值为61 ng/ml(图6)。

图5 YG5 SDS-PAGE分析Fig.5 SDS-PAGE analysis of YG5Note: M.Protein marker;1.Reduced SDS-PAGE analysis;2.Non-reducing SDS analysis

图6 ELISA检测YG5亲和力Fig.6 Detection of YG5 affinity by ELISA
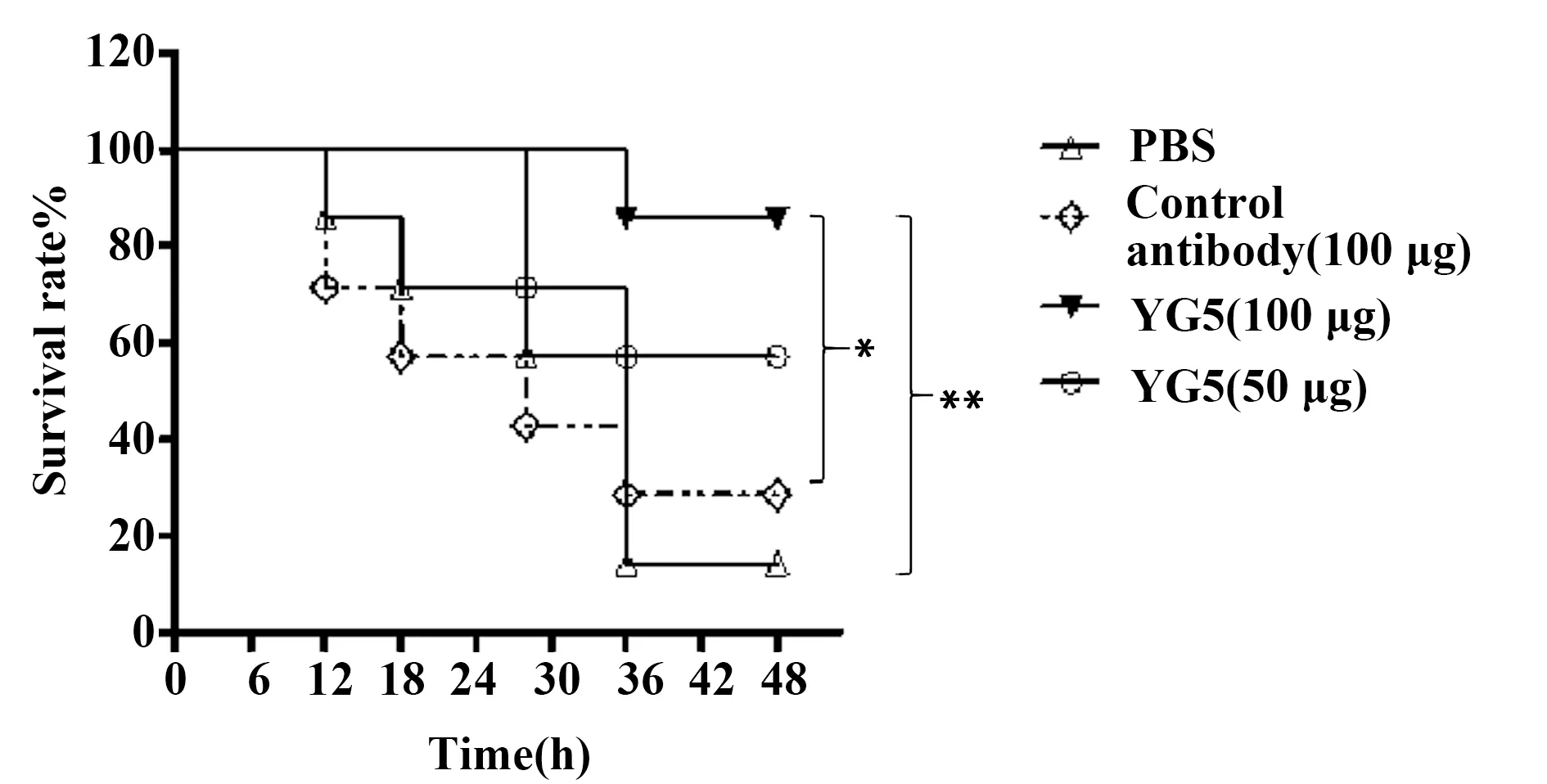
图7 小鼠生存曲线Fig.7 Survival rate of MouseNote: The control antibody is an antibody against Staphylococcus aureus exocrine protein.*.P<0.05;**.P<0.01.
2.3急性肺炎模型验证YG5抗体抗感染活性 由于铜绿假单胞菌是诱发肺部感染的主要致病菌之一,我们在随后的研究中,通过气管插管注入细菌的方式建立了小鼠肺部感染铜绿假单胞菌的致死性模型,并在此基础上检测YG5抗体是否能够抑制铜绿假单胞菌的感染,提高小鼠的存活率。我们的研究结果发现与对照抗体和PBS组相比,YG5能有效抑制铜绿假单胞菌的感染,降低小鼠的死亡率(图7)。
3 讨论
本研究成功构建了pET-28a-PcrV重组表达载体,表达并纯化铜绿假单胞菌重组蛋白PcrV。利用噬菌体抗体库筛选出具有较高亲和力的抗PcrV单克隆人源抗体YG5。进一步的研究结果表明,YG5抗体能有效保护小鼠抵御铜绿假单胞菌的感染。
目前已知铜绿假单胞菌能够感染宿主细胞导致疾病的主要原因是其能够通过 Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)的作用,逃避宿主巨噬细胞的吞噬降解 。T3SS蛋白按功能可分为分泌装置、转位器装置、毒素蛋白和分子伴侣四部分。分泌装置锚定在细菌胞膜上,通过针管状结构连接转位器装置,转位器装置被激活后,插入宿主细胞膜,形成转位孔道,向宿主细胞输入毒素蛋白,杀伤靶细胞[10]。PcrV 蛋白是形成转位孔道的必需条件,是T3SS至关重要的组成部分,已成为免疫治疗的重要靶点[11]。
针对微生物感染性疾病,治疗性抗体相关药物的研发取得了很大的进展。目前已经有4个用于治疗感染性疾病的单抗药物被FDA批准上市,分别是抗呼吸道合胞病毒(Respiratory syncytial virus,RSV)的Palivizumab单抗(Synagis)、抗炭疽杆菌的Raxibacumab单抗(ABthrax)和Obiltoxaximab单抗(Anthim)以及抗艰难梭菌感染的Bezlotoxumab单抗(Zinplava)[12]。除了以上几种抗体药物外,还有很多抗感染类的抗体药物正处于临床研究阶段或临床前研究阶段。随着病原微生物诱发感染的机制深入研究,会发现和鉴定一系列参与微生物致病的功能分子,这将为治疗性抗体研发提供更多的药物靶点。
目前针对铜绿假单胞菌感染的在研抗体主要有4种,分别是 MEDI3902、Panobacumab、KB001和AerucinTM[13-15]。其中,MEDI3902和AerucinTM已经完成Ⅰ期临床实验,Panobacumab和KB001已经完成Ⅱ期临床实验。全人源单克隆抗体YG5是不同于以上抗体的新抗体,能够显著抑制铜绿假单胞菌对机体的感染,有可能成为新的抗铜绿假单胞菌感染的治疗性药物。
[1] Stover CK,Pham XQ,Erwin AL,etal.Complete genome sequence of Pseudomonas aeruginosa PAO1,an opportunistic pathogen[J].Nature,2000,406(6799):959-964.
[2] Weber DJ,Rutala WA,Sickbert-Bennett EE,etal.Microbiology of ventilator-associated pneumonia compared with that of hospital-acquired pneumonia[J].Infect Control Hosp Epidemiol,2007,28,(7):835-831.
[3] Konstan MW,Berger M.Current understanding of the inflammatory process in cystic fibrosis:onset and etiology[J].Pediatr Pulmonol,1997,4:137-142.
[4] Lyczak JB,Cannon CL,Pier GB.Lung infections associated with cystic fibrosis[J].Clin Microbiol Rev,2002,15(2):194-222.
[5] Hoiby N,Ciofu O,Bjarnsholt T.Pseudomonas aeruginosa biofilms in cystic fibrosis[J].Future Microbiol,2010,5(11):1663-1674.
[6] Strateva T,Ouzounova-Raykova V,Markova B,etal.Problematic clinical isolates of Pseudomonas aeruginosa from the university hospitals in Sofia,Bulgaria:current status of antimicrobial resistance and prevailing resistance mechanism[J].J Med Microbiol,2007,56(Pt 7):956-963.
[7] Kipnis E,Sawa T,Wiener-kronish J.Targeting mechanisms of Pseudomonas aeruginosa pathogenesis[J].Medicine et Maladies Infectieuses,2006,36:78-91.
[8] Frank DW,Vallis A,Wiener-Kronish JP,etal.Generation and characterization of a protective monoclonal antibody to Pseudom-onas aeruginosa PcrV[J].J Infect Dis,2002,186(1):64-73.
[9] Goure J,Pastor A,Faudry E,etal.The Vantigen of Pseudomonas aeruginosa is required for assembly of the functional PopB/PopD translocation pore in host cell membranes[J].Infect Immun,2004,72(8):4741-4750.
[10] Dacheux D,Goure J,Chabert J,etal.Pore-forming activity of type Ⅲ system-secreted proteins leads to oncosis of Pseudomonas aeruginosa-infected macrophages[J].Mol Microbiol,2001,40(1):76-85.
[11] Sundinc C,Thelaus J,Broms JE,etal.Polarisation of type Ⅲ translocation by Pseudomonas aeruginosa requires PcrG PcrV and PopN[J].Microb Pathog,2004,37(6):313-322.
[12] 刘方杰,杨 光,沈倍奋.治疗感染性疾病抗体药物的概况及趋势[J].中国医药生物技术,2016,11(6):552-555.
Liu FJ,Yang G,Shen BF.Recent advances and trends in antibody drugs for the treatment of infectious disease[J].Chin Med Biotechnol,2016,11(6):552-555.
[13] Di Giandomenico A,Keller AE,Gao C,etal.A multifunctional bispecific antibody protects against Pseudomonas aeruginosa[J].Sci Transl Med,2014,6(262):262ra155.
[14] Lu Q,Rouby JJ,Laterre PF,etal.Pharmacokinetics and safety of panobacumab:specific adjunctive immunotherapy in critical patients with nosocomial Pseudomonas aeruginosa O11 pneumonia[J].J Antimicrob Chemother,2011,66(5):1110-1116.
[15] Franois B,Luyt CE,Dugard A,etal.Safety and pharmacokinetics of an anti-PcrV PEGylated monoclonal antibody fragment in mechanically ventilated patients colonized with Pseudomonas aeruginosa:a randomized,double-blind,placebo-controlled trial[J].Crit Care Med,2012,40(8):2320-2326.