采用响应面法优化大蒜素的提取工艺
2018-03-06詹盛文李磊蒯振彧李春玲孟艳秋
詹盛文,李磊,蒯振彧,李春玲,孟艳秋
(沈阳化工大学 制药与生物工程学院,沈阳 110142)
大蒜(AlliumsativumL.)又叫蒜头、胡蒜等,是百合科葱属植物。我国对大蒜的使用不仅具有悠久的历史,还积累了丰富的经验。体现在大蒜除了当作调味品被食用外,还有很好的药用价值。《名医别录》记载:“大蒜具有散痈肿魇疮,除风邪,杀毒气的功效”。《本草拾遗》也记载:“大蒜可以去水恶瘴气,除风湿,破冷气,烂疵癣,伏邪恶,宜通湿补,无认加。”明朝李时珍著《本草纲目》中称“大蒜捣汁饮,治吐血心病,煮汁饮
治角产反涨,捣膏敷脐能达下焦,消水利大小便,贴足心能引热下行,治泄泻暴痢及干湿霍乱;止衄血,纳肛中能通幽门治关格不通等。”
现代药理学研究表明:大蒜中的大蒜素(allicin)具有很好而广泛的药理活性。在心脑血管方面,起到抗血脂、抗高血压和抗动脉粥样硬化的作用[1-3];在抗微生物方面,具有抗病毒、抗菌、抗真菌和抗寄生虫的功效[4-6]。在中国的一项调查中发现,长期有规律地食用大蒜的人群比其他人患癌的风险降低了1000倍左右,进一步研究发现是大蒜素抑制了致癌物的激活[7,8]。
研究发现:大蒜素的生成主要来自于其前提物质蒜氨酸(alliin)。而蒜氨酸在大蒜体内的生物合成途径主要有以下两条:其一是谷胱甘肽中的半胱氨酸被烯丙基化,然后经过一系列步骤,生成蒜氨酸。在这个过程中同时也伴随着谷胱甘肽的降解;另一条途径是谷胱甘肽不直接参与反应,而是直接半胱氨酸烯丙基化,随后生成S-烯丙基半胱氨酸,最后经过氧化生成蒜氨酸[9,10],主要步骤见图1。

图1 蒜氨酸生物合成途径Fig.1 The biosynthesis pathway of alliin
注:GSH为L-半胱氨酸;GSAC为γ-L-谷氨酰-S-烯丙基-L-半胱氨酸。
在大蒜组织细胞破碎的情况下,蒜酶(alliinase)与底物蒜氨酸接触,触发一系列酶解反应。主要分为两步:第一步是蒜氨酸在蒜酶的作用下,一分子的蒜氨酸得到一分子烯丙基磺酸;第二步是两分子的烯丙基磺酸分子间脱水缩合为大蒜素[11],具体步骤见图2。
提取大蒜素的方法主要有三种,分别是水蒸气蒸馏法、超临界流体萃取法和有机溶剂提取法。水蒸气蒸馏法要在高温条件下进行,这使得蒜酶容易失活而不能充分地进行上述酶解过程,以致大蒜素生成减少。同时,大蒜素在高温条件下很容易降解。而超临界流体萃取法操作成本过高,无法大规模地应用到工业生产中。所以这两种方法都存在其局限性,而不能成为大蒜素提取的最适方法。有机溶剂提取法条件温和,最重要的是它的酶解过程和提取过程是独立进行的。这样不仅能够充分多地获得大蒜素,而且还能大量地提取出来。但是,工艺路线的延长,必然引入许多影响收率的因素。本实验选取四个决定性因素进行考察,以期获得最佳的大蒜素提取工艺条件,从而为工业化生产提供一些参考。
1 材料和方法
1.1 材料
1.1.1 原料和试剂
新鲜大蒜:沈阳大商佳商城;大蒜素标准品(PCS0325):北京北纳创联生物技术研究院;乙醇(分析纯);甲醇(色谱纯)。
1.1.2 主要仪器
RE-52cs旋转蒸发仪 上海亚荣生化仪器厂; SHZ-2000型双配套循环水式多用真空泵 巩义市予华仪器有限责任公司; JJ-2(2003-61)型组织捣碎匀浆机 常州国华电器有限公司;TDZ5-WS台式低速平衡离心机 长沙湘智离心机仪器有限公司; KDOQX-1000超声仪 上海科电公司; 安捷伦-1200系列高效液相色谱仪(HPLC,4.6 mm×250 mm,0.5 μm) 美国安捷伦科技公司。
1.2 方法
1.2.1 工艺流程
选取新鲜大蒜,去皮,用蒸馏水洗净,淋干。选取适量置于组织捣碎匀浆仪中捣碎成泥。蒜泥移置烧杯中,加入适量去离子水,置于恒温箱中酶解。酶解后按料液比1∶5(g/V)的比例加入95%乙醇。稀释后的原料液置于超声仪中超声提取,离心(9000 r/min,20 min,26 ℃),取上清液。上清液用滤纸过滤得大蒜素提取液。旋蒸浓缩到一定浓度,稀释定容到100 mL容量瓶中。吸取20 μL过微孔滤膜,注射入高效液相色谱仪,测定。
1.2.2 标准曲线的绘制
称取10.46 mg大蒜素标准品,用甲醇稀释到50 mL容量瓶中作为贮备液。精密吸取1,2,3,4,5,8,10 mL贮备液定容到10 mL容量瓶中。每个浓度梯度的标准液经过高效液相色谱仪测量,每个浓度测量2次,取平均值。色谱条件设置为:流速1 mL/s,柱温32 ℃,紫外检测波长为214 nm,流动相为水∶甲醇为15∶85(V/V)[12]。以峰面积(A)为纵坐标,标准液浓度(C)为横坐标,绘制标准曲线图(见图3),同时获得一元线性回归方程:A=9746.62C+10.13(R=0.9991)。

图3 大蒜素标准曲线图Fig.3 Standard curve of allicin
1.2.3 单因素试验
试验前处理:将新鲜大蒜去皮洗净之后,打浆成蒜泥。称取10 g蒜泥,加入适量的去离子水,调节pH值为6.8。
根据要考察的4个因素,每次考察1个因素时要固定另外3个因素。根据前期预实验结果,首先,确定酶解时间为30 min,超声功率为45 W,超声温度为35 ℃来考察酶解温度对大蒜素收率的影响;其次,确定酶解温度为40 ℃,超声功率为45 W,超声温度为35 ℃来考察酶解时间对大蒜素收率的影响;再次,确定酶解温度为40 ℃,酶解时间为30 min,超声温度为35 ℃来考察超声功率对大蒜素收率的影响;最后,确定酶解温度为40 ℃,酶解时间为30 min,超声功率为45 W来考察超声温度对大蒜素收率的影响。
1.2.4 响应面法优化试验设计
根据Box-Benhnken软件试验设计原理,综合单因素试验结果,以酶解温度(A)、酶解时间(B)、超声功率(C)和超声温度(D)4个因素,分别取低、中和高3个水平,用-1,0,1表示进行编码(见表1)。最后以大蒜素收率为响应值。

表1 响应面试验设计水平表Table 1 Factors and levels of response surface test design
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 酶解温度对大蒜素收率的影响
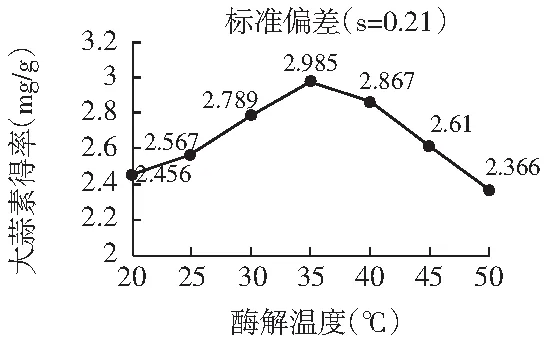
图4 酶解温度对大蒜素收率的影响Fig.4 Effect of enzymolysis temperature on the yield of allicin
由图4可知,大蒜素收率随着酶解温度的升高而出现增减。大蒜素收率随着温度的逐渐升高首先以较缓的速度增加,随后增速加快,持续到大约36 ℃左右时,大蒜素收率达到最佳酶解温度的临界值。这样的变化可以解释为:蒜氨酸酶的活性随着温度的增加,活性不断增强,当达到最适温度时,酶的活性也最高,因此蒜氨酸也能最充分地被酶解为大蒜素。而在拐点之后,大蒜素收率随着温度的增加出现下降的趋势,这是因为过高的温度导致酶的活性下降,如果继续升高温度,酶出现失活,大蒜素就无法获得了[13]。
2.1.2 酶解时间对大蒜素收率的影响

图5 酶解时间对大蒜素收率的影响Fig.5 Effect of enzymolysis time on the yield of allicin
由图5可知,大蒜素收率随着酶解时间的变化情况。大蒜素收率随着时间的延长出现平稳的增加,大约在提取时间为30 min时出现一个高值。随后大蒜素收率渐趋平缓,不再随着时间的延长而出现波动。这一结果可以解释为:开始时蒜氨酸分子的酶解活动平稳进行,当经过一段时间后,蒜氨酸已经全部转化为大蒜素,所以接下来不会再有大蒜素生成。反而,由于大蒜素的挥发性,长时间的放置会出现不增反减的现象。
2.1.3 超声功率对大蒜素收率的影响
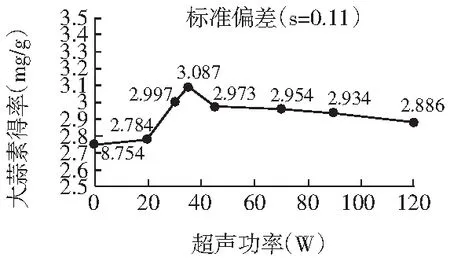
图6 超声功率对大蒜素收率的影响Fig.6 Effect of ultrasonic power on the yield of allicin
由图6可知超声功率对大蒜素收率的影响情况。在超声功率加大的过程中,大蒜素收率也在不断提高。当功率大概到45 W时,出现了最大值。而之后再不断地增大功率时,大蒜素收率出现下降的趋势。这可以解释为低强度的超声波能够起到空化效应,即类似于机械搅拌的作用。能够促进目标物质迅速地转移到溶剂中来。而过高的功率可能是引起了大蒜素这种不稳定物质的降解。
2.1.4 超声温度对大蒜素收率的影响

图7 超声温度对大蒜素收率的影响Fig.7 Effect of ultrasonic temperature on the yield of allicin
由图7可知超声温度对大蒜素收率的影响情况。随着超声温度的提高,大蒜素收率出现较小幅度的增加,大约在36 ℃附近出现最佳临界温度。之后再升高温度大蒜素收率出现下降的趋势,当达到某一温度时这种趋势变得越大越明显。这可能是适宜的温度能让目标分子更加活跃,以致大量转移到溶剂中去。而过高的温度显然不适于大蒜素分子的稳定,而发生降解为小分子的情况。
2.2 响应面试验结果分析
2.2.1 数据分析
根据单因素试验结果,对酶解温度、酶解时间、超声功率和超声温度进行四因素三水平的响应面优化试验。借助Design-Expert 8.0.6软件进行分析,获得大蒜素最佳提取工艺条件,结果见表2。

表2 响应面分析和结果Table 2 Response surface analysis and results
方差分析结果显示:模型(P=0.0026)显著,失拟项(P=0.1406)不显著。一次项中酶解温度(P=0.0018)、超声功率(P=0.0107)和超声温度(P=0.0031)为显著水平。二次项中酶解温度(P=0.0004)和超声温度(P=0.0009)为极显著水平,酶解时间(P=0.001)和超声功率(P=0.001)为显著水平。交互项中酶解温度与酶解时间(P=0.0099)以及酶解温度与超声温度(P=0.0068)为显著水平。其他项均为不显著水平。进一步分析发现,各因素对大蒜素收率的影响的显著性顺序是:酶解温度>超声温度>超声功率>酶解时间。
以大蒜素收率作为响应值Y(mg/g),酶解温度(A)、酶解时间(B)、超声功率(C)和超声温度(D)为因素。经过二次回归拟合得到一个四元二次回归方程:
Y=3.00-0.019A-0.027B+0.026C-0.11D+0.023AB+0.00875AC-0.00825AD-0.058BC+0.12BD-0.05CD-0.19A2-0.17B2-0.17C2-0.17D2。
根据回归方程得到大蒜素提取最佳工艺条件为酶解温度35.49 ℃、酶解时间31.09 min、超声功率49.49 W和超声温度28.60 ℃。在此条件下大蒜素收率预测值能够达到3.024 mg/g。我们从实际出发,把各因素数值校正为酶解温度35 ℃、酶解时间31 min、超声功率49 W和超声温度29 ℃后。用此条件进行3次重复的验证试验,获得大蒜素收率均值为3.018 mg/g,说明预测值与实际值具有较好的拟合性,同时也证明了回归模型的可靠性。
2.2.2 交互作用的响应面图分析
为了直观明显地展现4个因素对大蒜素收率的交互作用,使用Design-Expert 8.0.6软件对其中的每2个因素做出响应曲面图,见图8。


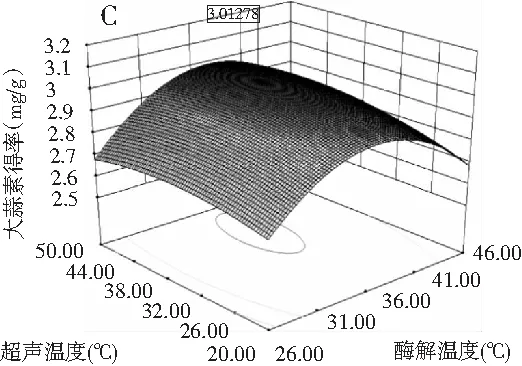


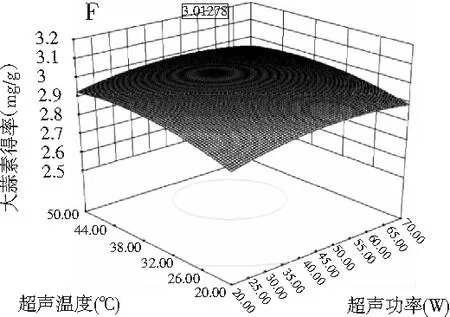
图8 两因素交互作用对大蒜素收率影响的响应曲面图Fig.8 The response surface map of the effect of two factors on the yield of allicin
注:A为酶解温度与酶解时间的交互作用;B为酶解温度与超声功率的交互作用;C为酶解温度与超声温度的交互作用;D为酶解时间与超声功率的交互作用;E为酶解时间与超声温度的交互作用;F为超声功率与超声温度的交互作用。
图8中A,C显示曲面比较陡峭,说明酶解温度和酶解时间以及酶解温度和超声温度的交互作用明显。相反,B,D,E,F的曲面表现较平缓,其他各项之间的交互作用不明显。
3 讨论
大蒜是一种极普遍的食药两用的植物,所含的大蒜素是评价其药用价值的重要指标。通过对其前体物质蒜氨酸的生物合成途径的研究,以及掌握酶解反应条件下大蒜素的生成方式,可以从分子水平揭示提取大蒜素所要注意的关键性条件。本实验通过对大蒜素提取的4个因素进行考察,借助Box-Benhnken软件设计方法,最后确定了酶解温度、超声功率和超声温度对大蒜素提取具有显著作用。通过拟合方程计算确定出大蒜素提取的最佳工艺参数:酶解温度35 ℃、酶解时间31 min、超声功率49 W和超声温度29 ℃。在此参数条件下大蒜素收率预测值达到3.024 mg/g,验证值为3.018 mg/g,很好地说明了模型的高拟合度。
[1]Barry S,Kendler.Garlic (Alliumsativum) and onion (Alliumcepa): a review of their relationship to cardiovascular disease[J].Preventive Medicine,1987,16(5):670-685.
[2]Kleijnen J,Knipschild P,Teriet G.Garlic,onions and cardiovascular risk factors: a review of the evidence from human experiments with emphasis on commercially available preparations[J].Br J Clin Pharmac,1989,28(8):535-544.
[3]Prakash S,Biseni,Mila Emeraid.Nutritional and therapeutic potential of garlic and onion (Alliumsp.)[J].Current Nutrition & Food Science,2016,12(14):190-199.
[4]Tariq H,Abduiiah.Garlic revisited: terapeutic for the major disease of our times[J].Journal of the National Medical Associationa,1989,80(4):439-445.
[5]Elnima E I,Ahmed S A,Mekkawi A G.The antimicrobial activity of garlic and onion extracts[J].Pharmazie,1983,38(11):747-748.
[6]Kallash C,Agarwal.Therapeutic actions of garlic constituents[J].Medicinal Research Reviews,1996,16(1):111-124.
[7]蒋淑婉,李云,陈鹤.大蒜素的抗肿瘤作用及其机制研究进展[J].医学综述,2014,19(8):1420-1422.
[8]Eduardo.Antitumoral activity of allicin from garlic[J].Boletn Vatinoamericanoy del Caribe de Plantas Medicinales Aromticas,2011,10(5):423-428.
[9]许真,严永,哲卢钢.葱属蔬菜植物风味前体物质的合成途径及调节机制[J].细胞生物学杂志,2007,29(8):508-512.
[10]Larry L,Christopher G.Composition,stability,and bioavailability of garlic products used in a clinical trial[J].Agric.Food Chem.,2005,53(7):6254-6261.
[11]Daynea R,Catherine D,Lynsey D.Garlic revisited: antimicrobial activity of allicin-containing garlic extracts against burkholderia cepacia complex[J].Plos One,2014,10(9):1371-1384.
[12]韩贵芝,王文军,王芳.高效液相色谱法测定大蒜中大蒜素的含量[J].安徽农业科技,2016,44(7):57-58.
[13]Fujisawa H,Suma K,Origuchi K.Biological and chemical stability of garlic-derived allicin[J].Agric.Food Chem.,2008,56(4):4229-4235.
