酿酒酵母发酵制备蒜氨酸的工艺研究
2022-12-05戴慧敏王立三涂媛蔡俊
戴慧敏,王立三,涂媛,蔡俊*
(1.湖北工业大学 工业发酵湖北省协同创新中心 工业微生物湖北省重点实验室 发酵工程教育部重点实验室,武汉 430068;2.劝农生态农业公司,湖北 恩施 444324)
蒜氨酸,化学名为S-烯丙基-L-半胱氨酸亚砜,是一种存在于百合科葱属植物鳞茎中的较稳定的非蛋白质类含硫氨基酸。高纯度的蒜氨酸是无臭无味的白色晶体,易溶于水但不溶于乙醇[1-3]。现代科学表明,蒜氨酸有降低胆固醇、预防肥胖、抗肿瘤和抗癌等功能[4-8],与肌苷酸或葡萄糖反应后的分离物具有烤肉味和蒜香味[9],可以被广泛应用于调味品的生产。此外,蒜氨酸对多种微生物尤其是食品腐败菌的生长有极强的抑制作用,并且对人体无毒害[10-13],是国内外均认可的食品添加剂[14]。因此,蒜氨酸既可作为良好的食品防腐剂来延长果蔬的保鲜期[15-16],也可以被开发成一种高效的药物制剂,具有很好的应用前景。
目前蒜氨酸的生产方法主要包括化学合成法[17-19]、组织培养法[20-21]和从植物中提取。化学合成法得率高,但是由于原料中的烯丙基溴具有强毒性,对人体和环境会造成较大的危害,反应收率低,后处理麻烦,并且化学合成会产生两种立体异构体L-(+)蒜氨酸和L-(-)蒜氨酸,而天然蒜氨酸仅以L-(+)形式存在,因此限制了它的应用范围。从植物中提取包括水提醇沉法和有机溶剂提取法,水提醇沉法的工艺不够成熟,而有机溶剂存在潜在的毒性,并且蒜酶的存在会导致蒜氨酸的分解,给蒜氨酸的提取造成了一定的难度,进一步增加了成本[22-24],因此开发绿色安全的生物法生产蒜氨酸势在必行。
植物体内的蒜氨酸是在半胱氨酸合成酶的作用下,由丝氨酸与乙酰辅酶A结合生成 O-乙酰丝氨酸后,与烯丙基硫醇结合生成 S-烯丙基-L-半胱氨酸,再氧化 S-烯丙基-L-半胱氨酸形成[25]。在微生物体内,丝氨酸乙酰转移酶(SAT)和O-乙酰丝氨酸(硫醇)裂解酶(OASS)共同组成酶复合体,即半胱氨酸合成酶。微生物也能利用半胱氨酸合成酶将环境中的无机硫还原成S2-,进入到半胱氨酸的合成中。而OASS能利用半胱氨酸生物合成体系,以亲核试剂和硫醇代替各种S2-合成非蛋白质氨基酸[26-27]。目前已有研究报道了利用大肠杆菌中重组表达的OASS合成药物中间体S-苯基-L-半胱氨酸及L-α-丙氨酸[28],为利用OASS在微生物体内合成蒜氨酸提供了参考。
本研究以烯丙基硫醇为底物,从实验室保藏的19种酵母菌株中,筛选出一株S-烯丙基-L-半胱氨酸产量较高的酿酒酵母CCCG,研究了温度、初始pH、接种量、装液量、摇瓶转速、烯丙基硫醇添加量等发酵条件对酿酒酵母产S-烯丙基-L-半胱氨酸含量的影响,通过单因素试验和正交试验,经酿酒酵母的发酵及H2O2的氧化得到蒜氨酸的最佳发酵条件,为生物法合成蒜氨酸提供了新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验室保藏酿酒酵母菌株:CGY2、CGY、CCCG、CLS、CCY、CHY、CBY、CGWY、CEPY、CKY、CMY、CRY、BDYD、JYYJS、JYYR、JYFI、GAQ1、GAQ2、
GAQ4。
1.1.2 试剂
葡萄糖、蛋白胨、酵母浸粉、硫酸铵、磷酸二氢钾、硫酸镁:国药集团化学试剂有限公司;甲醇(色谱纯):美国Fisher Scientific公司;蒜氨酸标准品(纯度≥98%):上海源叶生物科技有限公司;S-烯丙基-L-半胱氨酸标准品(纯度≥98%)、烯丙基硫醇(分析纯):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
斜面培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,琼脂20 g/L,pH 6.0,在115 ℃下灭菌30 min。
种子培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,pH 6.0,在115 ℃下灭菌30 min。
发酵培养基:葡萄糖20 g/L,酵母粉10 g/L,(NH4)2SO48 g/L,KH2PO43 g/L,MgSO40.15 g/L,pH 6.0,在115 ℃下灭菌30 min。
1.2 仪器与设备
LD-20AD高效液相色谱系统(配有SPD-20A紫外检测器) 日本岛津公司;质谱引导的高通量自动纯化系统(配有电喷雾离子源(ESI)) 沃特世科技(上海)有限公司;WH-2微型漩涡混合仪 上海沪西分析仪器厂有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 菌种筛选
分别将活化的菌种接种到发酵培养基中,接种量为10%,转速为180 r/min,在30 ℃培养12 h后,加入烯丙基硫醇,继续培养19 h。由于S-烯丙基-L-半胱氨酸经过H2O2的氧化后即为蒜氨酸,因此先筛选出能产生S-烯丙基-L-半胱氨酸的菌株。培养结束取样处理后,利用HPLC测定其中S-烯丙基-L-半胱氨酸的含量,而后在经过处理的样品中加入30% H2O2,持续搅拌24 h后测定其中蒜氨酸的含量[29-30],筛选出S-烯丙基-L-半胱氨酸和蒜氨酸产量较高的菌株,并利用质谱法进一步验证所筛选的菌株具有产S-烯丙基-L-半胱氨酸的能力。
1.3.2 样品处理
水分含量测定:菌悬液经8000 r/min离心去上清液,无菌水清洗菌体3次,称取湿菌体重量M1,置于65 ℃烘箱中烘干至恒重,称取干菌体重量M2。

(1)
式中:M1为湿菌体的重量,g/L;M2为干菌体的重量,g/L。
破壁提取胞内S-烯丙基-L-半胱氨酸:菌悬液经8000 r/min离心去上清液,无菌水洗涤3次,称取菌体湿重,重悬湿菌体定容至恒定体积。定容后取适量菌悬液稀释,于血球计数板计数,取3次平行计数结果。采用超声破壁法,设定功率为300 W,于冰浴条件下超声破碎30 min(设定工作1 s,间隔1 s)[31- 32],取适量破壁后的菌悬液稀释,于血球计数板计数,取3次平行计数结果。
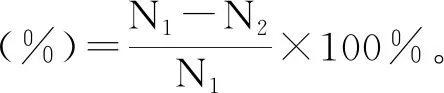
(2)
式中:N1为破壁前细胞数;N2为破壁后细胞数。
胞内S-烯丙基-L-半胱氨酸含量测定:破壁后的菌悬液经8000 r/min离心取上清液,将上清液用微滤膜(0.22 μm)过膜后利用高效液相色谱法计算得到提取液中S-烯丙基-L-半胱氨酸的浓度,最后计算得到每克干细胞中S-烯丙基-L-半胱氨酸的含量。
S-烯丙基-L-半胱氨酸干重产量(mg/g)=
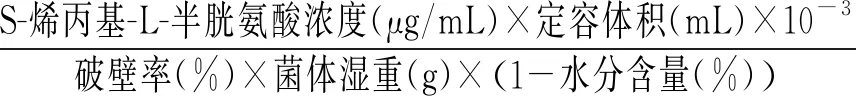
(3)
1.3.3 S-烯丙基-L-半胱氨酸和蒜氨酸的定量和定性分析
1.3.3.1 S-烯丙基-L-半胱氨酸和蒜氨酸的定量分析
色谱条件:色谱柱Inertsil ODS SP C18(4.6 mm×150 mm, 5 μm);流动相甲醇∶甲酸水溶液为5∶95(体积比);紫外检测波长220 nm;柱温30 ℃,流速0.8 mL/min,进样量20 μL。
1.3.3.2 标准曲线绘制
分别配制浓度为200,400,600,800,1000 μg/mL的S-烯丙基-L-半胱氨酸标准溶液和蒜氨酸标准溶液。以不同的S-烯丙基-L-半胱氨酸和蒜氨酸标准溶液浓度为横坐标,以HPLC法测定的峰面积数值为纵坐标,绘图得到S-烯丙基-L-半胱氨酸和蒜氨酸标准曲线。
1.3.3.3 S-烯丙基-L-半胱氨酸和蒜氨酸的定性分析
质谱条件:离子方式:电喷雾正离子化(ESI+);毛细管电压3.5 kV;锥孔电压25 V;离子源温度100 ℃;脱溶剂气温度300 ℃;质量扫描范围100~200 m/z;选择性离子检测(SIM)162 m/z和 178 m/z。
1.3.4 单因素试验设计优化发酵条件
通过单因素试验改变发酵条件,分别考察烯丙基硫醇添加量、初始pH、温度、摇瓶转速、接种量、装液量对S-烯丙基-L-半胱氨酸产量的影响,单因素试验设计表见表1,按照每个因素分别进行试验研究。
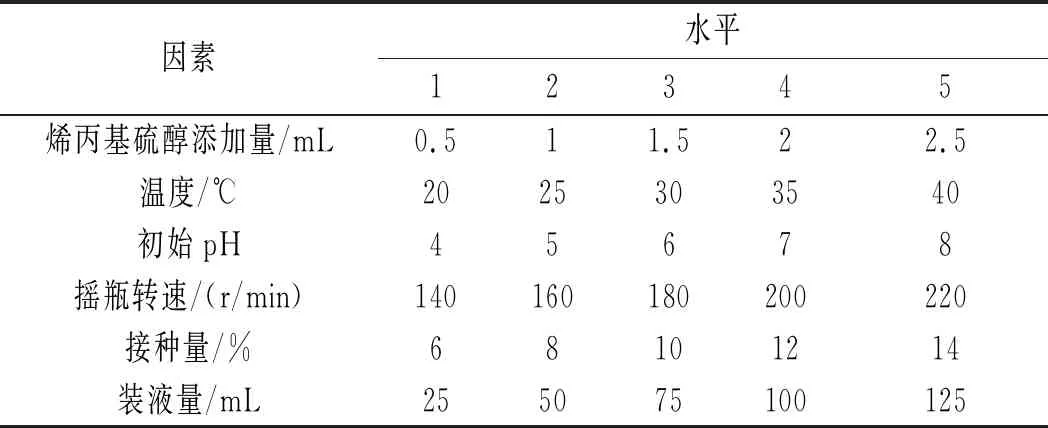
表1 单因素不同水平试验设计表Table 1 Single factor test design at different levels
1.3.5 正交试验设计优化发酵条件
在单因素试验的基础上,采用七因素三水平,通过正交试验L18(37)选取最优发酵条件,因素水平设计表见表2。
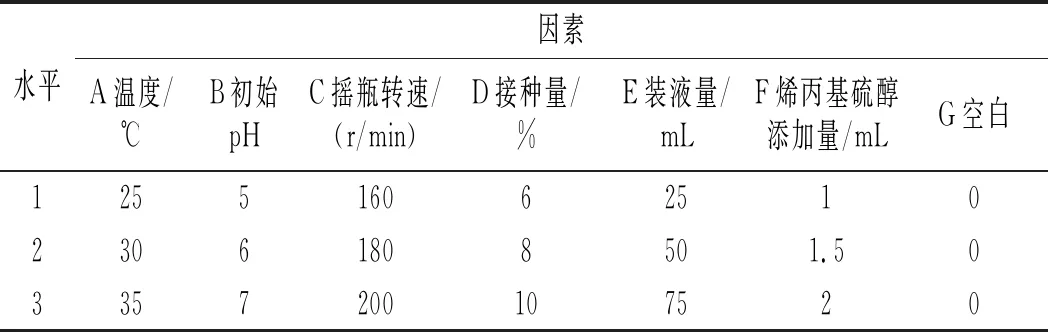
表2 正交试验因素水平表Table 2 The factors and levels of orthogonal test
2 结果与分析
2.1 高效液相色谱法测定S-烯丙基-L-半胱氨酸和蒜氨酸的标准曲线回归方程
按照1.3.3.1中的方法,在200 μg/mL~1 mg/mL范围内,进样量与其峰面积均呈良好的线性关系,S-烯丙基-L-半胱氨酸的回归方程为:Y=5496.3X-44949(R2=0.9997),蒜氨酸的回归方程为:Y=7232.5X+39674(R2=0.9998)。
2.2 高产S-烯丙基-L-半胱氨酸的菌株的筛选
通过高效液相色谱法测定15种酵母细胞合成S-烯丙基-L-半胱氨酸的产量,结果表明有10种酵母菌株具有利用烯丙基硫醇合成S-烯丙基-L-半胱氨酸的能力,在产S-烯丙基-L-半胱氨酸的菌株中,有两株酵母干重产量超过50 mg/g DCW,分别为酵母CCCG和酵母BDYD,干重产量分别为(52.35±0.86) mg/g DCW和(50.16±1.00) mg/g DCW;通过对两种菌株重复验证试验发现,酵母CCCG合成S-烯丙基-L-半胱氨酸的干重产量明显高于酵母BDYD,因此选择酿酒酵母CCCG作为发酵制备蒜氨酸的菌株。
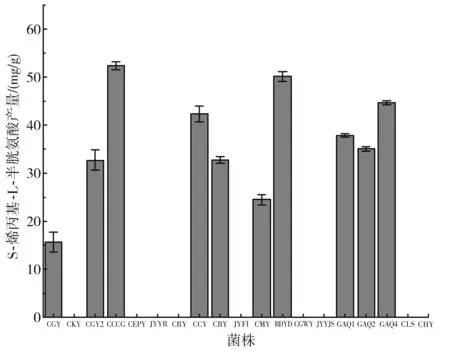
图1 不同酵母菌株S-烯丙基-L-半胱氨酸产量Fig.1 S-allyl-L-cysteine yield of different Saccharomyces cerevisiae strains
2.3 S-烯丙基-L-半胱氨酸及蒜氨酸的定性分析
对S-烯丙基-L-半胱氨酸标品、酵母CCCG的细胞破碎液、蒜氨酸标品及酵母CCCG的细胞破碎液经双氧水处理后的样品分别进行ESI-MS分析,进一步验证S-烯丙基-L-半胱氨酸和蒜氨酸的生成,试验结果见图2和图3。
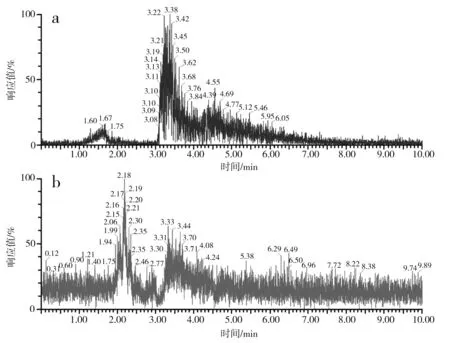
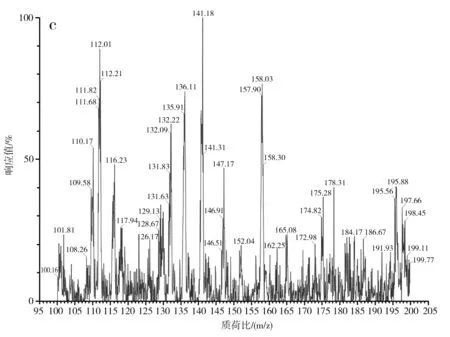
图2 S-烯丙基-L-半胱氨酸电喷雾电离源-质谱图Fig.2 ESI-MS of S-allyl-L-cysteine
由图2中a和b可知,S-烯丙基-L-半胱氨酸标品和酵母CCCG的细胞破碎液的准分子离子流图均在3.42 min左右出峰。由图2中c可知,酵母CCCG的细胞破碎液在3.42 min处出现m/z=162.25,为S-烯丙基-L-半胱氨酸的准分子离子[M+H]+,因此确定酵母CCCG具有合成S-烯丙基-L-半胱氨酸的能力。
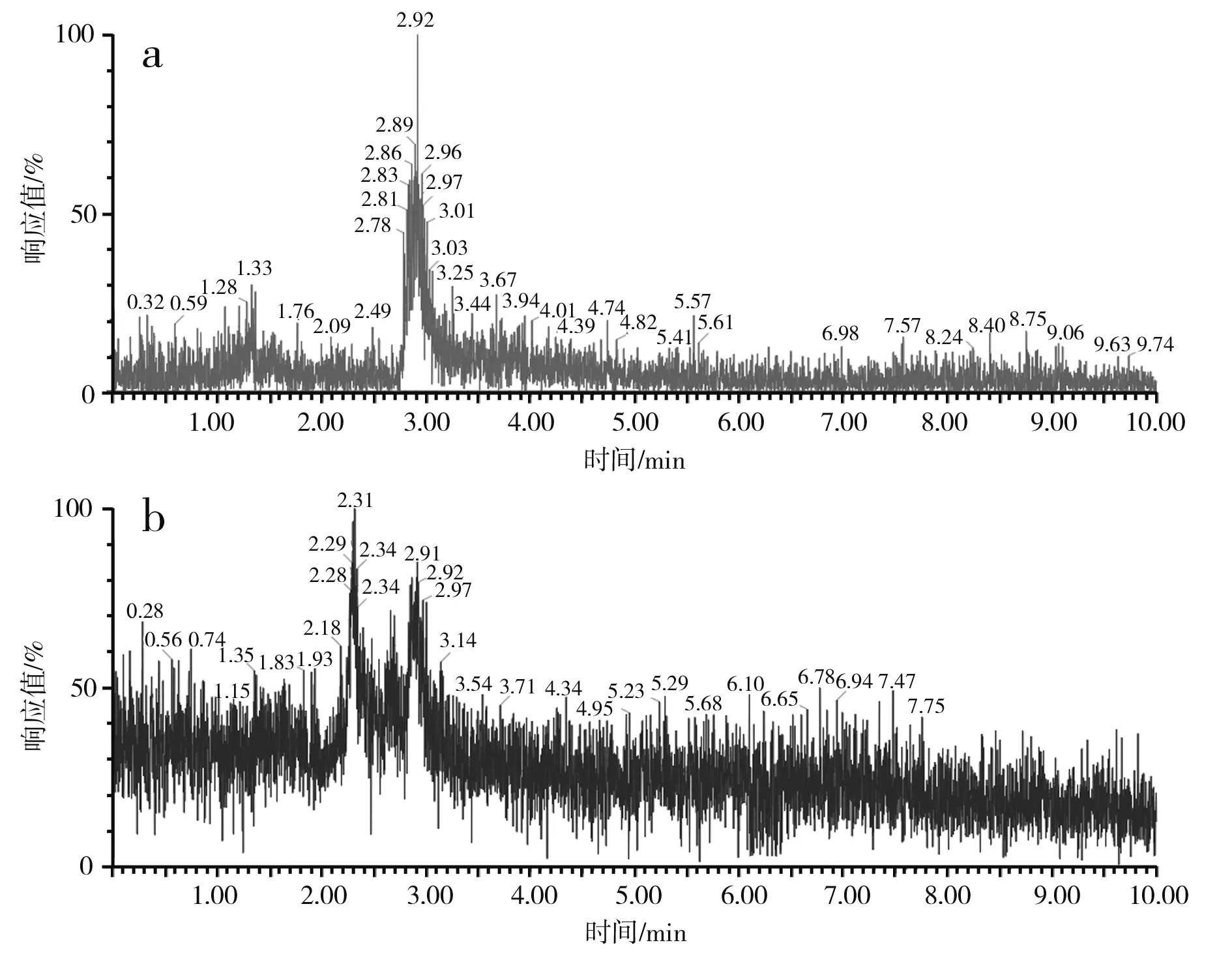
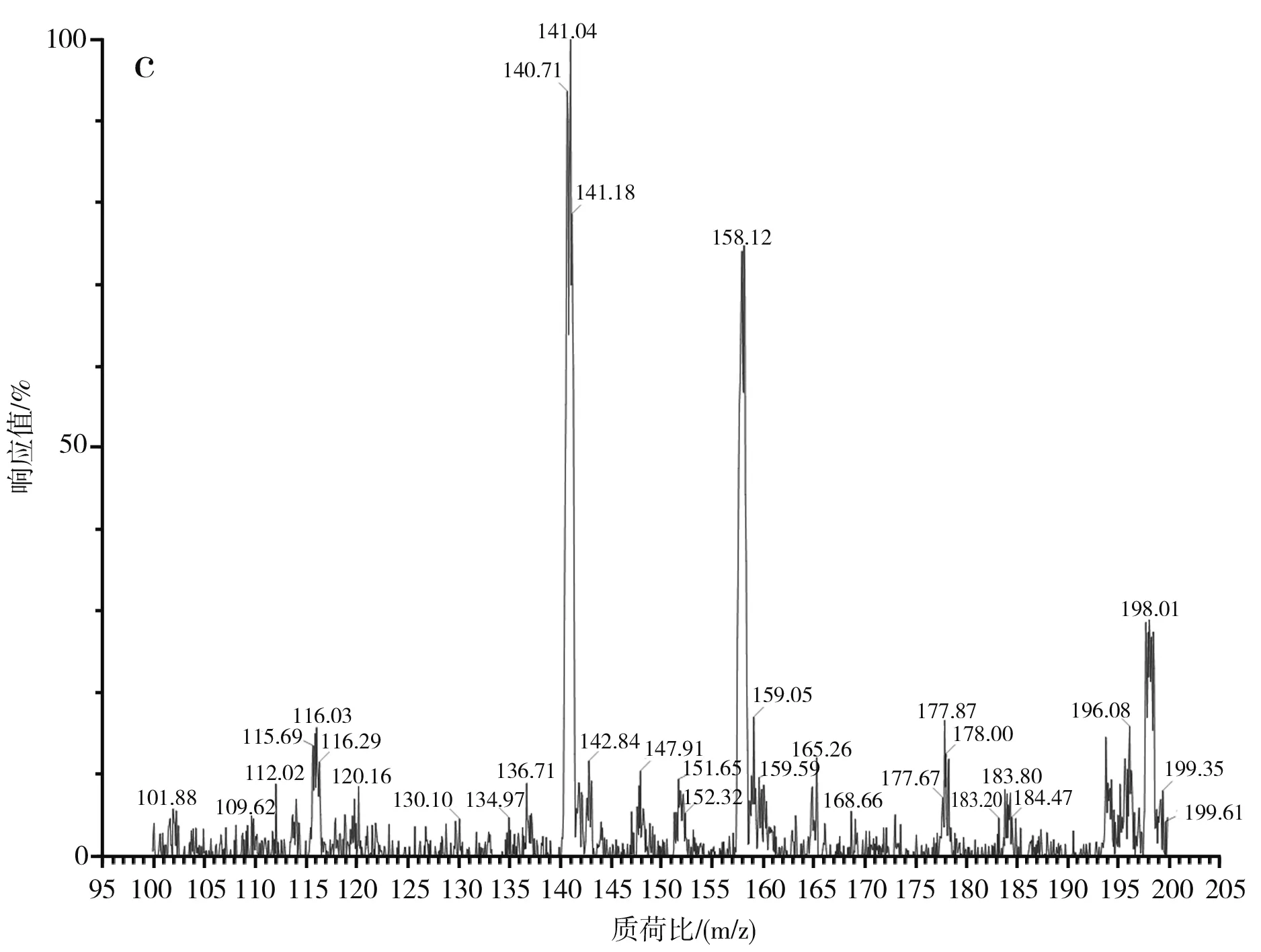
图3 蒜氨酸电喷雾电离源-质谱图Fig.3 ESI-MS of alliin
由图3中a和b可知,蒜氨酸标品和酵母CCCG的细胞破碎液经H2O2处理后的准分子离子流图均在2.88 min左右出峰。由图3中c可知,酵母CCCG的细胞破碎液经H2O2处理后的样品在2.887 min处出现m/z=178.00,为蒜氨酸的准分子离子[M+H]+,确定了产物蒜氨酸的生成。
2.4 发酵条件对S-烯丙基-L-半胱氨酸产量的影响
不同发酵条件对S-烯丙基-L-半胱氨酸产量的影响见图4 。
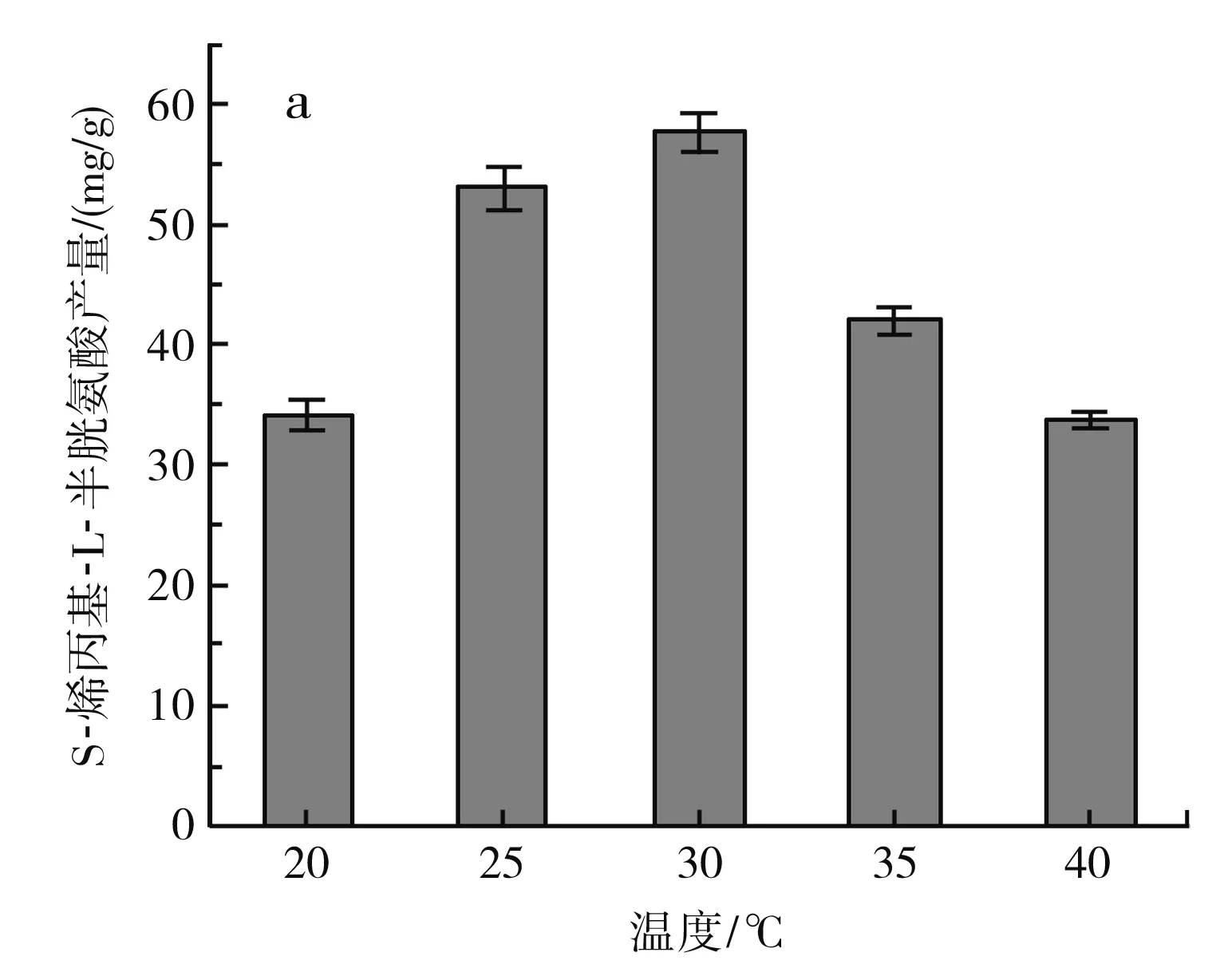
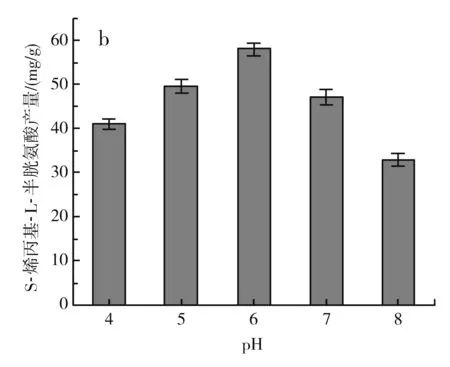
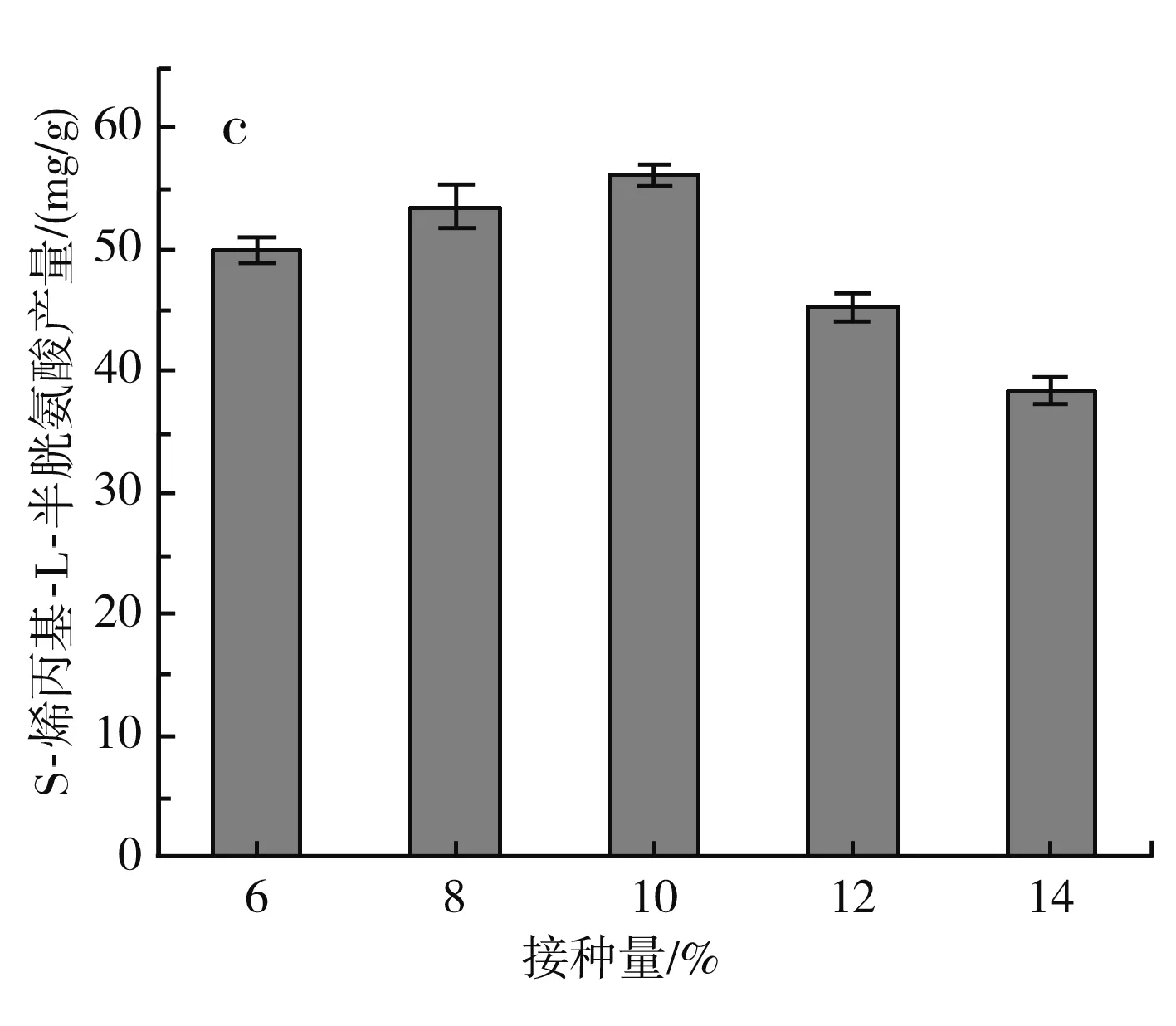
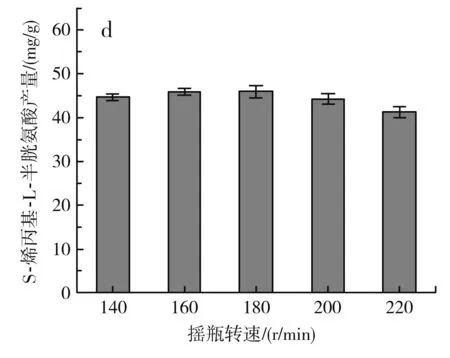
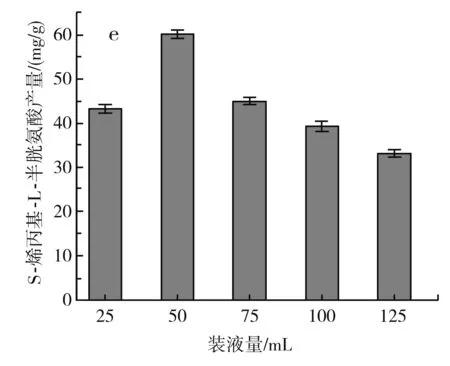
图4 不同发酵条件对S-烯丙基-L-半胱氨酸干重产量的影响Fig.4 Effect of different fermentation conditions on dry weight yield of S-allyl-L-cysteine
由图4中a可知,温度在20~30 ℃时,S-烯丙基-L-半胱氨酸的产量随着温度的升高而增加,在30 ℃时达到最大,为(57.7±1.65) mg/g DCW,但发酵温度继续升高,S-烯丙基-L-半胱氨酸的产量下降,可能是由于温度过高,发酵过程中添加的一部分烯丙基硫醇未反应就已经分解,从而降低了S-烯丙基-L-半胱氨酸的产量。
由图4中b可知,当pH在4~6之间时,S-烯丙基-L-半胱氨酸的产量逐渐增加,当pH为6时,S-烯丙基-L-半胱氨酸的产量达到最大,约为(58±1.44) mg/g DCW,pH继续升高,S-烯丙基-L-半胱氨酸的产量下降,可能是由于pH过高影响了酵母的生长,从而影响了S-烯丙基-L-半胱氨酸的产量。
由图4中c可知,当接种量在6%~10%之间时,S-烯丙基-L-半胱氨酸的产量随着接种量的增加而增加,当接种量为10%时,S-烯丙基-L-半胱氨酸的产量达到最大,为(56.2±0.89) mg/g DCW,当接种量继续增大时,S-烯丙基-L-半胱氨酸的产量减少,可能是因为接种量较少时,菌体的对数生长期会延长,导致处于生长繁殖期的菌体的发酵能力较差,S-烯丙基-L-半胱氨酸的合成不够,接种量较大时,发酵时间缩短,降低了S-烯丙基-L-半胱氨酸的产量,因此选取接种量10%为最佳。
由图4中d可知,摇瓶转速在140~180 r/min时,S-烯丙基-L-半胱氨酸的产量逐渐增加,当摇瓶转速继续增加时,S-烯丙基-L-半胱氨酸的产量下降,故确定最佳摇瓶转速为180 r/min。
由图4中e可知,装液量在25~50 mL之间时,S-烯丙基-L-半胱氨酸的产量逐渐增加,当装液量在50 mL时,S-烯丙基-L-半胱氨酸的产量最大,为(60.2±0.9) mg/g DCW,装液量继续增加,S-烯丙基-L-半胱氨酸的产量下降,因此确定最佳装液量为50 mL。
2.5 烯丙基硫醇添加量对S-烯丙基-L-半胱氨酸产量的影响
由图5可知,当烯丙基硫醇添加量在0.5~1.5 mL之间时,S-烯丙基-L-半胱氨酸的产量随着烯丙基硫醇添加量的增加而增加,当烯丙基硫醇添加量为1.5 mL时,S-烯丙基-L-半胱氨酸的产量达到最大,为(53.6±1.43) mg/g DCW,可能是由于烯丙基硫醇添加量过大时,会影响菌体的生长,从而导致S-烯丙基-L-半胱氨酸的产量下降,因此确定最佳的烯丙基硫醇添加量为1.5 mL。
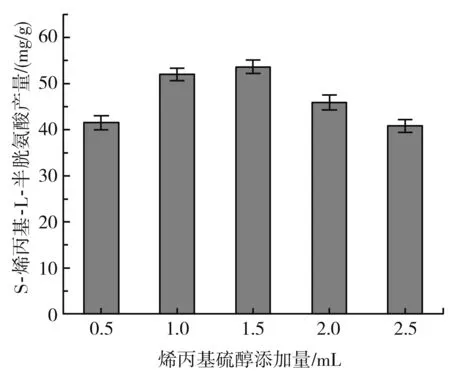
图5 烯丙基硫醇添加量对S-烯丙基-L-半胱氨酸干重产量的影响Fig.5 Effects of allyl mercaptan addition amount on dry weight yield of S-allyl-L-cysteine
2.6 正交试验结果及分析
正交试验结果分析见表3。
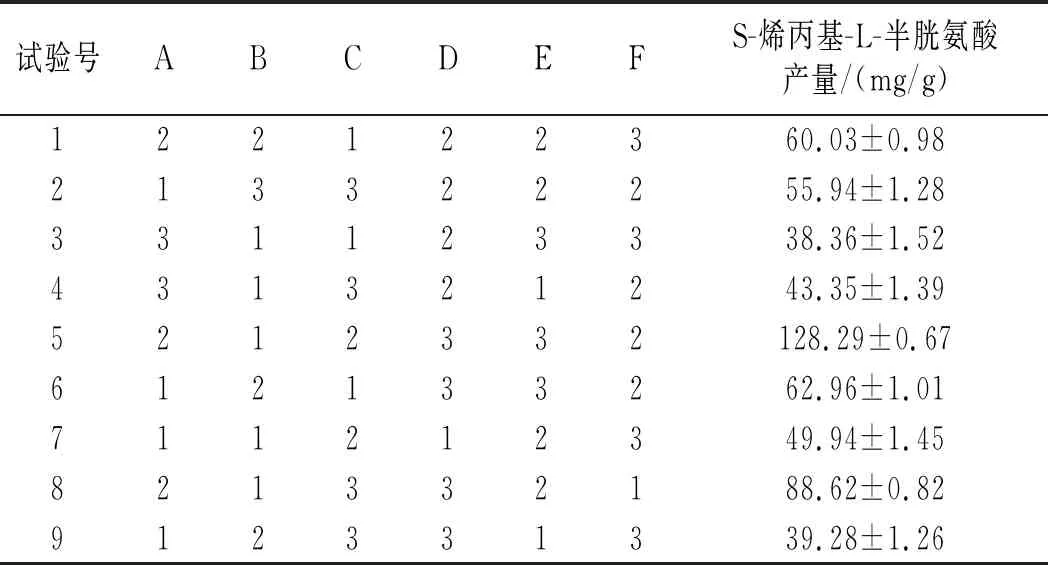
表3 L18(37)正交试验设计及结果Table 3 L18(37) orthogonal test design and results
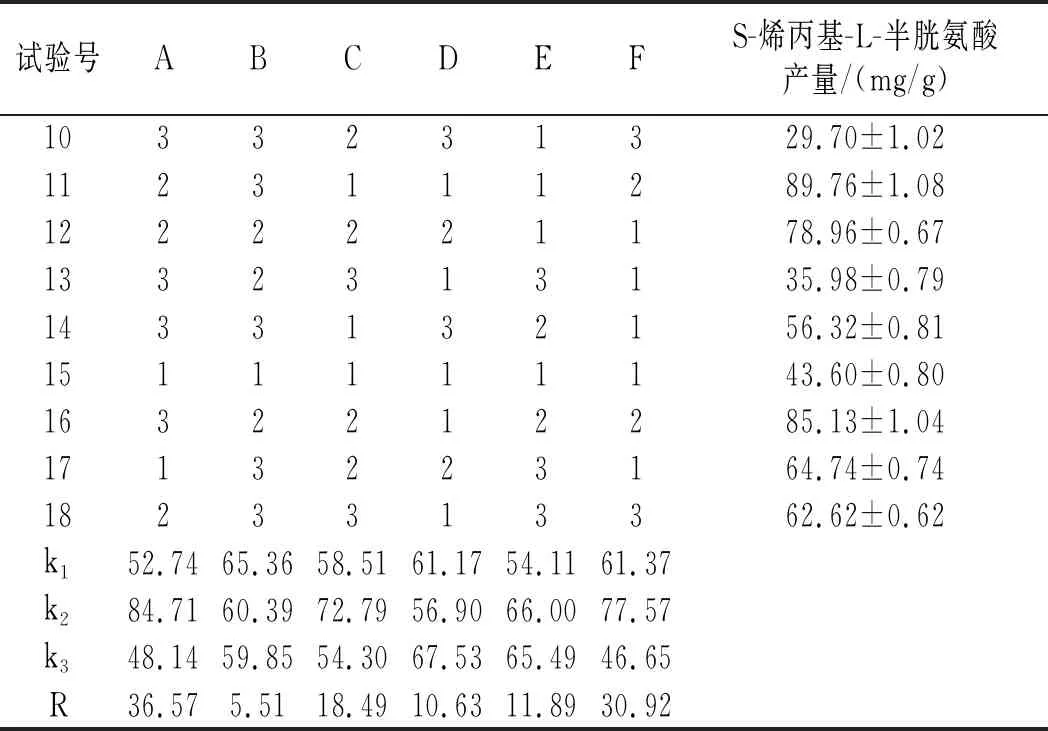
续 表
由表3可知,6个因素的影响程度由高到低为温度>烯丙基硫醇添加量>摇瓶转速>装液量>接种量>初始pH,最优水平组合为A2F2C2E2D3B1,正交试验方差分析结果见表4。
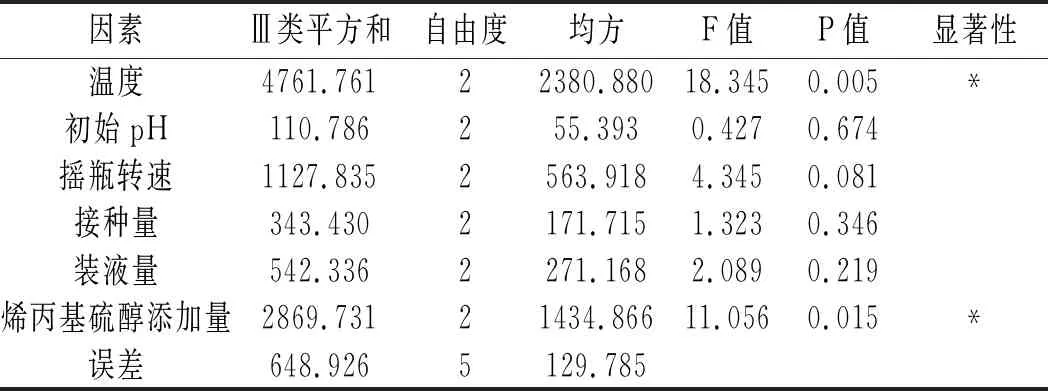
表4 正交试验方差分析结果Table 4 The variance analysis results of orthogonal test
由表4可知,温度和烯丙基硫醇添加量均为显著因素,其中温度的显著性大于烯丙基硫醇添加量的显著性,正交试验R2=0.938,说明试验中有93.8%的数据可信。
2.7 正交验证试验
对S-烯丙基-L-半胱氨酸标品、经试验验证最优组合得到的酵母细胞CCCG的细胞破碎液、蒜氨酸标品及细胞破碎液经双氧水处理后的样品分别进行HPLC分析,试验结果见图6和图7。
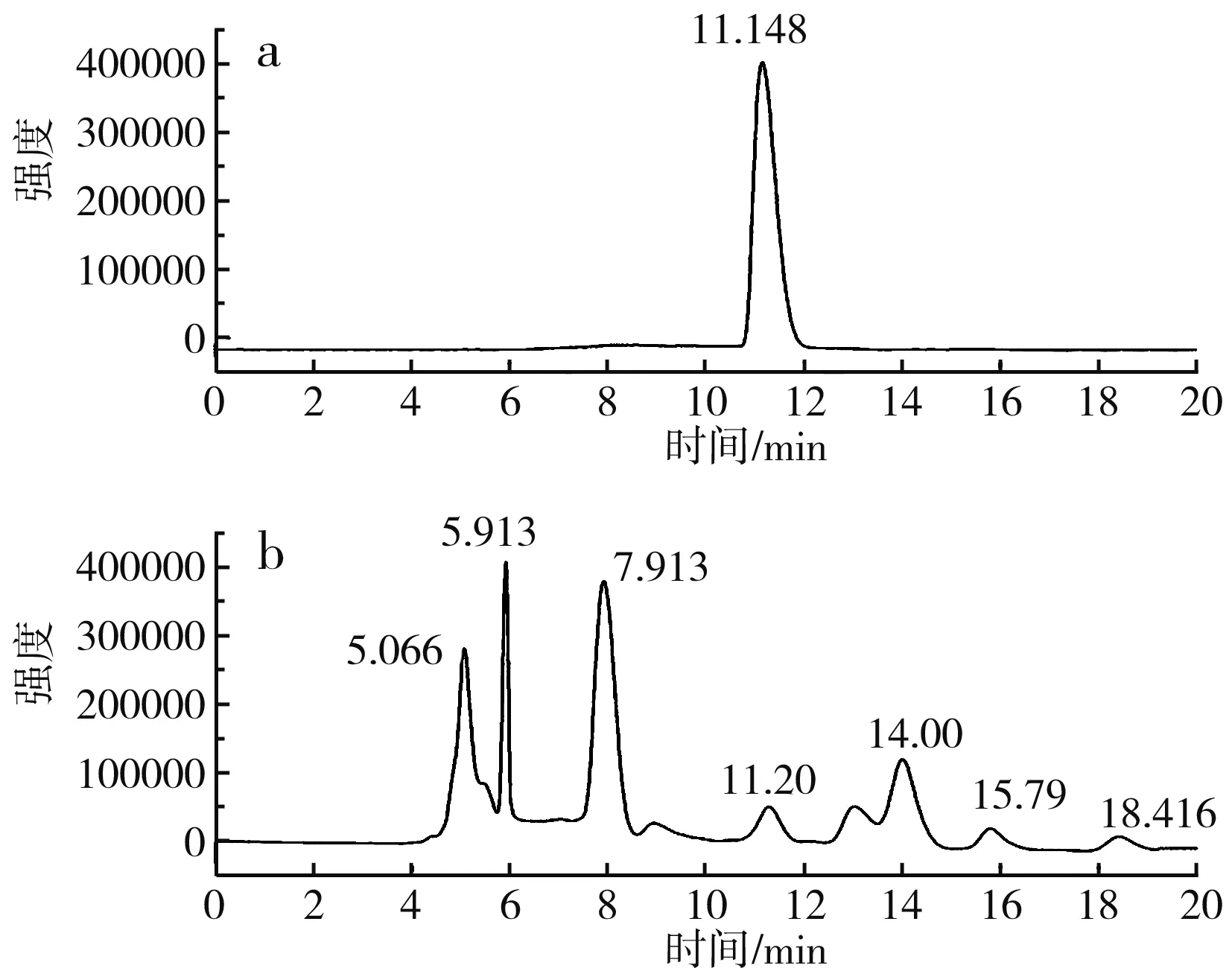
图6 S-烯丙基-L-半胱氨酸高效液相色谱图Fig.6 HPLC of S-allyl-L-cysteine
由图6可知,S-烯丙基-L-半胱氨酸标品的出峰时间为11.148 min,细胞破碎液在11.20 min出峰,与标品出峰时间相近,证明有产物S-烯丙基-L-半胱氨酸的生成。
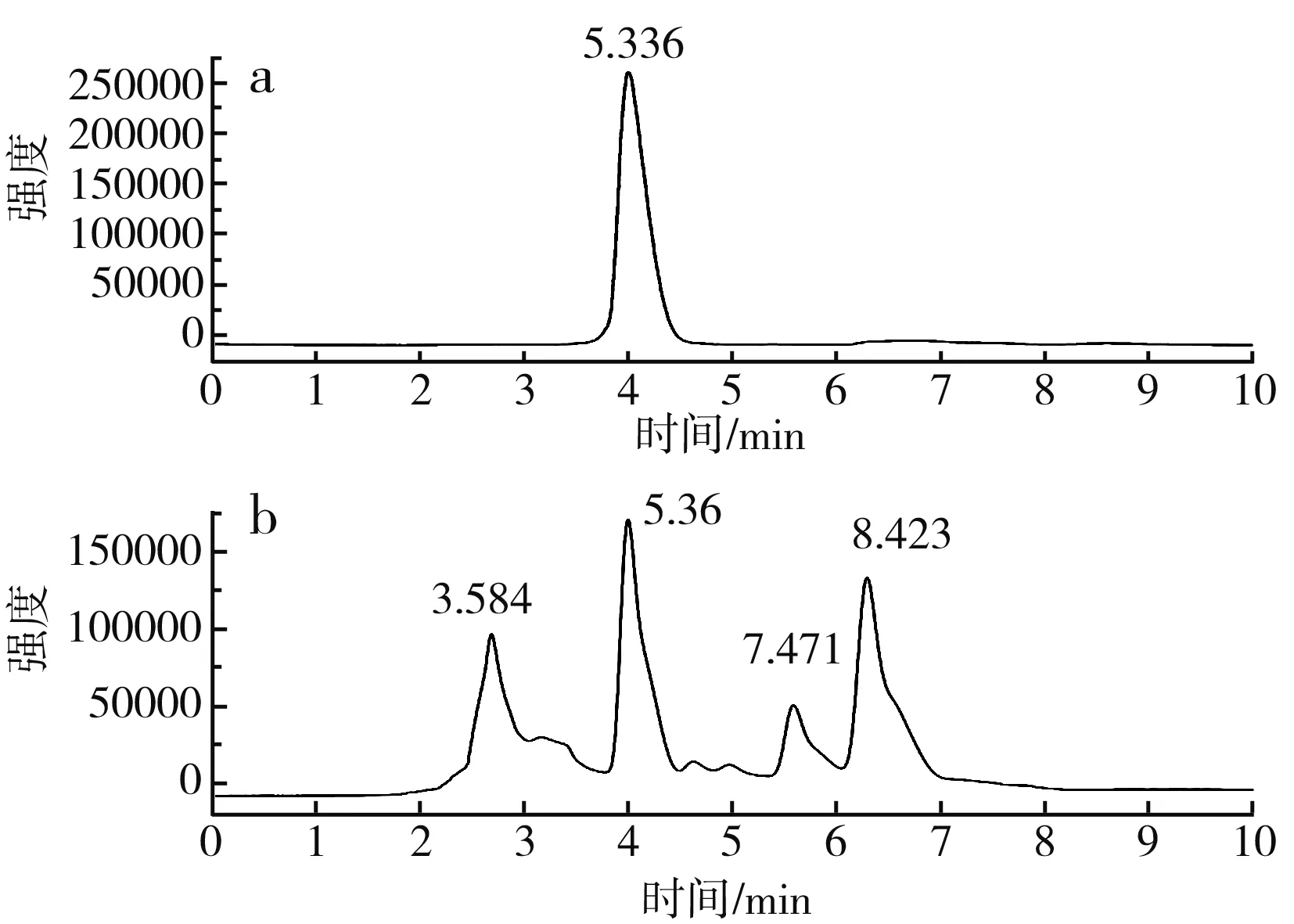
图7 蒜氨酸高效液相色谱图Fig.7 HPLC of alliin
由图7可知,蒜氨酸标品的出峰时间为5.336 min,细胞破碎液在5.36 min出峰,与标品出峰时间相近,证明有产物蒜氨酸的生成。
经方差分析得到的最优组合为A2B1C2D3E2F2,经试验验证最优组合的S-烯丙基-L-半胱氨酸干重产量为(136.01±0.88) mg/g DCW,正交试验中最佳组合A2B1C2D3E3F2的试验结果为(128.29±0.67) mg/g DCW,经H2O2氧化后得蒜氨酸的干重产量为(68.281±0.93) mg/g DCW。综合k值和正交试验方差分析结果可知,利用酿酒酵母产蒜氨酸的最优发酵条件为A2B1C2D3E2F2,即培养温度为30 ℃,初始pH为5,摇瓶转速为180 r/min,接种量为10%,装液量为50 mL/250 mL,烯丙基硫醇添加量为1.5 mL。
3 结论
蒜氨酸作为一种天然活性物质,性质稳定、生物活性高且安全无毒,其受热分解能产生多种具有特殊风味和生物活性的含硫化合物[33]。酵母作为国际上公认的安全的食品级微生物,其抽提物也是一种纯天然和营养的食品辅料[34-35]。因此,利用酿酒酵母发酵制备蒜氨酸在天然植物防腐保鲜剂、食品调味剂、保健品等方面具有极大的应用潜力。
本研究以烯丙基硫醇为底物,从19种酵母中筛选出能产生S-烯丙基-L-半胱氨酸的菌株,并通过H2O2的氧化作用,产生蒜氨酸,通过ESI-MS和HPLC法验证了产物的生成。通过单因素和正交试验对产S-烯丙基-L-半胱氨酸的发酵条件进行了优化,得最优发酵条件为发酵时间19 h,发酵温度30 ℃,接种量10%,初始pH 5,摇瓶转速180 r/min,装液量50 mL/250 mL,烯丙基硫醇添加量1.5 mL,在此条件下,经H2O2的氧化作用,蒜氨酸的干重产量为(68.281±0.93) mg/g DCW,比优化前提高了1.96倍。本研究利用蒜氨酸在植物体内的生物合成途径,以烯丙基硫醇为底物,作用于酿酒酵母CCCG的相关代谢途径中,实现了蒜氨酸的生物合成,为生物法合成蒜氨酸的研究提供了数据参考。后续研究将从代谢途径的调控入手,通过补料分批发酵提高底物的利用率以及由底物烯丙基硫醇直接发酵合成蒜氨酸;寻找替代外加H2O2氧化的方法,以期提高S-烯丙基-L-半胱氨酸转化为蒜氨酸的转化率,进一步优化生物法合成蒜氨酸的工艺。
