乳酸菌发酵产维生素B1和B6的研究
2018-03-06常若毅吕嘉枥余芳
常若毅,吕嘉枥,余芳
(陕西科技大学 食品与生物工程学院,西安 710021)
维生素是动物体和人类生命活动所必需的一类物质,当机体从外界摄取的维生素不能满足其生命活动的需要时,就会引起新陈代谢功能的紊乱,导致生病甚至死亡[1]。维生素B1和维生素B6作为食品添加剂,同时又是营养强化剂,在调味品行业有着广泛的应用[2]。
国内在乳酸菌产B族维生素方面的研究有报道,其中邓丽、李龙柱、肖平等[3-5]研究表明定植于肠道中的益生菌能产生VB1,VB2,VB6等各种维生素;张开屏、李俊芳等[6,7]筛选鉴定了保加利亚乳杆菌、嗜酸乳杆菌、植物乳杆菌等乳酸菌发酵产VB6和VB12,其中VB6可达32.62 g/100 L。国外Le Blanc等[8]研究发现乳酸乳球菌、嗜热链球菌、嗜酸性乳酸等为发酵剂时,增加了叶酸和视黄醇的产量;Hou等[9]研究表明双歧杆菌、嗜热链球菌ST5、瑞士乳酸杆菌R0052为发酵剂时,提高了维生素B1的含量; Champagne等[10]研究发现
乳酸菌发酵豆奶,维生素B1或B6含量没有明显变化。
本文研究的是乳酸菌代谢产维生素。试验选用10株乳酸菌分别在MRS肉汤培养基、鲜牛乳培养基和蔬菜汁培养基中培养,研究它们在发酵过程中B1和B6的产量。对B族维生素进行粗提等一系列操作,进一步为复合维生素的食品添加剂和营养强化剂的研制提供理论和技术依据。
1 实验材料和方法
1.1 供试菌种
保加利亚乳杆菌(Lactobacillusbulgaricus,LB)、嗜酸乳杆菌(Lactobacillusacidophilus,LA)、植物乳杆菌(Lactobacillusplantarum,LP)、乳双歧杆菌(Bifidobacteriumlactis,BL)、鼠李糖乳杆菌(Lactobacillusrhamnosus,LCR)、副干酪乳杆菌(Lactobacillusparacasei,LCP)、粪链球菌 (Streptococcusfaecalis,SF)、嗜热链球菌 (Streptococcusthermophilus,ST)、干酪乳杆菌 (Lactobacilluscasei,LC)、罗伊氏乳杆菌 (Lactobacillusreuteri,LR),由陕西科技大学食品与生物工程学院微生物研究室提供。
1.2 试验原料
油麦菜、莴笋、芹菜、荸荠、菊芋,市售;鲜牛乳,市售,鲜牛乳符合国家标准[11]。
1.3 试剂药品
甲醇(色谱纯)、VB1标准品(色谱纯)、VB6标准品(色谱纯)、磷酸二氢钾(分析纯)、盐酸(分析纯)、氢氧化钠(分析纯)。
1.4 培养基配制
1.4.1 MRS液体培养基
牛肉膏 10 g,磷酸氢二钾 2 g,蛋白胨 10 g,乙酸钠 5 g,葡萄糖 20 g,柠檬酸二铵 2 g,酵母浸粉 5 g,七水硫酸镁 0.58 g,硫酸锰 0.25 g,吐温-80 1 mL,蒸馏水 1000 mL。
1.4.2 鲜牛乳培养基
将鲜牛乳分装入厌氧管中,每管装15 mL左右,置于高压灭菌锅中灭菌,115 ℃灭菌15 min,冷却至室温。
1.4.3 蔬菜培养基
分别选取5种蔬菜,除去杂物,彻底清洗干净,使蔬菜和水的比例是2∶1,用打浆机榨汁,过100目筛,115 ℃灭菌15 min,备用。
1.5 仪器设备
1525-2487型高效液相色谱仪 美国Waters公司;DM750型LEICA数码显微镜 北京瑞科中仪科技有限公司;QSX-280B型手提式压力蒸汽灭菌器 上海申安医疗器械厂;PHS-3C型pH计 北京赛多利斯天平有限公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;SW-CJ-1D型单人净化工作台 苏州净化设备有限公司;DH-360型电热恒温培养箱 北京科伟永兴仪器有限公司。
1.6 实验内容及方法
1.6.1 菌种活化
将MRS液体培养基分装入厌氧管中,每管装15 mL左右,置于高压灭菌锅中灭菌121 ℃,15 min,冷却至室温。然后接入菌种,置于37 ℃恒温培养箱中培养24 h。将火化后的菌种放于4 ℃冰箱中保存备用。
1.6.2 10株乳酸菌在MRS培养基中产VB1和VB6的研究
10株乳酸菌按1%的接种量接种到MRS液体培养基中,在37 ℃条件下静置培养48 h时,离心,取上清液,测定VB1和VB6含量。
1.6.3 10株乳酸菌发酵鲜乳产VB1和VB6的研究
10株乳酸按1%的接种量接种到鲜牛乳培养基中,在37 ℃下静置培养至凝乳,离心,取上清液,测定VB1和VB6含量。
1.6.4 10株乳酸菌发酵不同蔬菜产VB1和VB6的研究
10株乳酸菌按1%的接种量接种到不同的蔬菜中,在37 ℃下静置培养48 h,离心,取上清液,进行测定VB1和VB6含量。
1.7 VB1和VB6测定方法
VB1和VB6的测定采用高效液相色谱法[12]。
1.7.1 标准储备液的制备
准确称取VB1和VB6标准品各0.010 g于10 mL容量瓶中,用0.1 mol/L盐酸溶解并定容至刻度,配成质量浓度均为1 g/L的VB1和VB6标准储备液。
1.7.2 色谱条件
色谱柱:C18(配有紫外检测器),流动相:0.05 mol/L KH2PO4(pH 6.0)-甲醇(体积比85∶15),流速:1.0 mL/min,柱温:30 ℃,波长:265 nm,进样量:20 μL。
1.7.3 标准曲线的绘制
分别配制质量浓度为10~50 mg/L的2种维生素标准溶液,在b所述的条件下进样测定,得到2种维生素的峰面积A与质量浓度C(mg/L)的线性关系。
1.7.4 样品处理
取5 mL发酵液,并加入40 mL的0.1 mol/L盐酸超声混合均匀。再用0.1 mol/L盐酸定容至50 mL,超声混匀后,静置,离心后取上清液,获得VB1和VB6的提取液,提取液过0.45 μm水系滤膜后上机测定。
1.7.5 标准品图谱
VB1和VB6标准品在上述色谱条件下进样测定,记录色谱图。

图1 50 mg/L VB1标准品溶液的高效液相色谱图
图2 50 mg/L VB6标准品溶液的高效液相色谱图
由图1和图2可知,在上述色谱条件下VB1的保留时间为2.804 min。VB6的保留时间为5.088 min。取VB1和VB6的标准品储备液,分别配制10~50 mg/L质量浓度梯度的2种B族维生素标准溶液,在色谱条件下分别测定,选取以B族维生素浓度C(mg/L)为横坐标、以峰面积A为纵坐标线性回归,获得回归方程,见表1。
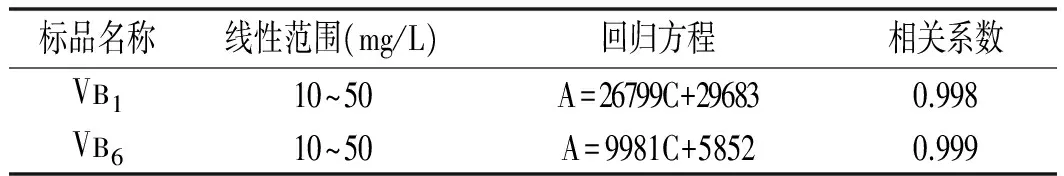
表1 VB1和VB6 的线性回归方程、相关系数、线性范围
1.7.6 VB1和VB6混标谱图

图3 VB1和VB6混合标准液高效液相色谱图
2 结果与讨论
2.1 10株乳酸菌发酵MRS培养基VB1和VB6含量
以10株乳酸菌为发酵菌种,接种到MRS培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图4。

图4 10株乳酸菌发酵MRS培养基 VB1和VB6的含量
由图4可知,10株乳酸菌发酵MRS培养基均产生VB1和VB6。其中,10株乳酸菌发酵液中VB1浓度在1.02~2.37 mg/L之间,VB6浓度在0.35~5.32 mg/L之间。ST发酵产VB1最大,为2.37 mg/L;LA发酵产VB6最大,为5.32 mg/L。
2.2 10株乳酸菌发酵乳VB1和VB6含量
以10株乳酸菌为发酵菌种,接种到鲜乳培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图5。

图5 10株乳酸菌发酵乳VB1和VB6的含量
由图5可知,10株乳酸菌发酵乳中均产生VB1和VB6。其中,发酵乳中VB1浓度在0.32~1.38 mg/L之间,VB6浓度在0.56~2.85 mg/L之间。LC发酵乳中VB1含量最高,为1.38 mg/L;LB发酵乳中VB6含量最高,为2.85 mg/L;10株菌在牛乳中发酵VB1产量小于在MRS培养基中发酵,LB,BL,ST,SF在牛乳中发酵VB6产量高于在MRS培养基中发酵。
2.3 10株乳酸菌发酵蔬菜VB1和VB6含量
2.3.1 10株乳酸菌发酵莴笋VB1和VB6的测定
以10株乳酸菌为发酵菌种,接种到莴笋培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图6。
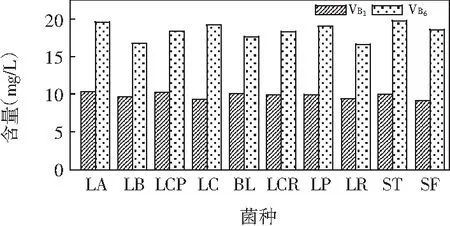
图6 10株乳酸菌发酵莴笋VB1和VB6的含量
由图6可知,10株乳酸菌发酵莴笋中均产生VB1和VB6。发酵莴笋中VB1含量在9.13~10.34 mg/L之间,VB6含量在16.56~19.78 mg/L之间。LA发酵莴笋时,VB1含量最高;ST发酵莴笋时,VB6含量最高。10株乳酸菌发酵莴笋产VB1的量基本一致。乳酸菌发酵蔬菜汁比发酵鲜牛乳和MRS培养基中维生素产量高出很多。
2.3.2 10株乳酸菌发酵芹菜VB1和VB6的测定
以10株乳酸菌为发酵菌种,接种到芹菜培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图7。

图7 10株乳酸菌发酵芹菜VB1和VB6的含量
由图7可知,10株乳酸菌发酵芹菜中均产生VB1和VB6。10株乳酸菌发酵芹菜时,VB1含量在8.43~9.75 mg/L,VB6含量在13.78~17.39 mg/L。LCR发酵芹菜汁VB1含量最大;LA发酵芹菜汁VB6含量最大。10株乳酸菌发酵芹菜产VB1的量基本一致。乳酸菌发酵芹菜VB1,VB6含量都低于发酵莴笋VB1,VB6含量。
2.3.3 10株乳酸菌发酵油麦菜VB1和VB6的测定
以10株乳酸菌为发酵菌种,接种到油麦菜培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图8。
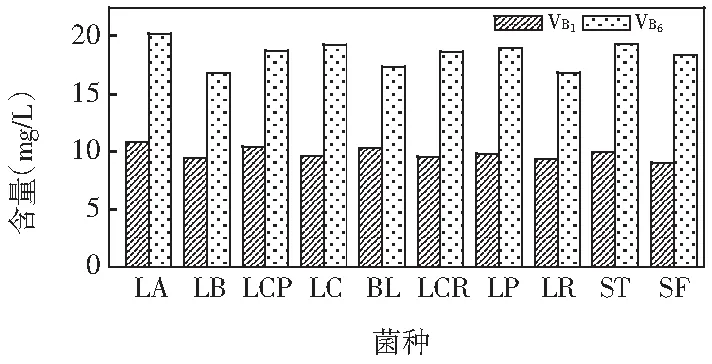
图8 10株乳酸菌发酵油麦菜VB1和VB6的含量
由图8可知,10株乳酸菌发酵油麦菜中均产生VB1和VB6。10株乳酸菌发酵油麦菜时,VB1含量在9.04~10.89 mg/L之间,VB6含量在16.72~20.31 mg/L之间。LA发酵油麦菜上清液中VB1,VB6含量都最大。10株菌发酵油麦菜VB6产量大于发酵芹菜的产量。除了菌种LCR,其余菌株发酵油麦菜产VB1的量均高于在芹菜中发酵的产量。
2.3.4 10株乳酸菌发酵荸荠VB1和VB6的测定
以10株乳酸菌为发酵菌种,接种到荸荠培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图9。
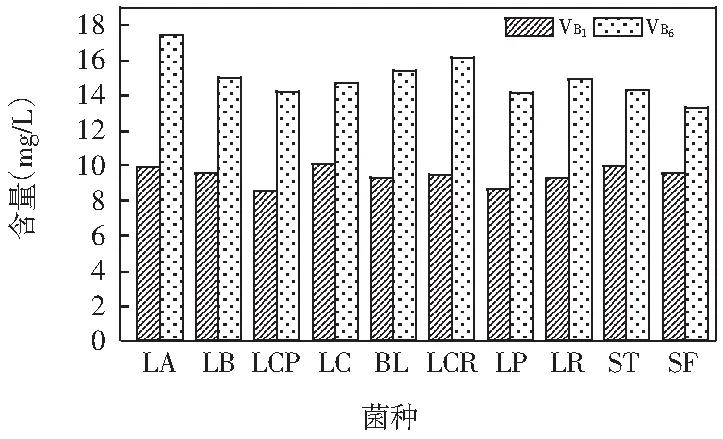
图9 10株乳酸菌发酵荸荠VB1和VB6的含量
由图9可知,10株乳酸菌发酵荸荠中均产生VB1和VB6。VB1含量在8.56~10.11 mg/L之间,VB6含量在13.28~17.44 mg/L之间。LC发酵荸荠时VB1含量最高;LA发酵荸荠时VB6含量最高。
2.3.5 10株乳酸菌发酵菊芋VB1和VB6的测定
以10株乳酸菌为发酵菌种,接种到菊芋培养基中发酵48 h后分别测定 VB1和VB6的含量,结果见图10。

图10 10株乳酸菌发酵菊芋VB1和VB6的含量
由图10可知,10株乳酸菌发酵菊芋均产生VB1和VB6。VB1含量在8.56~9.98 mg/L之间,VB6含量在13.43~17.87 mg/L之间。LA菌株发酵菊芋时,VB1和VB6都最高。LB,LC,ST,SF,LCR,LR在菊芋中发酵VB1的产量低于在荸荠中发酵的产量,ST,LCR,LR在菊芋中发酵VB6的产量低于在荸荠中发酵的产量,其余菌株VB6的产量高于在荸荠中发酵的产量。
3 结论
10株乳酸菌发酵MRS培养基、鲜牛乳和5种蔬菜均产生VB1和VB6。10株乳酸菌在MRS培养基中的维生素B1含量在1.02~2.37 mg/L,维生素B6含量在0.35~5.32 mg/L;在发酵乳中的维生素B1的含量在0.32~1.38 mg/L,维生素B6含量在0.56~2.85 mg/L;在不同的发酵蔬菜汁中维生素B1的含量在8.43~10.89 mg/L,维生素B6的含量在13.28~20.31 mg/L。乳酸菌发酵蔬菜VB1和VB6的产量大于发酵MRS培养基和发酵乳的维生素产量。
[1]邢亚东.营养素补充剂类保健食品中维生素类成分检测方法研究[D].合肥:安徽中医药大学,2015.
[2]姚继承,陈来胜.调味品行业现状与发展趋势分析(Ⅱ)[J].中国调味品,2011,36(5):24-33.
[3]邓丽,芮汉明.益生菌的研究进展[J].现代食品科技,2003,19(s1):84-87.
[4]李龙柱,张富新,马婷婷,等.乳制品中益生菌研究进展[J].农产品加工(学刊),2013(20):37-39.
[5]肖平,吕嘉枥,沈文.益生菌的保健功能及其在食品中的应用概述[J].食品科技,2009(10):23-26.
[6]张开屏,田建军,刘静.产维生素B6乳酸菌的筛选及其鉴定[J].中国乳品工业,2013,41(6):23-26.
[7]李俊芳.产维生素B乳酸菌的筛选及生物学特性的研究[D].呼和浩特:内蒙古农业大学,2007.
[8]Jean G L,María P T,Verónica M,et al.B-group vitamins production by probiotic lactic acid bacteria[M].New Jersey: John Wiley & Sons,2010:211-232.
[9]Hou J W,Yu R C,Chou C C.Changes in some components of soymilk during fermentation withBifidobacteria[J].Food Research International,2000,33(5):393-397.
[10]Champagne C P,Tompkins T A,Buckley N D,et al.Effect of fermentation by pure and mixed cultures ofStreptococcusthermophilus,andLactobacillushelveticus,on isoflavone and B-vitamin content of a fermented soy beverage[J].Food Microbiology,2010,27(7):968-972.
[11]GB 19301-2010,生乳[S].
[12]申烨华,张萍,孔祥虹,等.高效液相色谱法同时测定扁桃仁中的水溶性维生素C,B1,B2,B6[J].色谱,2005,23(5):538-541.
