RNA干扰沉默同源异型基因A5逆转K562/ADM细胞耐药性的研究*
2018-03-05高菲刘文君
高菲,刘文君
(西南医科大学附属医院 儿科,四川 泸州 646000)
白血病(leukemia)是一类造血干细胞异常的恶性克隆性疾病,是儿童最常见的恶性肿瘤,严重危害儿童的健康[1-2],其治疗主要是以化疗为主的综合性治疗,而耐药已成为白血病治疗的一大阻碍。研究发现,同源盒(homeobox,HOX)基因的过表达可使细胞分化成熟障碍、造血能力降低,最终可导致造血系统恶性肿瘤的发生和发展[3-4]。作为HOX基因家族中的一员,HOXA5定位于7号染色体(7p15.2),其表达主要局限在粒-单核细胞系。据报道,HOXA5基因与肿瘤的耐药性有关,但其作用机制不清[5]。近年来研究发现信号通路异常与白血病的发生、发展及其多重耐药密切相关,其中p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号转导通路异常是白血病耐药的重要机制之一[6-9],其主要参与细胞的活化、生长及凋亡。研究表明HOX基因与p38MAPK信号转导通路的活化存在相关性[10]。因此,我们推测HOXA5基因可能通过p38MAPK通路逆转K562/ADM的耐药性。
RNA干扰(RNA interferene,RNAi)技术是双链RNA(double strand RNA,dsRNA)介导的序列特异性转录后引起同向靶基因表达沉默,具有快速、特异、高效等优点[11]。本实验建立在前期设计并合成3条针对HOXA5的特异性有效siRNA序列,并通过相关检测方法筛选出对HOXA5表达抑制效率最佳的1条siRNA序列的基础上[12-13],通过RNAi技术沉默HOXA5,探讨p38MAPK信号通路在耐药白血病细胞中的作用,为耐药白血病的靶向治疗提供理论依据。
1 材料与方法
1.1 材料与试剂
人白血病耐阿霉素细胞株K562/ADM细胞(购自上海信裕生物科技有限公司),阿霉素(购自浙江海正药业股份有限工司),RPMI 1640培养液和胎牛血清(购自美国Hyclone公司),二甲基亚砜(DMSO)(购自美国Sigma公司),100 u/ml青霉素和0.1 mg/ml链霉素双抗、总RNA提取试剂盒、CCK8及辣根过氧化物酶标记山羊抗兔二抗(购自碧云天公司),逆转录试剂盒及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒(购自日本ToYoBo公司),Annexin V-PE/7-AAD细胞凋亡检测试剂盒及细胞周期检测试剂盒(购自南京凯基生物科技有限公司),脂质体LipofectamineTM2000(购自美国Invitrogen公司),靶向HOXA5的siRNA序列、阴性对照siRNA序列(杭州艾迪康公司合成),兔抗人HOXA5多克隆抗体一抗(购自英国Abcam公司),兔抗人p38MAPK及p-p38MAPK多克隆抗体一抗(购自美国CST公司)。
1.2 细胞培养
将K562/ADM细胞悬浮于含有10%胎牛血清、100 u/ml青霉素和0.1 mg/ml链霉素双抗、1 000 ng/ml阿霉素完全培养基中并接种在培养瓶,置于5%二氧化碳CO2的37℃饱和湿度的培养箱中连续培养。每2天更换1次培养液并传代,实验前细胞用无ADM的完全培养基培养2周,取对数生长期的细胞进行后续实验。
1.3 实验方法
1.3.1 细胞的实验分组及转染 实验先分为K562细胞及K562/ADM细胞组。然后以本课题组前期实验为基础对K562/ADM细胞进行转染后再分为3组:实验组(pRNAT-GFP-Neo-siHOXA5),阴性对照组(pRNAT-GFP-Neo-siNC),空白对照组(未作任何处理的K562/ADM)。本课题组前期设计并合成3条针对HOXA5的特异性有效siRNA序列,并筛选出对HOXA5抑制率最高的1条序列,正向:5'-TTGCGGTCGCTATCCAAATGG-3',反向:5'-CCATT TGGATAGCGACCGCAA-3'[12-13]。根据此序列合成靶向抑制HOXA5的特异性真核表达载体pRNAT-GFPNeo-siHOXA5,并设计合成阴性对照载体pRNATGFP-Neo-siNC。转染时调整细胞浓度为3×107个/ml接种于6孔板内,按LipofectamineTM2000说明书将脂质体与表达载体在无血清无抗生素培养基中混合配成转染液转染K562/ADM细胞。优化转染条件,实验独立重复3次。收集上述各组细胞进行后续实验。
1.3.2 CCK-8检测 CCK-8实验采用的ADM的干预浓度依次为1.25、2.50、5.00、10.00、20.00及40.00 μg/ml。分别收集上述各组细胞,经不同浓度的ADM干预后调整细胞浓度为1×105个/ml,用微量移液器吸取100 μl细胞悬液加入96孔板中,同时设置对照组和空白调零组,每组设3个复孔,每孔再加10 μl的CCK-8溶液,放入CO2培养箱内作用2 h,在450 nm处用酶标仪测量各孔的OD值。求得均值计算细胞增殖抑制率,增殖抑制率=(OD对照组-OD实验组)/(OD对照组-OD空白组)×100%。IC50=Ig-1[Xm-i(∑p-0.5)]。耐药逆转倍数=对照IC50/实验IC50。
1.3.3 qRT-PCR检测各组细胞中HOXA5及P38的mRNA表达 收集上述各组细胞,用总RNA提取试剂盒提取总RNA,逆转录为cDNA,荧光定量PCR法扩增目的基因和内参照基因人GAPDH。HOXA5、p38及GAPDH引物扩增片段长度分别为140、130及262 bp,各引物的序列见表1。荧光定量PCR反应条件:95℃预变性60 s;95℃变性15 s,60℃退火15 s,72℃延伸45 s,共40个循环。数据运用公式RQ=2-△△Ct的方法进行分析,由此表示目的基因mRNA的相对表达水平。

表1 HOXA5、p38及GAPDH引物序列
1.3.4 Western blot检测各组细胞中HOXA5、p38及p-p38的蛋白表达 分别收集上述各组细胞,按照全蛋白提取试剂盒说明书提取细胞全蛋白。BCA法测蛋白浓度,根据蛋白浓度取等量蛋白,加5×SDS上样缓冲液煮沸5 min,进行SDS-PAGE电泳后将蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST封闭2 h,经 TBST 充分漂洗(5 min,3次),HOXA5、p38及 p-p38多克隆抗体均按1∶1 000稀释。4℃孵育过夜,充分漂洗后加山羊抗兔二抗按照1∶3 000稀释,室温27℃孵育1 h,ECL发光显影。通过Gel-Pro annalyzer软件分析图像,以HOXA5、p38及p-p38蛋白条带的灰度值与β-actin蛋白条带的灰度值的比值表示目的蛋白的相对表达水平。
1.3.5 Annexin V-PE/7-AAD细胞凋亡检测 取对数生长期的K562/ADM,转染24 h后,每组再分为ADM未干预组及加浓度为2.5 μg/ml的ADM干预组。用冷PBS将上述细胞组的细胞洗2次,调整细胞密度为3×105个 /ml将细胞重悬于 50 μl的 Binding Buffer,并加入5 μl 7-AAD,室温27℃,避光染色5~15 min,然后分别加入450 μl Binding Buffer混匀,再加入1 μl Annexin V-PE,室温27℃,避光染色5~15 min,在1 h内上流式细胞仪检测细胞凋亡率。实验独立重复3次。
1.3.6 细胞周期的检测 取对数生长期的K562/ADM,转染24 h后用冷PBS将上述细胞组的细胞洗2次,调整细胞密度为1×106个/ml,取1 ml的单细胞悬液去除上清液,用70%的冷乙醇500 μl悬浮细胞4℃放置2 h或至过夜对细胞进行固定,PBS洗涤去乙醇。加入RNAase 100 μl 37℃水浴30 min。采用流式细胞仪进行DNA含量测定,结果用Multicycle software进行分析。实验独立重复3次。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,计数资料用方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜观察转染的各组细胞
用脂质体转染K562/ADM细胞24 h后,在荧光显微镜下观察各组细胞,因为转入的重组质粒载体pRNA-GFP-Neo-siHOXA5和pRNAT-GFP-Neo-siNC带绿色荧光蛋白(green fluorescent protein,GFP)基因,因此实验组和阴性对照组在荧光显微镜观察下出现绿色荧光,而空白对照组未见荧光。见图1。
2.2 ADM对各组细胞的抑制作用
ADM对各组细胞均有抑制作用,各组细胞的IC50比较,经方差分析,差异有统计学意义(F=98.325,P=0.000),实验组细胞的IC50与对照组比较降低(P<0.05)。见表 2。
2.3 细胞中HOXA5、p38的mRNA表达情况
K562/ADM细胞中HOXA5的mRNA表达高于K562细胞(P<0.05)。重组质粒转染对数生长期的K562/ADM细胞后,比较各组细胞中HOXA5 mRNA的表达量,经方差分析,差异有统计学意义(F=122.282和172.900,均P=0.000),重组质粒能抑制K562/ADM细胞中HOXA5的mRNA表达(P<0.05),同时p38的mRNA表达经方差分析,差异有统计学意义(F=152.817和34.227,均P=0.001),结果显示,实验组与对照组比较p38的mRNA表达增高(P<0.05),而阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。见表 3、4 和图 2。

图1 普通倒置相差显微镜及荧光显微镜下转染的各组K562/ADM细胞

表2 ADM作用下各组细胞IC50的变化
2.4 各组细胞中HOXA5、p38及p-p38的表达情况
Western blot检测发现,K562细胞中HOXA5蛋白的相对表达量低于K562/ADM细胞(P<0.05)。稳定转染后比较各组中HOXA5蛋白及p-p38的表达,经方差分析,差异有统计学意义(F=1722.480和115.433,均P=0.000),实验组中HOXA5蛋白被抑制(P<0.05)。实验组中p-p38的蛋白相对表达量高于对照组(P<0.05)。而阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。结果表明,siRNA能特异性沉默K562/ADM中的HOXA5基因,并使p38激活为p-p38,但对p38的蛋白表达量差异无统计学意义(F=4.153,P=0.074)。见表5和图3。
表3 HOXA5的mRNA表达 (±s)

表3 HOXA5的mRNA表达 (±s)
相对表达量(RQ=2-ΔΔCt)实验组 0.31±0.12 0.22±0.09阴性对照组 1.35±0.10 0.99±0.04空白对照组 1.37±0.06 1.00 K562 0.58±0.11 0.42±0.11 F值 122.282 172.900 P值 0.000 0.000组别 HOXA5 mRNA(目的基因/内参照基因)
表4 p38的mRNA表达 (±s)

表4 p38的mRNA表达 (±s)
相对表达量(RQ=2-ΔΔCt)实验组 1.17±0.07 3.26±0.59阴性对照组 0.38±0.06 1.06±0.29空白对照组 0.37±0.05 1.00 F值 152.817 34.227 P值 0.000 0.001组别 P38 mRNA(目的基因/内参照基因)

图2 HOXA5、p38及GAPDH的扩增产物
2.5 siRNA特异性沉默HOXA5后K562/ADM细胞的凋亡情况
比较ADM未干预及ADM干预中各组细胞的凋亡,经方差分析,差异有统计学意义(F=17.606和423.492,P=0.003和0.000)。ADM未干预及干预中实验组的凋亡率与对照组相比增高(P<0.05);ADM干预中各组细胞的凋亡率高于ADM未干预(P<0.05),而ADM干预与ADM未干预中阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。见表6和图4。
2.6 siRNA特异性沉默HOXA5后K562/ADM细胞的周期变化
各组细胞的G0/G1期和S期比较,经方差分析,差异有统计学意义(F=115.783和70.549,均P=0.000)。与对照组比较,实验组G0/G1期升高(P<0.05),而 S期降低(P<0.05)。阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。3组转染细胞的G2/M期差异无统计学意义(F=0.568,P=0.594)。见表7和图5。
表5 HOXA5、p38、p-p38的蛋白表达 (%,±s)

表5 HOXA5、p38、p-p38的蛋白表达 (%,±s)

图3 各组细胞中HOXA5、p38及p-p38的蛋白表达(Western blot)
表6 ADM干预下各组细胞的凋亡率 (%,±s)
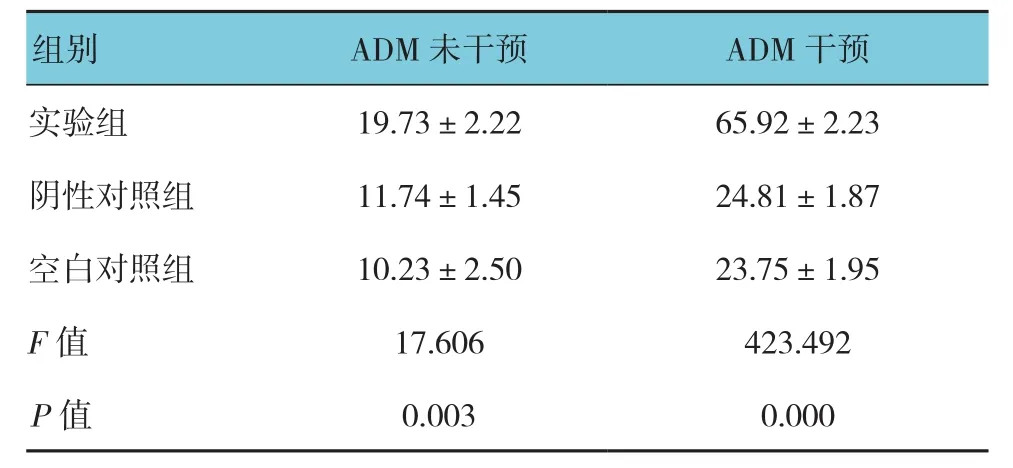
表6 ADM干预下各组细胞的凋亡率 (%,±s)
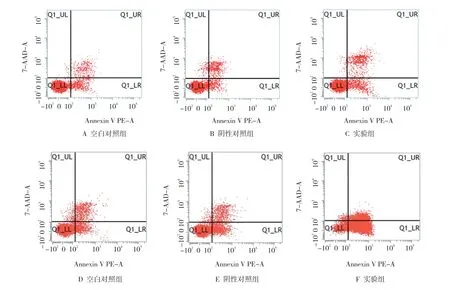
图4 细胞的凋亡情况 (FCM法)


图5 细胞周期的变化 (FCM法)
表7 沉默HOXA5后K562/ADM细胞周期的分布情况(%,±s)

表7 沉默HOXA5后K562/ADM细胞周期的分布情况(%,±s)
组别 G0/G1 G2/M S实验组 46.85±2.01 10.82±2.62 42.93±1.68阴性对照组 25.52±2.29 12.21±2.51 62.60±2.26空白对照组 27.55±1.22 11.85±3.00 60.26±2.59 F值 115.783 0.568 70.549 P值 0.000 0.594 0.000
3 讨论
哺乳动物的HOX基因在结构上分为A、B、C、D 4个簇,依次定位于7、17、12及2号染色体上,其按照线性顺序进行表达并参与造血细胞的发育调控[14]。据报道,HOX基因在许多髓系白血病样品中高表达,但是其表达的模式和相关监管机制并不清楚[15]。在MLL患者中能检测到上调的HOXA基因,HOXA异常表达是造血细胞正常分化的一大障碍[16]。而HOXA5基因作为HOXA族中的一员,对白血病的发生、发展同样具有重要影响。FULLER等[17]发现,过度表达HOXA5的K562细胞株红细胞分化被抑制,抑制HOXA5表达有助于增高红细胞祖细胞的分化及成熟。本实验结果显示,HOXA5基因在K562及K562/ADM细胞中高表达,且其在K562/ADM中的表达高于K562细胞,进一步证明HOXA5的过表达与白血病的发生、发展密切相关。
儿童慢性髓系白血病的5年生存率(5-year event-free survival,EFS)为44%[18],复发和耐药是影响其生存率的重要原因,因此,进一步研究髓系白血病的耐药机制具有重要意义[19]。有研究表明,运用RNAi技术抑制HOXA7基因的表达在一定程度上可逆转白血病细胞U937的多重耐药[20]。据报道,通过降低和提高细胞中HOXA5的表达,观察肺癌细胞对小细胞肺癌(SCLC)常用化疗药物敏感性的变化发现HOXA5可能参与SCLC耐药性的产生[5]。而本实验结果显示K562/ADM细胞中HOXA5的表达增高,RNAi特异性沉默K562/ADM细胞中的HOXA5基因后,实验组细胞对ADM的IC50较对照组的IC50降低2.55倍。结果提示,HOXA5基因与白血病细胞的耐药性相关,沉默HOXA5基因能在一定程度上逆转白血病细胞的耐药性,与上述报道[20,5]的研究结果相似。
CUI等[10]应用TGF-β2抑制性抗体及p38抑制剂等干预胰腺癌细胞后发现下调HOXA10能降低TGF-β2及MMP-3的表达并抑制p38的活化,表明HOX基因与p38的活化相关。本实验中有效沉默K562/ADM细胞中的HOXA5基因后,经检测后发现实验组细胞中的p38 mRNA及p-p38蛋白表达增高。结果提示,沉默HOXA5能增强p38mRNA的表达,并能激活p38使其磷酸化为p-p38,与CUI等[10]的研究结果相似。
结果显示ADM未干预及ADM干预中,实验组细胞的凋亡率较对照组增高;并且ADM干预组中各组细胞的凋亡率高于ADM未干预组。在细胞周期检测中,实验组与对照组比较G0/G1期细胞比例增加,S期细胞比例相应降低,说明抑制HOXA5的表达能减缓G0/G1期细胞进入增殖周期,减少细胞分裂增殖。以上结果提示沉默HOXA5基因后,能在一定程度上能增强细胞对ADM的敏感性,阻滞细胞的G0/G1期,减少细胞分裂增殖,从而促进细胞的凋亡。
综上所述,HOXA5与K562/ADM细胞的耐药性密切相关。沉默HOXA5在一定程度上能逆转白血病的多重耐药,其机制可能是通过增强p38的mRNA表达并使其激活为p-p38。RNAi技术沉默HOXA5基因后,激活p38MAPK信号转导通路逆转K562/ADM细胞的耐药性可能成为耐药白血病治疗的新靶点。
[1]MAGNO G D, SILVA N L, FELIZ P V, et al. Avascular necrosis of the jaws as initial presentation of acute leukemia[J]. Quintessence International, 2016, 47(9): 791-796.
[2]XU Q, LIU W J. Platelet changes in acute leukemia[J]. Cell Biochemistry and Biophysic, 2013, 67(3): 1473-1479.
[3]LIU W J, ZHANG T, GUO Q L, et al. Effect of ATRA on the expression of HOXA5 gene in K562 cells and its relationship with cell cycle and apoptosis[J]. MOL MED REP, 2016, 13: 4221-4228.
[4]FOURNIER M, RONDEAU I S, LAROCHELLE F, et al. Inability of HOXB4 to enhance self- renewal of malignant B cells:favourable pro fi le for the expansion of autologous hematopoietic stem cells[J]. Experimental Hematology, 2014, 42(7): 526-535.
[5]肖法嫚,陈珍珠 ,曾香萍,等. 同源异型盒基因 HOXA5对小细胞肺癌细胞多药耐药性的影响[J]. 南方医科大学学报,2013,33(11): 1665-1668.
[6]WESAM A, RICHARD V E. Signal transduction in the chronic leukemias: Implications for targeted therapies[J]. Curr Hematol Malig Rep, 2013, 8(1): 71-80.
[7]IGEA A, NEBREDA A R. The stress kinase p38αas a target for cancer therapy[J]. Cancer Research, 2015, 75(19): 3997-4002.
[8]KIM S H, BARK H, CHOI C H. Mercury induces multidrug resistance-associated protein gene through p38 mitogen-activated protein kinase[J]. Toxicology Letters, 2004, 155(1): 143-150.
[9]BARANCÍK M, BOHÁCOVÁ V, KVACKAJOVÁ J, et al.SB203580, a specific inhibitor of p38-MAPK pathway, is a new reversal agent of P-glycoprotein-mediated multidrug resistance[J].European Journal of Pharmaceutical Sciences, 2001, 14(1): 29-36.
[10]CUI X P, QIN C K, ZHANG Z H, et al. HOXA10 promotes cell invasion and MMP-3 expression via TGFβ2 -mediated activation of the p38 MAPK pathway in pancreatic cancer cells[J]. Digestive Diseases and Sciences, 2014, 59: 1442-1451.
[11]OLIVIERI D, SYKORA M M, SACHIDANANDAM R, et al.An in vivo RNAi assay identifies major genetic and cellular requirements for primary piRNA biogenesis in Drosophila[J].Embo Journal, 2010, 29(19): 3301-3317.
[12]HUANG H P, LIU W J, GUO Q L, et al. Effect of silencing HOXA5 gene using RNA interference on cell cycle and apoptosis in Jurkat cells[J]. INT J MOL MED, 2016, 37(3): 669-678.
[13]YANG Y, LIU W J, HUANG H P, et al. The in fl uence of HOXA5-speci fi c siRNA on the expression of Livin and Smac proteins[J].EUR REV MED PHARMACO, 2016(20): 3101-3111.
[14]ALHARBI R A, PETTENGELL R, PANDHA H S, et al. The role of HOX genes in normal hematopoiesis and acute leukemia[J].Leukemia, 2013, 27(5): 1000-1008.
[15]SPENCER D H, YOUNG M A, LAMPRECHT T L, et al.Epigenomic analysis of the HOX gene loci reveals mechanisms that may control canonical expression patterns in AML and normal hematopoietic cells[J]. Leukemia, 2015, 29(6): 1279-1289.
[16]ALESSA K, DENISE L, ROLF M. The IRX1/HOXA connection:insights into a novel t (4; 11) - specific cancer mechanism[J].Oncotarget, 2016, 7(23): 35341-35352.
[17]FULLER J F, MCADARA J, YARON Y, et al. Characterization of HOX gene expression during myelopoiesis: role of HOX A5 in lineage commitment and maturation[J]. Blood, 1999, 93(10):3391-3400.
[18]GATTA G, LUKSCH R, COLEMAN M P, et al. Survival from acute non- lymphocytic leukaemia (ANLL) and chronic myeloid leukaemia (CML) in European children since 1978: a populationbased study[J]. European Journal of Cancer, 2001, 37(6): 695-702.
[19]SUMITOMO Y, KOYA J, NAKAZAKI K, et al. Cytoprotective autophagy maintains leukemia- initiating cells in murine myeloid leukemia[J]. Blood, 2016, 128(12): 1614-1624.
[20]尹宝慧,贾秀红,李建厂. RNA干扰抑制HOXA7表达能逆转白血病U937细胞多药耐药[J]. 肿瘤,2013,33(7): 155-160.
