大鼠脂肪干细胞冷冻复苏后的生物学特性及成骨细胞分化潜能的研究*
2018-03-05章立群刘学任英华杨芬邓碧霞
章立群,刘学,任英华,杨芬,邓碧霞
(广东医学院附属南山医院 口腔科,广东 深圳 518052)
骨缺损的修复是临床研究面临的难题之一。目前骨组织工程技术在修复上下颌骨和牙槽骨缺损的研究中广泛应用,研究发现脂肪来源干细胞(adipose derived stem cells,ADSCs)和骨髓基质干细胞有相似的多项分化潜能[1],由于其来源丰富,取材简单、获得率高,体外增殖能力强且对供体损伤小等特点成为近年来研究的热点[2-3]。但体外长期培养的ADSCs会产生衰老从而造成表型不稳定,污染或培养箱故障等不利因素会对研究产生影响。此外传代过程产生过剩细胞,较浪费耗材和时间,因而低温冷冻适时复苏的细胞为比较合理的使用方法。由于干细胞低温保存效果的优劣直接影响干细胞的数量和质量,因此经过低温保存后的干细胞是否能存活并保持其生物学活性决定着相关研究和治疗的重要因素之一。本研究旨在了解冷冻保存复苏后ADSCs的生物学特性和诱导成骨分化潜能,为干细胞存储后的性能和组织工程的进一步研究提供实验依据。
1 材料与方法
1.1 材料
SD大鼠脂肪间充质干细胞(美国Cyagen公司);胎牛血清(FBS)(美国Gibco公司),DMEM培养基(美国Gibco公司);Ⅰ型胶原酶、胰蛋白酶(美国Hyclone公司)。基础培养基配方:DMEM,10% FBS,100 u/ml青霉素,100 u/ml链霉素;诱导培养基配方:DMEM,10% FBS,0.1 μmol/L地塞米松,50 μm/L维生素C,10 mm/L β-甘油磷酸钠,105 u/L青霉素,105 u/L链霉素;200 μmol/L消炎痛;BCIP/NBT碱性磷酸酶显色试剂盒(上海碧海云天生物技术研究所);CD105、CD44流式抗体(美国Biolegend公司);CCK8试剂盒(日本同仁化工研究所);茜素红染色试剂盒(南京建成生物公司);二氧化碳CO2细胞培养箱(德国Memmer公司);倒置显微镜(德国Zeiss公司),流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 脂肪干细胞的复苏培养和传代 将SD大鼠脂肪间充质干细胞扩增至第3代冷冻保存,每支含细胞1×106个细胞。将冷冻6个月的ADSCs迅速取出立即置入-80℃冰箱冷冻2~3 min,再迅速放入37℃温水复苏,快速晃动使管中内含物尽快融化,然后在无菌下取出细胞。取一滴细胞悬液台盼蓝染色,计算细胞存活率(%)=活细胞/(活细胞数+死细胞数)×100%。其余细胞液1 000 r/min离心5 min,去上清液,漂洗,接种至T25培养瓶。37℃、5% CO2培养箱中培养,每2天更换细胞培养基。当细胞融合达80%~90%时,加入0.25% Trypsin-0.04% EDTA进行传代培养。
1.2.2 HE染色 选择生长良好的第1、3代ADSCs细胞,胰酶消化后制成单细胞悬液,以1×105个细胞接种于事先放有盖玻片的6孔板中,待细胞达到80%~90%融合取出盖玻片,HE染色,显微镜下观察。同时对诱导成骨培养的ADSCs细胞同法进行HE染色,观察细胞形态。
1.2.3 生长曲线测定 取生长良好的第3代ADSCs细胞,胰酶消化后制成单细胞悬液,调整细胞数为1×104个/ml,接种于96空培养板。分别于第1、2、3、4、5、6、7及8天时,取样品进行CCK8检测,酶联免疫监测仪读取450 nm处的OD值,分析数据。
1.2.4 表面抗原鉴定 取第3代ADSCs细胞,用0.25%胰酶消化后调整细胞密度为1×106个/ml,1 000 r/min离心5 min,洗涤后弃上清液待标记。将待测管中分别加入FITC标记的CD105和PECY7标记的CD44,每种抗体加5 μl。(以不加抗体的作为空白对照组)用震荡器将所有样本中的抗体与细胞充分混匀后,室温避光孵育30 min,PBS清洗后,加入500 μl含1%多聚甲醛固定液,重悬后,流式细胞仪上机检测。
1.2.5 诱导成骨培养 取生长良好的第3代细胞以1×105个/ml的密度接种到6孔培养板中,更换成骨诱导培养基,每3天换液。以加入不含诱导剂培养基的3代细胞作为对照组。
1.2.6 ALP染色 分别取第7和14天诱导成骨培养的ADSCs样品,4%的多聚甲醛固定30 min;PBS清洗3~5次,加入适量BCIP/NBT染色工作液,室温避光孵育5~30 min,去除BCIP/NBT染色工作液,用蒸馏水洗涤1~2次即可终止显色反应,拍照。
1.2.7 茜素红染色 取第21天诱导成骨培养的ADSCs细胞,4%多聚甲醛固定,PBS洗涤,加500 μl 0.1% Triton X-100室温通透10 min。PBS洗涤;加入茜素红-S染色液染色30 min,PBS清洗残留染液,拍照成像。
2 结果
2.1 形态
复苏后的细胞初始呈圆形,12 h后贴壁细胞明显增多,24 h后可见大多数细胞贴壁,72 h后细胞开始伸展呈短梭形或多角形。传代后细胞增长迅速,呈分散集落方式生长,约7~10 d后细胞达80%左右融合,呈典型的纤维样细胞,长梭形漩涡样生长(见图1、2)。细胞从11到12代开始逐渐出现衰老,14~15代开始衰老细胞明显增多。成骨诱导后细胞变为多角形或不规则状,体积有所增大。见图3。
2.2 ADSCs细胞接种后的生长曲线
细胞在种植后前2天为缓慢的生长期,从第3天开始快速增殖,到第6天时达到峰值,第7天后细胞发生接触性抑制或者细胞量较多,培养基消耗快,细胞生长进入平台期,第8天开始细胞数量减少。见图4。

图1 复苏后传至第3代ADSCs细胞

图2 复苏后第1代和第3代ADSCs细胞 (HE×100)
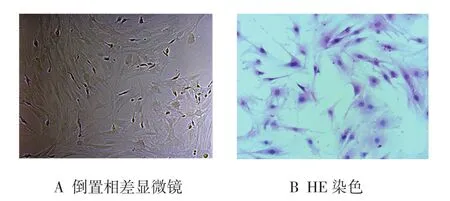
图3 诱导成骨培养14 d后ADSCs细胞 (×100)
2.3 表面抗原鉴定结果
经流式细胞仪检测CD105和CD44在ADSCs中表达,发现CD105和CD44的表达在90%以上,符合ADSCs的免疫学表型。见图5。
2.4 ALP和茜素红染色结果
成骨诱导7 d后实验组ALP染色阳性细胞呈深紫蓝色,继续诱导14 d,染色持续增强,第21天达顶峰,呈强阳性,而对照组则为阴性。茜素红染色:7 d开始出现红色钙化结节,并随着时间推移持续增强,21 d细胞聚集区钙结节互相融合,形成片状,不加诱导组为阴性。见图6、7。

图4 生长曲线

图5 流式细胞仪检测CD105和CD44

图6 成骨诱导培养 (ALP染色×100)

图7 成骨诱导培养情况 (茜素红染色×100)
3 讨论
骨组织工程很大程度上依赖于种子细胞的选择,目前研究较多的骨髓间充质干细胞,但骨髓采集有潜在的局限性,骨髓中干细胞含量很少,不易获取,扩增能力有限,属于有创操作,对患者伤害大。胚胎干细胞(embryonic stem cells,ESC)虽具有多向分化能力,但是ESC很难获得纯化的特定细胞系,而且其研究和应用受到伦理和法律的限制。2001年ZUK等[3]首次分离ADSCs,后续研究发现ADSCs在不同的诱导条件下可以向脂肪、骨、软骨、神经、骨骼肌、心肌或胰岛细胞等多个方向分化[4]。不仅如此,ADSCs还能够分泌多种生长因子,促进血管新生[5]。此外,ADSCs还具有获得率高、分离纯化简便、扩增能力强、手术供区并发症少、不受伦理法律限制等优势,使其成为颅颌面修复重建较为理想的种子细胞来源。
目前,绝大部分研究者采用的都是取新鲜脂肪组织进行分离培养,但是这存在几个问题:①原代细胞的培养往往需要经过动物饲养、脂肪取材到细胞培养过程,比较耗费时间和金钱;②部分脂肪组织富含血管和淋巴结,分离过程中不易去除;如果取材不当或方法不正确容易混有较多杂质细胞需要经过多次筛选;③取材不当易造成细胞污染同时反复多次取材的结果也造成脂肪组织的浪费,降低脂肪组织的利用率。而低温冷冻适时复苏的细胞为比较合理的使用方法,可避免反复进行原代培养的中间环节,极大缩短时间,提高效率。尽管冻存复苏技术在大多数细胞的研究中较为常用,但ADSCs经过一段时间的低温冻存再复苏后其生物学特性如何?是否能够进行成骨化诱导?该问题还需要进一步的实验数据支持。因而本研究的主要目的则为研究冻存复苏后的干细胞生物学特性,为骨组织工程技术提供更多细胞来源和数据支持。
本实验发现,复苏后的ADSCs细胞存活率约80%,其贴壁良好,同样可进行扩增传代。基本形态特征,多数呈梭形,集落样生长,传代后长梭形细胞大量增加。其细胞生长曲线基本呈S形,表面能够表达脂肪干细胞表面标记物,其基本生物学特性和以往研究报道原代培养的ADSCs特性相似[6-8]。OWE等[9]将骨形成分为3期:成骨细胞增殖、细胞外基质分泌期 、细胞外基质成熟期、细胞外基质矿化期。在成骨诱导分化过程中,ALP是成骨细胞分化的早期标志,矿化结节是成骨细胞分泌的功能指标。因此,ALP及矿化结节的检测对成骨细胞的鉴定有重要意义。本实验中,复苏后的细胞经过成骨诱导培养后形态逐渐向纺锤形、多角形转变,7 d时ALP表达阳性,14和21 d表达逐渐增强,表明不断向成骨细胞分化演变;7 d茜素红染色阳性,检测到钙盐沉积的矿化结节,表明此时已经有部分细胞进入成骨过程的细胞外基质矿化期。同样14和21 d表达逐渐增强,说明随着时间的推移,细胞外钙化基质也不断增加。由此证明冷冻保存复苏的ADSCs同样具有良好诱导成骨能力。
通过本实验发现,冷冻复苏的ADSCs其生物学特性保持稳定,成骨诱导性能良好,为骨组织工程ADSCs的大量快速构建提供的实验基础。此外,ADSCs更长期冷冻复苏后否仍能够保持其良好的形态及生长特性,复苏后ADSCs经更多次传代是否仍具有成骨分化潜能,尚需今后进一步研究。
[1]ZUK P A, ZHU M, MIZUNO H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J].Tissue Eng, 2001, 7(2): 211-228.
[2]古振. 脂肪干细胞在骨组织工程中的研究进展[J]. 组织工程与重建外科杂志, 2012, 8(1), 43-55.
[3]BHATTACHARYA, GHAYOR C, WEBER F E. The use of adipose tissue-derived progenitors in bone tissue engineering - a review[J].Transfus Med Hemother, 2016, 43(5): 336-343.
[4]ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002, 13(12):4279-4295.
[5]MESIMÄKI K L, LINDROOS B, TÖRNWALL J, et al. Novel maxillary reconstruction with ectopic bone formation by GMP adipose stem cells[J]. Int J Oral Maxillofac Surg, 2009, 38(3): 201-209.
[6]耿德春, 徐耀增, 李荣群, 等. 大鼠脂肪基质干细胞的体外培养及其成骨细胞分化特性的研究[J]. 苏州大学学报, 2007, 27(4):517-519.
[7]程文丹, 赵宇, 何金生. 大鼠脂肪干细胞体外定向诱导分化为脂肪细胞和成骨细胞的研究[J]. 安徽医科大学学报, 2007, 42(5),501-504.
[8]单秀莉, 王青, 林志勇, 等. 大鼠脂肪干细胞体外定向诱导分化为成骨细胞的研究[J]. 牙体牙髓牙周病学杂志, 2006, 16(8):441-445.
[9]OWEN T A, ARONOW M, SHALHOUB V, et al. Progressive development of the rat osteoblast phenotype in vitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix[J]. J Cell Physiol, 1990, 143(3): 420-430.
