miRNA-381对胃癌细胞增殖和侵袭的影响及机制*
2018-03-05李丽平叶俊吴舜马松林周艳玲
李丽平,叶俊,吴舜,马松林,周艳玲
(1.武汉科技大学医学院 生理与病理生理学系,湖北 武汉 430014;2.华中科技大学同济医学院附属武汉中心医院后湖院区 消化内科,湖北 武汉 430014)
胃癌是致死率很高的恶性肿瘤之一,据统计,2012年全球范围内胃癌发病人数约951,000例,死亡人数高达723,000例[1]。同时胃癌也是一种高度异质性疾病,侵袭和转移能力极强,具有复杂的分子和组织学特征[2]。微小RNA(microRNA,miRNA)是在多细胞生物中发现的一类调节性RNAs,在人体内广泛分布,通过靶向mRNA 3’UTR触发翻译抑制或RNA降解[3]。越来越多的研究表明,miRNA的改变如缺失、扩增、突变或表观遗传沉默等与大多数恶性肿瘤的发生、发展、转移有关[4]。由于miRNA在恶性肿瘤细胞中普遍表达异常,表明miRNAs控制抑癌基因或促癌基因,亦或是被其控制,因此miRNA的发现为寻找肿瘤早期诊断特异性分子标志物及基因靶向治疗提供新的方向[4]。研究发现,miRNA与胃癌的发生密切相关,如Let-7[5]、miRNA-101[6]、miRNA-130b 等[7]。miRNA-381是miRNA家族一员,被证实参与胶质瘤[8]、肾癌[9]及乳腺癌等[10]肿瘤生长。但是miRNA-381在胃癌中的研究还未有涉及,本研究观察miRNA-381在胃癌细胞系及正常胃上皮细胞系中的表达及过表达miRNA-381对胃癌细胞增殖、迁移、侵袭的影响,探索其可能的作用机制。
1 材料与方法
1.1 材料
胃癌细胞系AGS、MGC-803、Hs746T及BSG823和正常胃黏膜上皮细胞系RGM-1(购自北京协和医学院),RPMI 1640培养基、胎牛血清、胰蛋白酶及Trizol(购自美国BD公司),肝受体类似物1(liver receptor homolog-1,LRH-1)和扭曲相关蛋白1(twistrelated protein-1,Twist1)一抗(购自cell signaling公司),羊抗兔二抗(购自武汉博士德生物科技有限公司),miRNA-381 mimics及scramble(由上海吉玛生物科技有限公司合成)。
1.2 细胞培养、转染及分组
将胃癌细胞系 AGS、MGC-803、Hs746T及BSG823和正常胃黏膜上皮细胞系RGM-1加入到RPMI 1640培养基,于37℃、5% 二氧化碳CO2培养箱中培养,经48 h后消化传代。将AGS细胞系分成两组,阴性对照组和miRNA-381模拟物组,采用LipofectamineTM2000 reagent(Invitrogen,USA)分别转染 miRNA-381 scramble及 mimics,miRNA-381 mimics转染序列:miRNA-381 mimics 正向引物:5'-UAUACAAGGGCAAGCUCUCUGU-3',反向引物 :5'-AGAGAGCUUGCCCUUGUAUAUU-3';miRNA-381 scrramble正向引物:5'-UUCUCCGAACGUGUC ACGUTT-3',反向引物:5'-ACGUGACACGUUCGGAG AATT-3'。
1.3 RNA提取及实时荧光定量聚合酶链反应
①miRNA-381表达量测定:用All-in-One micro RNA抽提试剂盒提取AGS、MGC-803、Hs746T、BSG823和RGM-1细胞系的miRNAs,ABI Prism 7700 system 的 SYBR Green Reagents(TaKaRa,日本 Tokyo)实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR),在 ABI 7500 qRTPCR仪中,以U6小核RNA作为内参,使用2-ΔΔCt方法定量,量化miRNA-381相对表达水平;②LRH-1和Twist1 mRNA表达量测定。
提取miRNA-381模拟物组和阴性对照组两组细胞总RNA后,在ABI 7500实时定量PCR仪中,以GAPDH为内参,引物序列:LRH-1,正向引物:5'-CT GATACTGGAACTTTTGAA-3',反向引物:5'-CTTCATT TGGTCATCAACCTT-3';Twist1,正向引物:5'-AGAAGT CTGCGGGCTGTGGCG-3',反向引物:5'-GAGGGCAGC GTGGGGAGATC-3';GAPDH正向引物:5'-GAAGGT GAAGGTCGGAGTC-3',反向引物:5'-GAAGATGGTG ATGGGATTT-3'。使用 2-ΔΔCt方法定量,量化 LRH-1和Twist1 mRNA相对表达水平。
1.4 细胞增殖实验
采用CCK-8法,将阴性对照组和miRNA-381模拟物组细胞,按2×103个/孔接种于96孔板上,按200 μl每孔标准培养,在培养后0、24、48、72及96 h后,按每孔20 μl的标准加入CCK-8溶液,用酶标仪在490 nm处的波长下测定各孔的光密度(optical density,OD)值,绘制细胞增殖曲线。
1.5 细胞侵袭实验
采用Transwell法,将阴性对照组和miRNA-381模拟物组两组细胞各取2×104个细胞,接种于碳酸磷脂表面,于37℃下培养24 h,用1%多聚甲醛与膜下面的细胞结合并用0.2%结晶紫溶液染色,随机取10个视野(×200),计算穿过膜的细胞数量,重复3次该实验,并取均值。
1.6 Western blot
将阴性对照组和miRNA-381模拟物组两组细胞经RIPA细胞裂解液冰上裂解30 min后,变性、上样,以每孔30 μg总蛋白上样,浓缩胶80 V电泳40 min,分离胶100 V电泳2 h。常规湿法转膜,加入LRH-1、Twist 1及GAPDH一抗,浓度为1∶200,一抗孵育过夜,二抗(1∶500)于37℃孵育4 h,PBST漂洗3次,ECL液显影,Quantity One 1-D分析软件对蛋白印迹条带进行定量。目的蛋白相对表达量=目的蛋白测定值/GAPDH,实验重复3次,取平均值。
1.7 统计学方法
数据分析用SPSS 17.0统计软件和Graph软件,计量资料以均数±标准差(±s)表示,采用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-381在胃癌及正常胃黏膜上皮细胞系中的表达
qRT-PCR检测miRNA-381的表达量,正常胃黏膜上皮细胞系RGM-1的miRNA-381相对表达量为1.0,在胃癌细胞系AGS中相对表达量为(0.19±0.03),MGC-803 为(0.29±0.03),Hs746T 为(0.47±0.06),BSG823为(0.56±0.06),经方差分析,差异有统计 学 意 义(F=93.260,P=0.000);经 LSD-t检 验,miRNA-381在胃癌细胞系AGS、MGC-803、Hs746T及BSG823中相对表达量均低于RGM-1(P<0.05)。见图1。
2.2 miRNA-381过表达抑制胃癌细胞AGS增殖
在AGS细胞中过表达miRNA-381模拟物,用qRT-PCR检测其相对含量变化,miRNA-381模拟物组miRNA-381相对表达量为(10.5±0.9),阴性对照组为(1.0±0.03),miRNA-381模拟物组的miRNA-381表达量高于阴性对照组(t=18.272,P=0.000)。转染 后 0、24、48、72及 96 h,miRNA-381模 拟 物组vs对照组的OD 450 nm值分别为(0.32±0.03 vs 0.31±0.04)(t=0.346,P=0.373),(0.53±0.06 vs 0.55±0.07)(t=-0.375,P=0.363),(1.05±0.09 vs 1.10±0.12)(t=-0.577,P=0.297),(1.49±0.15 vs 2.36±0.25)(t=-5.168,P=0.003)及(2.22±0.21 vs 3.55±0.29)(t=-6.433,P=0.000)。见图 2。
2.3 miRNA-381过表达抑制胃癌细胞AGS侵袭
Transwell实验示,200倍视野下,阴性对照组侵袭细胞数为(79.6±7.2)个,miRNA-381模拟物组侵袭细胞数为(31.70±4.2)个,miRNA-381模拟物组侵袭细胞数少于阴性对照组(t=9.953,P=0.002)。见图3。
2.4 miRNA-381下调LRH-1和TWIST1的表达
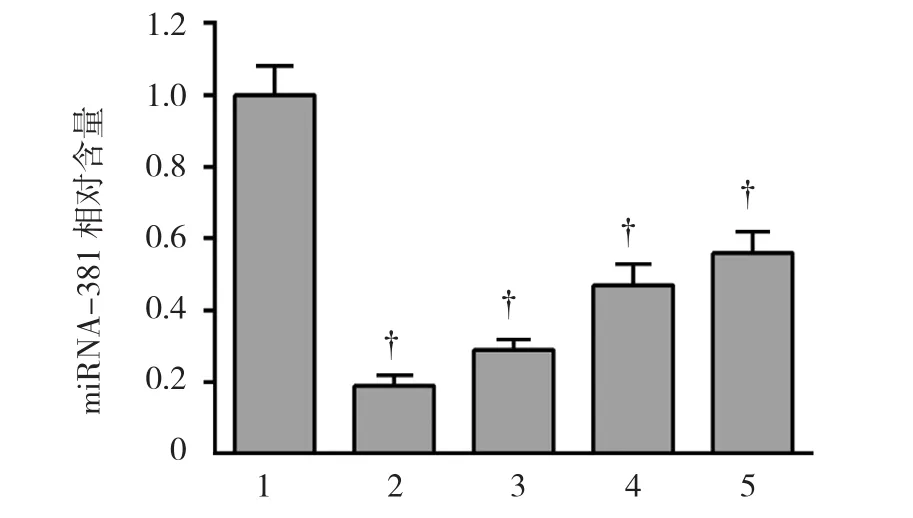
图1 miRNA-381在胃癌细胞系及正常胃黏膜上皮细胞系中的表达
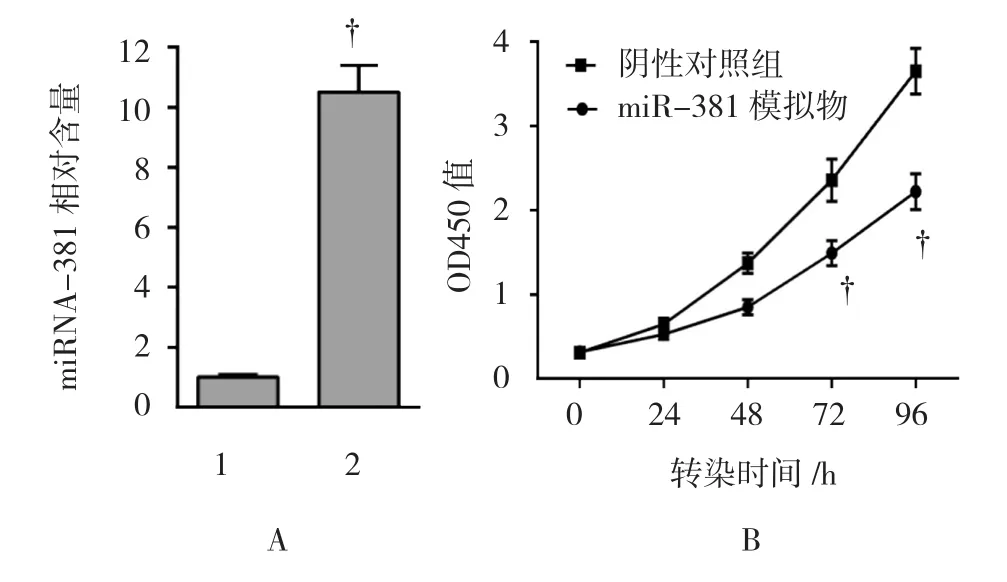
图2 miRNA-381过表达抑制胃癌细胞AGS增殖
qRT-PCR示,miRNA-381模拟物组LRH-1 mRNA相对表达量为(0.33±0.04),阴性对照组为(1.0±0.02),miRNA-381模拟物组LRH-1 mRNA相对表达量低于阴性对照组(t=25.948,P=0.000);见图4A;miRNA-381模拟物组Twist1 mRNA相对表达量为(0.45±0.04),阴性对照组为(1.0±0.02),miRNA-381模拟物组Twist 1 mRNA相对表达量低于阴性对照组(t=-21.301,P=0.000),见图 4B。
Western blot示,miRNA-381模拟物组LRH-1蛋白相对表达量为(0.39±0.04),阴性对照组为(1.0±0.02),miRNA-381模拟物组LRH-1蛋白相对表达量低于阴性对照组(t=-23.625,P=0.000);见图4C、4D;miRNA-381模拟物组Twist 1蛋白相对表达量为(0.51±0.05),阴性对照组为(1.0±0.01),miRNA-381模拟物组Twist 1蛋白相对表达量低于阴性对照组(t=-16.644,P=0.000),见图4C和4E。
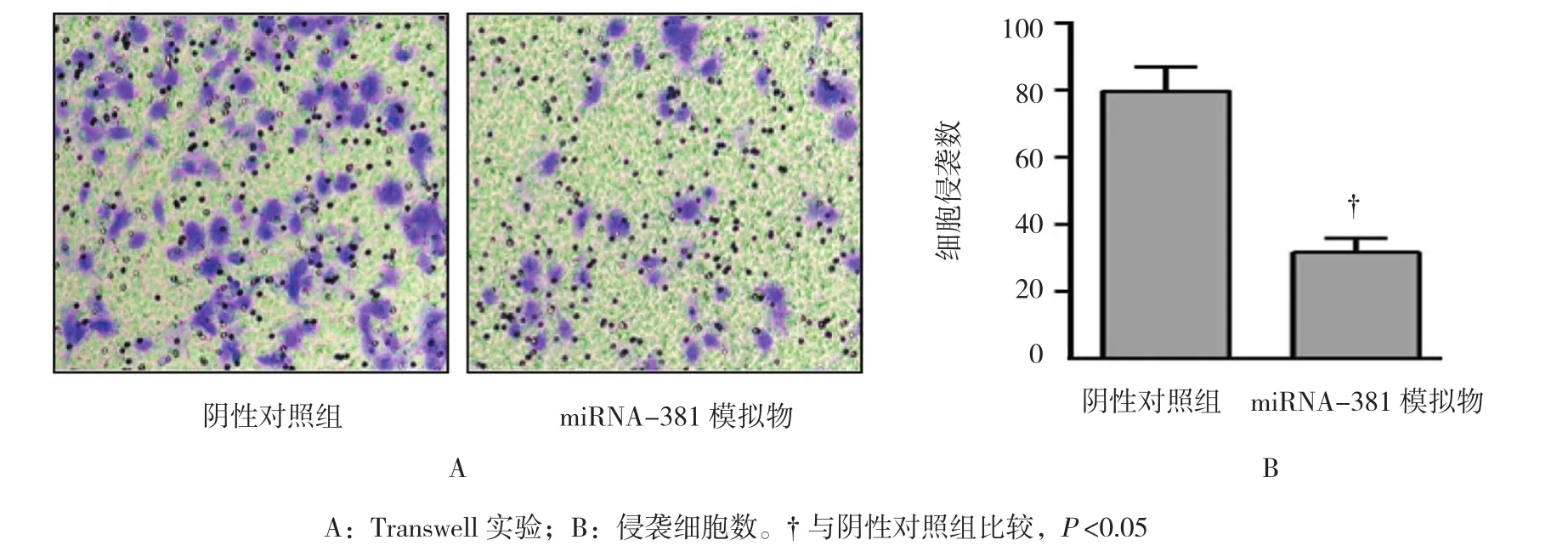
图3 miRNA-381过表达抑制胃癌细胞AGS侵袭
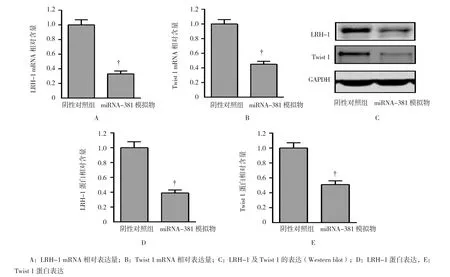
图4 miRNA-381下调LRH-1和TWIST 1的表达
3 讨论
尽管过去几十年中,胃癌的发病率和死亡率持续下降,但是胃癌仍然是世界上第4大常见的恶性肿瘤和癌症死亡的第2大原因[11]。胃癌患者预后较差,5年生存率低于30%,大多数胃癌患者的死亡是由于转移或复发导致[11]。研究发现,miRNAs通过调控一系列侵袭和转移相关基因,在肿瘤的侵袭和转移过程中起到关键作用[12]。在本研究显示,在正常胃上皮细胞系中miRNA-381表达高于胃癌细胞系。更重要的是,过量表达miRNA-381能抑制胃癌细胞增殖、侵袭、迁移能力,表明miRNA-381在胃癌浸润、侵袭及转移中发挥抑癌基因作用。
本研究发现,miRNA-381过表达引起LRH-1蛋白表达水平下降。研究证实,LRH-1是miRNA-381的靶蛋白,miRNA-381通过直接靶向LRH-1 3'-UTR抑制肝癌细胞生长和侵袭[13]。在结肠癌中,miRNA-381表达下降上调LRH-1蛋白水平促进结肠癌细胞生长、增殖、迁移[14]。意味着LRH-1活性的增加与胃癌细胞迅速增长和增殖有一定关联。细胞周期蛋白D1和E1(Cyclin D1和Cyclin E1)是细胞周期G1期关键蛋白,能够与细胞周期蛋白依赖性激酶(CDK)组成Cyclin D1-CDK4/6和Cyclin E1-CDK2复合物参与调控G1/S期转变[15]。Cyclin D1已被证实是一种原癌基因,其过度表达导致细胞增殖失控和恶化[16]。Cyclin E1在多种肿瘤组织中表达较高,与肿瘤发生、发展密切相关[17]。C-Myc基因也是一个公认的原癌基因,在多种肿瘤中被激活,其靶基因参与肿瘤细胞生长、凋亡和代谢等过程中[18]。研究发现,LRH-1与β-catenin能够协同共激活下游基因Cylin D1、Cyclin E1及c-Myc的表达,促进肠肿瘤细胞增殖[19]。已有研究证实,LRH-1基因沉默降低Cylin D1、Cyclin E1及c-Myc的表达水平,抑制胰腺癌细胞增殖[19]。本研究中,miRNA-381表达上升导致LRH-1蛋白表达下调,其作用机制可能是miRNA-381直接绑定结合LRH-1 3'-UTR,在转录后水平负调控LRH-1基因的表达。笔者推测,LRH-1与β-catenin协同共激活Cyclin D1、Cyclin E1及c-Myc的作用减弱,使G1/S期转换受抑制,导致细胞阻滞于G0/G1期,进入S期和G2期的细胞数目减少,同时使c-Myc靶基因表达失控,降低胃癌细胞增殖和侵袭能力。
在肿瘤转移过程中,细胞间黏附和连接能力降低,导致肿瘤细胞脱落并迁移到其他组织、器官是肿瘤转移的重要环节[20]。上皮间质转化是上皮细胞表型向间质细胞表型转变的过程,主要特征为细胞黏附分子的表达减少、细胞骨架及形态改变,在肿瘤浸润和迁移过程中起关键作用[21]。转录因子Twist-1是上皮间质转化的重要调节因子,Twist-1表达上升诱导发生该过程,参与肿瘤侵袭和转移发生机制[22]。研究发现,Twist-1 3'-UTR含有大量miRNAs的调控元件,包括miRNA靶点,多个miRNAs被证实能够抑制Twist-1的翻译,如miRNA-145a-5p、miRNA-151-5p等[23]。据报道,miRNA-106b通过靶向Twist-1调控子宫内膜癌细胞系上皮间质转化[24],在结直肠癌中miRNA-381通过直接靶向Twist-1发挥抑癌作用[25]。在本研究中,miRNA-381可能通过特异性结合Twist-1 3'-UTR靶位点,降低Twist1基因翻译水平,抑制胃癌细胞上皮间质转化,从而阻碍细胞转移和侵袭。
综上所述,miRNA-381通过抑制LRH-1和Twist-1蛋白的表达,调控细胞周期和上皮间质转化,进而抑制胃癌细胞增殖和侵袭。miRNA-381在胃癌中功能及其作用机制的鉴定,有望成为肿瘤早期诊断标志物及基因靶向治疗的新靶点。
[1]FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. International journal of cancer,2015, 136(5): 359-386.
[2]Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma[J]. Nature,2014, 513(7517): 202-209.
[3]Iorio M V, Ferracin M, Liu C G, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer research, 2005,65(16): 7065-7070.
[4]CROCE C M. Causes and consequences of microRNA dysregulation in cancer[J]. Nature reviews genetics, 2009, 10(10):704-714.
[5]OHSHIMA K, INOUE K, FUJIWARA A, et al. Let-7 microRNA family is selectively secreted into the extracellular environment via exosomes in a metastatic gastric cancer cell line[J]. PloS one,2010, 5(10): e13247.
[6]WANG H J, RUAN H J, HE X J, et al. MicroRNA-101 is downregulated in gastric cancer and involved in cell migration and invasion[J]. European journal of cancer, 2010, 46(12): 2295-2303.[7]LAI K W, KOH K X, LOH M, et al. MicroRNA-130b regulates the tumour suppressor RUNX3 in gastric cancer[J]. European Journal of Cancer, 2010, 46(8): 1456-1463.
[8]TANG H, LIU X, WANG Z, et al. Interaction of hsa-miR-381 and glioma suppressor LRRC4 is involved in glioma growth[J]. Brain research, 2011, 1390: 21-32.
[9]CHEN B, DUAN L, YIN G, et al. miR-381, a novel intrinsic WEE1 inhibitor, sensitizes renal cancer cells to 5-FU by up-regulation of Cdc2 activities in 786-O[J]. Journal of Chemotherapy, 2013, 25(4):229-238.
[10]MING J, ZHOU Y, DU J, et al. miR-381 suppresses C/EBPαdependent Cx43 expression in breast cancer cells[J]. Bioscience reports, 2015, 35(6): e00266.
[11]ZHANG G, ZHAO X, LI J, et al. Racial disparities in stagespeci fi c gastric cancer: analysis of results from the Surveillance Epidemiology and End Results (SEER) program database[J].Journal of Investigative Medicine, 2017: jim-2017-000413.
[12]ZHANG Y, WANG Z, CHEN M, et al. MicroRNA-143 targets MACC1 to inhibit cell invasion and migration in colorectal cancer[J]. Molecular cancer, 2012, 11(1): 23.
[13]ZHANG Q, ZHAO S, PANG X, et al. MicroRNA-381 suppresses cell growth and invasion by targeting the liver receptor homolog-1 in hepatocellular carcinoma[J]. Oncology reports, 2016, 35(3):1831-1840.
[14]LIANG Y, ZHAO Q, FAN L, et al. Down-regulation of MicroRNA-381 promotes cell proliferation and invasion in colon cancer through up-regulation of LRH-1[J]. Biomedicine &Pharmacotherapy, 2015, 75: 137-141.
[15]FINN R S, CROWN J P, LANG I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as fi rst-line treatment of oestrogen receptorpositive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study[J]. The lancet oncology,2015, 16(1): 25-35.
[16]PARONETTO M P, CAPPELLARI M, BUSÀ R, et al. Alternative splicing of the cyclin D1 proto-oncogene is regulated by the RNA-binding protein Sam68[J]. Cancer research, 2010, 70(1): 229-239.
[17]KEYOMARSI K, TUCKER S L, BUCHHOLZ T A, et al. Cyclin E and survival in patients with breast cancer[J]. New England Journal of Medicine, 2002, 347(20): 1566-1575.
[18]WANG J, WANG Z, WANG H, et al. Curcumin induces apoptosis in ej bladder cancer cells via modulating c-myc and pi3k/akt signaling pathway[J]. World Journal of Oncology, 2011, 2(3):113-122.
[19]BENOD C, VINOGRADOVA M V, JOURAVEL N, et al. Nuclear receptor liver receptor homologue 1 (LRH-1) regulates pancreatic cancer cell growth and proliferation[J]. Proceedings of the National Academy of Sciences, 2011, 108(41): 16927-16931.
[20]SCHOONJANS K, DUBUQUOY L, MEBIS J, et al. Liver receptor homolog 1 contributes to intestinal tumor formation through effects on cell cycle and inflammation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(6): 2058-2062.
[21]RADISKY D C. Epithelial-mesenchymal transition[J]. Journal of cell science, 2005, 118(19): 4325-4326.
[22]SUN T, ZHAO N, ZHAO X, et al. Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry[J]. Hepatology, 2010, 51(2): 545-556.
[23]NAIRISMÄGI M L, FÜCHTBAUER A, LABOURIAU R, et al.The proto-oncogene TWIST1 is regulated by microRNAs[J]. PloS one, 2013, 8(5): e66070.
[24]DONG P, KANEUCHI M, WATARI H, et al. MicroRNA-106b modulates epithelial–mesenchymal transition by targeting TWIST1 in invasive endometrial cancer cell lines[J]. Molecular carcinogenesis, 2014, 53(5): 349-359.
[25]CHENG G Z, CHAN J, WANG Q, et al. Twist transcriptionally up-regulates AKT2 in breast cancer cells leading to increased migration, invasion, and resistance to paclitaxel[J]. Cancer research, 2007, 67(5): 1979-1987.
