溶酶体在巨噬细胞极化中的作用研究*
2018-03-05吴鹏田孝祥刘丹齐艳萍闫承慧韩雅玲
吴鹏,田孝祥,刘丹,齐艳萍,闫承慧,韩雅玲
(1.锦州医科大学研究生院,辽宁 锦州 121000;2.沈阳军区总医院 心内科,辽宁 沈阳 110016)
巨噬细胞是机体内重要的吞噬和抗原提呈细胞,是炎症和先天性免疫的关键效应物,并在多种炎症相关疾病,包括心血管病(动脉粥样硬化、心肌梗死、心肌炎)、代谢性疾病(肥胖、糖尿病,代谢综合征)及癌症等中发挥重要作用[1-3]。在不同病理生理条件下,巨噬细胞可发生极化,成为功能不同的经典活化型M1[脂多糖(lipopolysaccharide,LPS)和干扰素γ(interferon-γ,IFN-γ)共同作用]或替代活化型M2[白细胞介素4(interleukine-4,IL-4)作用]。M1型巨噬细胞可以分泌多种促炎因子[如:肿瘤坏死因子α(tumor necrosis factor,TNF-α)、单核细胞趋化因子 1(monocyte chemotactic protein-1,MCP-1)],在动脉粥样硬化及代谢性疾病的发生、发展过程中增多,发挥促炎症作用;M2型巨噬细胞分泌抑炎因子[如:白细胞介素10(interleukine-10,IL-10)、转化生长因子 β1(transforming growth factor beta 1,TGF-β1)],增强细胞清除能力,在动脉粥样硬化及代谢性疾病的发生、发展过程中增多,抑制炎症的作用[4-5]。目前认为,巨噬细胞极化是巨噬细胞发挥病理生理作用的主要机制之一。因此,巨噬细胞极化调控研究已成为多种疾病研究的热点。
目前,有研究报道C-Jun N-terminal kinase(JNK)及Notch等信号通路参与巨噬细胞极化调控,但其机制尚未阐明[6]。溶酶体在巨噬细胞中大量表达,是其对抗外源和内源性病原分子不可或缺的重要细胞结构,在炎症反应中发挥重要作用[7]。但是对溶酶体是否参与调控巨噬细胞极化仍少见报道。因此,本研究拟采用单核巨噬细胞系,在体外建立巨噬细胞极化模型,探讨溶酶体在巨噬细胞极化中的作用。本研究将为巨噬细胞新的极化调控机制提供实验依据和理论线索,并为多种巨噬细胞极化相关疾病的防治提供新的干预靶点。
1 材料与方法
1.1 材料与试剂
小鼠巨噬细胞系RAW264.7(购自中国科学院细胞库),抗GAPDH抗体、Lipopolysaccharide-LPS(Sigma公司),DMEM(Gibcobrl公司),胎牛血清(Biochrom公司),蛋白测定BCA试剂盒(Pierce公司),辣根过氧化物酶标记的二抗(北京中杉金桥生物公司),Mouse IL-10/Mouse MCP-1/Mouse TNF-α/Mouse TGF-β1ELISA检测试剂盒(R&D公司),PE标记大鼠抗小鼠F4/80抗体、FITC标记抗小鼠CD206抗体(BD Pharmingen公司),FITC标记抗小鼠CD16/32抗体(Biolegend公司),抗TNF-α、INOS抗体(Cell signaling公司),抗CD206抗体、抗LAMP-1/LAMP-2/LIMP-2抗体(Abcam公司),逆转录试剂盒、SYBR Green染料(TaKaRa公司),PCR引物(上海生工生物工程股份有限公司),重组小鼠IFN-γ、白细胞介素4 (IL-4)(Peprotech公司)。
1.2 方法
1.2.1 细胞处理及分组 实验分为对照组(未接受诱导剂刺激)、经 LPS(100 ng/ml)+IFN-γ(20 ng/ml)刺激24 h诱导M1组及IL-4(20 ng/ml)刺激24 h诱导M2 组[8]。
1.2.2 光镜观察细胞形态变化 细胞进行上述处理后,倒置显微镜下观察各组细胞形态学变化。
1.2.3 流式细胞术检测M1、M2型巨噬细胞比例
经上述处理的细胞,每组经胰0.25%蛋白酶消化后并计数。取5×105个细胞/管,PBS液洗3次,50 μl PBS重悬,加入5 μl PE标记的大鼠抗小鼠F4/80抗体、2 μl FITC标记的抗小鼠CD16/32抗体、2 μl FITC标记的抗小鼠CD206抗体,冰上孵育20~30 min,用PBS洗去未结合的抗体。PBS重悬后,用流式细胞仪FACS Calibur检测M1型及M2型巨噬细胞比例。
1.2.4 ELISA检测细胞培养上清中炎症因子及趋化因子 分别收集3组经24 h刺激的细胞培养上清液,按照ELISA试剂盒产品说明书进行操作,分别检测细胞培养上清液中TNF-α、MCP-1、IL-10及TGF-β1含量。在30 min内用酶标仪读取结果,450 nm为测定波长,570 nm为校正波长。
1.2.5 Western blot 细胞刮刀刮取并收集各组细胞,每1×105个细胞比例加入细胞裂解液100~200 μl。吹打混匀,冰上裂解细胞30 min,每5分钟振荡1次。用4℃离心机12 000 r/min离心15 min,取上清液。采用BCA试剂盒测定蛋白浓度,各组取40 μg总蛋白SDS-PAGE凝胶电泳。半干法将蛋白转印到PVDF膜上。5%脱脂奶粉TBS-T溶液室温封闭1 h。一抗4℃摇晃过夜(1∶1 000稀释),TBS-T洗3遍。次日相应二抗(1∶10 000稀释)室温摇晃孵育1 h。增强型化学发光(enhanced chemiluminescence,ECL)试剂盒显色,暗室发光显影。扫描胶片,采用Quantity-One(Biorad公司)软件对条带进行灰度分析。
1.2.6 实时PCR(real-time PCR) 各组细胞弃培养基,PBS洗3次,加入1 ml Trizol。按Trizol法提取总RNA,测定浓度及纯度,A260/280比值在1.7~1.8之间满足实验要求。按照TaRaRa Prime ScriptTM试剂盒产品说明书进行逆转录cDNA。使用Takara SYBR荧光染料,配制20 μl反应体系:10 μl 2×SYBR Premix Ex TaqⅡ(Tli RNaseH Plus),PCR正向、反向引物(10 μmol/L)0.8 μl,0.4 μl ROX Reference Dye,2.0 μl CDNA,6.0 μl dH2O。反应条件:95℃ 3 min热变性;95℃ 5 s变性、60℃ 31 s退火40个循环;95℃ 15 s、60℃ 30 s、95℃ 15 s熔解。每个样本设2~3个复孔,其中GAPDH为内参。采用诱导型一氧化碳合酶(inducible nitronic oxide synthase,iNOS)、IL-6 及MCP-1标记M1型巨噬细胞;精氨酸酶1(arginase-1,Arg-1)和甘露醇受体(mannitol receptor,CD206)标记M2型巨噬细胞;溶酶体标志物[如溶酶体膜相 关 蛋 白 1(lysosomal membrane associated protein 1,LAMP-1)、溶酶体膜相关蛋白2(lysosomal membrane associated protein 2,LAMP-2)及溶酶体整合膜蛋白2(lysosome integral membrane protein 2,LIMP-2)]目的基因mRNA的相对表达量根据2-△△Ct的公式及方法进行换算。本研究所用引物序列见附表。
1.2.7 免疫荧光观察溶酶体发生情况 将上述处理的3组细胞以合适密度接种于置有玻片的6孔板中,行细胞免疫荧光染色。弃上清液,PBS洗4次,4%多聚甲醛固定5 min,PBS洗4次;0.2% Triton X-100室温通透10 min,PBS洗3次;10%山羊血清封闭1 h,弃掉血清,加入PBS稀释的抗LAMP-1、LAMP-2、LIMP-2抗体(1∶100),4℃过夜;PBS洗3次,加入Alexa Fluor 488/555标记的荧光二抗(1∶100)室温避光孵育1 h,PBS洗3次;PBS稀释DAPI(1∶200)染细胞核1 min,PBS洗3次,去离子水漂洗,抗淬灭封片剂封片。在共聚焦显微镜下观察、照像。
1.2.8 溶酶体抑制剂可影响巨噬细胞极化 在分别经LPS+IFN-γ和IL-4刺激诱导M1型和M2型巨噬细胞中同时各加入25 μmol/l氯喹刺激24 h,流式细胞术检测M1型、M2型巨噬细胞比例(方法同1.2.3)。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,两组比较采用独立样本t检验;多组间比较用单因素方差分析(One-way,ANOVA),组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 诱导后细胞形态学改变
与对照组RAW264.7细胞比较,经LPS+IFN-γ诱导M1型极化组中,细胞形态呈小圆型,伪足少;经IL-4刺激诱导M2型极化中,细胞形态呈长梭型,伪足多。见图1。
2.2 M1、M2型巨噬细胞诱导比例
M1型及M2型巨噬细胞均表达巨噬细胞标志物F4/80。此外,M1型巨噬细胞特异性表达CD16/32,而M2型巨噬细胞特异性表达CD206。流式细胞术结果显示,经LPS+IFN-γ诱导M1型极化组中,PE-F4/80、FITC-CD16/32双阳性的M1型巨噬细胞比例较对照组增加[与对照组比较,(83.18±3.07)%vs(24.33±2.95)%;t=13.81,P=0.000]。经IL-4诱导M2型极化组中,PE-F4/80、FITC-CD206双阳性的M2型巨噬细胞比例较对照组增加[与对照组比较,(42.79±2.70)% vs (5.90±1.08)%;t=12.63,P=0.000]。见图2。

附表 引物序列

图1 巨噬细胞形态 (相差显微镜×20)
2.3 细胞培养上清液中炎症因子水平
ELISA结果显示,经LPS 100 ng/ml+IFN-γ 20 ng/ml刺激诱导M1型巨噬细胞培养上清中TNF-α和MCP-1含量高于对照组(与对照组比较,tTNF-α=10.96,PTNF-α=0.000 和tmcp-1=66.07,Pmcp-1=0.000),而 经 IL-4 20 ng/ml刺激诱导M2型巨噬细胞培养上清中IL-10和TGF-β1较对照组增多(与对照组比较,tIL-10=10.18,PIL-10=0.001 和tTGF-β1=8.821,PTGF-β1=0.001)。见图 3。
2.4 M1、M2型巨噬细胞表面分子及溶酶体相关分子表达
各组iNOS、TNF-α和CD206蛋白水平比较,经方差分析,差异有统计学意义(FiNOS=2700,PiNOS=0.000;FTNF-α=97.197,PTNF-α=0.000 ;FCD206=535.79,PCD206=0.000)。与对照组比较,在经LPS+IFN-γ向M1型诱导的巨噬细胞中高表达iNOS和TNF-α蛋白(PiNOS=0.001;PTNF-α=0.018);经 IL-4向 M2型 诱 导的巨噬细胞高表达CD206蛋白(PCD206=0.003)。各组LAMP-1、LAMP-2及LIMP-2蛋白水平比较,经方差分析,差异有统计学意义(FLIMP-2=120.537,PLIMP-2=0.000;FLAMP-2=121.437,PLAMP-2=0.000;FLAMP-1=99.771,PLAMP-1=0.000)。与对照组比较,LAMP-1、LAMP-2及LIMP-2蛋白在M1型巨噬细胞中的低表达(PLIMP-2=0.001,PLAMP-2=0.001,PLAMP-1=0.001),而在M2型巨噬细胞中高表达(PLIMP-2=0.000,PLAMP-2=0.000,PLAMP-1=0.000)。见图 4。

图2 M1、M2型巨噬细胞比例 (流式细胞术)

图3 细胞培养上清液中炎症因子水平
2.5 M1、M2型巨噬细胞表面分子及溶酶体相关分子表达
各组iNOS、IL-6、MCP-1、Arg-1和CD206 mRNA水平比较,经方差分析,差异有统计学意义(FiNOS=4850.693,PiNOS=0.000;FIL-6=377.775,PIL-6=0.000;FMCP-1=10682.159,PMCP-1=0.000;FArg-1=757.883,PArg-1=0.000;FCD206=326.235,PCD206=0.000)。与对照组比较,在经LPS+IFN-γ向M1型诱导的巨噬细胞中iNOS、IL-6和MCP-1 mRNA表达水平升高(均P=0.000),而在经IL-4向M2型诱导的巨噬细胞中Arg-1和CD206 mRNA水平高于对照组和LPS+IFN-γ组(均P=0.000)。同时,各组细胞中LAMP-1、LAMP-2及LIMP-2 mRNA水平比较,经方差分析,差异有统计学意义(FLIMP-2=436.174,PLIMP-2=0.000;FLAMP-2=1403.731,PLAMP-2=0.000;FLAMP-1=308.116,PLAMP-1=0.000)。与对照组比较,在LPS+IFN-γ向M1型诱导细胞中LAMP-1、LAMP-2及LIMP-2 mRNA降低(均P=0.000),而且在M2组细胞中升高(均P=0.000)。见图5。


图4 M1、M2型巨噬细胞表面分子及溶酶体相关分子表达 (Western blot)

图5 M1、M2型巨噬细胞表面分子及溶酶体相关分子表达 (real-time PCR)
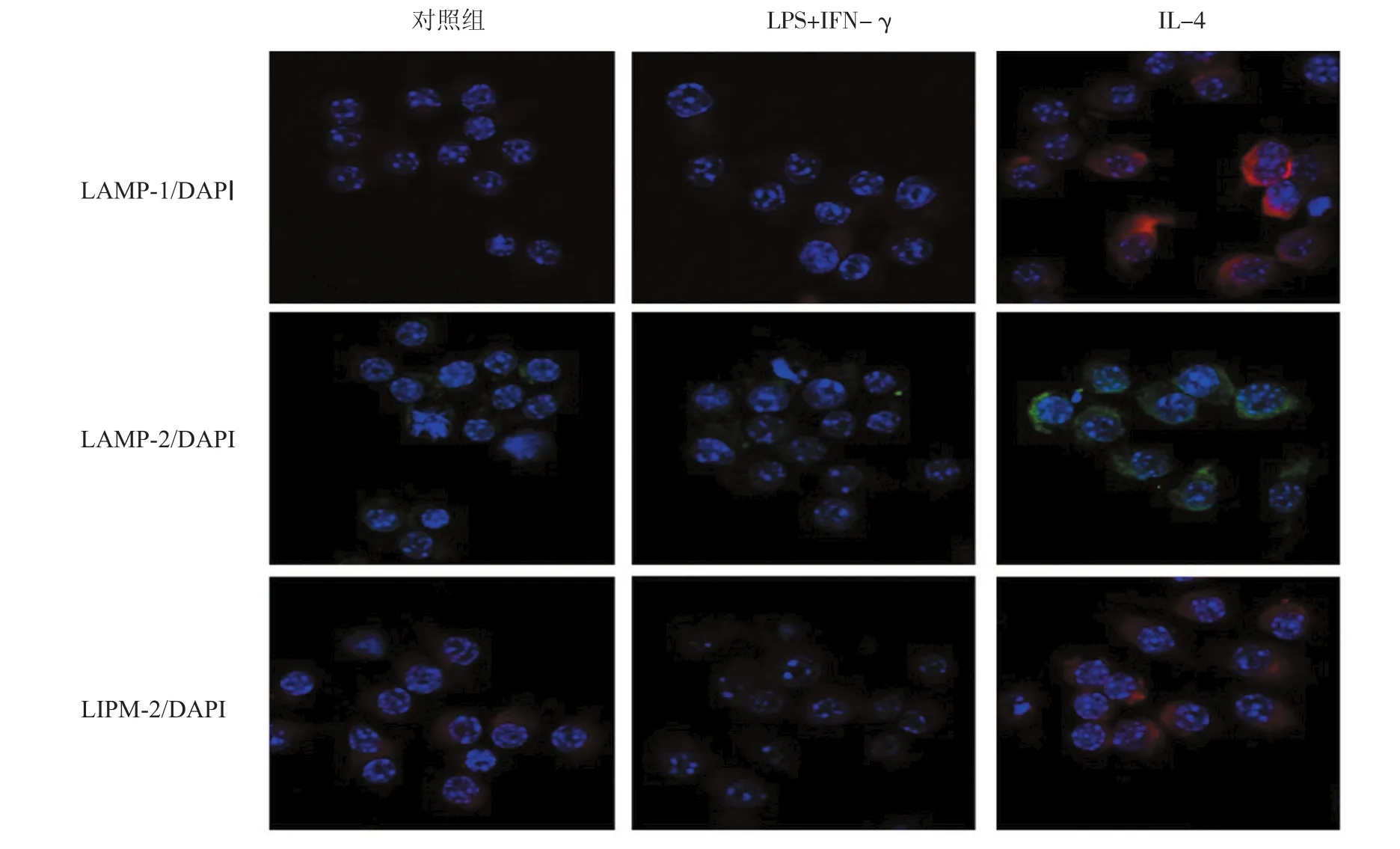
图6 M1、M2型巨噬细胞溶酶体 (免疫荧光×40)
2.6 M1、M2型巨噬细胞中溶酶体发生情况
M1型巨噬细胞中红色荧光标记的LAMP-1、LIMP-2以及绿色荧光标记的LAMP-2少于未刺激组和M2组,而在M2型巨噬细胞中LAMP-1、LIMP-2及LAMP-2都多于未刺激组和M1组。见图6。
2.7 溶酶体抑制剂对巨噬细胞极化的作用
为进一步明确溶酶体与巨噬细胞极化的关系,在M1组和M2组中加入溶酶体抑制剂氯喹(chloroquine),流式细胞术结果显示,在LPS+IFN-γ+chloroquine组PE-F4/80、FITC-CD16/32双阳性的M1型巨噬细胞比例较LPS+IFN-γ组增加[与LPS+IFN-γ组比较,(85.33±1.333)%vs(73.52±2.348)% ;t=4.377,P=0.012]。同时,在 IL-4+chloroquine组 PE-F4/80、FITC-CD206双阳性的M2型巨噬细胞比例较IL-4组降低[与IL-4组比较,(42.79±2.702)% vs (21.02±1.528)% ;(t=7.021,P=0.002)]。见图 7。

图7 M1型、M2型巨噬细胞比例 (流式细胞术)
3 讨论
巨噬细胞是一种重要、多功能的细胞,在先天性免疫和获得性免疫系统中扮演着极为重要的角色。同时,巨噬细胞具有高度的可塑性,在不同环境的刺激下巨噬细胞可极化为经典活化巨噬细胞M1型和替代性活化巨噬细胞M2型,两者极化功能几乎相互拮抗,M1、M2型巨噬细胞之间的平衡,是维持机体稳定的重要方面[9-11]。近年来研究发现,巨噬细胞极化表型与动脉粥样硬化(atherosclerosis,AS)密切相关。在急性炎症反应初期和进展期,巨噬细胞主要表现为M1型,参与病原体吞噬并促发炎症反应;在急性炎症的消退期,巨噬细胞则由M1型转分化为具有抗炎作用的M2型,抑制过度的炎症反应,促进损伤组织的修复。在AS发生过程中,M1型巨噬细胞吞噬脂蛋白,分泌促炎因子,参与炎症反应,促进AS发生和演进;而M2型巨噬细胞分泌抑炎因子,增强细胞清除能力,抑制炎症反应,促进斑块稳定和消退。但AS演进过程中,由于脂质和炎症刺激持续存在,使斑块中M1型巨噬细胞长期占主要位置,不能顺利转化为M2型巨噬细胞,因此呈现为一种长期慢性炎症,导致AS难以消退和修复[4-5]。因此,若能明确调节M1型和M2型巨噬细胞极化的具体分子及其调控的分子机制,有望在AS的防治中进行有效干预。目前多项研究表明,巨噬细胞极化是1个多因子、多环节相互作用的复杂过程,受多种信号分子及通路的调控。迄今研究较为成熟的信号通路有:PI3K/Akt、C-Jun N-terminal kinase(JNK)、Notch 以及B7-H3-STAT3等信号通路[12-14]。最新研究发现,溶酶体在巨噬细胞极化表型调控中也起着重要作用。M1型巨噬细胞中溶酶体的稳定性较M2型降低,表现为溶酶体组织蛋白酶严重渗漏,细胞吞噬能力下降,易演进成泡沫细胞。2014年XU等研究发现,溶酶体在脂肪巨噬细胞M2型极化中起重要作用,抑制溶酶体功能会引起巨噬细胞脂质降解能力降低,发生脂代谢紊乱,形成泡沫细胞[15-16]。根据以上研究结果表明溶酶体参与并影响巨噬细胞极化过程,但是都未明确溶酶体在巨噬细胞极化中的作用。因此,本研究的目的是探讨溶酶体在巨噬细胞极化中的作用。
本流式细胞术检测结果显示,PE-F4/80、FITCCD16/32双阳性标记的M1型巨噬细胞比例达88.85%,PE-F4/80、FITC-CD206双阳性标记的M2型巨噬细胞比例达41.93%。与文献中报道的诱导比例相同[9]。为进一步标记M1和M2型巨噬细胞,本研究选择目前研究公认的标志物,如iNOS、TNF-α标记M1型巨噬细胞;CD206标记M2型巨噬细胞。不仅从蛋白水平及转录水平分别验证建立巨噬细胞极化模型,而且本研究分别从M1和M2型巨噬细胞功能上验证建立极化模型。结果显示,M1型巨噬细胞中高表达iNOS、TNF-α蛋白并大量分泌促炎症因子MCP-1、TNF-α;而M2型巨噬细胞中高表达CD206蛋白并大量分泌抑炎因子IL-10、TGF-β1。根据以上结果表明成功建立巨噬细胞极化模型。
本研究发现,溶酶体标志物(LAMP-1、LAMP-2及LIMP-2)转录及蛋白水平表达在M1型极化组中降低,而在M2型极化组中增加,与免疫荧光结果一致。最后,给予溶酶体抑制剂氯喹(chloroquine)刺激巨噬细胞,流式细胞术检测M1、M2型巨噬细胞比例。其结果示溶酶体抑制剂氯喹处理可降低M2型极化比例,增加M1型极化比例。目前研究认为,氯喹作为自噬-溶酶体抑制剂,其主要作用是抑制内体成熟,改变其酸性环境[17]。但具体地分子机制尚不明确,笔者推测氯喹可能改变溶酶体的酸性环境来影响巨噬细胞极化。
综上所述,不同的微环境下巨噬细胞有着不同功能形式的表型并参与多种疾病的病理过程。M1型巨噬细胞虽然可以分泌多种促炎症因子诱发机体的炎症,但是M1型分泌的肿瘤坏死因子TNF-α在抑制肿瘤的发生、发展中发挥巨大作用;而M2型巨噬细胞作为机体中的抑制炎症细胞,可以促进肿瘤的发生、发展[18]。因此,平衡M1型和M2型巨噬细胞的极化,可以有效的干预不同疾病的病理过程。溶酶体作为巨噬细胞行使功能的重要细胞器,其结构和数量的稳定是维持巨噬细胞正常功能的重要方面。研究表明溶酶体在巨噬细胞极化过程中有着重要作用,为巨噬细胞新的极化调控机制提供实验依据和理论线索,并为多种巨噬细胞极化相关疾病的防治提供新的干预靶点。
[1]YUGAMI M, ODAGIRI H, ENDO M, et al. Mice deficient in angiopoietin-like protein 2 (Angptl 2) gene show increased susceptibility to bacterial infection due to attenuated macrophage activity[J]. J Biol Chem, 2016, 291(36): 18843-18852.
[2]VIEGAS C S B, COSTA R M, SANTOS L, et al. Gla-rich protein function as an anti-in fl ammatory agent in monocytes/macrophages:Implications for calcification-related chronic inflammatory diseases[J]. PLos One, 2017, 12(5): e0177829.
[3]CHUNG S, RANJAN R, LEE Y G, et al. Distinct role of FoxO1 in M-CSF-and GM-CSF-differentiated macrophages contributes LPS-mediated IL-10: implication in hyperglycemia[J]. J Leukoc Biol,2015, 97(2): 327-339.
[4]LIU G and YANG H. Modulation of macrophage activation and programming in immunity[J]. J Cell Physiol, 2013, 228(3): 502-512.
[5]FANG S, XU Y, ZHANG Y, et al. Irgm1 promotes M1 but not M2 macrophage polarization in atherosclerosis pathogenesis and development[J]. Atherosclerosis, 2016, 251: 282-290.
[6]SOLINAS G and BECATTINI B. JNK at the crossroad of obesity,insulin resistance, and cell stress response[J]. Mol Metab, 2017,6(2): 174-184.
[7]SAFTIG P and KLUMPERMAN J. Lysosome biogenesis and lysosomal membrane proteins: traf fi cking meets function[J]. Nat Rev Mol Cell Biol, 2009, 10(9): 623-635.
[8]TABAS I and BORNFELDT K E. Macrophage phenotype and function in different stages of atherosclerosis[J]. Circ Res, 2016,118(4): 653-667.
[9]ANTONIOS J K, YAO Z, LI C, et al. Macrophage polarization in response to wear particles in vitro[J]. Cell Mol Immunol, 2013,10(6): 471-482.
[10]DUEWELL P, KONO H, RAYNER K J, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010, 464(7293): 1357-1361.
[11]LODDER J, DENAES T, CHOBERT M N, et al. Macrophage autophagy protects against liver fibrosis in mice[J]. Autophagy,2015, 11(8): 1280-1292.
[12]张颖,王永福. 巨噬细胞极化相关机制的研究进展[J]. 细胞与分子免疫学杂志 ,2016,32(11): 1570-1574.
[13]马坚妹. 巨噬细胞极化表型与转录因子调节[J]. 大连医科大学学报 ,2017,39(1): 1-7.
[14]孙康,瞿建国,陈吉祥. 干扰素调节因子5(IRF5)调控小鼠骨髓源性巨噬细胞的极化[J]. 细胞与分子免疫学杂志,2017,2:168-173.
[15]OKAHASHI N, NAKATA M, KUWATA H, et al. Streptococcus oralis induces lysosomal impairment of macrophages via bacterial hydrogen peroxide[J]. Infect Immun, 2016, 84(7): 2042-2050.
[16]XU X, GRIJALVA A, SKOWRONSKI A, et al. Obesity activates a program of lysosomal-dependent lipid metabolism in adipose tissue macrophages independently of classic activation[J]. Cell Metab, 2013, 18(6): 816-830.
[17]YE H, CHEN M, CAO F, et al. Chloroquine, an autophagy inhibitor, potentiates the radiosensitivity of glioma initiating cells by inhibiting autophagy and activating apoptosis[J]. BMC Neurol,2016, 16(1): 178.
[18]LAM R S, O’BRIEN-SIMPSON N M, HOLDEN J A, et al.Unprimed, M1 and M2 macrophages differentially interact with porphyromonas gingivalis[J]. PLoS One, 2016, 11(7): e0158629.
