外泌体在前列腺癌发展和转移中的作用*
2018-03-05吴维江娟吕磊梁嘉前孙莹袁敬东章传华周高峰
吴维,江娟,吕磊,梁嘉前,孙莹,袁敬东,章传华,周高峰
(湖北省武汉市第一医院 泌尿外科,湖北 武汉 430022)
近年来我国男性前列腺癌的发病率和死亡率呈上升趋势,且我国大多数前列腺癌患者在初诊时就已经出现转移,给临床治疗带来极大的挑战[1-3]。外泌体(Exosomes)是细胞通过胞内体内陷形成多泡体再与细胞膜融合释放,该种细胞脂质双层膜结构,直径大约40~100 nm[4]。外泌体携带母体细胞特征性生物信息分子(如脂质,蛋白质,DNA,mRNA,miRNA),并可作为细胞间运输载体将该生物分子传递给其他细胞[5-6],参与多种生物学行为。研究证实,外泌体不仅存在于体外培养的细胞上清中,且大量存在于机体的血液、尿液和唾液等体液和疾病状态下的胸水、腹水之中[7-9]。其中,外周血中的外泌体与多种疾病如心血管疾病和恶性肿瘤密切相关,并可作为这些疾病诊断的重要潜在标志物[10-12]。本研究的目的是比较正常人和前列腺患者外周血外泌体的含量,并探究外泌体在前列腺癌远处转移中的作用。
1 资料与方法
1.1 临床资料
选取2016年1月1日-2016年12月31日于武汉市第一医院泌尿外科就诊的前列腺癌患者16例。手术切除16例前列腺癌标本及相应瘤旁组织,所有标本均由2位病理医师独立诊断,并结合患者临床表现、影像学及组织学特点确诊。患者年龄54~72岁,中位年龄61.81岁。所有患者均无饮酒爱好,多数患者无吸烟爱好。标本获取前均告知患者并签署知情同意书,研究方案经武汉市第一医院伦理委员会批准。
1.2 外泌体检测
1.2.1 材料和设备 DMEM培养基、胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphate buffered solution,PBS)及双抗(青霉素+链霉素)、胰蛋白酶(购自美国Hyclone公司),MTT、DAPI封片剂(购自武汉谷歌生物科技有限公司),Ki-67、CD63、CD9、GAPDH一抗(购自美国Sigma公司),细胞培养耗材(购自无锡耐思生物科技有限公司)。
1.2.2 外泌体的分离与纯化 用含抗凝剂的真空采血管收集前列腺癌者5 ml静脉血样品;并转移至离心管中,4℃条件下,1 000 r/min离心20 min,取上清液,加入上清体积3倍的无菌PBS稀释血清;4℃条件下4 600 r/min离心20 min;取上清液,并将上清液以0.2 μm滤器过滤,最后4℃条件下34 000 r/min离心70 min,得到沉淀,并以150 μl无菌PBS重悬沉淀,即获得外泌体。以BCA法测定外泌体蛋白浓度,置于-80℃冰箱冷冻保存备用。收集细胞培养上清,以上述离心方法收集细胞上清中外泌体。
1.2.3 外泌体形态表征 取10 μl外泌体PBS垂悬液滴于碳支持膜铜网上,室温孵育5 min,滤纸吸干铜网;将铜网置于1%磷钨酸复染液中染色,3 min后滤纸吸干液体,自然晾干铜网;将铜网置于Hitachi HT7700型透射电镜上观察、拍照,测量外泌体粒径大小。将PBS重悬的外泌体样品吸附至镍网上,自然风干;2.5%的戊二醛固定10 min,PBS漂洗3次;加入CD63抗体20 ml(1∶100)或CD9抗体20 ml(1∶100)于37℃孵育2 h,PBS漂洗3次,加入金标二抗20 ml(1∶100)于37℃孵育1 h,PBS漂洗3次;醋酸铀负染5 min,以滤纸吸干染液;待样品干燥后置于透射电镜下观察。
1.2.4 Western blot 收集蛋白,并用BCA蛋白定量检测试剂盒测定蛋白浓度。按所测蛋白浓度计算样品(蛋白上样量为20 μg)和上样缓冲液体积后,将其混合并置于95℃水浴锅中水浴5 min。配制10%SDS-聚丙烯酰胺凝胶(SDS-PAGE),80 V恒压下蛋白电泳至分离胶与浓缩胶界面时换为120 V电压,然后200 mA,2 h恒流下将蛋白转至PVDF膜。封闭2 h后,分别以 CD63(1∶ 1 000)、CD9(1∶ 1 000)、Cyclin D1(1 ∶ 1 000)、phospho-Rb(pRb,1 ∶ 1 000)、GAPDH(1∶10 000)抗体4℃孵育过夜。TBST洗膜3次,每次10 min。相应二抗室温孵育2 h,TBST洗膜3次,每次10 min。化学发光剂显色后,蛋白凝胶成像系统分析样品中目标蛋白的相对含量。
1.2.5 细胞培养 前列腺细胞系LNCap细胞来源于中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)。LNCap细胞培养于含10%FBS的DMEM培养基中,隔天换液,每3天传代1次;细胞培养环境为37℃、约95%湿度、5%二氧化碳CO2浓度。
1.2.6 MTT实验 收集对数期细胞,调整细胞悬液浓度加入96孔板:每孔加入100 μl,使细胞调密度1 000~10 000/孔。细胞分为对照组和实验组,实验组细胞分别加入终浓度为5、10和15 μg/ml前列腺癌患者来源的外泌体。5% CO2,37℃孵育0~72 h,每孔加入10 μl MTT溶液(5 mg/ml),继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入100 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD490 nm处测量各孔的吸光值,并与对照组0 h的吸光度值比较。
1.2.7 细胞活力检测 收集对数期细胞,调整细胞悬液浓度加入12孔板:每孔加入2 ml,使细胞调密度5×105/孔。细胞分为对照组和实验组,实验组细胞分别加入终浓度为15 μg/ml前列腺癌患者来源的外泌体。5% CO2,37℃孵育24 h,终止培养,小心吸去孔内培养液,消化细胞,细胞活力仪器检测细胞活力。
1.2.8 免疫组织化学染色 标本取材后切成小块组织,4%多聚甲醛固定标本、流水冲洗后,梯度酒精脱水、石蜡包埋及组织切片(4 μm)。然后二甲苯脱蜡、梯度酒精入水、高压抗原修复、羊血清37℃孵育切片20 min,甩去血清,滴加CD63一抗(1∶200),4℃孵育过夜。滴加相应辣根过氧化物酶标记的二抗约50 μl完全覆盖切片,37℃孵育切片20 min。PBS缓冲液漂洗后,滴加链霉亲和素-过氧化物酶,37℃孵育切片20 min。PBS缓冲液漂洗后,于光学显微镜下显色。苏木素复染细胞核后流水冲洗15 min后,梯度酒精脱水,切片晾干后行二甲苯透明及中性树胶封片过夜。光学显微镜随机拍摄5个高倍视野(×200)/张切片,利用Image-Pro Plus软件统计CD63着色强度。染色评分由2位经验丰富的病理医师进行双盲阅片完成,取其平均值。
1.2.9 外泌体对前列腺癌肺转移模鼠的影响 将对数生长期的LNCap细胞以PBS重悬,使细胞密度为1×107个/ml。将200 μl含有细胞的PBS悬液经尾静脉注入裸鼠体内(每组各10只)。实验组老鼠,每3天经尾静脉注射1次外泌体(50 μg/次),连续注射3次。观察期结束后,安乐死动物,收获肺组织切片脱蜡、梯度酒精入水后,滴加适量ki-67(鼠源)和CD-63(兔源)一抗,37℃孵育1 h;PBS洗去抗体;滴加适量对应二抗,37℃避光孵育30 min,PBS洗去抗体;以含DAPI封片剂封片;最后置于荧光显微镜下观察并拍照成像。
1.3 统计学方法
数据分析采用GraphPad Prism 6.0软件,计量资料以均数±标准差(±s)表示,两两比较用t检验,3组及3组以上采用单因素方差分析(One-way-ANOVA)及重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的分离和鉴定
按图1A所示的程序,离心法收集前列腺患者外周血中的外泌体。将离心所得沉淀以PBS垂悬后,置于透射电镜下观察:分离所得的沉淀呈双层膜结构,大小范围为20~100 nm,其中30~60 nm的双层膜结构最多(见图1B)。Western blot结果提示,离心分离的沉淀中高表达CD63和CD9(见图1C)。免疫电镜结果进一步提示,CD63、CD9表达的位置位于双侧膜结构外膜(见图1D)。上述鉴定结果显示分离所得的沉淀的粒径分布范围和表面标志分子的表达均与报道的文献结果一致[13],证明本研究分离所得的沉淀为外泌体。
2.2 前列腺癌患者外周血外泌体水平
分别收集正常人和前列腺癌患者外周血外泌体,以BCA法测定外泌体总蛋白含量。结果发现,前列腺癌患者外泌体含量为(27.69±11.66)μg/ml,高于正常人外周血中外泌体含量(7.41±5.2)μg/ml(见图2A),差异有统计学意义(t=6.313,P=0.000)。16例前列腺癌患者分为无远处转移(n=6)和伴发远处转移(n=10)两组,并进一步分析两组患者外周血外泌体含量。见图2B所示,伴远处转移的前列腺癌患者外周血中外泌体含量(33.40±10.45)μg/ml<无远处转移前列腺癌患者外周血中外泌体含量(18.17±5.96)μg/ml,差异有统计学意义(t=3.055,P=0.0086)。以上结果提示外泌体可能在前列腺癌的进展中起重要作用。同时,前列腺癌中CD63组织学评分(2.04±0.61)高于癌旁正常前列腺组织组织学评分(0.55±0.21),差异有统计意义(t=3.870,P=0.000)。见图2C、2D。
2.3 前列腺癌患者外泌体对前列腺癌细胞增殖和外泌体分泌的影响
为进一步研究外泌体在前列腺发展中的作用,评估外泌体对前列腺癌细胞活力和增殖能力的影响。实验组和对照组数据的方差分析,结果:不同浓度外泌体处理24 h后细胞活力无差异(F=0.360,P=0.836)(见图3A),不同浓度的外泌体对细胞活力无影响。MTT实验证实,不同浓度处理后的细胞增殖活性有差异(F=0.650,P=0.018)。实验组间细胞增殖活性有差异(F=0.845,P=0.025),外泌体浓度越高,细胞增殖活性越高。实验组和对照组细胞增殖活性变化趋势有差异(F=0.576,P=0.015),见图 2B。

图1 前列腺癌患者外周血外泌体的分离和鉴定
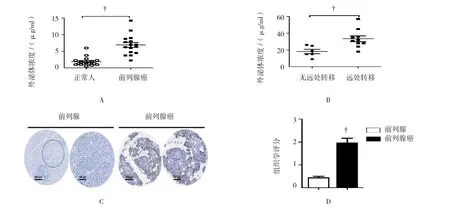
图2 前列腺癌患者外周血外泌体含量
Western blot实验显示 Cyclin D1(F=0.725,P=0.027)和 pRb(F=0.618,P=0.015)高于对照组细胞。实验组间细胞增殖活性有差异(F=0.320,P=0.014),外泌体浓度越高,Cyclin D1和pRb表达水平越高。实验组和对照组细胞增殖活性变化趋势有差异(F=0.576,P=0.015),见图3B、3C。收集外泌体处理组和对照组细胞培养上清液,并分离上清中外泌体。BCA测定外泌体总蛋白后发现,外泌体处理组细胞外泌体分泌量大于对照组细胞外泌体产量(F=0.451,P=0.027)(见图3D),且促进作用具有浓度依赖性。
2.4 外泌体对前列腺癌肺转移裸鼠的影响
注射外泌体组裸鼠肺部转移灶数目(16.28±6.94)多于对照组(4.72±2.51)差异有统计学意义(t=5.265,P=0.000)(见图4A、B)。肺组织切片H&E染色结果进一步证实,单位面积内肺转移灶面积大于对照组(见图4C)。外泌体处理组裸鼠存活时间较对照组组裸鼠存活时间短,差异有统计学意义(见图4D)(χ2=6.606,P=0.000)。肺转移灶免疫荧光分析结果显示,外泌体处理组转移瘤标本中CD63和Ki-67表达水平高于对照组(见图5A、B),差异有统计学意义(t=4.238,P=0.0067)。

图3 前列腺癌患者外泌体对前列腺癌细胞增殖和外泌体分泌的影响

图4 前列腺癌患者外泌体对前列腺癌肺转移裸鼠的影响

图5 肺转移灶中CD63和Ki-67的表达
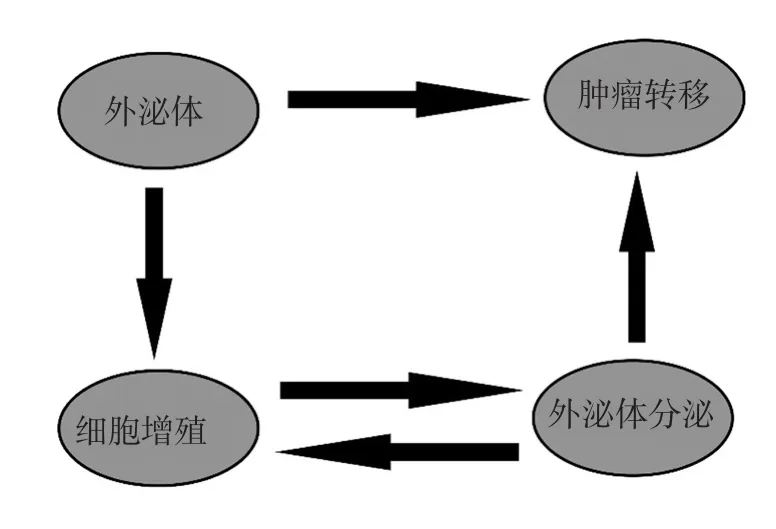
图6 外泌体在前列腺癌发展和转移中的作用
3 讨论
尽管外泌体最初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物[14]。然而最近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。该发现点燃了人们对细胞分泌膜泡的兴趣。最近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、肿瘤的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。近期有学者报道,乳腺癌细胞来源的外泌体可在肺部或肝部形成利于乳腺癌细胞生成的微环境,为迎接癌细胞向上述器官转移铺平道路[15]。说明外泌体在肿瘤转移中起前锋作用。我国大多数前列腺癌患者在初诊时就已经出现转移,远处转移最常见于骨转移和肺转移。前列腺癌细胞来源的外泌体在前列腺癌的远处转移中是否起作用作用目前尚无文献报道。
本研究结果显示,前列腺癌患者外周血外泌体浓度高于正常人。此外,伴远处转移的前列腺癌患者外周血中外泌体的含量对于无远处转移前列腺癌患者。提示外泌体可能在前列腺癌的发生和发展中起重要作用。并且前列腺癌患者外周血外泌体可以提高前列腺癌细胞的增殖活性。随后在肺转移模型中发现,前列腺癌患者来源的外泌体在裸鼠体内可促进前列腺癌细胞的肺转移。该结果可解释伴远处转移的前列腺患者外周血中外泌体的含量高于无远处转移的前列腺癌患者。同时,上述结果还显示,外泌体可促进前列腺癌的发展,并加速前列腺癌的远处转移。此外,还发现,前列腺癌患者来源的外泌体还可以提高前列腺癌细胞分泌外泌体的能力,促进前列腺癌细胞分泌更多的外泌体。笔者推测,外泌体分泌的增加,导致患者外周血中外泌体含量的进步一提高,从而进一步促进前列腺癌的发展和转移,并诱使细胞分泌更多的外泌体,形成1个正反馈环(见图6),最终导致前列腺癌发展加速和远处转移的形成。
总之,本研究发现:①前列腺癌患者外周血外泌体含量高于正常人;②伴远处转移的前列腺癌患者外泌体含量高于无远处转移前列腺患者;③外泌体促进前列腺细胞增殖和外泌体分泌;④外泌体促进前列腺癌的远处转移。本研究的结果有助于理解前列腺癌的发生、发展以及转移转移的机制,以期寻找更好的治疗方法。
[1]韩苏军, 张思维, 陈万青, 等. 中国前列腺癌发病现状和流行趋势分析[J]. 临床肿瘤学杂志, 2013, 18(4): 330-334.
[2]李汉忠, 张玉石. 2016年前列腺癌诊治热点回顾[J]. 中华外科杂志, 2017, 55(1): 59-62.
[3]叶定伟, 朱耀. 中国前列腺癌的流行病学概述和启示[J]. 中华外科杂志, 2015, 53(4): 249-252.
[4]MAUSE S F, WEBER C. Microparticles: protagonists of a novel communication network for intercellular information exchange[J].Circulation research, 2010, 107(9): 1047-1057.
[5]KANADA M, BACHMANN M H, HARDY J W, et al. Differential fates of biomolecules delivered to target cells via extracellular vesicles[J]. Proceedings of the National Academy of Sciences,2015, 112(12): E1433-E1442.
[6]CHEN G, ZHU J Y, ZHANG Z L, et al. Transformation of cellderived microparticles into quantum-dot-labeled nanovectors for antitumor siRNA delivery[J]. Angewandte Chemie (International ed in English), 2015, 54: 1036-1040.
[7]PICCIN A, MURPHY W G, SMITH O P. Circulating microparticles: pathophysiology and clinical implications[J]. Blood Reviews, 2007, 21(3): 157-171.
[8]OROZCO A F, LEWIS D E. Flow cytometric analysis of circulating microparticles in plasma[J]. Cytometry A, 2010, 77(6): 502-514.
[9]MRVAR-BRECKO A, SUSTAR V, JANSA V, et al. Isolated microvesicles from peripheral blood and body fl uids as observed by scanning electron microscope[J]. Blood Cells Mol Dis, 2010,44(4): 307-312.
[10]REN J G, MAN Q W, ZHANG W, et al. Elevated level of circulating platelet-derived microparticles in oral cancer[J].Journal of Dental Research, 2016, 95(1): 87-93.
[11]BEREZIN A, ZULLI A, KERRIGAN S. Predictive role of circulating endothelial-derived microparticles in cardiovascular diseases[J]. Clinical Biochemistry, 2015, 48(9): 562-568.
[12]AMABILE N, HEISS C, REAL W M, et al. Circulating endothelial microparticle levels predict hemodynamic severity of pulmonary hypertension[J]. American Journal of Respiratory and Critical Care Medicine, 2008, 177(11): 1268-1275.
[13]SIMONS M, RAPOSO G. Exosomes-vesicular carriers for intercellular communication[J]. Current Opinion in Cell Biology,2009, 21(4): 575.
[14]TAYLOR D D, GERCELTAYLOR C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecologic Oncology, 2008, 110(1): 13-21.
[15]AYUKO H, BRUNO C S, SHEN T L, et al. Tumour exosome integrins determine organotropic metastasis[J]. Nature, 2015,527(7578): 329.
