微滴式数字PCR对肉制品中羊肉和猪肉定量分析
2018-03-01陈晨张岩李永波李鹏李永艳张涛张薇周巍张志胜
陈晨,张岩,李永波,李鹏,李永艳,张涛,张薇,周巍,张志胜
(1.河北农业大学食品科技学院,河北保定 071000)(2.河北省食品检验研究院,河北省食品安全重点实验室,河北石家庄 050071)(3.32142部队厨师培训中心,河北保定 071000)
随着我国经济高速发展,不同肉类价格差异,使“掺杂使假”成为食品加工、流通和餐饮中存在的重要问题[1]。一些不法商贩用一些廉价肉冒充高价肉进行出售,这对于市场的监管是不利,这需要有关部门建立相关的检测方法。PCR技术是检测动物源性成分中发展较为完善、灵敏度及准确度都相对较好的技术手段[2,3]。用现有常见的荧光PCR进行检测不能区分是故意掺假还是加工过程中无意的带入,这就给监管部门带来了一定的困难,需要可靠的定量技术作为依托。
荧光PCR鉴别动物源性成分,一般根据线粒体进行特异性引物的设计。线粒体基因进化速度快,物种的区分度高,在科研上宜为物种分类的靶基因[4~8]。但不同物种中线粒体的拷贝数不同,对于物种的定量具有局限性。与线粒体相比,看家基因属于单拷贝基因,有利于量化分析[9]。王珊等[10]建立了一种定量检测羊肉制品中羊源性成分与猪源性成分的方法。René等[3]开始探索定量分析食品中的动物源性成份的技术方法,利用单拷贝基因设计引物,进行荧光PCR检测,可以达到定量的检测。宋丽萍等[11]根据猪的单拷贝基因β-actin和绵羊的单拷贝基因催乳素受体所设计的特异性引物,对于猪和羊的定量检测取得了满意的效果。
聚合酶链式反应(polymerase chain reaction,PCR)提出至今已有20年时间,期间PCR已发展成为分子生物学领域的一项关键技术和常规技术,极大地推动了生命科学各个领域的发展[12]。dPCR构想最早于1992年由Sykes等[13]基于样品稀释和泊松分布数据处理的巢式PCR定量技术而提出。20世纪末,Vogelstein等提出数字PCR( digital PCR,dPCR)的概念[14]。微滴式数字PCR方法与实时荧光PCR方法相比较,无需标准曲线,下限可调至单拷贝,阳性微滴计算直接且准确[15,16]。本方法无需依靠标准曲线或参照基因,可直接得出DNA拷贝数,是对起始样品的绝对定量[17]。因此该技术广泛应用于物种鉴定[18]、病原检测[19]、转基因[20,21]及肉源成分检测[22,23]及基因表达分析[24]等,该方法具有实用性强的应用前景。
本文在前人的基础上初步探讨了羊肉、猪肉及肉制品中动物源性成分的定量分析,采用羊肉和猪肉的精瘦肉作为研究的样本,以基因组中单拷贝基因为靶基因设计引物和探针,采用微滴式数字PCR技术,建立动物源成分中羊肉和猪肉的定量分析,有利于市场的监管。
1 材料与方法
1.1 材料与仪器
生鲜羊肉、牛肉、猪肉、鸡肉和鸭肉等肉样均为精瘦肉,羊肉卷、羊肉片、羊肉串、猪肉松、火腿肠、培根切片、烟熏肘花等羊肉和猪肉制品,均购于石家庄各大超市;引物及探针,由上海生物工程技术有限公司合成。
蛋白酶K(目录号:DP304),天根公司;Bio-Rad QX200 ddPCR微滴生成仪,美国Bio-Rad公司;ME204/02,电子天平,梅特勒-托利多仪器(上海)有限公司;NanoDrop 2000微量核算蛋白测定仪,美国Thermo公司;C1000 Touch Thermal Cycler基因扩增仪,美国伯乐公司;Sigma 1-15pk冷冻离心机,德国Sigma公司。
1.2 实验方法
1.2.1 样品的制备
取新鲜的肉样、市售样品用组织绞肉机进行绞碎于鼓风干燥箱中80 ℃、72 h烘干,用组织破碎机及液氮进行破碎处理研磨成超细的粉末,此肉样用作实验的样品、掺假模型的建立及实际检测,处理过程中不同肉样分开处理,防止交叉污染。掺假模型及市售样品的检测称取质量均为100 mg。
1.2.2 DNA的提取
实验中分别称取10~100 mg肉样,所有样品均加入1000 μL组织细胞裂解缓冲液和150 μL蛋白酶k,涡旋振荡,混匀,65 ℃水浴振荡3 h;之后加入体积各半的苯酚、氯仿,混匀,12000 r/min离心10 min;将上层清液转移至无菌的离心管中,加入与上层清液等体积的氯仿,混匀,12000 r/min离心5 min;再将上层清液转移至无菌的离心管中,重复上一步骤;加入两倍体积的冰乙醇(100%)和十分之一体积的3 M的乙酸钠,混匀,并在-20 ℃下过夜处理;然后在12000 r/min下离心30 min,去上清,用75%的乙醇洗涤沉淀两次,12000 r/min离心5 min,去上清,将沉淀物室温风干,重悬于无菌的100 μL ddH2O中,并储存在-20 ℃。以上所有离心过程均在4 ℃下进行。
1.2.3 样品中羊、猪源性成分的检测
羊源性和猪源性成分的引物和探针序列分别参考宋丽萍[11]和René Köppel[3]合成,具体的引物和探针序列见表1。
1.2.4 微滴式数字PCR反应体系
ddPCR TM Supermix for Probes(No dUTP)10 μL,上下游引物各1.2 μL(900 nmol/L),探针0.4 μL(250 nmol/L),DNA模板4 μL,用双蒸水补齐至20 μL。进行微滴化处理,之后进行普通PCR反应。PCR反应条件:95 ℃ 10 min;94 ℃ 30 s,62 ℃ 1 min,98 ℃10 min,40个循环。最后用微滴分析器对微滴进行分析。
1.2.5 羊肉和猪肉的质量与拷贝数换算公式的确定
1.2.5.1 肉样本质量与DNA含量的关系
用精密天平准确称取10 mg~100 mg的样品,提取基因组DNA,并用Nanodrop2000进行DNA浓度的测定,每个质量的肉样设置三个重复。
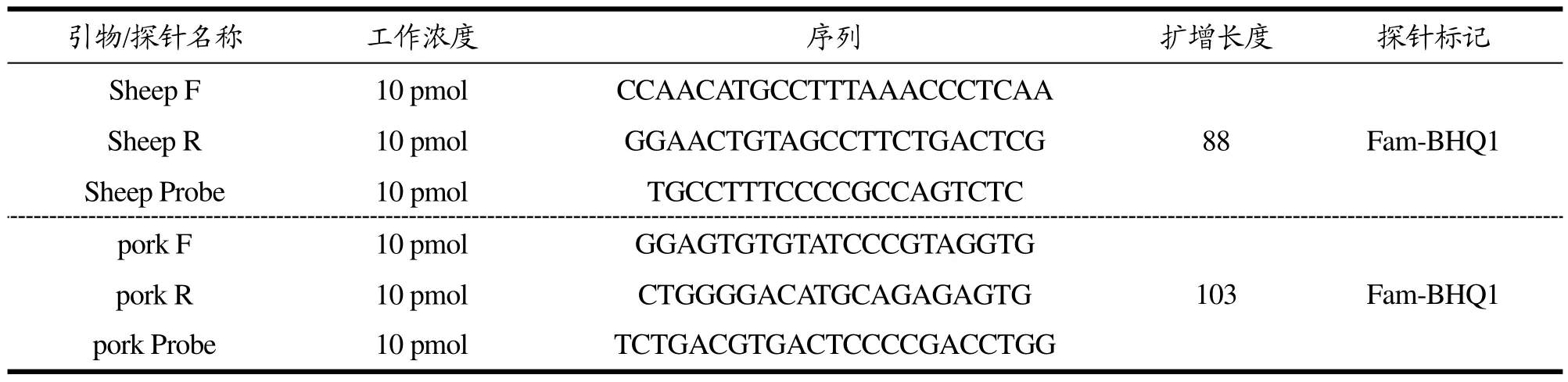
表1 实验所用的引物和探针列表Table 1 The list of primers and probes used in the experiments
1.2.5.2 肉样本DNA含量与拷贝数的关系
分别对提取的羊肉和猪肉DNA进行9个和10个梯度的稀释,羊肉为5、10、20、30、40、50、60、70、80 ng/μL,猪肉为20、40、60、80、100、120、140、160、180、200 ng/μL,进行ddPCR的的检测,每个梯度设置三个重复。
1.2.6 已知混合肉样的检测
为验证该方法准确性,对已知掺假比例的肉样进行检测(羊肉和猪肉的掺假比例为9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9),总质量为100 mg,按1.2.2的方法进行DNA的提取,对提取的DNA稀释30倍,进行ddPCR的检测。
1.2.7 对市售样品的检测
为进一步验证数字PCR在肉类掺假中的实际应用能力,对在超市购买的预包装羊肉串、散装羊肉串、预包装羊肉片、预包装羊肉卷、散装羊肉卷等羊肉制品和培根切片、酱熏肘花、肉灌肠、烟熏火腿、猪肉铺等猪肉制品进行检测。
1.2.8 数据分析
所有结果采用SPSS 17.0软件进行统计学分析,利用Excel进行图表编辑
图1 羊源性和猪源性引物和探针体系的特异性检测Fig.1 The specificity detections of mutton and pork primer-probe systems
2 结果与分析
2.1 特异性检测
本实验在单拷贝上设计引物,为验证引物的特异性,分别用牛、羊、猪、鸡和鸭等进行特异性检测,以无菌双蒸水作为空白对照,如图1所示,结果显示羊源性引物和猪源性引物的特异性良好,能用于猪肉掺羊肉的掺假模型的检测。
2.2 羊肉和猪肉DNA的提取率

图2 羊肉质量和DNA浓度的关系Fig.2 Linear relationship between meat quantity and DNA concnetration of mutton
为减少实验误差,本实验采用精瘦肉进行掺假模型的制备,对不同质量梯度的肉样(10~100 mg)进行DNA的提取,并用Nanodrop 2000对提取的DNA的浓度进行测定,每个质量三个重复,结果显示生肉的质量和DNA的浓度呈一定的线性关系,羊肉和猪肉的相关性系数R2均为0.9989。
该实验表明羊肉和猪肉的生肉质量和提取的DNA的浓度均呈明显的线性关系。

图3 猪肉质量和DNA浓度的关系Fig.3 Linear relationship between meat quantity and DNA concentration of pork
2.3 DNA含量和拷贝数的关系

图4 羊肉DNA浓度和DNA拷贝数之间的关系Fig.4 Linear relationship between DNA concentration and DNA copy number of mutton
将羊和猪提取的基因组DNA进行稀释,羊的稀释浓度为5~80 ng/μL,猪的稀释浓度为20~200 ng/μL,取4 μL稀释后的DNA进行数字PCR的检测,结果显示随着DNA浓度的增加,DNA的拷贝数也增加,成一定的线性关系,羊和猪的相关性系数分别为R2=0.9986和0.9984,每个梯度重复三次。
2.4 羊肉和猪肉质量与拷贝数关系的确定
根据生肉质量和DNA浓度、DNA浓度和DNA拷贝数呈一定的线性关系,以DNA浓度为中间换算值,得到生肉质量和DNA拷贝数的计算公式,羊的计算公式M羊=0.12C-10.6,猪的计算公式M猪=0.07C+4,其中,C指每微升的拷贝数(copies/μL),M指肉样的质量(mg)。

图5 猪肉DNA浓度和DNA拷贝数之间的关系Fig.5 Linear relationship between DNA concentration and DNA copy number of pork
2.5 已知肉样质量的检测
为验证建立的ddPCR方法的准确性,本实验对已知掺假比例的肉样进行DNA的提取,对提取的DNA进行30倍的稀释,取4 μL进行实验,将实验得到的拷贝数带入生肉质量和拷贝数的计算公式中计算得出生肉的质量。实验表明,测量值和实际值相差不大,可以作为实际市售样品的检测提供依据。表2即是已知掺假比例的肉样的检测结果。
2.6 市售样品的检测
通过对市售样品的检测,验证本实验ddPCR方法的准确性和实用性。由于目前市场上肉制品种类众多,鱼龙混杂,单从感官上无法识别肉制品的真实性,更无法识别肉制品是蓄意掺假还是无意识的污染,本实验从定量的角度来判别肉制品的掺假问题,弥补了普通PCR和荧光PCR的不足。
本实验针对所建立物种羊和猪的肉制品进行检测,经实验所得市售羊和猪的样品均存在一定的掺假现象,结果如表3所示,市售的羊肉制品标签上并未显示含有其它物种的肉。经ddPCR测定后羊肉的含量最高是56%,最低为43.4%,所测样品结果大概在50%左右。猪肉制品所含的实际含量就更少了,最高含量在36.69%,最低为5.25%。这表明了现有的市售样品都存在一定的掺假情况,本实验从定量的角度区别了掺假的程度,建立羊肉和猪肉检测体系的实际应用能力。

表2 已知掺假比例的模拟混合样品的ddPCR的定量分析Table 2 Quantitative analysis of ddPCR in simulated mixed samples of known adulteration ratio

表3 市售样品ddPCR的定量分析Table 3 Quantitative analysis of samplesin local supermarket
3 结论
现在普通PCR研究肉类掺假已不能满足要求,定量研究肉源性成分,解决目前市场上对肉类掺假问题的监管和控制,是目前研究的热点。
3.1 数字PCR建立了肉类掺假的定量分析,给肉制品市场监管提供了有效的方法,该技术不依靠标准曲线和内参基因,而是通过DNA的浓度作为中间换算值,建立生肉质量和拷贝数的关系,通过拷贝数直接推算出生肉的质量。王珊等[10]主要做了荧光PCR和数字PCR的方法比较,具有一定的意义,本文针对数字PCR对肉类掺假的检测进行了更为细致的研究。数字PCR对肉类掺假的检测方法比普通和荧光PCR的方法更方便和快捷,用时短,且能很好的解决在肉类流通过程中是人为因素的掺假还是无意的沾染,提高了工作的效率。
3.2 为验证ddPCR方法的准确性,本实验进行了已知质量的肉类的掺假检测,实验结果表明实际值和测得的理论值相差不大,说明该方法的实际应用能力较强,市场应用潜力较大。
3.3 为更加贴合实际,本实验还采取了市售样品的检测,由于市售肉及肉制品成分复杂多样,肉品种类复杂,通过建立的ddPCR的方法能特异性的对羊肉和猪肉进行检测。发现某些品牌的羊肉制品未标明掺假,但实际含量却都在50%左右,均与标签不符;所选的几项猪肉制品,猪肉含量最高者为36.69%,最低含量为5.25%,实际猪肉的含量都不到总量的一半。说明现在市场上掺假现象还是严重的。该方法的建立能快速准确的对市场上用廉价肉代替高价肉的现象进行检测。综上所述,数字PCR快速、便捷具有一定的抗干扰能力,满足了绝对定量的要求。目前市场肉制品的混乱,宗教和民族信仰的问题,数字PCR方法的建立为市场监管,打击不法商贩,维护民族宗教信仰等问题上开辟了一条新的途径,维护了消费者的权益。
[1] 李家鹏,乔晓玲,田寒友,等.食品和饲料中动物源性成分检测技术研究进展[J].食品科学,2011,32(9):340 -347
LI Jia-peng, QIAO Xiao-ling, TIAN Han-you, et al.Advances in the detection of animal derived components in food and feed [J]. Food Science, 2011, 32(9): 340 -347
[2] 赵新,王勇,兰青阔,等.荧光定量PCR方法鉴别肉制品中羊源性成分[J].食品工业科技,2015,36(1):299-302
ZHAO Xin, WANG Yong, LAN Qing-kuo, et al.Identification of sheep derived components in meat products by fluorescent quantitative PCR [J]. Science and Technology of Food Industry, 2015, 36(1): 299-302
[3] Koppel R, Jurg R, Jurg R. Multiplex real-time PCR for the detection and quantification of DNA from beef, pork, horse and sheep [J]. European Food Research and Technology,2011, 232(6): 151-155
[4] Pray-grant M G, Daniel J A, Schieltz D, et al. Chd1 chromodomain links histone H3 methylation with SAGA-and SLIK-dependent acetylation [J]. Nature, 2005, 433(7024):434-438
[5] Guo J, Guo A. Crossmodal interactions between olfactory and visual learning in Drosophila [J]. Science, 2005,309(5732): 307-310
[6] Elias M, Hill R I, Willmott K R, et al. Limited performance of DNA barcoding in a diverse community of tropical butterflies [J]. Proc. Biol. Sci., 2007, 274(1627): 2881-2889
[7] Vences M, Thomas M, Bonett R M, et al. Deciphering amphibian diversity through DNA barcoding: chances and challenges [J]. Philos. Trans. R Soc. Lond B. Biol. Sci., 2005,360(1462): 1859-1868
[8] Armstrong K F, Ball S L. DNA barcodes for biosecurity:invasive species identification [J]. Philos. Trans. R Soc. Lond.B Biol. Sci., 2005, 360(1462): 1813-1823
[9] Rodriguez M A, Garcia T, Gonzalez L, et al. TaqMan real-time PCR for the detection and quantitation of pork in meat mixtures [J]. Meat Sci., 2005, 70(1): 113-120
[10] 王珊,李志娟,苗丽.微滴式数字PCR与实时荧光PCR检测羊肉制品中羊源和猪源性成分方法的比较[J].肉类工业,2015,7:38-41
WANG Shan, LI Zhi-juan, MIAO Li. Comparison of microsphere digital PCR and real-time fluorescence PCR for detection mutton-derived and porcine-derived ingredients in mutton products [J]. Meat Industry, 2015, 7: 38-41
[11] 宋丽萍,薛晨玉,路勇,等.应用实时荧光PCR技术定量检测羊肉中的猪肉成分[J].食品科技,2014,39(10):319-322
SONG Li-ping, XUE Chen-yu, LU Yong, et al. Detection and quantification pork in sheep products using real-time PCR [J].Food Science and Technology, 2014, 39(10): 319-322
[12] 黄留玉.PCR最新技术原理、方法及应用(第二版)[M].北京:化学工业出版社,2011
HUANG Liu-yu. The new pcr technology, principle and application, 2nd ed [M]. Beijing: Chemical Industry Press,2011
[13] Sykes P J, Neoh S H, Brisco M J, et al. Quantitation of targets for PCR by use of limiting dilution [J]. Biotechniques, 1992,13(3): 444-449
[14] Vogelstein B, Kinzler K W. Digital PCR [J] Proc. Natl. Acad.Sci. USA, 1999, 96: 9236-9241
[15] Hindson C M, Chevillet J R, Briggs H A, et al. Absolute quantification by droplet digital PCR versus analog real-time PCR [J]. Nature Methods, 2013, 10(10): 1003-1005
[16] Sanders R, Huggett J F, Bushell C A, et al. Evaluation of digital PCR for absolute DNA quantification [J]. Analytical Chemistry,2011, 83(17): 6474-6484
[17] Sanders R, Huggett J F, Bushell C A, et al. Evaluation of digital PCR for absolute DNA quantification [J]. Analytical Chemistry, 2011, 83(17): 6474-6484
[18] 胡伟,陈荣华,张晨,等.微滴式数字PCR技术用于生物样品种属鉴定和绝对定量[J].法医学杂志,2014,30(5):342-345
HU Wei, CHEN Rong-hua, ZHANG Chen, et al. Species identification and absolute quantification of biological samples by droplet digital PCR [J]. Journal of Forensic Medicine, 2014, 30(5): 342-345
[19] 董莲华,张玲,姜君,等.大肠杆菌O157:H7微滴数字PCR定量方法的建立[J].分析化学,2015,43(3):319-324
DONG Lian-hua, ZHANG Ling, JIANG Jun, et al.Development of droplet digital polymerase chain reaction for quantifying Escherichia Coli O157:H7 [J]. Chinese Journal of Analytical Chemistry, 2015, 43(3): 319-324
[20] Morisset D, Stebih D, Milavec M, et al. Quantitative analysis of food and feed samples with droplet digital PCR [J]. PLoS One, 2013, 8(5): 1-9
[21] 姜羽,胡佳莹,杨立桃.利用微滴数字PCR分析转基因生物外源基因拷贝数[J].农业生物技术学报,2014, 22(10):1298-1305
JIANG Yu, HU Jia-ying, YANG Li-tao. Estimating the exogenous genes copy number of genetically modified organisms by droplet digital PCR [J]. Journal of Agricultural Biotechnology, 2014, 22(10): 1298-1305
[22] CAI Yi-cun, LI Xiang, LÜ Rong, et al. Quantitative analysis of pork and chicken products by droplet digital PCR [J]. Bio.Med. Research International, 2014, 8: 1-6
[23] 朱鹏宇.利用微滴数字PCR定量检测食品或饲料样品[J].农业生物技术学报,2013,12:1-6
ZHU Peng-yu. Quantitative analysis of food and feed samples with droplet digital PCR [J]. Journal of Agricultural Biotechnology, 2013, 12: 1-6
[24] Brunetto G S, Massoud R, Leibovitch E C, et al. Digital droplet PCR(ddPCR)for the precise quantification of human T-lymphotropic virus 1 proviral loads in peripheral blood and cerebrospinal fluid of HAM/TSP patients and identification of viralmutations [J]. Journal of Neurovirology, 2014, 20(4):341-351
