新型瘦肉精多残留胶体金检测卡的研制
2018-03-01罗奕铭
罗奕铭
(广州瑞森生物科技股份有限公司,广东广州 511400)
进入21世纪以来,食品安全问题受到越来越多人的重视,我国多起瘦肉精中毒事件的频繁发生,引起社会对食品安全监管的强烈不满。瘦肉精[1,2]是一类药物,而不是一种特定的物质,是指能够促进瘦肉生长的药物添加剂,例如盐酸克伦特罗、沙丁胺醇、莱克多巴胺、苯乙醇胺A、溴布特罗、马布特罗、马贲特罗、塞曼特罗、齐帕特罗、妥布特罗和特布他林[3,4]等。瘦肉精能使猪提高生长速度,增加瘦肉率,猪毛色红润光亮,收腹,卖相好;屠宰后,肉色鲜红,脂肪层极薄,往往是皮贴着瘦肉,瘦肉丰满。但对人体会产生副作用[5],轻则导致心律不整,严重一点就会导致心脏病[6]。
目前检测瘦肉精主要有方法有色谱技术和免疫分析技术等方法。色谱法包括高效液相色谱法和气质联用色谱法。高效液相色谱(HPLC)法的优点是检测精密度高,假阳性率低,但存在样品处理时间长检测过程繁琐、仪器昂贵、难于操作等缺点,在实际应用中受到一定的限制。而气质联用法(GC-MS)检测前需要对分子上的羟基、氨基等极性基团衍生化,难以作为常规方法应用,不能进行现场检测。
免疫分析检测包括放射性免疫分析技术、酶免疫分析技术和金标免疫分析技术等。放射性免疫分析技术具有特异性强、灵敏度高、准确、快速、操作简便、易于标准化等优点[7~9]。但其所用仪器昂贵,且使用的放射性同位素存在辐射和污染,其废弃物不易处理,限制了此种方法的广泛应用。酶联免疫法和金标免疫法是目前检测瘦肉精较高效的免疫分析技术,但常规的酶联免疫检测一次只能检测一种瘦肉精,所以如果要对多种瘦肉精进行检测则需要进行多次实验,操作繁琐费时,常规的金标免疫检测也有此缺陷,且传统的检测方法只能进行粗略的阴性与阳性判定,且判定时间相对较短,因此,我们需要一种能够同时检测多种瘦肉精的新型检测方法[10,11]。
本研究建立一种快速、有效、高灵敏度的新型瘦肉精多残留胶体金检测卡[12],试验根据胶体金免疫层析原理,实现特异性免疫检测。
1 材料和方法
1.1 材料与设备
主要试剂和仪器:牛血清白蛋白(BSA)(天津正将高科公司);聚乙二醇(PEG)、三羟甲基氨基甲烷(Tris)(北京鼎国生物);柠檬酸三钠、碳酸氢钠、碳酸钾、碳酸钠、叠氮钠、磷酸氢二钠、磷酸二氢钠、吐温-20、盐酸(广州化学试剂厂);氯金酸(上海国药);羊抗鼠抗体(武汉博士德);新型瘦肉精多克隆抗体、瘦肉精-BSA(瑞森生物);硝酸纤维素膜(Sartorius);聚酯膜、玻璃纤维(Pall);吸水纸、磁白板(上海金标);塑料卡、铝箔袋(广州)。
三维划膜喷金仪HM3030、金标试纸分切机WM-100(上海金标);连续点膜机R5DD-2(韩感);磁力搅拌器(国产)。
1.2 试验方法
1.2.1 胶体金溶液的制备
量取40 mL纯水于洁净的圆底烧杯,用磁力搅拌器加入至沸腾,加入0.04 mL 10%氯金酸溶液沸腾5 min后加入0.096 mL 10%柠檬酸三钠溶液,保持沸腾10 min。待溶液温度降至室温后装入棕色密封容量瓶中,避光保存。
1.2.2 金标记新型瘦肉精多克隆抗体的制备
量取20 mL胶体金溶液,倒入洁净离心管内,用0.1 M碳酸钾溶液和0.1 M盐酸溶液调胶体金溶液pH值至8.2。再称取0.186 mg的新型瘦肉精多克隆抗体加入到胶体金溶液内,振荡混匀,室温放置20 min后加入0.02 mL 10% BSA溶液,振荡混匀,室温放置20 min后,把金标记的抗体溶液分装到离心管内,11000 r/min离心15 min。吸取上清液。再加入10 mL 0.1 M磷酸盐缓冲液将沉淀混匀,于11000 r/min离心15 min,吸取上清液后加入4 mL金标缓冲液将沉淀混匀,得到金标记新型瘦肉精多克隆抗体溶液。
1.2.3 金标抗体结合垫的制备
量取0.42 mL金标新型瘦肉精多克隆抗体溶液倒入洁净小离心管内。设定喷金仪主机程序:喷金浓度为20 μL/cm,平台移动速度为132 mm/s,再将玻璃纤维膜放置于喷金仪平台,按设定程序将金标抗体均匀喷洒于玻璃纤维膜上。将喷好的金标抗体结合垫放置于真空干燥箱内室温抽干6 h后,再放于有干燥剂的自封袋中保存备用。
1.2.4 划膜
称取0.332 mg瘦肉精-BSA原液于洁净离心管内,加入划膜缓冲液稀释至终浓度为1 mg/mL,称取1.79 mg羊抗鼠二抗溶液于另一离心管内,加入划膜缓冲液稀释终浓度为2 mg/mL。将硝酸纤维素膜放置于划膜仪平台,两端用压条固定,设定划膜仪主机程序:划膜浓度为2 μL/cm,平台移动速度为128 mm/s。按设定程序将瘦肉精-BSA按一定比例混合后和二抗划于硝酸纤维素膜上后置于真空干燥箱内室温抽干6 h,干燥后封袋保存备用。使瘦肉精-BSA所划线标记为检测线T,羊抗鼠二抗所划线标记为质控线C。
1.2.5 胶体金免疫层析新型瘦肉精多残留胶体金检测卡组装
将样品垫、胶体金垫、已包被好抗原抗体的NC膜、吸水纸依次粘贴到PVC底板上,切割成条,装卡封口密封,置于干燥器中常温保存备用。
1.2.6 样品制备
1.2.6.1 阴性样品的制备
经GC-MS法(农业部1031号公告-3-2008中的“猪肝和猪尿中β-受体激动剂残留检测-气相色谱-质谱法”)检测克伦特罗、莱克多巴胺、沙丁胺醇、西马特罗、班布特罗、妥布特罗、特布他林、氯丙那林、马布特罗、溴布特罗阴性的80份尿液。
1.2.6.2 克伦特罗
(莱克多巴胺、沙丁胺醇、西马特罗、班布特罗、妥布特罗、特布他林、氯丙那林、马布特罗、溴布特罗)添加阳性样品的制备。见表1。
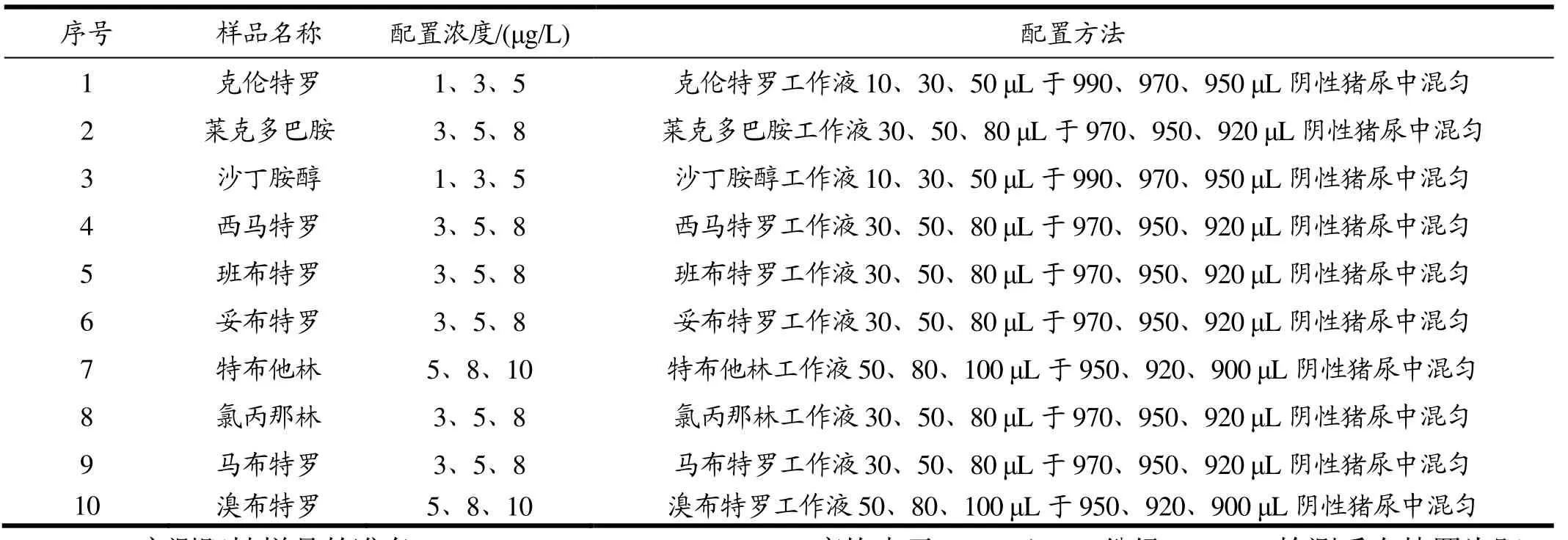
表1 标准品配制Table 1 Preparation of Standards
1.2.6.3 实测阳性样品的准备
10份经GC-MS检测克伦特罗为阳性的实际猪尿样品(浓度均大于3 μg/L)。10份经GC-MS检测莱克多巴胺为阳性的实际猪尿样品(浓度均大于5 μg/L)。10份经GC-MS检测沙丁胺醇为阳性的实际猪尿样品(浓度均大于3 μg/L)。10份经GC-MS检测西马特罗为阳性的实际猪尿样品(浓度均大于5 μg/L)。10份经GC-MS检测班布特罗为阳性的实际猪尿样品(浓度均大于5 μg/L)。10份经GC-MS检测妥布特罗为阳性的实际猪尿样品(浓度均大于5 μg/L)。10份经GC-MS检测特布他林为阳性的实际猪尿样品(浓度均大于8 μg/L)。10份经GC-MS检测氯丙那林为阳性的实际猪尿样品(浓度均大于5 μg/L)。10份经GC-MS检测马布特罗为阳性的实际猪尿样品(浓度均大于3 μg/L)。10份经GC-MS检测溴布特罗为阳性的实际猪尿样品(浓度均大于8 μg/L)。见表2。

表2 实际猪尿样品Table 2 Pratical urine sample of pig
1.2.7 灵敏度
取3批次新型瘦肉精多残留胶体金检测卡分别检测添加克伦特罗/沙丁胺醇浓度为0 μg/L、1 μg/L、3 μg/L和5 μg/L的猪尿样;添加莱克多巴胺/西马特罗/班布特罗/妥布特罗/氯丙那林/马布特罗浓度为0 μg/L、3 μg/L、5 μg/L和8 μg/L的猪尿样;添加特布他林/溴布特罗为0 μg/L、5 μg/L、8 μg/L和10 μg/L的猪尿样各10份。室温条件下操作,肉眼观测进行判定。
1.2.8 假阳性率试验
新型瘦肉精多残留胶体金检测卡对80份经GC-MS检测为阴性的猪尿进行检测,并分别以含克伦特罗/沙丁胺醇为0和3 μg/L的猪尿;特布他林/溴布特罗为0和8 μg/L的猪尿;莱克多巴胺/西马特罗/班布特罗/妥布特罗/氯丙那林/马布特罗为0和5 μg/L的猪尿为阴性对照和阳性对照,计算假阳性率。
1.2.9 假阴性率试验
新型瘦肉精多残留胶体金检测卡对40份阳性猪尿(10份为3 μg/L克伦特罗/沙丁胺醇阳性添加样品,10份为8 μg/L特布他林/溴布特罗阳性添加样品,10份为5 μg/L莱克多巴胺/西马特罗/班布特罗/妥布特罗/氯丙那林/马布特罗阳性添加样品,10份为浓度均大于3 μg/L实测克伦特罗/沙丁胺醇阳性样品,10份为浓度均大于8 μg/L实测特布他林/溴布特罗阳性样品,10份为浓度均大于5 μg/L实测莱克多巴胺/西马特罗/班布特罗/妥布特罗/氯丙那林/马布特罗阳性样品)进行检测,并分别以含克伦特罗/沙丁胺醇0和3 μg/L尿样;特布他林/溴布特罗0和8 μg/L尿样;莱克多巴胺/西马特罗/班布特罗/妥布特罗/氯丙那林/马布特罗0和5 μg/L尿样为阴性对照和阳性对照,计算假阴性率。
1.2.10 新型瘦肉精多残留胶体金检测卡的批内和批间重复
将同批和不同批次的新型瘦肉精多残留胶体金检测卡分别检测上述阴性样品、阳性样品、实测阳性样品,每个浓度重复10次,观察其重复性。
2 结果与讨论

图1 试纸条结构示意图Fig.1 Structure diagram of colloidal gold strip
胶体金免疫试纸条的作用原理主要有双抗夹心和竞争结合两种。本试验研制的新型瘦肉精多残留胶体金检测卡采用了竞争原理,如图1所示拆开卡壳的试纸条,底板为PVC底板(双面胶白色塑料板),从加样处开始分别为样品吸收垫、胶体金垫(玻璃纤维)、硝酸纤维素膜(NC膜)和吸水垫。胶体金垫上喷涂胶体金标记的新型瘦肉精多克隆抗体,NC膜上分别喷涂偶联新型瘦肉精-BSA(检测线T)和羊抗鼠IgG(质控线C)。该法检测线T出现红色条带,结果显示为新型瘦肉精阴性;检测线无条带,结果显示为新型瘦肉精阳性。这是因为当被检物质溶液中不含新型瘦肉精时,玻璃纤维上释放的胶体金标记新型瘦肉精多克隆抗体便会被检测线处的偶联抗原新型瘦肉精-BSA物质识别并结合,因而被截留在该处,当累积到一定程度便出现红色线,但弱阳性时会出现反应强度减弱的检测线;当被检物质溶液中新型瘦肉精的浓度达到一定时,新型瘦肉精与胶体金标记的全部多抗体的反应位点结合,这样当免疫胶体金到达检测线时不能再与偶联抗原发生反应,因而不出现红色线。无论被检测物质中有无新型瘦肉精,胶体金标记的新型瘦肉精多克隆抗体都会与喷涂在NC膜上的羊抗鼠IgG发生免疫反应,即在质控区出现红色线。
2.1 灵敏度与滴尿量

图2 梯度浓度显色结果Fig.2 the results of color gradient concentration
试验结果如图2所示,三个批号各梯度浓度的检测卡在3 min内结果呈梯度变化,CLEN 3 μg/L、RAC 5 μg/L、SAL 3 μg/L、SiT 5 μg/L、BUT 5 μg/L、BBT 5 μg/L、TER 8 μg/L、CLOR 5 μg/L、MAT 5 μg/L、BUB8 μg/L的添加样品质控带显色,检测带无明显显色;CLEN 5 μg/L、RAC 8 μg/L、SAL 5 μg/L、SiT 8 μg/L、BUT 8 μg/L、BBT 8 μg/L、TER 10 μg/L、CLOR 8 μg/L、MAT 8 μg/L、BUB 10 μg/L的添加样品质控带显色,检测带无显色;0 μg/L,样品质控带和检测带均显色。表明胶体金免疫层析试验具有良好的敏感性和特异性,故该胶体金检测试纸卡的检测限可定为CLEN 3 μg/L、RAC 5 μg/L、SAL 3 μg/L、SiT 5 μg/L、BUT 5 μg/L、BBT 5 μg/L、TER 8 μg/L、CLOR 5 μg/L、MAT 5 μg/L、BUB 8 μg/L。滴尿量约为70~90 μg/L,对判读效果无大影响,但发现滴尿量超过200 μg/L以上,胶体金检测卡会出现死金现象、或者层析垫因浸泡太多液体而出现假阳性,通过图示可知,三个批次的稳定性及色度辨析达到判读要求,可以实现现场快速检测,对监管检测工作提供便捷的检测利器。
2.2 假阳性率试验
一般检测猪尿出现假阳性现象主要由以下因素导致:喂养的兽药会产生干扰性物质,饲料中金属离子浓度过高,过夜未保存好的猪尿影响检测结果,尿液含有特殊的、或者其他新型瘦肉精导致交叉反应等。现对80份经GC-MS法检测为阴性的猪尿进行检测,以该方法检测限CLEN 3 μg/L、RAC 5 μg/L、SAL 3 μg/L、SiT 5 μg/L、BUT 5 μg/L、BBT 5 μg/L、TER 8 μg/L、CLOR 5 μg/L、MAT 5 μg/L、BUB 8 μg/L为判定限进行判断,80份尿样均为阴性,该80份样品的假阳性率为0。见表3。
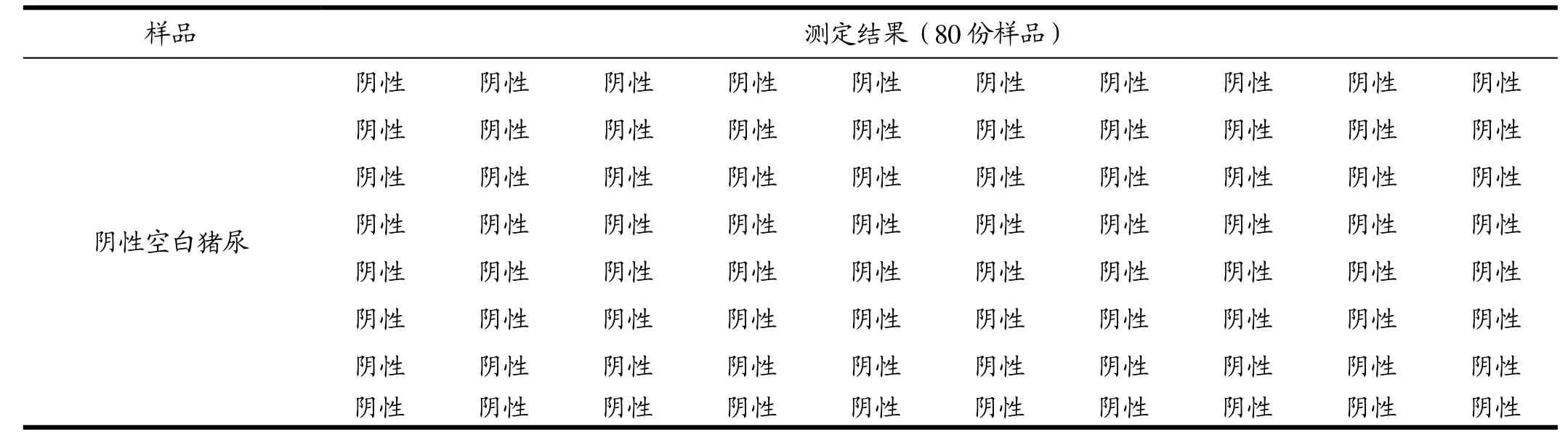
表3 猪尿阴性样本检测结果Table 3 Results of negative samples of pig urine
2.3 假阴性率试验
新型瘦肉精多残留胶体金检测卡对160份阳性猪尿进行检测,以该方法检测限CLEN 3 μg/L、RAC 5 μg/L、SAL 3 μg/L、SiT 5 μg/L、BUT 5 μg/L、BBT 5 μg/L、TER 8 μg/L、CLOR 5 μg/L、MAT 5 μg/L、BUB 8 μg/L为判定限进行判断,160份尿样均为阳性,该160份样品的假阴性率为0。见表4。

表4 猪尿阳性样本检测结果Table 4 Results of positive samples of pig urine

BUT阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 5 5 5 5 5 5 5 5 5 5实测BUT阳性样品 GC-MS测定/(μg/L) 6.8 8.3 7.8 9.2 7.9 7.9 9.1 8.3 8.2 8.8 BBT阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 5 5 5 5 5 5 5 5 5 5实测BBT阳性样品 GC-MS测定/(μg/L) 7.2 7.2 8.6 8.4 7.9 8.9 91 8.2 7.5 9.1 TER阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 8 8 8 8 8 8 8 8 8 8实测TER阳性样品 GC-MS测定/(μg/L) 10.911.29.3 10.29.8 10.911.1 9.2 9.9 11.1 CLOR阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 5 5 5 5 5 5 5 5 5 5实测CLOR阳性样品 GC-MS测定/(μg/L) 8.5 8.4 8.7 7.7 8.3 8.5 7.4 8.9 8.9 7.9 MAT阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 5 5 5 5 5 5 5 5 5 5实测MAT阳性样品 GC-MS测定/(μg/L) 8.0 9.2 8.7 7.9 6.7 8.3 9.5 8.3 8.5 8.8 BUB阳性样品 检测卡(10份) 阳性阳性阳性阳性阳性阳性 阳性 阳性 阳性阳性添加浓度/(μg/L) 8 8 8 8 8 8 8 8 8 8实测BUB阳性样品 GC-MS测定/(μg/L) 9.8 10.410.810.79.9 9.9 11.3 11.2 10.710.4
3 总结
本文研究成功建立检测新型瘦肉精多残留胶体金检测卡的方法,通过大量样本的测试,梯度浓度显色结果表明:新型瘦肉精多残留胶体金检测卡的灵敏度分别为CLEN 3 μg/L、RAC 5 μg/L、SAL 3 μg/L、SiT 5 μg/L、BUT 5 μg/L、BBT 5 μg/L、TER 8 μg/L、CLOR 5 μg/L、MAT 5 μg/L、BUB 8 μg/L,浓度梯度性可以有效确认样本的半定量结果,其检测最快观察时间为3 min,若想显色更加稳定,可以在5 min后进行判读,本研究没有体系化的测试检测卡的保质期,没法确保产品在长期保存时间下的稳定性,后续应进行保质期稳定性测试,通过大批实际样品及加标样品的测试,批内和批间重复性为100%,假阳性率和假阴性率均为0,达到预期的测试效果,同时,测通过测试,检测滴加的最优尿液量为70~90 μL。该方法应用胶体金免疫层析技术,实现一个样本可同时检测8种类似的激素,大大降低了检测时间和检测成本,比单检技术更有优势,这方法既简捷又可靠,是一种值得推广的定性筛选方法,可作为液相色谱等仪器法的补充,通过与孙晓亮[12]针对猪尿中30种不同瘦肉精的药物残留进行比对,虽没达到全面覆盖所有的新型瘦肉精,但适合现场检测,本方法属于快速检测法,是猪尿初筛的便捷途径,能有广泛应用于全国基础检测,减少资源的浪费,同时,也作为新型瘦肉精快速检测的利器,在我国家禽生产场、动物性食品加工厂、国家和地方的检验/监督部门、食品卫生与安全检验/监察部门等行业领域推广应用,将为我国农药/兽药残留检测和监控计划提供技术支撑,促进我国农业全面发展,提升食品安全和质量等级、提高市场竞争力和增加进出口贸易。
[1] Zhang G, Guo J, Wang X. Immunochromatographiclateral flow strip tests [J]. Methods Mol. Bio1., 2009, 504: 169-183
[2] Harkins J D, Woods W E, Lehner A F, et a1. Clenbuterol in the horse: urinary concentrations determ ined by ELISA and GC/MS after clinical doses [J]. J Vet. Pharmacol. Ther., 2001,24(1): 7-14
[3] 农业部.猪尿液中克伦特罗检测方法-酶联免疫吸附测定法[J].中国兽药杂志,2002,36(12):12-13
Ministry of agriculture. Methods for the detection of clenbuterol in swine urine -an enzyme-linked immunosorbent assay [J]. Chinese Journal of Veterinary Drug, 2002, 36(12):12-13
[4] Du W, Zhao G, Fu Q, et al. Combined microextraction by packed sorbent and high-performance liquid chromatography-ultraviolet detection for rapid analysis of ractopamine in porcine muscle and urine samples [J]. Food Chem., 2014, 145: 789-795
[5] Shiu T C, Chong Y H. A cluster of clenbuterol poison-ing associated with the pork and pig ofal in Hong Kong [J].Public Health Epidemiol Bull (Hong Kong), 2001, 10: 14-17
[6] 黄克群,马艳玲,李冬雪,等.关于“瘦肉精”介绍及监管措施[J].中国动物检疫,2011,28(9):21-22
HUANG Ke-qun, MA Yan-ling, LI Dong-xue, et al. About the introduction and regulatory measures of lean meat [J].China Animal Quarantine, 2011, 28(9): 21-22
[7] 黄小洁,朱永仁.盐酸克伦特罗检测方法的比较和应用[J].现代农业科技 2011,15:37
HUANG Xiao-jie, ZHU Yong-ren. Comparison and application of detection methods for clenbuterol hydrochloride [J]. Modern Agricultural Science and Technology, 2011, 15: 37
[8] Chai J, Xu Q, Dai J, et al. Investigation on potential enzymetoxicity of clenbuterol to trypsin [J]. Spectrochim.Acta A Mol. Bomol. Spectrosc., 2013, 105: 200-206
[9] Grimmer N M, Gimbar R P, Bursua A, et al. Rhabdomyolysis secondary to clenbuterol use and exercise [J]. J Emerg. Med.,2016, 50(2): 71-74
[10] National Committee for Clinical Laboratory Standards Performance standards for antimicrobial susceptibility testing Ninth informational supplemenMt 100-S9 [S] Wayne:NCCLS, 1999: 32-75
[11] 张改平,王选年,肖肖.瘦肉精的毒害作用及其试纸快速检测技术[J].中国动物检疫,2011,28(5):1-6
ZHANG Gai-ping, WANG Xuan-nian, XIAO Xiao. Rapid detection technology [J]. Chinese Animal Quarantine and Toxicity Test Clenbuterol, 2011, 28(5): 1-6
[12] 孙晓亮,李雪莲,曹旭敏.超高效液相色谱-串联质谱法快速测定猪尿液中30种不同种类“瘦肉精”药物残留[J].分析化学,2017,45:124-132
SUN Xiao-liang, LI Xue-lian, CAO Xu-min. Rapid determination of 30 different kinds of clenbuterol residues in pig urine by ultra performance liquid chromatography tandem mass spectrometry [J]. Analytical Chemistry, 2017,45: 124-132
