食品中羧甲基赖氨酸的形成机理和抑制途径研究进展
2018-03-01韩文凤谭兴和林晓丽邱泼孟宏昌贾娟
韩文凤,谭兴和,林晓丽,邱泼,孟宏昌,贾娟
(1.湖南农业大学食品科技学院,湖南长沙 410128)(2.漯河职业技术学院食品工程系,河南漯河 462000)(3.食品科学与生物技术湖南省重点实验室,湖南长沙 410128)(4.浙江麦吉士食品有限公司,浙江杭州 310000)
食品中的还原糖与蛋白质、氨基酸等可以通过美拉德反应产生一组性质稳定的产物,被称为晚期糖基化终末产物(advanced glycation end-products),简称AGEs[1]。目前已经发现的AGEs物质有20多种,代表性化合物包括CML、羧乙基赖氨酸(Nε-carboxyethyllysine,CEL)、吡咯素(pyrraline)、戊糖苷素(pentosidine)、咪唑赖氨酸(imidazolysine)和交联素(crosslines)等。AGEs化合物中,CML是第一个从食品(超高温瞬时灭菌乳)中分离鉴定出来的,同时也是存在于食品中的最为主要的一种AGEs[2]。与其它AGEs相比,CML具有较高的酸稳定性,可以作为评价食品体系美拉德反应中蛋白质化学修饰、羰基应激和脂质氧化的一个重要指标。CML通过食品介质进入人体后,可积聚于多个不同的组织器官中,达到一定数量后,会直接影响组织器官的功能,导致机体的病理变化。CML与许多疾病的发生密切相关,能促进糖尿病、克雅二氏病、动脉粥样硬化等疾病的发展和人体器官的快速衰老[3~5]。在食品生产加工过程中CML形成的途径十分复杂,可能受多种因素的影响。蛋白质、还原糖、脂质和抗坏血酸等均可作为形成CML的底物;涉及的主要反应包括氨基酸的糖基化反应和还原糖、油脂以及抗坏血酸的氧化降解反应,CML会通过一个或多个反应同时形成;食品热加工处理方式和加热时间、加热温度、水分含量和pH值等加工工艺条件也会影响CML的形成。
为了避免或降低食品中CML对人类的危害,近年来相关研究人员一直致力于研究降低食品中CML含量的措施。控制食品中CML的含量以及寻找安全、高效、天然的CML抑制剂,是国内外研究的一个重点方向。本文就CML形成机理和抑制途径等方面的研究进展进行综述,以期为寻找有应用前景的CML抑制剂提供理论依据。
1 食品中CML形成机理
1.1 食品中CML的形成途径
早期有关美拉德反应的研究主要集中在该反应对食品风味和外观的改善上,近年对其营养作用和毒副作用的研究日渐加强。食品中CML形成的途径与美拉德反应密切相关,相关资料证实蛋白质和碳水化合物主要是赖氨酸和还原糖是美拉德反应中形成CML的主要底物。Fu等[6]人研究证实油脂中的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)通过氧化反应也可以形成CML。Dunn[7]等人的研究结果证实抗坏血酸也是形成CML的重要底物。Ferreira等[8,9]人研究证实果糖赖氨酸(Fructoselysine,FL)和乙二醛(Glyoxal,GO)是形成CML的关键中间产物。这些中间产物主要来自5个方面[6,10]:(1)还原糖的自动氧化;(2)还原糖和赖氨酸的阿姆德瑞(Amadori)重排;(3)还原糖和赖氨酸的反应产物席夫碱(SchiffBase)降解;(4)油脂中PUFA的自动氧化;(5)抗坏血酸的自动氧化。
为揭示CML的形成机理,在总结国内外相关研究成果的基础上得知食品中CML的形成途径主要有5个方面(如图1所示):
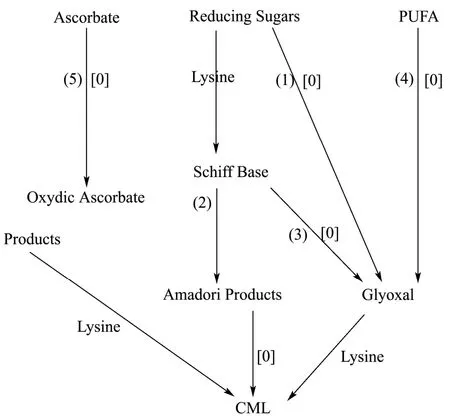
图1 食品中CML形成的重要途径Fig.1 Important formation pathway of CML in food
(1)Wolf途径:还原糖在有氧条件下,发生自动氧化降解反应形成二羰基化合物GO,GO作为形成CML的中间产物与赖氨酸残基反应生成CML[11,12];(2)Hodge途径:美拉德反应第一阶段的产物SchiffBase碱经过Amadori重排反应生成FL,其通过氧化降解生成CML[13,14]。(3)Namiki途径:美拉德反应第一阶段的产物SchiffBase发生氧化降解反应生成二羰基化合物GO,GO与赖氨酸残基发生反应形成CML[15,16];(4)Fu途径:油脂中的PUFA发生氧化降解,生成中间产物GO,GO与赖氨酸残基反应生成CML[6];(5)Dunn途径:抗坏血酸在适宜的条件下发生自动氧化降解反应形成氧化降解中间产物,然后与赖氨酸残基发生反应形成CML[7]。
可以看出,参与CML形成的主要底物包括还原糖、氨基酸、油脂和抗坏血酸等,涉及的主要反应是氨基酸的糖基化反应和还原糖、油脂以及抗坏血酸的氧化降解反应。在食品生产加工过程中形成的CML途径可能受多种因素的影响,CML会通过一条或多条途径同时形成。
1.2 影响食品中CML形成的因素
大量研究结果证实了影响食品中CML形成的因素主要包括反应底物种类及含量;热加工处理方式和加热时间、加热温度、水分含量、pH值等加工工艺条件。
1.2.1 反应底物蛋白质种类和含量的影响
作为形成CML的主要底物,蛋白质的种类和含量对食品热处理过程中CML的形成具有重要的影响。Bosch等人发现不同种类的蛋白质产生的CML含量差别很大,婴儿奶粉、大豆饮料、煮鸡蛋、法式薄饼中的CML含量跨度为62~440 mg/100 g蛋白质;并证实了不同蛋白质形成CML量的高低顺序为:牛血清白蛋白>大豆蛋白>酪蛋白>谷蛋白[17]。蛋白质的中赖氨酸是形成CML的重要底物,CML的生成量取决于蛋白质含有的赖氨酸残基数量。其它氨基酸(如:丙氨酸、天冬氨酸、苏氨酸、谷氨酸和甲硫氨酸)作为底物时,产生的CML数量非常小。Lima等人从赖氨酸损失的角度研究酪蛋白-脂肪酸,酪蛋白-葡萄糖模拟反应体系中CML的产生规律,发现在95 ℃的水浴条件下,酪蛋白-葡萄糖模拟反应体系生成的CML远高于酪蛋白-脂肪酸生成的CML[18]。由Lima等人的结论可以看出,食品中CML的形成主要来源是蛋白质的糖基化反应。不同品种的原料主要因为其蛋白质中氨基酸种类的不同使食品中CML生成量存在差异;同一品种的原料也因气候条件、耕种施肥、采收时间、贮藏温度和时间的不同而使CML生成量存在差异。主要原因是外部条件影响了原料蛋白质中氨基酸的种类和含量及含水量、pH值等指标,从而影响食品中CML的生成量。
1.2.2 反应底物油脂的影响
Fu等人研究发现油脂中的PUFA通过氧化降解反应生成二羰基化合物GO,然后与蛋白质中的赖氨酸反应可以生成CML[6]。在美拉德反应系统中脂质的存在可以使体系产生碱性的环境,促进中间产物FL和GO生成CML[19]。数据表明高脂肪类食品中CML的含量高于肉制品和碳水化合物类食品,而且油脂和蛋白质反应也能够生成CML[10,20]。Han等[21]人研究发现,植物油脂(大豆油、菜籽油、玉米油、棕榈油和橄榄油)和动物油脂(乳脂)都可以与赖氨酸反应生成CML,且牛奶中的CML含量随乳脂含量增加而增加。Lima等人建立的酪蛋白-脂肪酸模拟反应体系在95 ℃水浴条件下,产生CML量的高低顺序为:花生四烯酸>亚麻酸>亚油酸>油酸[32]。周燕琼研究了四种脂肪酸-赖氨酸模拟反应体系中产生CML的规律,发现不同脂肪酸生成CML量的高低顺序为:亚油酸>油酸>棕榈酸>硬脂酸[22]。由此推断,CML生成量与脂肪酸的饱和程度和碳链的长度均有关。脂肪酸的不饱和水平越高,形成CML的能力越强;饱和程度相同时,碳链越短产生CML的能力越强。
1.2.3 反应底物还原糖的影响
碳水化合物中的还原糖,由于其具有易发生烯醇式转变的还原基团和开链式结构,成为生成CML的重要底物[23]。研究数据表明,还原糖均能与赖氨酸反应生成CML。Ruttkat等人采用烘烤加热方式建立了四种不同的还原糖(葡萄糖、半乳糖、山梨糖、果糖)与赖氨酸生成CML的模拟反应体系,经检测发现,四种还原糖的模拟反应体系均能生成CML,形成CML数量的高低顺序为:半乳糖>葡萄糖>山梨糖>果糖[14]。Li等人建立了三种糖(葡萄糖、蔗糖和乳糖)与赖氨酸生成CML的模拟反应体系,发现蔗糖也能与赖氨酸反应生成CML,形成CML量的高低顺序为:乳糖>葡萄糖>蔗糖[24]。Lüdemann[25]等人认为,乳糖与赖氨酸反应产生CML的效率高于葡萄糖。Courel等人对饼干体系研究发现,在焙烤模式下葡萄糖产生CML的效率高于蔗糖,并且不受温度高低的影响[26]。乳糖是由葡萄糖和半乳糖脱水缩合而成的双糖,蔗糖是由葡萄糖和果糖脱水缩合而成的双糖,上述研究成果结合分子结构分析,结论是一致的。但是Sakai[27]等人指出,果糖比葡萄糖具有更强的糖基化能力;Hinton等人的研究也表明,果糖-牛血清白蛋白体系产生的CML含量是葡萄糖-牛血清白蛋白体系的17倍[28]。有关果糖和葡萄糖生成CML的研究结果不尽相同,还有待进一步深入研究。
1.2.4 热处理方式的影响
食品在食用前进行热加工处理是获得营养性和安全性的一个必要条件。热处理的方式对食品中CML的形成具有非常重要的影响,蒸、煮、油炸、焙烤和微波加热均能促进CML的形成。Chen等人研究了几种肉类食品在不同加工方式下CML含量的变化,发现高温焙烤和油炸条件下CML含量较高,经高温焙烤后的牛肉中CML含量可达21.80 µg/g[29]。付全意[23]对葡萄糖-赖氨酸模拟体系的研究表明,在95 ℃温度下反应20 min,采用微波加热生成的CML分别是水浴加热和干法加热的5.65倍和6.94倍。微波加热能使体系温度迅速上升,具有不稳定结构的a-D-葡萄糖的比例增加,大量的还原糖氧化降解生成GO,或者与赖氨酸形成Schiff Base等中间产物,加快美拉德反应的程度,从而促进食品模拟体系中CML的产生[30]。
1.2.5 加工工艺条件的影响
食品原料含水量、加热温度、加热时间和pH值等加工工艺参数均能影响食品中CML的形成。食品原料中含水量在10%~15%最易发生美拉德反应,也最易生成CML,随着含水量的增加,生成CML的效率反而降低。水分活度对CML也有一定的影响,新鲜的水果、蔬菜等可能因为水分充足,且含有大量的天然抗氧化剂而抑制了CML的生成[31]。
Lima在果糖-赖氨酸模拟反应体系中发现,当温度在70~110 ℃范围内上升时,CML的含量呈线性增加[18]。周燕琼证明了在脂肪酸-赖氨酸模拟反应体系中,180 ℃加热26 min,可使体系中CML的生成量达到最大值为53.9 µmol/L[22]。刘春霞对果糖-赖氨酸模拟反应体系研究发现,20 ℃时CML的含量仅0.03µg/mL,120 ℃时可达到14.36 µg/mL,约为20 ℃含量的479倍[32]。付全意对三种糖与赖氨酸生成CML的模拟反应体系研究发现在100~180 ℃范围内,体系中CML含量随着温度的升高而升高,当温度超过180 ℃,CML的分解速率开始高于其形成速率,在温度达到220 ℃时,CML的分解率基本达到100%[23]。可见,在一定的温度范围内,温度与CML的生成量呈正相关,超出特定温度,反而能抑制CML的形成。
食品加工过程热处理时间的长短对于CML形成有重要影响。刘春霞研究发现,对果糖-赖氨酸模拟反应体系于100 ℃下进行热处理,时间从20 min到120 min延长的过程中,CML的生成量先显著增加后基本不变;60 min时达到最大值为4.94 µg/mL,是20 min时的3.88倍[32]。付全意对微波加热的葡萄糖-赖氨酸模拟反应体系研究发现,体系在220 ℃反应60 min的过程中,CML含量在10 min内达到最大值5.02 mol/L,在反应60 min时CML含量降到最低值0.12 mo1/L[37];可见,反应时间延长并不一定能够产生更多的CML。反应时间延长,会产生CML-赖氨酸的交联物质[33,34];并且CML可能会转化为含氮的类黑精大分子物质,结果导致CML的含量反而降低。
pH值是影响生成CML的重要因素。相对于酸性条件而言,碱性条件下更容易生成CML。Ajandouz等[35]人发现,在果糖-赖氨酸模拟反应体系中,pH值由4.0~12.0过程中,美拉德反应产物随pH值上升而增加。刘春霞对果糖-赖氨酸模拟反应体系研究发现,在pH 4.0~8.0范围内,CML含量随pH值上升而增加,pH 8.0时,CML的含量为4.28 µg/mL,较pH 4.0时增加77%[32]。
2 食品中CML的抑制途径
为了避免或降低食品中CML对人类的危害,近年来相关研究人员一直致力于研究降低食品中CML含量的措施。这些措施的主要原理为通过改变反应条件、降低反应底物或添加外源物质等来减缓底物的反应速率、抑制某些关键中间产物的形成或转化。综合考虑食品体系中CML形成的途径以及影响其生成的因素,降低食品中CML含量的措施主要有以下三个方面:一是食品原料中CML底物含量的控制;二是加工工艺条件和方法的优化;三是外源性食品添加剂的使用。
2.1 食品原料中CML底物含量的控制
通过控制食品原料中CML的底物赖氨酸、还原糖和脂质等成分的含量,可以有效抑制产品中CML生成量。Loaëc等[36]人研究发现氮肥的施用量在0~30 kg/ha范围内增加时,菊苣根中的赖氨酸的含量增加显著;收获时间晚3个月菊苣根中的赖氨酸含量可以增加22.56%。从食品原料田间管理的角度考虑,通过合理施用氮肥,调整收获时间能控制农作物中赖氨酸的含量,有效防止后期加工过程中高水平CML的产生。Chuda[37]等人把马铃薯分别置于20 ℃ 2周,2 ℃ 2周和2 ℃ 1年条件下贮藏,测得果糖的含量分别为0.09、3.56和6.58 mg/g。可见,原料的还原糖的含量会与温度呈负相关,与时间呈正相关;即使在较低温度下,糖基化反应也会缓慢地发生,因此长期储存的食物也会积累大量的CML。从原料贮藏的角度考虑,合理设定原料贮藏温度,抑制淀粉转化为还原糖,可以有效抑制CML的形成。Grob等[38]人发现马铃薯经削皮和切片后,于水中浸泡15 min,可以清除表面的氨基酸和还原糖。Srey等[39]人研究发现选择糖化反应活性低的原料有助于降低蛋糕中CML的含量。
因此,通过选用底物含量低的原料,避免过低的贮藏温度和过长的贮藏时间,加工前采用浸渍预处理等方法可以有效地控制食品中CML的含量。
2.2 加工工艺条件和方法的优化
通过优化食品加工工艺条件(水分含量、加热温度、加热时间等)可以达到抑制CML的效果。相同的食品原料经低温高湿处理(如蒸、煮和炖)产生的CML含量较高温低湿处理(烘焙、油炸和烧烤)要低很多[40,41]。Goldberg等[20,41]人研究发现烤鳕鱼中CML含量是水煮鳕鱼的6倍。虽然CML的含量与加热时间有一定的相关性,但是反应时间延长并不一定能生成更多的CML。因此选择合理的加热温度和湿度,避免长时间加热,可以有效地抑制CML的形成。
2.3 外源性食品添加剂的使用
2.3.1 酸度调节剂的使用
研究表明,通过添加柠檬酸等酸度调节剂来适当调控食品体系的pH值,可以抑制CML的形成。Uribarri等[40]人研究发现,牛肉用醋或柠檬汁腌制1 h后再进行热加工处理,生成的CML含量较未腌制的牛肉中要低50%。碱性条件下,赖氨酸会发生脱质子化反应变成具有更高反应活性的自由基,易于CML的生成[42];而酸性条件下,不利于赖氨酸变成具有较强反应活性的自由基[43];CML则不易生成。
2.3.2 反应底物竞争剂的使用
丁斌鹰[44]的研究表明,在棉酚和干酪素的美拉德反应体系中添加尿素能够有效地保护干酪素中赖氨酸。棉酚是一种含有羰基的多酚醛,干酪素是动乳汁中的含磷蛋白质,尿素分子能够提供两个氨基与棉酚的羰基生成SchiffBase,可以竞争性地抑制棉酚与干酪素发生美拉德褐变反应,有效地阻止干酪素中赖氨酸含量的损失,同时降低CML的生成量。
Srey[39]等人研究发现维生素B1是一种赖氨酸ε-基团的竞争剂,对模拟反应体系中CML生成有较好的抑制效果。维生素B1中的氨基与赖氨酸残基竞争还原糖的羰基,导致赖氨酸残基与还原糖的羰基发生反应的机率降低,从而抑制了美拉德反应模拟体系中部分CML的生成。
2.3.3 抗氧化剂的使用
2.3.3.1 化学合成抗氧化剂的使用
化学合成抗氧化剂中,硼氢化钠(NaBH4)是最常用的CML抑制剂。NaBH4分子中的4个H原子呈-1价,具有很强的选择还原性,能够将酮类、醛类和酰氯类等羰基化合物中的羰基选择还原成羟基。NaBH4能够通过还原CML的中间产物GO和FL来抑制CML的形成。
付全意对葡萄糖-赖氨酸模拟反应体系的研究发现,NaBH4对羰基化合物具有很强的还原能力,不仅能够还原CML的中间产物GO,而且还可以将形成CML的主要中间产物FL还原,终止其氧化裂解生成CML,从而抑制CML的形成[23]。Hartkopf等[45]人研究发现,食品经NaBH4还原处理后CML的含量仅为未处理的8~55%。在检测模拟反应体系以及食品体系中CML的含量时,通常将样品经过NaBH4还原处理,防止CML的中间产物在水解过程中转化为CML,导致测得的CML含量结果偏高。
2.3.3.2 天然抗氧化剂的使用
抗氧化剂对CML的抑制作用是目前研究的热点,现有资料表明部分天然抗氧化剂能够有效抑制食品体系中CML的形成。Rice-Evans等[46]人研究发现黄酮类和多酚类化合物可以通过抑制葡萄糖的自氧化反应和清除自由基等方式来抑制食品体系中CML的形成。付全意[23]通过引入多级动力学研究发现,黄酮类物质芦丁对葡萄糖向GO和FL的转化,以及GO和FL生成CML均具有抑制作用。Zhang等[47]人研究发现多酚类化合物可通过结合CML的中间产物GO及清除自由基的方式对葡萄糖-酪蛋白模拟反应体系中CML的形成发挥抑制作用。Srey等[39]人研究发现阿魏酸可以通过清除反应体系自由基的方式对CML的形成进行抑制。葡萄籽提取物富含的原花青素和儿茶素具有很强抗氧化性可以清除食品体系中CML生成的中间产物GO,数据显示面包中葡萄籽提取物添加量为1000 mg/kg时CML的抑制率可超过50%[48]。Peng[49]等人研究发现由肉桂皮提取得到的原花青素B2和表儿茶素能够有效抑制CML生成,特别是原花青素B2还可以捕获CML形成过程中的中间产物GO。Ahmad[50]等人研究发现陈年大蒜提取物中的烯丙基半胱氨酸也可以通过与Amadori重排产物反应抑制CML的形成。
3 结论
CML在体内的积聚与糖尿病、心血管疾病、肾病、克雅二氏病和衰老等老年性疾病密切相关。CML形成途径十分复杂,蛋白质、还原糖、脂质和抗坏血酸等均可作为形成CML的底物。通过控制食品原料中CML的底物赖氨酸、还原糖和脂质等成分的含量;优化食品加工工艺条件(水分含量、加热温度、加热时间等);使用外源性食品添加剂等途径可以有效降低食品中CML含量。天然抗氧化剂尤其是黄酮类和多酚类化合物对CML有较好的抑制作用,但是抑制作用发生的机理还有待进一步深入有研究。
[1] Singh R, Barden A, Mori T, et al. Advanced glycation end-products:a review [J]. Diabetologia, 2001, 44(2):129-146
[2] Büser W, Erbersdobler H F, Liardon R. Identification and determination of Nε-carboxymethyllysine by gas-liquid chromatography [J]. Journal of Chromatography A, 1987,387: 515-519
[3] Nursten H E. The Maillard reaction: chemistry, biochemistry,and implications [M]. Royal Society of Chemistry, 2005
[4] Goldin A, Beckman J A, Schmidt A M, et al. Advanced glycation end products sparking the development of diabetic vascular injury [J]. Circulation, 2006, 114(6): 597-605
[5] Baynes J W. The role of AGES in aging: causation or correlation [J]. Experimental Gerontology, 2001, 36(9):1527-1537
[6] Fu M X, equena J R, Jenkins A J, et al. The advanced glycation end product,Nε- (carboxymethyl)lysine, is a product of both lipid peroxidation and glycoxidation reactions [J].Journal of Biological Chemistry, 1996, 271(17): 9982-9986
[7] Dunn J A, Ahmed M U, Murtiashaw M H, et al. Reaction of ascorbate with lysine and Protein under autoxidizing conditions: formation of Nepsilon-(carboxymethyl)lysine by reaction between lysine and products of autoxidation of ascorbate [J]. Biochemistry, 1990, 29(49): 10964-10970
[8] Ferreira A E N, Ponces-Freire A M J, Voit EO.A quantitative model of the generation of Nε-(carboxymethyl)lysine in the Maillard reaction between collagen and glucose [J].Biochemical Journal, 2003, 376(1): 109-121
[9] Erbersdobler H F, Somoza V. Forty years of furosine-Forty years of using Maillard reaction products as indicators of the nutritional quality of foods [J]. Molecular Nutrition & Food Research, 2007, 51(4): 423-430
[10] Koschinsky T, He C J, Mitsuhashi T, et al. Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy [J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(12): 6474-6479
[11] Wolff S P, Dean R T. Glucose autoxidation and protein modification.The potential role of ‘autoxidative glycosylation’ in diabetes [J]. Biochemical Journal, 1987,245(1): 243-250
[12] Wells-Knecht K J, Zyzak D V, Litcbfield J E, et al.Identification of glyoxal and arabinose as intermediates in the autoxidative modification of proteins by glucose [J].Biochemistry, 1995, 34(11): 3702-3709
[13] Dills W L. Protein fructosylation: fructose and the Maillard reaction [J]. American Journal of Clinical Nutrition, 1993,58(5): 779-787
[14] Ruttkat A, Erbersdobler H F. Nepsilon-carboxymethyllysine is formed during heating of lysine with ketoses [J]. Journal of the Science of Food and Agriculture, 1995, 68(2): 261-263
[15] Hayashi T, Namiki M. Role of sugar fragmentation in the Maillard reaction [J]. Developments in Food Science, 1986,13: 29-38
[16] Glomb M A, Monnier V M. Mechanism of protein modification by glyoxal and glycolaldehyde, reactive intermediates of the maillard reaction [J]. Journal of Biological Chemistry, 1995, 270(17): 10017-10026
[17] Bosch L, Sanz M L, Montilla A, et al. Simultaneous analysis of lysine,Nε- carboxymethyllysine And lysinoalanine from proteins [J]. Journal of Chromatography B, 2007, 860(1):69-77
[18] Lima M, Assar S H, Ames J M. Formation of Nε-carboxymethyllysine and loss of lysine in casein glucose-fatty acid model systems [J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1954-1958
[19] Han L, Li L, Li B, et al. Hydroxyl radical induced by lipid in Maillard reaction model system promotes diet-derived Nε-carboxymethyllysine formation [J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2013, 60:536-541
[20] Goldberg T, Cai W, Peppa M, et al. Advanced glycoxidation end products in commonly Consumed foods [J]. Journal of the American Dietetic Association, 2004, 104(8): 1287-1291
[21] Han L, Li L, Li B, et al. Glyoxal derived from triglyceride participating in diet-derived Nε-carboxymethyllysine formation [J]. Food Research International, 2013, 51(2):836-840
[22] 周燕琼.植物多酚抑制食品中晚期糖基化终末产物的形成的作用机理研究[D].杭州:浙江大学,2015
ZHOU Yan-qiong. Study on the inhibition effects and mechanism of plant polyphenol on advanced glycation end-products in food [D]. Hangzhou: Zhejiang University,2015
[23] 付全意.食品模拟体系糖化反应过程中羧甲基赖氨酸的形成和抑制[D].广州:华南理工大学,2012 FU Quan-yi. Formation and inhibition of Nε-carboxymethyllysine during glycation reaction in food model systems [D]. Guangzhou: South China University of Technology, 2012
[24] Li L, Han L P, FU Q Y, et al. Formation and Inhibition of Nε-carboxymethyllysine in Saccharide-Lysine Model Systems during Microwave Heating [J]. Molecules, 2012,17(11): 12758-12770
[25] Lüdemann G, Erbersdobler H F. Model experiments on the formation of Nε-carboxymethyllysine (CML) in foods [J].Human Nutrition and Physiology, 1990, 1: 91-96
[26] Courel M, Ait-Ameur L, Capuano E, et al. Effects of formulation and baking conditions on neo-formed contaminants in model cookies [J]. Czech Journal of Food Sciences, 2009, 27(1): 93-95
[27] Sakai M, Oimomi M, Kasuga M. Experimental studies on the role of fructose in the development of diabetic complications[J]. Kobe Journal of Medical Sciences, 2002, 48(5): 125-136
[28] Hinton D J S, Ames J. Site specificity of glycation and carboxymethylation of bovine serum albumin by fructose [J].Amino Acids, 2006, 30(4): 425-434
[29] Chen G J, Smith J S. Determination of advanced glycation endproducts in cooked meat products [J]. Food Chemistry,2015, 168(3): 190-195
[30] Whittaker A G, Mingos D M P. The application of microwave heating to chemical syntheses [J]. Journal of Microwave Power Electromagnetic Energy, 1994, 29(4): 195-219
[31] Cristina D A, Isabel S, Ana H, et al. Development of the Maillard reaction in foods cooked by different techniques.Intake of Maillard-derived compounds [J]. Food Chemistry,2010, 122(1): 145-153
[32] 刘春霞.果糖赖氨酸体系中羧甲基赖氨酸和羧乙基赖氨酸的形成研究[D].杨凌:西北农林科技大学,2015
LIU Chun-xia. Study on formation of Nε-carboxymethyllysine (CML) and Nε-Carboxyethyllysine(CEL) in fructose-lysine system [D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2015
[33] Arribas-Lorenzo G, Morales F J. Analysis, distribution and dietary exposure of glyoxal and methylglyoxal in cookies and their relationship with other heat-induced contaminants [J].Journal of Agricultural & Food Chemistry, 2010, 58(5):2966-2972
[34] Kato A. Industrial applications of maillard-type protein-polysaccharide conjuates [J]. Food Science &Technology Research, 2002, 8(3): 193-199
[35] Ajandouz E H, Tchiakpe L S, Dalle O F, et al. Effects of pH on caramelization and maillard reaction kinetics in fructose-lysine model systems [J]. Journal of Food Science,2001, 66(7): 926-931
[36] Loaëc G, Niquet-Léridon C, Henry N, et al. Impact of variety and agronomic factors on crude protein and total lysine in chicory, and Nε-carboxymethyl-lysine-forming potential during drying and roasting [J]. Journal of Agricultural &Food Chemistry, 2015, 63(47): 10295-10302
[37] Chuda Y, Ono H, Yada H, et al. Effects of physiological changes in potato tubers (Solanum tuberosum L.) after low temperature storage on the level of acrylamide formed in potato chips [J]. Bioscience Biotechnology & Biochemistry,2003, 67(5): 1188-1190
[38] Grob K, Biedermann M, Biedermann-Brem S, et al. French fries with less than 100ug/kg acrylamide. A collaboration between cooks and analysts [J]. European Food Research and Technology, 2003, 217(3): 185-194
[39] Srey C, Hull GL J, Connolly L, et al. Effect of inhibitor compounds on Nε-(carboxymethyl)-lysine (CML) and Nε-(carboxyethyl)lysine (CEL) formation in model foods [J].Journal of Agricultural & Food Chemistry, 2010, 58(22):12036-12041
[40] Uribarri J, Woodruff S, Goodman S, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet [J]. Journal of the American Dietetic Association, 2010, 110(6): 911-916
[41] Hull G L J, Woodside J V, Ames JM, et al.Nε-(carboxymethyl)-lysine content of foods commonly consumed in a Western style diet [J]. Food Chemistry, 2012,131(1): 170-174
[42] Yin J, Andersen M L, Thomsen M K, et al. Formation of radicals during heating lysine and glucose in solution with an intermediate water activity [J]. Free Radical Research, 2013,47(8): 643-650
[43] Labuza T P, Baisier W M. The kinetics of nonenzymatic browning [J]. Physical Chemistry of Foods, 1992: 595-649
[44] 丁斌鹰.尿素对棉酚和干酪素反应抑制作用的研究[J].武汉工业学院学报,2000,1:6-7
DING Bin-ying. A study on urea inhibition effect on the reaction of gossypol and casein [J]. Journal of Wuhan Polytechnic University, 2000, 1: 6-7
[45] Hartkopf J, Pahlke C, Lüdemann G, et al. Determination of Nε-carboxymethyllysine by a reversed-phase highperformance liquid chromatography method [J]. Journal of Chromatography A,1994, 672(1-2): 242-246
[46] Rice-Evans C A, Miller N J, Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids [J].Free Radical Biology and Medicine, 1996, 20(7): 933-956
[47] Zhang X, Hu S, Chen F, et al. Treatment of proteins with dietary polyphenols lowers the formation of AGES and AGE-induced toxicity [J]. Food and Function, 2014, 5(10):2656-2661
[48] Peng X F, Ma J Y, Cheng K W, et al. The effects of grape seed extract fortification on the antioxidant activity and quality attributes of bread [J]. Food Chemistry, 2010, 119(1):49-53
[49] Peng X F, Cheng K W, Ma J Y, et al. Cinnamon bark proanthocyanidins as reactive carbonyl scavengers to prevent the formation of advanced glycation endproducts [J]. Journal of Agricultural and Food Chemistry, 2008, 56(6): 1907-1911
[50] Ahmad M S, Ahmed N. Antiglycation properties of aged garlic extract: possible role in prevention of diabetic complications [J]. Journal of Nutrition, 2006, 136(3):796-799
