基于NanoLC-Orbitrap技术测定六种不同栽培品种大豆中多肽Lunasin含量
2018-03-01高梦笛孟献斌幸岑璨张玥邓海腾王凤忠
高梦笛,孟献斌,幸岑璨,张玥,邓海腾,王凤忠
(1.中国农业科学院农产品加工研究所,北京 100193)(2.清华大学生物医学检测中心,北京 100084)
大豆(Glycine max( L ). Merr)是我国四大油料作物之一,具有非常高的营养价值。大豆中含有丰富的蛋白质和多肽,其中露那辛(Lunasin)是最早由日本新泻大学医学部的研究小组从大豆中分离纯化并鉴定出来的一种功能多肽,分子质量为5.5 ku,由43个氨基酸组成,氨基酸序列为SKWQHQQDSCRKQLQ GVNLTPCEKHIMEKIQGRGDDDDDDDDD[1]。2005年Lunasin被美国加利福尼亚大学伯克利分校de Lumen研究小组成功克隆,发现Lunasin能破坏细胞有丝分裂并引起染色体破裂和细胞凋亡,具有抗肿瘤的功效[2]。2012年,Gakvez等[3]在肝脏细胞HepG2中发现Lunasin可能通过降低HMGCR的活性来降低胆固醇。
研究表明Lunasin具抗氧化、抗炎、抗癌及降低胆固醇等功效,被预测可作为预防癌症和降低心血管疾病风险的药物。由于Lunasin来源于天然植物大豆,安全性相对较高,几乎没有毒副作用且不良反应少,使其可能成为保护心血管方面的一线药物。
目前报道的对Lunasin的定量分析常采用依赖于抗体的方法,Jeong等[4,5]用Western Blot法研究了美国市售的部分大豆产品,包括脱脂豆奶粉、大豆分离蛋白Lunasin的含量;Gonzalez等[6]用酶联免疫吸附法(ELISA)研究发现美国产不同种大豆中Lunasin的含量不同,Ren等[7]用LC-MS的方法检测了藜麦中含有Lunasin。Western Blot和ELISA检测依赖于Lunasin抗体的特异性,若抗体将具有相同抗原决定簇的其它肽类误认为是Lunasin,则可能干扰测定结果。只采用传统LC-MS测定Lunasin,样品中的复杂基质干扰严重目标肽响应较低[7],影响质谱测定的阈值、线性、准确度,甚至会出现假阳性[8,9]。本研究尝试采用纳流液相色谱串联轨道阱质谱Orbitrap Fusion系统来进行检测,该仪器可实现三种质量分析器的共同协作,平行反应监视法(PRM)实现了对全部离子碎片的检测,该方法可以显著提高识别的多肽数量,能够更好地排除背景干扰和假阳性。
我国大豆资源丰富、产区众多,品种逾越千个,主要有三大大豆主产区[10,11]。黑河43大豆是东北春大豆区主栽大豆品种;黔豆7号大豆是云贵高原春夏大豆区主栽大豆品种,是适宜西南山区种植的丰产性好、稳产性强的优质品种;徐豆14大豆、皖豆35大豆是黄淮海夏大豆区的主栽品种,具有高产、籽粒商品性优良等特点;中黄系列大豆是近年来我国大面积推广栽培的品种之一,由中国农业科学院作物研究所选育且具有高蛋白、适应性广等特点[12,13]。美国和韩国等国外大豆品种中的Lunasin含量多有研究,而国产大豆品种中Lunasin含量鲜有报道。因此有必要建立有效的方法通过不同品种的比较筛选出富含多肽Lunasin的最佳品种,为功能性食品的开发提供理论支撑。
本研究以六种国产大豆:中黄13大豆、中黄75大豆、徐豆14大豆、黑河43大豆、黔豆7号大豆、皖豆35大豆为实验材料,建立了分离提取并测定大豆多肽Lunasin的方法,采用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离降低了基质干扰,用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap)平行反应监视法(PRM)对六种国产大豆中Lunasin含量进行测定,本测定方法准确可靠,重现性好。
1 材料与方法
1.1 材料
1.1.1 样品
黑河43大豆由黑龙江省农业科学院大豆研究所提供;徐豆14大豆由徐州市农业科学院提供;黔豆7号大豆由贵州省油料研究所提供;中黄13大豆、中黄75大豆由中国农业科学院作物科学研究所提供。
1.1.2 试剂
乙醇(色谱纯)、乙腈(色谱纯)、甲酸(色谱纯)、三氟乙酸,美国赛默飞世尔科技公司;质谱级碳酸氢氨,美国Sigma公司;质谱级二硫苏糖醇(DTT),美国Sigma公司;胰蛋白酶(Trypsin),美国Promega公司;Mini-PROTEAN® TGX™预制胶,美国Bio-Rad公司;Lunasin标准品,成都凯捷生物医药科技发展有限公司;Blue Plus® IV预染Protein Marker,北京全式金生物技术有限公司。
1.1.3 主要仪器设备
电子天平YQ116-01,梅特勒-托利多公司;超速多功能粉碎机,浙江永康公司;恒温培养振荡器,上海智城分析仪器制造公司;离心机(LYNX6000),美国赛默飞世尔科技公司;ZLS-1真空离心浓缩仪,湖南赫西仪器装备有限公司;电泳仪(JY600C),北京君意东方电泳设备有限公司;EASY-Spray column(50 μm×15 cm,2 μm)色谱柱,美国赛默飞世尔科技公司;纳流液相色谱串联轨道阱质谱(EASY-nLC 1000-Orbitrap Fusion Tribrid),美国赛默飞世尔科技公司;配制试剂所用的水为经美国密里博公司的Milli-QAdvantage超纯水仪处理过的超纯水。
1.2 实验方法
1.2.1 Lunasin的提取
Lunasin的提取:将六种大豆粉碎过60目筛,参考Krishnan等[14]人的提取方法并稍作改动,称量中黄13大豆、中黄75大豆、徐豆14大豆、黑河43大豆、黔豆7号大豆、皖豆35大豆,各100 mg,每份分别加入1 mL超纯水,1 mL 30%的乙醇。在37 ℃震荡提取30 min,于4 ℃ 12000 r/min转速离心10 min,收集上层清液。取上层清液加入20 μL 100 mM氯化钙,混匀,静置5 min,于4 ℃ 12000 r/min转速离心10 min,弃去上层清液,取下层风干。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(SDS-PAGE):将上述样品用1ml 1X SDS loading buffer溶解后离心,取上清液移至干净的EP管中,煮沸5 min,上样量5 μL,用Bio-rad预制胶和垂直电泳槽,恒定电压80 V电泳120 min,考马斯亮蓝染色后脱色。
切下对应凝胶条带,进一步切碎成1 mm3小块,转移于EP管中,用乙腈和碳酸氢氨脱色,二硫苏糖醇(DTT)还原二硫键,用胰蛋白酶(trypsin)酶解,37 ℃过夜处理,然后用10%的三氟乙酸终止酶解反应,所得到的肽段用含0.1%的三氟乙酸的50%丙酮溶液提取两次,然后将提取好的肽段用真空离心浓缩仪进行浓缩,再用0.1%的甲酸超纯水复溶,高速离心混匀,用于质谱检测。
1.2.2 Lunaisn标准品的配制
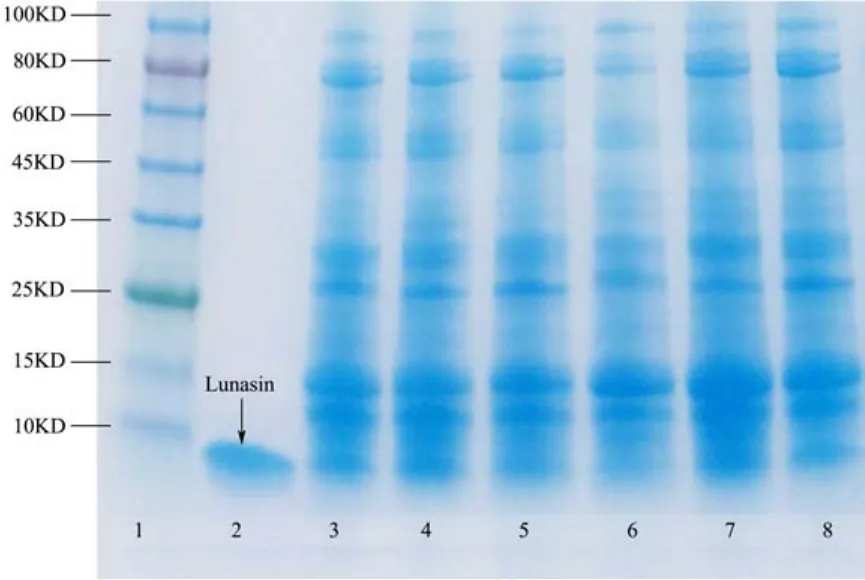
图1 大豆提取物及Lunasin标准品SDS-PAG电泳图Fig.1 SDS-PAG electrophoresis of soybean extractsand lunaisn standard
Lunaisn标准品的配制:精密称取Lunasin标准品20 mg,配成20 mg/mL的高标,并梯度稀释为2000 mg/L,100 mg/L、500 mg/L、250 mg/L和125 mg/L。SDS-PAGE和酶解用同上1.2.1所述的条件进行处理。
1.2.3 Lunasin的测定
用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap)平行反应监视法(PRM)测定六种大豆中Lunasin含量。
色谱条件:色谱柱:EASY-Spray column (50 μm×15 cm,2 μm);柱温:25 ℃;流速:300 nL/min;进样体积2 μL;A液:0.1%甲酸水溶液,B液:0.1%甲酸的乙腈溶液;洗脱程序如表1所示。
质谱条件:离子源:电喷雾电离源(ESI);扫描方式:平行反应监视法(PRM);采用正离子模式,离子传输管温度320 ℃;一级全扫描范围为m/z 350~1550,自动增益控制(AGC)和离子注入时间(IT)分别设为2.0e5和50 ms;二级扫描(dd-MS2) AGC设为5.0e4,离子注入时间IT设为100 ms,碰撞能量为32 eV,对所有质谱结果使用Proteome Discover(Vesion PD1.4)软件在Uniprot/Swiss-prot数据库进行检索,得到最合适的鉴定结果。
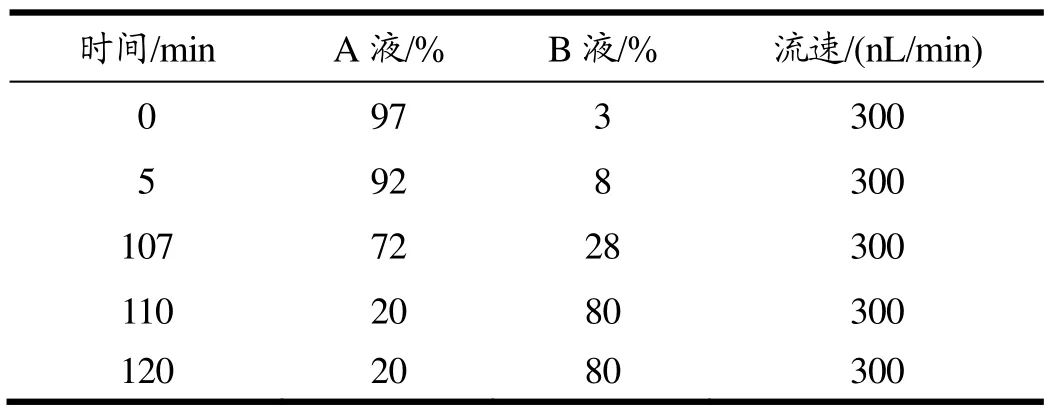
表1 洗脱程序Table 1 Elution program
2 结果与讨论
2.1 大豆提取物及Lunasin电泳结果
恒定电压80 V电泳120 min,以考马斯亮蓝G-250染色后脱色,以Marker及阳性对照Lunasin标准品作为参照物,电泳结果见图1。从大豆提取物及Lunasin标准品电泳结果图中可以看出,在2号阳性对照Lunasin标准品条带相应的位置,3~8号都有条带出现,可能是多肽Lunasin。六种大豆的提取物的电泳条带样式近似,但颜色深浅不同。
2.2 Lunasin含量的测定

图2 标准品总离子流图和一级质谱图Fig.2 Total ion chromatogram and mass spectrogram of standard substance
2.2.1 Lunasin定量肽段的确定及标准曲线的建立
如图2所示是酶解后的标准品的总离子流图和一级质谱图,从总离子流图中可以看出,响应最强的化合物保留时间为26.53~27.37 min的峰,一级质谱图显示该峰对应的质荷比(m/z)是693.86377。用NCBI中大豆蛋白库Blast检索得QLQGVNLTPCEK是大豆中Lunasin的特异性肽段,是其氨基酸序列SKWQHQQDSCRKQLQGVNLTPCEKHIMEKIQGR GDDDDDDDDD中的一部分,符合胰蛋白酶酶切位点特征,实际检测出来的m/z是693.86377(理论值693.85999,误差5.81×10-6),误差小于10×10-6,可以认为是同一肽段。
我们用Lunasin酶解后的特征性肽段QLQGVNLTPCEK来进行定量。如图3所示是Lunasin标准品的二级质谱图,从图中可以看出响应最高的离子为y4+离子。因此,选择肽段QLQGVNLTPCEK,母离子m/z为693.86377,特征子离子y4+m/z为533.24133,来进行大豆中Lunasin的定量。

图3 标准品二级质谱图Fig.3 Two stage mass spectrogram of standard substance
按照1.2.2中的方法,Lunasin标准品为2000 mg/L、1000 mg/L、500 mg/L、250 mg/L和125 mg/L系列稀释溶液用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap),平行反应监视法(PRM)法依次进行检测。以标准品峰面积对其浓度进行线性回归,质量浓度(mg/L)为横坐标,峰面积为纵坐标制作标准曲线,结果显示得到标准曲线为y=7993552.01x-1264601495.50,R2=0.998,线性关系良好,适用于定量分析。
2.2.2 精密度及样品加标回收率实验
精密度实验:取2.2.1标准品溶液,以2 μL进样量连续进样6次,计算得峰面积的RSD分别为0.21%。
回收率实验:样品加标回收实验参照许高燕[15]的方法,取同一大豆样品粉末2份各100 mg,一份作为对照,另一份加入0.2 mg Lunasin标准品,按照1.2.3中方法提取并进行NanoLC-Obitrap分析,重复三次。实验结果表明:PRM方法测定大豆中Lunasin含量,可操作性强,方法准确可靠,回收率为81.00%,RSD为2.10%。结果显示,本法具有较好的重复性与灵敏度,适用于定量分析。
2.2.3 六种国产栽培大豆中Lunasin含量测定
取中黄13大豆、中黄75大豆、徐豆14大豆、黑河43大豆、黔豆7号大豆、皖豆35大豆,各100 mg,按上述方法,用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap),平行反应监视法(PRM)法依次进行检测其中多肽Lunasin含量,具体结果见表2。

表2 六种国产栽培大豆中Lunasin含量Table 2 Lunasin content in six different cultivars of domestic soybeans
3 结论
本文利用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap)平行反应监视法(PRM)对六种国产大豆中Lunasin的含量进行了测定。发现国产的六种大豆中均含有Lunasin,皖豆35大豆中Lunasin含量最高,为4.66 mg/g;中黄13中含量为2.24 mg/g;中黄75中含量为3.35 mg/g;徐豆14中含量为2.59 mg/g;黔豆7号中含量为2.03 mg/g;黑河43号含量为2.87 mg/g。实验结果表明大豆中Lunasin含量丰富。
本研究以国产六种大豆为实验材料,建立了提取大豆多肽Lunasin的方法,采用SDS-PAGE分离的方法降低了基质干扰,并采用纳流液相色谱串联轨道阱质谱(NanoLC-Obitrap)平行反应监视法(PRM)对大豆中Lunasin含量进行测定。本测定方法准确可靠,重现性好。为全面认识不同品种大豆中Lunasin及优质蛋白和多肽,开展大豆品种营养评价奠定了必要的理论基础。同时Lunasin作为大豆中目前发现的含量较高的多肽,通过该分析方法检测多肽的含量,可以用于筛选富含Lunasin大豆的优势品种,或许可能作为大豆质量评价的一个方法,为功能性食品的开发提供支撑。
[1] Lule V K, Garg S, Pophaly S D, et al. Potential health benefits of Lunasin: a multifaceted soy-derived bioactive peptide [J]. Journal of Food Science, 2015, 80(3): 485-494
[2] De Lumen B O. Lunasin: a cancer preventive soy peptide [J].Nutrition Reviews, 2005, 63(1): 16-21
[3] Galvez A F. Identification of Lunasin as the active component in soy protein responsible for reducing LDL cholesterol and risk of cardiovascular disease [J]. Circulation, 2012, 126(21):A10693
[4] Jeong H J, Jeong J B, Kim D S, et al. Inhibition of core histone acetylation by the cancer preventive peptide Lunasin[J]. Journal Agricultural and Food Chemistry, 2007, 55(3):632-637
[5] Park J H, Jeong H J, de Lumen B O. Contents and bioactivities of Lunasin, bowman-birk inhibitor, and isoflavones in soybean seed [J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 7686-7690
[6] Gonzalez de M, E Vasconez, M de Lumen B O, et al. Lunsin concerntration in different soybean gentoyprs, commercial soy protein, and isoflavone products [J]. Journal Agricultural and Food Chemistry, 2004, 52(19): 5882-5887
[7] Ren G, Zhu Y, Shi Z, et al. Detection of Lunasin in quinoa(Chenopodium quinoa Willd.) and the in vitro evaluation of its antioxidant and anti-inflammatory activities [J]. Journal of the Science of Food and Agriculture,2017, 97(12): 4110-4116
[8] Nakurte I, Klavins K, Kirhnere I, et al. Discovery of Lunasin peptide in triticale (X Triticosecale Wittmack) [J]. Journal of Cereal Science, 2012, 56(2): 510-514
[9] Dinelli G, Bregola V, Bosi S, et al. Lunasin in wheat: a chemical and molecular study on its presence or absence [J].Food Chemistry, 2014, 151(4): 520-525
[10] 李莉峰.我国大豆加工利用发展研究[J].农业科技与装备,2011,1(199):6-8
LI Li-feng, Research on the processing and utilization of soybeans in China [J]. Agricultural Science & Technology and Equipment, 2011, 1(199): 6-8
[11] 赵力超,陈永泉,金越.我国大豆加工利用研究的综合分析[J].现代食品科技,2015,21(1):157-159
ZHAO Li-chao, CHEN Yong-quan, JIN Yue. Analysis of Chinese soybean processing and utilization [J]. Modern Food Science and Technology, 2005, 21(1): 157-159
[12] 韩德志,闫洪睿,梁吉利,等.黑河43号大豆品种大面积推广分析[J].中国西部科技,2013,11:55-56
HAN De-zhi, YAN Hong-rui, LIANG Ji-li. Heihe 43 soybean large extension analysis [J]. Science and Technology of West China, 2013, 11: 55-56
[13] 成雪峰,张凤云.黄淮海夏大豆生产现状及发展对策[J].大豆科学,2010,29(1):157-160
CHENG Xue-feng, ZHANG Feng-yun. Prensent conditions and countermeasures of soybean production in huang-huai-hai region [J]. Soybean Science, 2010, 29(1):157-160
[14] Krishnan H B, Wang T T. An effective and simple procedure to isolate abundant quantities of biologically active chemopreventive Lunasin Protease Inhibitor Concentrate(LPIC) from soybean [J]. Food Chemistry, 2015, 177:120-126
[15] 许高燕,刘莹雯,银董红.高效液相色谱-串联质谱法同时测定水溶性迷迭香提取物中迷迭香酸、阿魏酸和咖啡酸的含量[J].分析科学学报,2006,229(1):567-569
XU Gao-yan, LIU Ying-wen, YIN Dong-hong. Simultaneous determination of rosmarinic acid, caffeic acid and ferulic acid in water- soluble extract of rosemary by LC/MS/MS [J].Journal of Analytical Science, 2006, 22(5): 567-569
