乳酸菌对活菌型发酵大豆复合蛋白饮料中脲酶的影响
2018-03-01杨晓娟黄秀敏鲍志宁黄宜辉戴南艺谭颖嫦
杨晓娟,黄秀敏,鲍志宁,黄宜辉,戴南艺,谭颖嫦
(广州市微生物研究所,广东广州 510630)
我国豆类资源丰富,并且大豆中含有蛋白质、低聚糖、大豆异黄酮、磷脂和维生素等多种对人体有益的营养成分[1]。大豆蛋白含有多种人体必需氨基酸,不仅能够补充动物蛋白中某些氨基酸的不足,还具有降低胆固醇、抗氧化和抗肿瘤等益生作用[2,3],更好地满足人们对蛋白质的需求。以豆奶和牛奶为原料,依靠乳酸菌的发酵作用生产发酵型大豆复合蛋白饮料,既能够起到双重的营养和保健作用[4],又能降低生产成本、解决豆奶货架期较短的状况[5],为我国大豆资源的利用以及新型大豆复合蛋白饮料的开发创造新的途径。
值得注意的是,实际应用中发现,在豆乳基原料本身不含脲酶的情况下,用乳酸菌发酵的活菌型大豆复合蛋白饮料中有脲酶被检出。按照《GB 7101-2015食品安全国家标准 饮料》规定,以大豆为原料的饮料需进行脲酶试验且检出结果为阴性,即脲酶不得检出[6],但国标未注明其不适用于活菌型饮料,没有考虑到发酵过程中乳酸菌自身造成脲酶检出阳性的可能情况。脲酶(Urease)是能将尿素水解成NH3和CO2的酶,本身没有毒性,大豆中含有胰蛋白酶抑制剂、植物血凝素、皂甙等热敏性物质,而脲酶对热敏感性与胰蛋白酶抑制剂、植物血凝素、皂甙等极为相似,利用脲酶试验可以鉴别胰蛋白酶抑制剂和血凝素等的存在程度[7,8],这也是《GB 7101-2015 食品安全国家标准 饮料》中要求检测以大豆为原料的饮料是否含有脲酶的原因。研究表明,在自然界中已鉴定的产脲酶菌株包括克雷白氏杆菌、变形杆菌、乳酸杆菌和链球菌[9]。国外已有对牛乳发酵中乳酸菌与脲酶活性关系等进行较深入的研究,嗜热链球菌和罗伊氏乳杆菌拥有脲酶基因簇,是少有已知可产生脲酶的乳酸菌菌株[10~14];Stefania等[10]首次发现,在牛乳缺乏碳源的条件下,嗜热链球菌的脲酶活性可提高德氏乳杆菌保加利亚亚种的胞内pH从而促进其生长;至于豆乳饮料中乳酸菌与脲酶产生关系还未见具体研究报道。目前国内对于活菌型发酵大豆复合蛋白饮料的报道也多为生产工艺的研究,而乳酸菌对活菌型发酵大豆复合蛋白饮料中脲酶的影响研究尚未见诸报端。本文从实际生产中质量管理发现的问题出发,以不含脲酶的豆浆粉为原料,考察了由四种不同乳酸菌菌株发酵的大豆复合蛋白饮料在发酵过程及贮藏过程中活菌数和脲酶的变化情况,以期为该类产品的生产和推广提供新的理论依据和参考。
1 材料与方法
1.1 菌种
德氏乳杆菌保加利亚亚种(Lactobacillus bulgaricus,CLB134-1)、嗜热链球菌(Streptococcus thermophilus,ST-L134-7-P),由华南理工大学食品科学与工程学院保藏;罗伊氏乳杆菌(Lactobacillus reuteri,CICC6118)、干酪乳杆菌(Lactobacillus casei,GBHM-21),由广东省微生物种质资源库保藏。
1.2 试剂与试验设备
1.2.1 主要试剂
龙王纯豆浆粉-C42,食品级,黑龙江省龙垦龙王食品有限公司;雀巢全脂奶粉,食品级,雀巢中国有限公司;白砂糖,食品级,雷州市信通糖业有限公司;其他试剂均为国产分析纯。
1.2.2 主要仪器设备
微电脑电陶炉,广东艾诗凯奇智能科技有限公司;超净工作台,江苏净化设备有限公司;恒温培养箱,上海一恒科学仪器有限公司;pH计,上海仪电科学仪器股份有限公司;电热恒温水浴锅,上海浦东荣丰科学仪器有限公司;碱式滴定管,北玻集团;海尔冰箱,青岛海尔股份有限公司。
1.3 试验方法
1.3.1 活菌型发酵大豆复合蛋白饮料的制备工艺流程
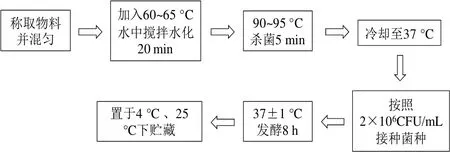
1.3.2 试验样品的制备
在接种环节,1#样品接种罗伊氏乳杆菌,2#样品接种干酪乳杆菌,3#样品接种德氏乳杆菌保加利亚亚种和嗜热链球菌(活菌量1:1),4#样品接种四种菌的组合菌(活菌量1:1:1:1),其他工艺环节相同。
1.3.3 活菌数的测定
参考国标GB 4789.35-2010[15]。
1.3.4 脲酶的定性测定
参考国标GB 5009.183-2003[16]。
1.3.5 脲酶的定量测定
参考国标GB/T 8622-2006[17]。
1.3.6 分析方法
试验数据通过SPSS 19软件进行数据处理,检验水准取(p)=0.05,所有数据均以平均值±SD表示。采用单因素方差分析(one-way ANOVA),方差齐时组间比较采用Duncan法,方差不齐时组间比较采用DunnettsT3法。p<0.05为差异有统计学意义。并采用Excel 2013软件作图。
2 结果与讨论
2.1 乳酸菌在发酵过程中对脲酶的影响
2.1.1 发酵过程中的脲酶定性结果
四种大豆复合蛋白饮料样品在发酵过程中的脲酶定性结果如图1所示。1#、2#和4#样品在发酵到第6 h开始有脲酶检出,而3#样品在发酵到第3 h即开始检出脲酶,并且,四种样品中检出的脲酶定性结果均呈淡黄色或微黄色澄清液,脲酶定性为弱阳性。由此得出,罗伊氏乳杆菌、干酪乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌在以单菌或者组合菌发酵的过程中均可产生脲酶。

图1 发酵过程中的脲酶定性结果Fig.1 The qualitative results of urease during fermentation
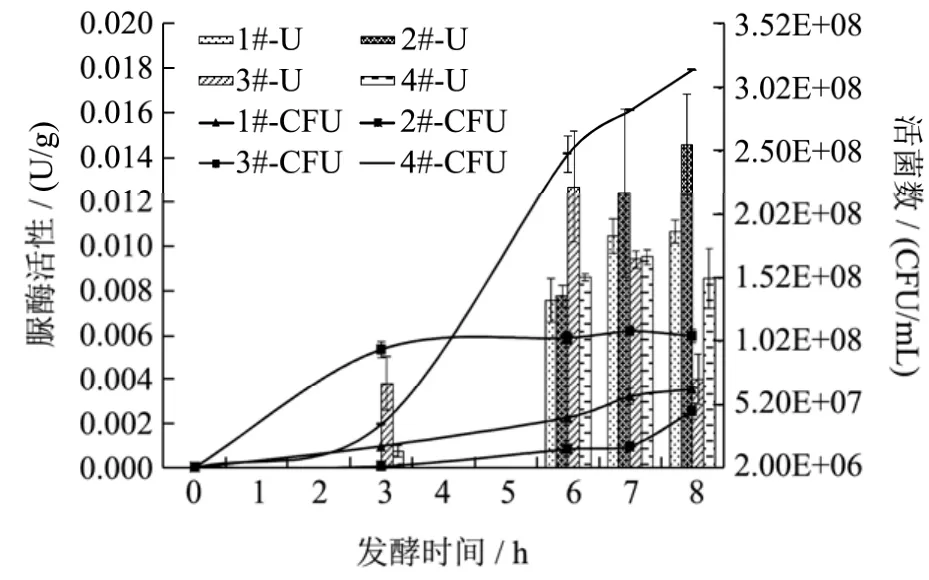
图2 发酵过程中的活菌数和脲酶活性变化Fig.2 The changes of viable bacteria amount and urease activity during fermentation
大豆复合蛋白饮料在发酵过程中的活菌数和脲酶活性变化结果如图2所示,而样品间活菌数和脲酶活性的差异性分析结果见表1。
2.1.2 发酵过程中的活菌数和脲酶活性变化

表1 发酵过程中的活菌数和脲酶活性差异性分析结果Table 1 Differential analysis results of viable bacteria amount and urease activity during fermentation
在发酵过程中,四种样品中活菌数均呈逐渐增长的态势。由表1可知,在发酵的各个时间段,四种样品中的活菌数彼此间均存在显著性差异(p<0.05)。相较而言,罗伊氏乳杆菌在豆乳基中的生长状况较干酪乳杆菌有优势,且二者在活菌数上存在显著性差异(p<0.05),但1#和2#样品在发酵结束时活菌数仅增加了一个数量级,可见单株的罗伊氏乳杆菌和干酪乳杆菌并不适合在本研究的豆乳基中生长。前人研究表明,使用组合菌发酵可有效克服单一菌株发酵中的不足之处[18]。德氏乳杆菌保加利亚亚种和嗜热链球菌组合是传统乳酸菌发酵剂的基本配方,3#样品中活菌数增长较快,两种菌的互惠共生作用使得发酵到第3 h活菌数即增加两个数量级。后续发酵过程中,由于豆乳基中乳糖被消耗,而德氏乳杆菌保加利亚亚种不产生蔗糖酶、半乳糖酶,不能分解利用蔗糖、水苏糖和棉籽糖,从而使得活菌数增加不显著。而四种菌组合发酵的4#样品,其活菌数增长态势最为明显,这可能是四种发酵菌株间存在互惠共生的机制,克服了豆乳基中乳糖不足的劣势,到发酵结束时,4#样品活菌数增加到3.16×108CFU/mL。
通过脲酶活性试验发现,在豆乳基本身不含脲酶的情况下,四种大豆复合蛋白饮料样品在发酵过程中均有脲酶活性被检出,但检出的脲酶活性较低,最高不超过0.020 U/g。由图2可见,随着发酵时间的延长,罗伊氏乳杆菌、干酪乳杆菌单菌发酵的1#、2#样品在发酵第6 h即可检出脲酶活性,与脲酶定性试验相符,并且脲酶活性逐渐增加,与活菌数呈正相关性。图2中2#样品中脲酶活性较1#样品高,但表2差异显著性分析发现,二者差异不显著(p>0.05)。至发酵结束时,2#样品脲酶活性为0.01656±0.00367 U/g,与3#、4#样品中脲酶活性存在显著性差异(p<0.05)。在由德氏乳杆菌保加利亚亚种和嗜热链球菌组合发酵的3#样品中,发酵第3 h开始检出脲酶活性,与脲酶定性试验相符,在发酵6 h后,脲酶活性并未随着活菌数的增加而增加,反而出现了减少的态势,这可能同保加利亚乳杆菌和嗜热链球菌在豆乳基中的共生机理存在一定的相关性。由于本研究所使用豆乳基配料的特殊性,对于整个发酵过程来说乳糖是相对缺乏的,发酵前期,仅有的乳糖可提供嗜热链球菌的生长从而使得脲酶活性较高,到发酵中后期,乳糖不足,限制了两种菌的生长,脲酶活性在一定程度上受到抑制而使得活性降低。同样的,由四种菌组合发酵的4#样品中脲酶活性也未随着活菌数的增加而增加,在发酵后3 h变化趋势不明显。由表1可知,3#、4#样品在发酵3 h和6 h时脲酶活性存在显著性差异(p<0.05),而发酵7 h和8 h时两样品中脲酶活性无显著性差异(p>0.05)。由此推测,在由组合菌发酵的3#、4#样品中,菌种间的共生作用可使脲酶活性受到一定程度的抑制,但具体抑制机理还不得而知。
2.2 乳酸菌活菌量在贮藏过程中对脲酶的影响
2.2.1 4 ℃贮藏过程中的脲酶定性结果
活菌型发酵大豆复合蛋白饮料在4 ℃贮藏过程中的脲酶定性结果如图3所示。

图3 4 ℃贮藏过程中的脲酶定性结果Fig.3 The qualitative results of urease during storage at 4 ℃
研究发现,贮藏2周后,2#、3#样品脲酶检测为阴性,而1#、4#样品在第3周时脲酶检测为阴性,表明,随着贮藏时间的延长,样品中的脲酶活性逐渐减弱,直至消失。
2.2.2 4 ℃贮藏过程中的活菌数和脲酶活性变化
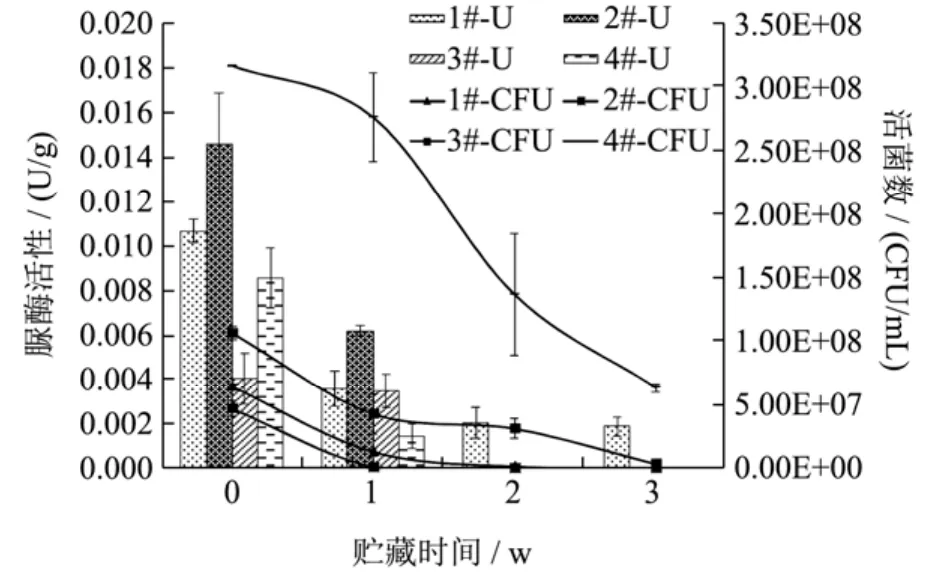
图4 4 ℃贮藏过程的活菌数和脲酶活性变化Fig.4 The changes of viablebacteria amount and urease activity during storage at 4 ℃
活菌型发酵大豆复合蛋白饮料在4 ℃贮藏过程中的活菌数和脲酶活性变化结果如图4所示。而样品间活菌数和脲酶活性的差异性分析结果见表2。由图4和表2可知,低温的限制以及后酸化作用造成的酸度升高致使四种样品活菌稳定性减弱,在3周的贮藏过程中,四种样品活菌数均逐渐降低,且各个贮藏时间段活菌数均呈现显著性差异(p<0.05)。其中,1#、2#样品中活菌数分别在贮藏时间为第3周及第2周时降为0;3#样品中活菌数降低了两个数量级(贮藏3周),为(3.03±0.04)×106CFU/mL,而4#样品中活菌数仅下降了一个数量级,为(6.33±0.18)×107CFU/mL。上述结果表明,四种菌组合发酵的4#样品贮藏稳定性优势明显,可见多菌的共生作用有利于提高发酵菌株贮藏稳定性。
除单菌罗伊氏乳杆菌发酵的1#样品外,其他三种活菌型发酵大豆复合蛋白饮料中脲酶活性均在贮藏过程中逐渐减弱或消失,与脲酶定性试验相符,而1#样品在贮藏3周后仍有脲酶活性,这可能与罗伊氏乳杆菌本身产脲酶的特性有关,尚待进一步研究。
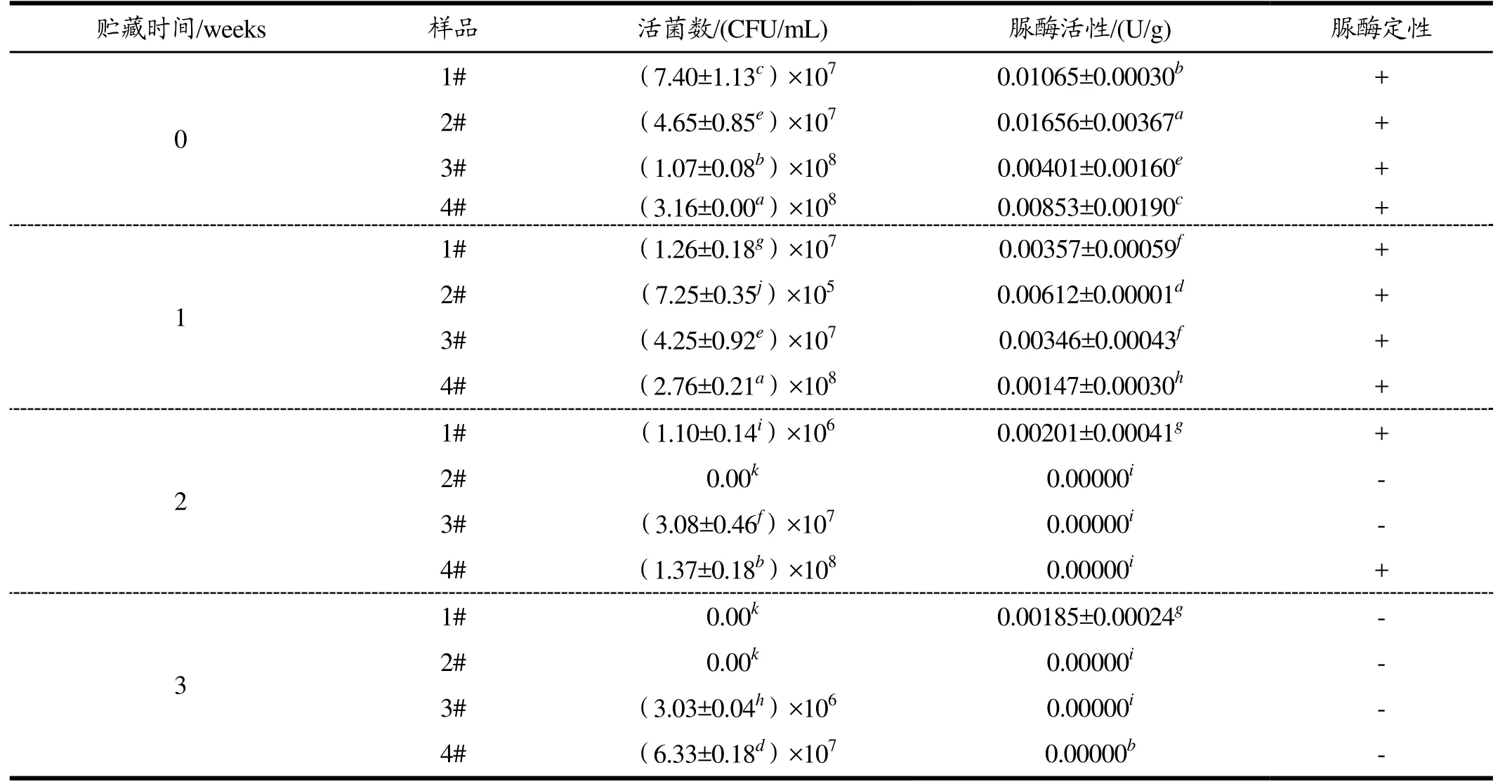
表2 4 ℃贮藏过程中的活菌数和脲酶活性差异性分析结果Table 2 Differential analysis results of viablebacteria amount and urease activity during storage at 4 ℃
2.2.3 25 ℃贮藏过程中的脲酶定性结果

图5 25 ℃贮藏过程中的脲酶定性结果Fig.5 The qualitative results of urease during storage at 25 ℃
活菌型发酵大豆复合蛋白饮料在25 ℃贮藏过程中的脲酶定性结果如图5所示。由图5可见:4#样品经过1周贮藏,其脲酶检测为阴性,2#样品经过2周贮藏,其脲酶检测为阴性;而1#、3#样品经过3周贮藏,其脲酶检测为阴性。同时,相比于4 ℃条件下贮藏,4#样品在25 ℃条件下脲酶消失得更快。
2.2.4 25 ℃贮藏过程中的活菌数和脲酶活性变化
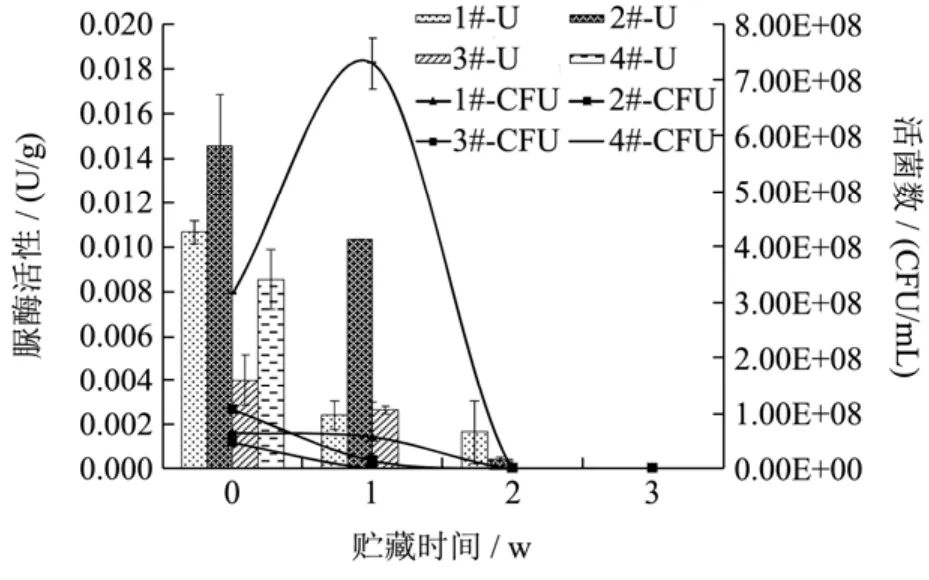
图6 25 ℃贮藏过程中的活菌数和脲酶活性变化Fig.6 The changes of viable bacteria amount and urease activity during storage at 25 ℃
活菌型发酵大豆复合蛋白饮料在4 ℃贮藏过程中的活菌数和脲酶活性变化结果如图6所示,而样品间活菌数和脲酶活性的差异性分析结果见表3。
在25 ℃贮藏下,活菌型发酵大豆复合蛋白饮料中的菌株依然处于产酸增殖的状态,当产酸量累积到较高水平,又会抑制菌株增殖甚而使其失活。图6中除4#样品外,1#、2#和3#样品中活菌数在3周的贮藏过程中均逐渐降低,其中,1#、2#样品中活菌数经过2周的贮藏即分别降为0。4#样品中活菌数经过1周的贮藏增加至7.29×108CFU/mL,与其他三种豆酸奶活菌数存在显著性差异(p<0.05),表明菌株间的相互作用仍在促进其活菌数的增长,但随着产酸增加,样品活菌数逐渐降为0。

表3 25 ℃贮藏过程中的活菌数和脲酶活性差异性分析结果Table 3 Differential analysis results of viable bacteria amount and urease activity during storage at 25 ℃
3 结论
3.1 本研究综合分析了罗伊氏乳杆菌、干酪乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌以不同配比接种后对活菌型发酵大豆复合蛋白饮料中脲酶的影响,得出以下结论:(1)在豆乳基原料本身不含脲酶的情况下,罗伊氏乳杆菌、干酪乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌不论是单菌还是组合菌发酵均可产生脲酶,脲酶定性为弱阳性,脲酶活性最高不超过0.020 U/g;单菌发酵样品中脲酶活性与活菌数呈正相关性,而组合菌发酵样品中脲酶活性却未随着活菌数的增加而提高。(2)在4 ℃和25 ℃贮藏过程中,随着活菌型发酵大豆复合蛋白饮料样品中活菌数的降低,脲酶活性逐渐减弱或消失。
3.2 现行的《GB 7101-2015食品安全国家标准 饮料》中规定以大豆为原料的饮料中脲酶试验应该为阴性,即脲酶不得检出,但国标未提及经由活性乳酸菌发酵产生脲酶从而造成脲酶检出阳性的情况。本研究结果证实在豆乳基原料本身不含脲酶的情况下,罗伊氏乳杆菌、干酪乳杆菌、德氏乳杆菌保加利亚亚种和嗜热链球菌不论是以单菌发酵还是以组合菌发酵均可产生脲酶。目前含有大豆蛋白的活菌型发酵饮料也在逐步进入市场,在此类产品中检出脲酶是否就意味着产品质量不合格,或者是否应对此类产品中的脲酶活性进行安全范围的限度,希望本研究能够引起相关关注和讨论。
3.3 本研究也有自身的局限与不足:(1)由于没有专门检测食品或大豆蛋白饮料中脲酶活性的国标,本研究参考了《GB/T 8622-2006饲料用大豆制品中尿素酶活性的测定》,这在检测值上可能与真实值存在一定的误差;(2)本研究仅涉及四株乳酸菌,并不能代表其他菌株,因此不能定论所有乳酸菌菌株发酵的含大豆蛋白饮料均产脲酶,筛选不产脲酶的菌株也是解决本问题的有效途径之一;(3)本研究也未进行纯牛乳、纯豆乳发酵是否有脲酶活性检出的对比试验,这也是有待于去研究完善的地方。
[1] Isanga J, Zhang G N. Soybean bioactive components and their implications to health-a review [J]. Food Reviews International, 2008, 24(2): 252-276
[2] Chen H M, Muramoto K, Yamauchi F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein [J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2619-2623
[3] Carroll K K. Review of clinical studies on cholesterol-lowering response to soy protein [J]. Journal of the American Dietetic Association, 1991, 91(7): 820-827
[4] Tsai T Y, Chu L H, Lee C L, et al. Atherosclerosis-preventing activity of lactic acid bacteria-fermented milk-soymilk supplemented with Momordica charantia [J]. Journal of Agricultural and Food Chemistry, 2009, 57(5): 2065-2071
[5] Farnworth E, Mainville I, Desjardins M P, et al. Growth of probiotic bacteria and bifidobacteria in a soy yogurt formulation [J]. International Journal of Food Microbiology,2007, 116(1): 174-181
[6] GB 7101-2015,食品安全国家标准 饮料[S]GB 7101-2015, Food Safety National Standard Beverage [S]
[7] 何学军,齐德生.大豆抗营养因子及豆粕的质量评价[J].饲料研究,2006,5:32-34
HE Xue-jun, QI De-sheng. Quality evaluation of soybean anti-nutrition factor and soybean pulp [J]. Feed Research,2006, 5: 32-34
[8] 吴洁英.建议在大豆制品的理化指标中增加脲酶定性试验[J].食品科学,1992,13(7):48-49
WU Jie-ying. The advice of increasing the determination of urease in physical and chemical indexes of soybean products[J]. Food Science, 1992, 13(7): 48-49
[9] Balan, Senthil S, Fathima, et al. Characterization of urease enzyme from marinebacterium Klebsiella species [J]. African Journal of Microbiology Research, 2012, 30(6): 5914-5923
[10] Stefania A, Giulia D S, Maria C R, et al. Streptococcus thermophilus urease activity boosts Lactobacillus delbrueckiisubsp. bulgaricus homolactic fermentation [J].International Journal of Food Microbiology, 2017, 247(SI):55-64
[11] Teresa Z, Annamaria R, Rocco R, et al. Urease production by Streptococcus thermophilus [J]. Food Microbiology, 2008,25(1): 113-119
[12] Yang Y Q, Zhen K, Zhou J L, et al. High-level expression and characterization of recombinant acidurease for enzymatic degradation of urea in rice wine [J]. Applied Microbiology and Biotechnology, 2015, 99(1): 301-308
[13] Janina A K, Nathan L M, Steven A F, et al. Characterization of the ecological role of genesmediating acid resistance in Lactobacillus reuteri duringcolonization of the gastrointestinal tract [J]. Environmental Microbiology, 2016,7(SI): 2172-2184
[14] Mora D, Maguin E, Masiero M, et al. Characterization of urease genes cluster of Streptococcusthermophilus [J].Journal of Applied Microbiology, 2004, 96(1): 209-219
[15] GB 4789.35-2010,食品安全国家标准 食品微生物学检验乳酸菌检验[S]
GB 4789.35-2010, Food safety national standard Food microbiology test of lactic acid bacteria [S]
[16] GB 5009.183-2003,植物蛋白饮料中脲酶的定性测定[S]GB 5009.183-2003, Determination of urease in vegetable protein beverage [S]
[17] GB/T 8622-2006,饲料用大豆制品中尿素酶活性的测定[S]GB/T 8622-2006, Determination of urease activity in feed soybean products [S]
[18] 范兴艺.嗜酸乳杆菌的分离、鉴定及其在发酵豆乳中生长特性的研究[D].杭州:浙江工商大学,2008
FAN Xing-yi. Studies on isolation and identification of Lactobacillus acidophilus and its growth characteristics in fermented soymilk [D]. Hangzhou: Zhejiang University of Commerce and Industry, 2008
