鸭疫里默氏杆菌OmpA/motb蛋白的表达纯化及免疫学特性分析
2018-03-01张雪梅王小兰任晓梅窦亚峰王桂军于圣青
张雪梅,王小兰,任晓梅,丁 铲,窦亚峰,李 涛,王桂军,于圣青
(1. 安徽农业大学动物科技学院,合肥 230036;2. 中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌OmpA/motb蛋白的表达纯化及免疫学特性分析
张雪梅1,2,王小兰2,任晓梅2,丁 铲2,窦亚峰2,李 涛2,王桂军1,于圣青2
(1. 安徽农业大学动物科技学院,合肥 230036;2. 中国农业科学院上海兽医研究所,上海 200241)
本研究对血清1型鸭疫里默氏杆菌(Riemerella anatipestifer,RA)CH3株的ompA/motb基因核苷酸序列及其蛋白进行生物学信息分析,用PCR技术扩增获得去除信号肽编码区段的ompA/motb基因,并构建重组表达质粒pET30a-OmpA/mtob,成功表达分子量约为55 kDa的重组蛋白rOmpA/motb。Western blot结果显示,rOmpA/motb能与血清1、2、10和15型RA阳性血清发生特异性反应,表明rOmpA/motb具有交叉免疫原性。以纯化的rOmpA/motb免疫新西兰大白兔,经3次免疫后兔血清中抗OmpA/motb蛋白的抗体效价为1:256 000;Western blot结果显示OmpA/motb兔多抗可与血清1型、2型、10型和15型RA菌株发生特异性结合反应,与其他菌株无反应性。本研究制备的RA OmpA/motb多克隆抗体具有良好的反应性及特异性,为进一步研究OmpA/motb蛋白的免疫学功能及建立鸭疫里默氏杆菌病的诊断方法奠定了基础。
鸭疫里默氏杆菌;rOmpA/motb蛋白;多克隆抗体;免疫学特性
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)主要感染家鸭、火鸡、鹅和其他多种鸟类后引起接触性高致病性传染病[1],1~8周龄雏鸭对RA易感,其中以2~3周龄雏鸭最易感。RA感染呈急性败血或慢性过程,临床上主要表现为纤维素性心包炎、肝周炎、干酪样输卵管炎等。在我国,郭玉璞[2]首次报道了本病,随后全国各地相继有RA感染的报道[3,4]。目前,几乎所有发展集约化养鸭生产的国家均发现有RA感染[5]。
外膜蛋白(outer membrane proteins,OMPs)是革兰氏阴性菌外膜的主要结构成分,具有较强的免疫原性且能诱导保护性免疫反应。前期研究表明,RAOmpA/motb蛋白是血清1、2、10型菌株的一个共同免疫原性蛋白[6]。本研究克隆并表达了RAompA/motb基因,获得纯化的重组OmpA/motb蛋白,并制备了该蛋白的多克隆抗体,为进一步建立RA快速诊断方法奠定了基础。
1 材料与方法
1.1 菌株、质粒和实验动物 本研究所用的菌株及引物详见表1。原核表达载体pET-30a(+)由中国农业科学院上海兽医研究所公共卫生研究室(以下简称本实验室)保存;8周龄雌性新西兰大白兔购自中国科学院斯莱克动物实验中心。

表1 本研究中所用的菌株及引物Table1 Stains and primers used in this study
1.2 主要试剂 质粒小提试剂盒、可溶型单组分TMB底物溶液购自天根生化科技(北京)有限公司;DNA连接酶solution I、限制性核酸内切酶BamH I和SalI购自宝生物工程(大连)有限公司;HisTrap亲和层析柱购自GE Healthcare Life Sciences公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;HRP标记的山羊抗兔IgG抗体购自KPL公司;基本型ECL发光液购自上海圣尔生物科技有限公司。
1.3 RA ompA/motb基因的生物信息学分析、扩增及重组表达质粒的构建 根据GenBank上发表的RACH3株ompA/motb基因(locus_tag:M949_1325)序列,利用Primer premier 5.0软件设计ompA/motb开放阅读框引物,PCR扩增RANJ3株、HXb2株和LAG1株的ompA/motb基因后进行序列测定。运用Signal PV4.1预测OmpA/motb氨基酸的信号肽,TMHMM工具预测跨膜区。
提取RACH3株的全基因组DNA为模板,使用Premix TaqTM扩增ompA/motb的基因序列(去除信号肽编码区)。PCR产物经琼脂糖凝胶电泳后回收目的片段,并以BamH I和SalI酶切,回收目的片段与经同样酶切处理pET-30a(+)载体连接,并转入感受态E.coliDH5α中,挑取阳性克隆培养后提取质粒,分别进行酶切和测序鉴定。
1.4 重组蛋白OmpA/motb的表达与纯化 将重组质粒pET30a-OmpA/motb转入宿主菌BL21(DE3),挑取阳性克隆接种于含卡那霉素的LB培养基,37℃振荡培养至OD600值为0.6~0.8时,加入IPTG诱导表达6 h,同时设置阴性对照。收集菌体,通过高压破碎法裂解细菌,离心后收集上清和包涵体,SDSPAGE检测重组蛋白的表达情况。
收集诱导表达rOmpA/motb的细菌,菌体裂解后收集包涵体,溶于8 mol/L尿素溶解液。溶解后的蛋白用HisTrap亲和层析柱进行纯化。经SDS-PAGE分析纯度后,用BCA蛋白浓度测定试剂盒检测蛋白浓度。
1.5 OmpA/motb蛋白免疫原性的检测 采用Western blot检测OmpA/motb蛋白的免疫原性。诱导表达rOmpA/motb的细菌裂解后进行SDS-PAGE分析,半干转印至硝酸纤维素(nitrocellulose,NC)膜上。经含5%脱脂乳的PBS封闭后,分别与RA血清1、2、10、15型阳性鸭血清及健康阴性鸭血清孵育,再与HRP标记羊抗鸭IgG孵育。最后用基本型ECL发光液显色,Tanon全自动化学发光图像分析系统进行分析。
1.6 抗OmpA/motb蛋白多克隆抗体的制备及效价的测定 将500 μg纯化后的rOmpA/motb蛋白与等体积弗氏佐剂混合并充分乳化后,经皮下多点注射免疫新西兰大白兔。此后每隔2周,取首免等剂量的免疫原与等体积弗氏不完全佐剂混合乳化后加强免疫2次。三免后10 d采血,分离血清,-20℃保存备用。
用本实验室已建立的间接ELISA测定兔血清抗体效价。具体方法如下:用纯化的rOmpA/motb、CH3全菌蛋白、NJ3全菌蛋白和HXb2全菌蛋白分别包被ELISA板;经含5%脱脂乳的PBS溶液封闭后,依次以2倍倍比稀释的抗OmpA/motb蛋白兔血清作为一抗,以HRP标记的羊抗兔IgG作为二抗,孵育后PBST洗涤,TMB底物显色,2 mol/L H2SO4终止反应后测定OD450值。以未免疫兔血清作为阴性对照,当阳性血清OD450与阴性血清OD450之比,即(P/N)≥2.1,判定为阳性。
1.7 抗OmpA/motb蛋白多克隆抗体的特异性检测 取RA血清1型、血清2型、血清10型、血清15型菌株(CH3、NJ3、HXb2、LAG1)、禽致病性大肠杆菌血清O1型菌株APECO1、血清O2型菌株DE719、血清O78型菌株E937、沙门氏菌菌株CVCC1805、CAU0118和禽巴氏杆菌菌株CVCC493,培养至对数生长期,4℃、12 000×g离心5 min,收集菌体,PBS洗涤后重悬(2.0×109CFU/mL)于1×SDSPAGE蛋白上样缓冲液中,煮沸获得各菌株的全菌蛋白。对提取的全菌蛋白和纯化的rOmpA/motb蛋白进行SDS-PAGE分析,半干转印至NC膜上;用含5%脱脂乳的PBS封闭后,以抗OmpA/motb蛋白兔血清为一抗;IRDye®800CW标记的驴抗兔IgG为二抗,分析抗OmpA/motb蛋白兔血清的特异性。
2 结果
2.1 ompA/motb基因的生物信息学分析 运用ompA/motb基因特异性引物可从RACH3株、NJ3株、HXb2株和LAG1株中扩增到ompA/motb基因,经序列测定其片段长度均为1467 bp。序列分析表明RACH3株的ompA/motb基因与NJ3株、HXb2株和LAG1株的基因具有很高的同源性,其核苷酸序列相似性为95.8%~98.8%,编码产物氨基酸序列相似性为96.7%~99.2%。经预测OmpA/motb蛋白有Tsp-3和OmpA-C-Like 2个保守区;有一个N端信号肽,位于1-21号氨基酸残基;无跨膜区。
2.2 融合表达载体pET30a-OmpA/motb的构建 以RACH3株基因组DNA为模板,经PCR扩增获得与预期1374 bp大小一致的ompA/motb基因去信号肽片段(图1A);克隆至载体pET-30a(+)后构建重组表达载体pET30a-OmpA/motb,PCR鉴定获得2株阳性克隆(图1B);重组质粒pET30a-OmpA/motb经双酶切鉴定,获得与理论值一致的目的条带(图1C)。测序结果显示,重组载体中的ompA/motb基因序列完全正确,表明重组载体pET30a-OmpA/motb构建成功。

图1 重组载体pET30a-OmpA/motb的构建Fig.1 Construction of recombinant pET30a-OmpA/motb
2.3 rOmpA/motb的原核表达、纯化及抗原性分析将诱导的菌体裂解,分离上清和沉淀后进行SDSPAGE分析。结果表明,rOmpA/motb在55 kDa左右出现目的条带,且重组蛋白以包涵体形式存在(图2A)。经亲和层析柱纯化后,获得了较高纯度的rOmpA/motb,浓度为2.0 mg/mL。
对rOmpA/motb的免疫原性进行Western blot检测,结果显示,重组蛋白能够与RA血清1、2、10型及15型阳性血清发生特异性反应,在55 kDa处出现单一特异性目的带(图2B),表明OmpA/motb蛋白具有良好的交叉免疫原性。
2.4 兔抗rOmpA/motb多克隆抗体的效价测定 运用间接ELISA方法检测rOmpA/motb免疫新西兰大白兔后获得的高免血清,结果显示,第3次免疫后兔血清中抗OmpA/motb蛋白的抗体效价为1:256 000;而且可与血清1、2、10型RA(CH3、NJ3、HXb2)发生良好的交叉反应(图3),表明成功获得了高效且具有交叉反应性的RA OmpA/motb兔多抗。
2.5 兔抗OmpA/motb多克隆抗体的特异性检测Western blot分析表明,RAOmpA/motb兔多抗可与血清1、2、10型和15型RA(CH3、NJ3、HXb2和LAG1)发生特异性交叉反应,与禽致病性大肠杆菌(APECO1、DE719、E937)、沙门氏菌(CVCC1805、CAU0118)、禽巴氏杆菌(CVCC493)不发生反应(图4),表明制备的RAOmpA/motb多克隆抗体具有良好的反应性及特异性。

图2 RA OmpA/motb蛋白的原核表达、纯化及抗原性分析Fig.2 Expression, puri fi cation and speci fi city of RA OmpA/motb protein
3 讨论
OMPs在细菌的生命过程中起着重要的作用。OMPs具有良好的免疫原性,可同时激发机体的体液免疫和细胞免疫,具有异种血清型的免疫交叉保护作用,是一种潜在的共同保护性抗原。前期研究表明,OmpA/motb蛋白是RA血清1、2、10型的一个共同免疫原性蛋白[6]。本研究成功扩增了RA的ompA/motb基因,并利用pET-30a(+)表达载体成功获得rOmpA/motb,该蛋白能与不同血清型RA阳性血清发生特异性结合反应,表明OmpA/motb具有交叉免疫原性。rOmpA/motb免疫新西兰大白兔后获得的高免血清能够与血清1、2、10型及15型RA菌株发生特异性反应,而不与禽致病性大肠杆菌、沙门氏菌和禽巴氏杆菌发生反应,表明制备的RAOmpA/motb多克隆抗体具有良好特异性。

图3 鸭疫里默氏杆菌OmpA/motb多克隆抗体的ELISA效价Fig.3 The ELISA titer of the rabbit anti-OmpA/motb antibody
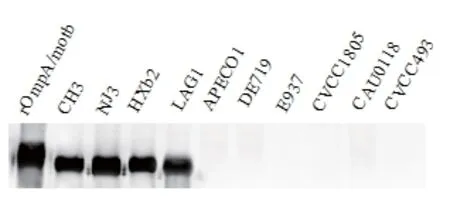
图4 OmpA/motb多克隆抗体的Western blot鉴定Fig.4 Identi fi cation of rabbit anti-OmpA/motb antibody by Western blot analysis
研究表明,ompA是不同血清型RA菌株的保守基因[10],杨建远等[11]以ompA基因建立的PCR检测方法可以检测出多种血清型RA菌株。对RAompA/motb基因的序列分析表明,该基因编码产物OmpA/motb在RA中高度保守,而与大肠杆菌、沙门氏菌等的OmpA蛋白和Motb蛋白的相似性很低;且OmpA/motb蛋白能与不同血清型RA阳性血清发生特异性结合反应,因此OmpA/motb可以作为RA血清学诊断的一个诊断靶标。
目前,临床上检测RA的方法有病原菌的分离鉴定、凝集试验或琼脂凝胶免疫扩散试验的血清学方法以及PCR诊断的分子生物学方法等,这些方法存在程序繁琐、灵敏性低、成本较高等缺点,因此需要建立一种快速灵敏、特异性强的方法以满足快速诊断检测的要求。本研究获得的RAOmpA/motb兔多抗反应性好、特异性强,可用于研制具有高灵敏性和特异性胶体金免疫检测试剂盒,以实现鸭疫里默氏杆菌病的快速检测及鉴别诊断。
[1]朱德康, 程安春, 汪铭书, 等. 鸭疫里默氏杆菌基因组文库的构建及免疫原性基因初筛选[J]. 中国兽医学报,2007, 27(6): 834-837.
[2]郭玉璞, 陈德威, 范国雄, 等. 北京小鸭传染性浆膜炎的调查研究[J]. 畜牧兽医学报, 1982, 13(2): 107-112.
[3]郭玉璞. 我国对鸭传染性浆膜炎研究概况[J]. 中国兽医杂志, 1997, 23(12): 37-38.
[4]程安春, 汪铭书, 陈孝跃. 我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原性[J]. 中国兽医学报, 2003,23(4): 320-323.
[5]Pathanasophon P, Phuektes P, Tanticharoenyos T,et al. A potential new serotype ofRiemerella anatipestiferisolated from ducks in Thailand[J]. Avian Pathol, 2002, 31(3):267-270.
[6]Hu Q, Ding C, Tu J,et al. Immunoproteomic analysis of whole cell bacterial protein ofRiemerella anatipestifer[J].Vet Microbiol, 2012, 157(3): 428-438.
[7]Han X, Ding C, He L,et al. Development of loopmediated isothermal amplification (LAMP) targeting the GroEL gene for rapid detection ofRiemerella anatipestifer[J]. Avian Dis, 2011, 55(3): 379-383.
[8]姜安安, 王小兰, 王少辉, 等. 血清15型鹅源鸭疫里默氏杆菌的分离鉴定及交叉免疫保护研究[J]. 中国动物传染病学报, 2015, 23(3): 17-23.
[9]陈文静, 韩先干, 何亮, 等. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析[J]. 中国动物传染病学报, 2010,18(2): 34-40.
[10]Sumathi S, Bin H, Hilad L,et al. Characterization of a predominant immunogenic outer membrane protein ofRiemerella anatipestifer[J]. Clin Diagn Lab Immunol,2000, 7(2): 168-174.
[11]杨建远, 邓舜洲, 何后军, 等. PCR法快速检测鸭疫里氏杆菌的研究[J]. 江西农业大学学报, 2005, 27(3): 339-442.
PROKARYOTIC EXPRESSION AND IMMUNOLOGICAL CHARACTERIZATION OF RECOMBINANT RIEMERELLA ANATIPESTIFER OMPA/MOTB PROTEIN
ZHANG Xue-mei1,2, WANG Xiao-lan2, REN Xiao-mei2, DING Chan2, DOU Ya-feng2, LI Tao2,WANG Gui-jun1, YU Sheng-qing2
(1. College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The OmpA/motb domain protein (OmpA/motb) has been identi fi ed as an immunogenic antigen of Riemerella anatipestifer by using immunoproteomics analysis. In this study, OmpA/motb of R. anatipestifer was expressed and recombinant protein was evaluated for its immunogenicity. The ompA/motb gene was ampli fi ed from serotype 1 strain CH3 of R. anatipestifer by polymerase chain reaction(PCR) and cloned into expression vector pET-30a (+). The pET30a-OmpA/motb plasmid was constructed and transformed into E. coli strain BL21(DE3). The recombinant OmpA/motb (rOmpA/motb) was expressied in E.coli with induction of IPTG and con fi rmed to be a recombinant protein of 55 kDa in SDS-PAGE with Coomassie blue staining. The recombinant protein rOmpA/motb reacted with duck antisera against R. anatipestifer CH3, NJ3, HXb2 and LAG1 in Western blot, suggesting it was a cross-immunogenic protein among R.anatipestifer strains of different serotypes. Subsequently, rabbit anti-OmpA/motb antibodies were generated by immunization of rabbits with purified rOmpA/motb. The titer of antiserum was assessed to be over 1:256 000 in ELISA. The rabbit anti-OmpA/motb serum reacted with R. anatipestifer CH3, NJ3, HXb2 and LAG1 in Western blotting but did not react with avian pathogenic E. coli, Salmonella enterica and Pasteurella multocida strains. The results showed that rabbit anti-OmpA/motb serum was speci fi c to and cross-reactive with R.anatipestifer strains of serotypes 1, 2, 10 and 15, suggesting it might be used for developing diagnostic kits in the further study.
Riemerella anatipestifer; rOmpA/motb; polyclonal antibody; immunologicity
S852.615
A
1674-6422(2018)01-0037-06
2017-08-18
国家重点研发计划项目(2016YFD0500800)
张雪梅,女,硕士研究生,预防兽医学专业
于圣青,E-mail:yus@shvri.ac.cn;王桂军,E-mail:wangguijun@ahau.edu.cn
