不同来源黑色素瘤BRAF V600E基因突变分析
2018-03-01高正君谢沛霖司小强杨国虎薛晓东徐靖宏
高正君,谢沛霖,司小强,杨国虎,薛晓东,徐靖宏
(1.甘肃省人民医院整形美容科 甘肃 兰州 730000;2.浙江大学附属第一医院整形美容科 浙江 杭州 310003)
黑色素瘤(Melanoma,M)是起源于神经嵴的黑素细胞恶性肿瘤,恶性度极高。若早期发现可能通过手术治愈,但进展期和发生远处转移者5年生存率不足5%,平均生存期仅2~8个月[1]。美国国立卫生研究院(简称NIH)研究表明,黑色素瘤在世界各地的发病率迅速上升。据统计,黑色素瘤中,只有约13%~30%为色素痣来源,其余均为非色素痣来源[2],而对黑色素瘤相关基因研究发现,BRAF基因是黑色素瘤中突变率最高的基因,是黑色素瘤特异性靶向治疗的热点基因,90%以上是BRAF V600E位点突变[3],国内目前关于色素痣来源和非色素痣来源的黑色素瘤中BRAF V600E基因突变率的研究尚属空白。本研究通过对不同来源黑色素瘤中BRAF V600E基因突变进行检测,以探讨BRAF基因突变与不同来源黑色素瘤的临床表型关系。
1 材料和方法
1.1 材料:选取2010年1月1日-2016年12月31日于本院皮肤科和整形外科收治的84例黑色素瘤患者为研究对象,采集新鲜标本或病灶石蜡组织,所有标本均经病理HE染色和免疫组化诊断证实,见图1。所有患者均自愿参与本研究,并签署知情同意书。

图1 黑色素瘤标本病理检测结果
1.2 临床特征
1.2.1 非色素痣来源:共62例标本,男35例,女27例;汉族57例,回族3例,藏族2例;发病年龄26~90岁,平均57.2岁;发病部位:肢端33例,非肢端24例,黏膜5例;淋巴结转移(-)36例,淋巴结转移(+)26例,其中远处转移6例。
1.2.2 色素痣来源:共22例标本,男12例,女10例;汉族21例,回族1例,藏族0例;发病年龄29~88岁,平均57.5岁;先天性小痣9例,后天痣13例;发病部位:肢端12例,非肢端7例,黏膜3例;淋巴结转移(-)13例,淋巴结转移(+)9例,其中远处转移1例。
1.3 BRAF V600基因突变检测方法
1.3.1 肿瘤基因组DNA提取方法:新鲜样本使用Qiagen公司QIAamP DNA Mini试剂盒提取DNA,石蜡组织使用Qiagen公司的QIAamP DNA FFPE Tissue试剂盒提取DNA,提取后置于-20℃保存备用。
1.3.2 PCR扩增目标片段:特异引物PCR扩增BRAF V600E基因外显子15,引物参照相关文献[3]报道。引物序列:15F:5’-TCATAATGCTTGCTCTGATAGGA-3’,15R:5’-GGCCAAAAATTTAATCAGTGGA-3’扩增后目标片段长度362bP。PCR反应体系:总体积为40μl,其中BRAF PCR反应液37μl,BRF酶系3μl。往上述PCR反应管中分别加入提取后的待测样本核酸、BRAF阴性质控品、BRAF野生型阳性质控品、BRAF突变型阳性质控品10µl,按下列条件扩增:50℃ 2min,95℃ 15min预变性,然后按(94℃30s→55℃ 30s→72℃ 45s)×40个循环扩增,最后72℃延伸7min。
1.3.3 PCR产物检测并纯化:为证实PCR产物中有无目标DNA片段,取5μl PCR产物做1%~2%琼脂糖凝胶电泳,观察是否有目的条带扩增(目的条带大小为362bP),如观察到明显的单一目的条带,则将上述PCR产物及时进行纯化,具体操作详见PCR产物纯化试剂盒说明书。
1.3.4 基因分析仪测序分析:变性后的测序产物按加样顺序编辑样品列表。使用ABI基因分析仪,应用ABI公司Data Collection与Sequencing Analysis软件进行数据收集和分析。运行SeqScanner程序,导入测序结果。找出序列“TAGGTGATTT”。突变分析:序列“TAGGTGATTT”后的第14~16位碱基为600位点,观察突变位点为单峰或双峰。
1.4 统计学分析:所有数据应用SPSS 13.0软件进行统计分析,四格表资料行χ2检验,或行×列表资料的χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 BRAF V600E基因突变检测结果:V600E未发生突变时,序列为GTG野生型,突变位点为单峰(见图2A);发生V600E突变时,为GWG,W表示T/A碱基杂合,突变位点
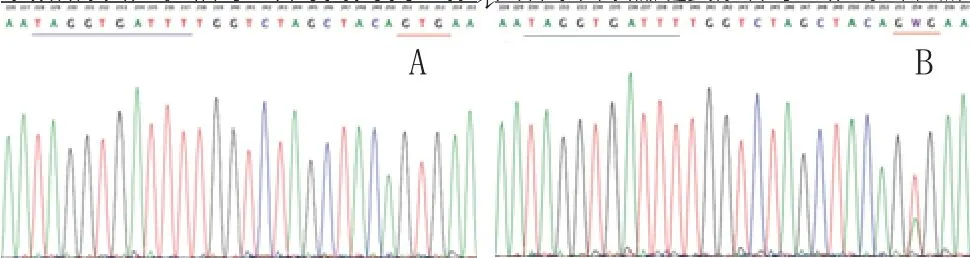
图2 BRAF基因突变检测结果
2.2 BRAF V600E基因突变与临床表型的关系:由表1可知,非色素痣来源黑色素瘤突变率为45.2%;先天性小痣来源黑色素瘤突变率为11.1%;后天痣来源黑色素瘤突变率为15.4%,组间比较差异有统计学意义(χ2=6.972,P<0.05)。非色素痣来源黑色素瘤男性、女性突变率分别为28.6%、18.5%,色素痣来源黑色素瘤男性、女性突变率分别为41.7%、30.0%,组间比较差异无统计学意义(χ2=2.358,P>0.05)。非色素痣来源不同发病部位,肢端、非肢端及黏膜部位,突变率分别为27.3%、29.2%、40.0%,色素痣来源突变率分别为33.3%、28.6%、33.3%,组间比较差异无统计学意义(χ2=0.449,P>0.05)。
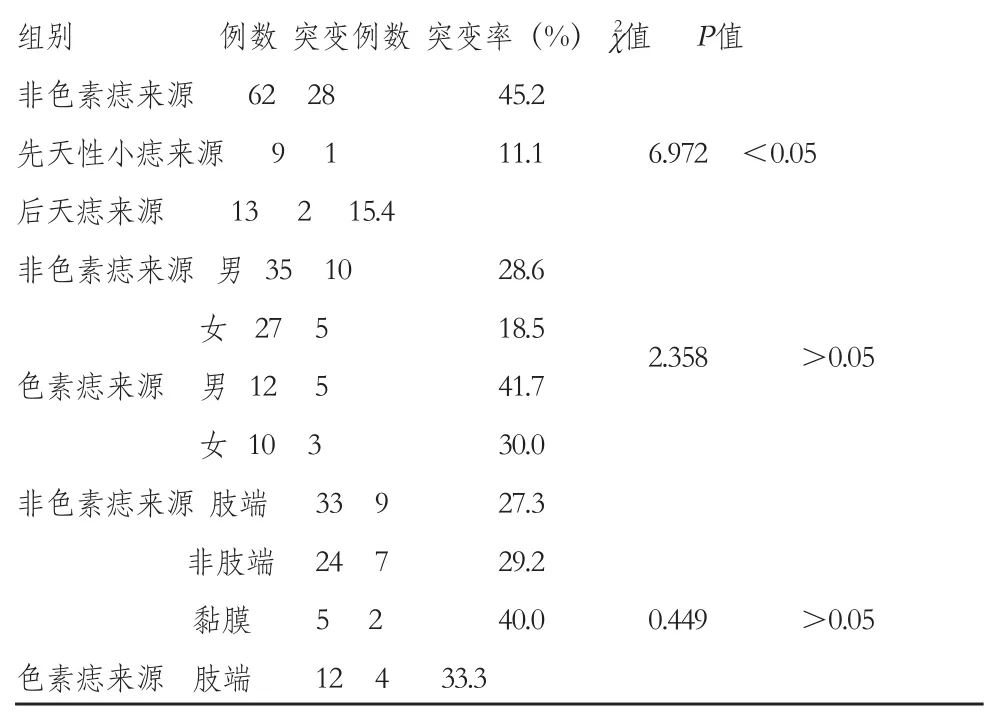
表1 BRAF V600E基因突变率与临床表型关系 (例)

3 讨论
BRAF基因是位于染色体7q34的一种原癌基因。编码一种丝/苏氨酸特异性激酶,在丝裂原活化蛋白激酶(Mitogenactivated Protein Kinase,MAPK)途径中起着关键作用,通过参与活化细胞表面黑素皮质激素受体,从而参与黑素细胞的增殖分化过程。许多恶性肿瘤中均存在不同比例的BRAF基因突变,黑色素瘤中已知的V600突变有V600E,V600K,V600R,其中V600E位点突变较多[3]。据报道,BRAF基因突变在30%~60%的黑色素瘤中及50%的交界痣中可被观察到[4],与国外报道相比,我国黑色素瘤BRAF基因突变率偏低,约为24.3%[5]。中国黑色素瘤的发病和遗传学特点跟欧美完全不同,欧美黑色素瘤多发生于面部和体表皮肤,诱因主要是阳光暴晒,紫外线接触过多[6-7],而亚洲的黑色素瘤多发生于不接触阳光的部位,发病与基因突变关系更加密切[5]。
BRAF基因突变导致恶性黑色素瘤发生机制尚不清楚,研究发现,突变BRAF基因产物的过表达可增加下游ERK(细胞外调节蛋白激酶,Extracellular Regulated Protein Kinases,ERK)的活性,减少T细胞识别的黑素瘤抗原(Melan-A/MART-1)、糖蛋白100(gp100)等的表达,造成免疫治疗障碍。另有文献报道[8-10],MAPK通路联同STAT3(信号传导与转录激活因子通路,Signal Transducer and Activator of Transcription,STAT)可以使黑色素瘤细胞产生多种免疫抑制因子,从而导致免疫逃逸。
在黑色素瘤药物治疗方面,大剂量α-2b干扰素作为黑色素瘤辅助治疗用药已经近半个世纪[11],分子靶向治疗近年来发展迅速,BRAF抑制剂(如vemurafenib维罗非尼、dabrafenib达拉非尼)首先取得突破,随后BRAF抑制剂联合MEK(丝裂原活化的细胞外信号调节激酶,Mitogen-activated Extracellular Signal-regulated Kinase,MEK) 抑制剂、PD-1单抗(程序性细胞死亡蛋白-1,Programmed Death-1,PD-1)使得有效率再次提高[12-14]。最近,除BRAF抑制剂外,免疫靶向治疗[15-16]、溶瘤病毒瘤体内注射等[17],也成为治疗黑色素瘤的新方向。
色素痣在黑色素瘤的发生中占有重要地位,色素痣恶变为黑色素瘤的百分比各家报道差异甚大,可能与病史回顾不清或如何正确判断是否源于色素痣有关。有资料显示,先天性巨痣的恶变率约6%,由于先天性巨痣发生率低,在黑色素瘤中所占比例不大,本研究也无此类病例。
有文章报道BRAF基因突变率与发病部位有相关性,本次研究中将色素痣来源或非色素痣来源的黑色素瘤根据不同来源及发病部位分成了6组,BRAF基因突变率为27.3%~40.0%,但经统计学处理后,差异无统计学意义。而非色素痣来源、先天性小痣来源、后天痣来源的黑色素瘤中BRAF基因突变率分别为45.2%、11.1%、15.4%,组间比较差异有统计学意义,且非色素痣来源黑色素瘤BRAF基因突变率近50%,说明BRAF基因突变在非色素痣来源黑色素瘤中多见,应引起重视。但本次研究中样本量较少,仍需进一步充实样本量,以明确不同来源黑色素瘤BRAF基因突变率是否存在差异。
[1]Tas F,Erturk K.Anemia in Cutaneous Malignant Melanoma:Low Blood Hemoglobin Level is Associated with Nodal Involvement, Metastatic Disease, and Worse Survival[J]. Nutr Cancer,2017,21:1-5.
[2]王炜.整形外科学[M].杭州:浙江科学技术出版社,2008:474-77.
[3]Helen Davies,Graham R,Bignell,et al.Mutations of the BRAF gene in human cancer[J].Nature,2002,417(6892):949-954.
[4]Moran B,Silva R,Perry AS,et al.Epigenetics of malignant melanoma[J].Semin Cancer Biol,2017.
[5]Wu X,Yan J,Dai J,et al.Mutations in BRAF codons 594 and 596 predict good prognosis in melanoma[J].Oncol Lett,2017,14(3):3601-3605.
[6]Fajuyigbe D,Young AR.The impact of skin colour on human photobiological responses[J].Pigment Cell Melanoma Res,2016,29(6):607-618.
[7]Slominski AT,Brożyna AA,Zmijewski MA,et al.Vitamin D signaling and melanoma: role of vitamin D and its receptors in melanoma progression and management[J].Lab Invest,2017,97(6):706-724.
[8]Yinghui Li,Hui Shan Cheng,Wee Joo Chng,et al.Activation of mutant TERT promoter by RAS-ERK signaling is a key step in malignant progression of BRAF-mutant human melanomas[J].Proc Natl Acad Sci U S A,2016,113(50):14402-14407.
[9]Tomei S,Bedognetti D,De Giorgi V,et al.The immune-related role of BRAF in melanoma[J].Mol Oncol,2015,9(1):93-104.
[10]Fischer GM,Vashisht Gopal YN,McQuade JL,et al.Metabolic strategies of melanoma cells: Mechanisms, interactions with the tumor microenvironment, and therapeutic implications[J].Pigment Cell Melanoma Res,2018,31(1):11-30.
[11]Di Franco S,Turdo A,Todaro M,et al.Role of Type I and II Interferons in Colorectal Cancer and Melanoma[J].Front Immunol,2017,8:878.
[12]Ribas A,Gonzalez R,Pavlick A,et al.Combination of vemurafenib and cobimetinib in patients with advanced BRAF-mutated melanoma: a phase 1b study[J].Lancet Oncol,2014,15(9):954-965.
[13]Merope Griffi n,Daniele Scotto,Debra H.Josephs,et al.BRAF inhibitors:resistance and the promise of combination treatments for melanoma[J].Oncotarget,2017,8(44):78174-78192.
[14]Hao C,Tian J,Liu H,et al.Efficacy and safety of anti-PD-1 and anti-PD-1 combined with anti-CTLA-4 immunotherapy to advanced melanoma: A systematic review and meta-analysis of randomized controlled trials[J].Medicine,2017,96(26):e7325.
[15]Valpione S,Campana LG.Immunotherapy for advanced melanoma:future directions[J].Immunotherapy,2016,8(2):199-209.
[16]Hassan Sadozai,Thomas Gruber,Robert Emil Hunger,et al.Recent Successes and Future Directions in Immunotherapy of Cutaneous Melanoma[J].Front Immunol,2017,8:1617.
[17]Tiantian Zhang,Yogesh R Suryawanshi,Helene M Woyczesczyk,et al.Targeting Melanoma with Cancer-Killing Viruses[J].Open Virol J,2017,11:28-47.
