潘糖标准品的制备与应用可行性评价
2018-02-28董自星李普均刘晓光路福平王正祥
李 玮,董自星,李普均,金 鹏,刘晓光,路福平,王正祥
(1. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2. 天津科技大学化工与材料学院,天津 300457)
功能性低聚糖是一类由 2~10个单糖通过α–1,6糖苷键结合成的直链或支链的低聚合度糖类[1],主要包括低聚异麦芽糖、低聚果糖、低聚木糖、低聚半乳糖、大豆低聚糖、异麦芽酮糖和低聚龙胆糖等[2].其中低聚异麦芽糖(isomaltooligosaccharides,IMO)主要存在于大米、酱油、日本清酒以及蜂蜜中[3],它是一种良好的益生元,并可选择性地刺激肠道益生菌的生长与繁殖,不会打破肠道菌群平衡,有利于宿主机体健康[4].
近年来,随着对低聚异麦芽糖研究的不断深入,无论在科研还是食品工业与医药等领域,都需要利用其中起到主要生理活性的关键组分(潘糖)的标准品,才能对其进行精确分析与研究.目前,对于功能性低聚糖中的关键组分的制备方法有层析法、膜分离法等.尽管层析法的分离效果好,但是需要使用有机溶剂,生产成本高,缺乏市场竞争力[5].而膜分离法的收率较高,但只可对底物进行逐级分离,无法对特定的单组分进行选择性地分离,且步骤较为繁琐[6].
二级标准物质为特性量值通过与一级标准物质直接比对或用其他准确可靠的分析方法测试而获得,准确度和均匀性能满足一般测量的需要,稳定性在半年以上的标准物质[7–8].由于潘糖的标准品在国内市面不易购买,且从国外订购的价格昂贵,在很大程度上限制了低聚异麦芽糖的相关研究与应用.本实验以低聚异麦芽糖粗糖液为研究对象,通过高效液相色谱法对功能性关键组分(潘糖)进行分离与纯化,最终制得高品质的潘糖标准品,为低聚异麦芽糖的相关研究与应用提供了基础材料.
1 材料与方法
1.1 实验材料
1.1.1 样品
低聚异麦芽糖粗糖液由实验室前期制备获得,其中潘糖含量为47.6,g/L.
1.1.2 试剂与仪器
葡萄糖、麦芽糖和异麦芽糖标准品,北京索莱宝科技有限公司;麦芽三糖、潘糖和异麦芽三糖等标准品,美国 Supelco公司;乙腈,色谱纯,Fisher Scientific公司;其他试剂均为国产分析纯.
1260,series型蒸发光液相色谱仪、1200,series型示差液相色谱仪,美国 Agilent精密仪器有限公司;PrevailTMCaborhydrate ES 5u分析柱(250,mm×4.6,mm),美国GRACE精密仪器有限公司.
1.2 低聚异麦芽糖组分的定性分析
1.2.1 样品处理
称取 25,g低聚异麦芽糖粗糖液,加水稀释并定容至 250,mL,配制成 100,mg/mL低聚异麦芽糖溶液作为母液,稀释50倍后得到2,mg/mL溶液,待用.
1.2.2 低聚异麦芽糖混合标准品的配制
准确称取葡萄糖、麦芽糖、异麦芽糖、麦芽三糖、潘糖和异麦芽三糖各 4,mg置于 4,mL梯形容量瓶中,并分别加水定容,配制成 1,mg/mL的 6种母液.再分别从每种母液中吸取 150,µL至 1.5,mL EP管中,混匀,制成总质量浓度为1,mg/mL的低聚异麦芽糖混合标准品待用.
1.2.3 低聚异麦芽糖样品中组分的分析
采用高效液相色谱–蒸发光散射检测法对低聚异麦芽糖样品中的组分进行定性分析,以确定各组分的出峰时间及出峰顺序.色谱条件:流动相为体积分数70%,乙腈水溶液,流量1,mL/min,柱温30,℃,蒸发光液相检测器温度 90,℃,气体流量 2.2,L/min,使用GRACE Prevail ES 5u分析柱(250,mm×4.6,mm)进行分析,进样量为10,µL(自动进样).
1.3 潘糖的分离纯化
1.3.1 分离样品浓度的确定
将 1.2.1节中的 100,mg/mL样品溶液分别稀释至 30、50、80,mg/mL,采用可回收废液的高效液相色谱–示差折光检测法对样品中的关键组分潘糖进行分离纯化,通过峰形判断出达到最佳分离效果的样品浓度.色谱条件:流动相为体积分数 70%,乙腈水溶液,流量 1,mL/min,柱温 30,℃,检测器温度 35,℃,使用GRACE Prevail ES 5u分析柱(250,mm×4.6,mm)进行分析与分离,进样量为100,µL(自动进样).
1.3.2 潘糖的制备
在上述研究基础上,根据潘糖在高效液相色谱–示差折光检测法中的峰形及出峰时间,在保证所得潘糖的纯度最高的条件下,对潘糖进行收集,并通过高效液相色谱-蒸发光散射检测法对所得的每个潘糖流分进行分析鉴定,按照式(1)计算潘糖流分的纯度,按照式(2)和式(3)计算其平均纯度以及最终得率.

式中:E为潘糖得率,%,;m为收集的所有流分冻干后的平均干质量,mg;P为 5次实验的潘糖平均纯度,%,;ρ为IMO粗糖液质量浓度,mg/mL;V为进样量,mL;N为进样次数.
1.4 精密度实验[9]
从所收集的混合潘糖流分中取 5份样品,每份1,mL.在相同条件下,按照 1.2.3节的方法采用蒸发光散射检测器对样品进行检测,并计算潘糖峰面积比的相对标准偏差(relative standard deviation,RSD).
1.5 重复性实验
从所收集的潘糖流分中取 1,mL,并制成液相样品.采用 1.2.3节中高效液相色谱-蒸发光散射检测法对潘糖流分连续进样5次,并在同样条件下进行检测,根据峰面积的比例计算其RSD值.
1.6 回收率实验
将潘糖流分每连续收集 50,mL 记为 1组,共收集 5组,每组各取样 0.75,mL,然后将其分别与 5份0.25,mL、1,mg/mL的葡萄糖标准品溶液混合,使葡萄糖标准品在混合溶液中的终质量浓度为 0.25,mg/mL.采用高效液相色谱–蒸发光散射检测法对该样品进行分析,并通过葡萄糖与潘糖在液相图谱中峰面积的关系以及已知的葡萄糖浓度,计算其中潘糖含量的理论值(mg).将其余潘糖流分中的乙腈挥干后冻干,称取所得潘糖的干质量(mg),并计算回收率、平均回收率及其RSD值.

1.7 稳定性检验
随机抽取 60个样本(每个样本为 0.25,mg潘糖固体粉末)于 2~8,℃放置 12个月,每月抽取 5个样品,每个样本检测 2次,与初始数据进行比较,评价其在冷藏(2~8,℃)保存条件下的稳定性.对数据进行统计学分析,以P<0.05为有统计学意义.
2 结果与讨论
2.1 蒸发光散射检测法定性分析样品中的组分
采用蒸发光散射检测法对 2,mg/mL的低聚异麦芽糖溶液中的组分进行分析,结果如图1所示.
由于色谱柱为正相柱,低聚异麦芽糖产品中各组分按标准品图谱中的出峰时间从左至右依次为麦芽糖、异麦芽糖、麦芽三糖、潘糖和异麦芽三糖,标准品和样品中的潘糖出峰时间分别为 15.958,min和16.092,min,这为后续通过示差折光检测法对潘糖组分进行分离纯化提供了依据.

图1 蒸发光散射检测法分析2,mg/mL低聚异麦芽糖产品组分的液相图谱Fig. 1 The liquid chromatogram of 2,mg/mL IMO analyzed by HPLC-ELSD
2.2 关键组分潘糖的分离
根据高效液相色谱–蒸发光散射检测法中潘糖的出峰顺序和出峰时间,采用高效液相色谱-示差折光检测法分别对 3种不同浓度的低聚异麦芽糖产品中的潘糖进行分离纯化,以确定最佳分离浓度,其结果如图2所示.

图2 样品浓度对低聚异麦芽糖中潘糖的分离效果的影响Fig. 2 Effects of concentration on the separation of panose from IMO samples
由潘糖与麦芽三糖、异麦芽三糖之间的分离度可 知,当样品质量浓度为 80,mg/mL时,潘糖与麦芽三糖和异麦芽三糖的分离效果最差.样品质量浓度为30,mg/mL时,潘糖的分离效果较好.而当 IMO溶液的质量浓度为 50,mg/mL时,潘糖与麦芽三糖和异麦芽三糖的分离效果最好(图 2(b)).此外,在该浓度下,通过示差折光检测法对潘糖进行分离纯化时,潘糖的出峰时间为14.564,min.
在保证得率最大的前提下,从潘糖出峰开始对潘糖组分进行收集直到出峰结束,通过蒸发光散射检测法对其鉴定,结果如图 3(a)所示.根据峰面积的比例可知,潘糖的纯度为 69.36%,,得率为 34.68%,.应继续进行潘糖收集方法的优化.
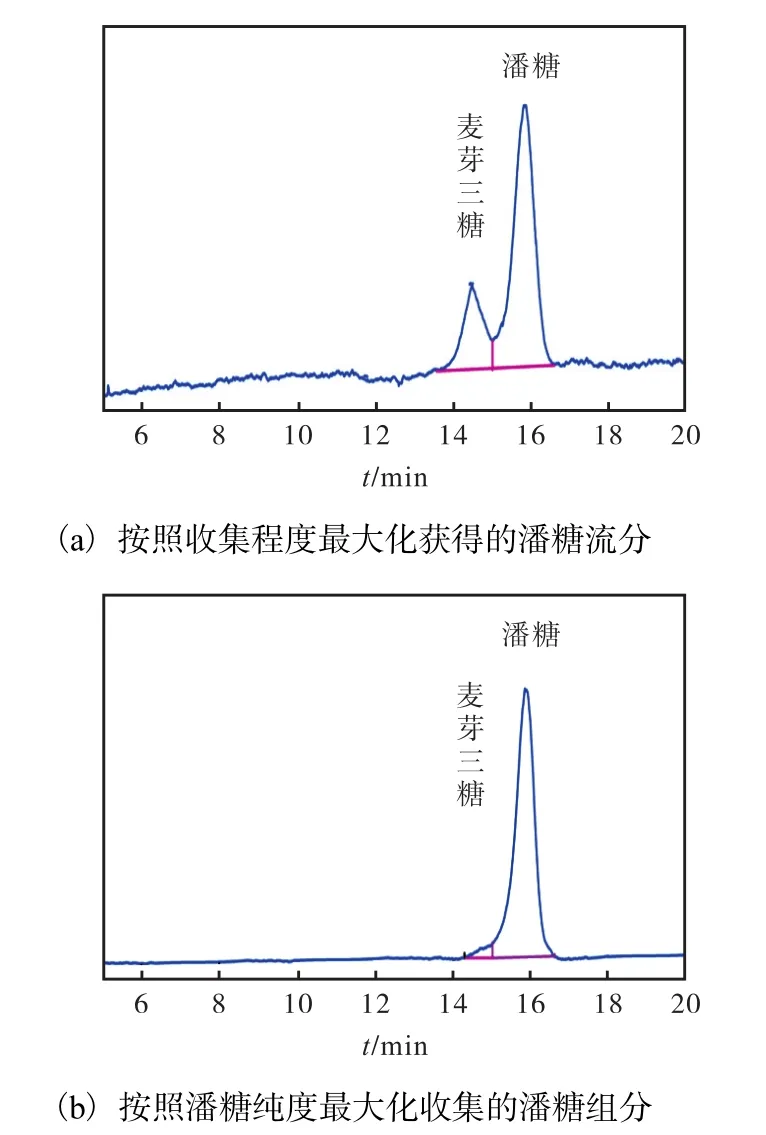
图3 蒸发光散射检测法分析纯化得到的潘糖流分Fig. 3 Analysis of the purified panose using HPLC-RID
由于样品随流动相经过检测器对于流分收集会有时间上的延迟,所以按全峰所收集的流分中潘糖纯度较低,增加了分离纯化的难度,故将收集的时间缩短,增加收集次数(共收集 8次).为了保证所收集的潘糖的纯度最大,从峰顶收集至峰尾,并将所得潘糖流分经过蒸发光散射检测法进行鉴定,确定其纯度,结果如图3(b)所示.所收集的潘糖流分中,除大部分为潘糖外,还有少部分麦芽三糖杂质.根据峰面积的比例关系可知潘糖的纯度为98.43%,得率为49.22%.且潘糖的出峰时间为16.053,min,与图1(a)中潘糖标准品的出峰时间(15.958,min)的差值的比值为0.6%,,小于 5%,,可以确定此收集方法所得的流分为潘糖.经过多次实验,所分离得到的潘糖纯品的纯度为(98.43±0.25)%,,略高于阿拉丁试剂和梯希爱(上海)化成工业发展有限公司等销售的潘糖(CAS号:33401-87-5)的纯度(98%).
2.3 精密度实验
为了验证所得潘糖流分纯度的稳定性,在相同条件下,采用蒸发光散射检测法对5份潘糖样品进行检测.5份样品的峰面积及其百分比见表 1.通过计算可知,其RSD为 0.25%,,符合 2015年版中华人民共和国药典(精密度实验中 RSD 应小于 3.0%,)的相关规定[10],精密度较好.
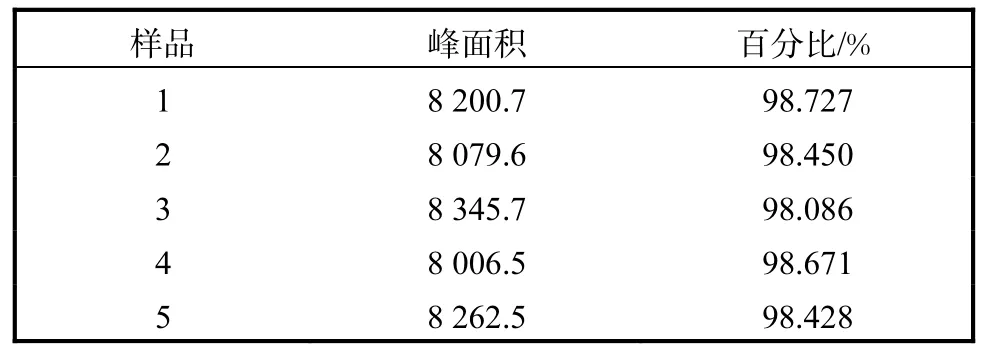
表1 精密度实验的结果Tab. 1 Results of precision experiment
2.4 重复性实验
重复性实验的结果见表 2,计算获得 RSD为0.27%,符合 2015年版中华人民共和国药典(HPLC系统适用性要求中连续进样5次峰面积 RSD应小于2.0%)的规定[10],重复性较好.

表2 重复性实验的结果Tab. 2 Results of repetitive experiment
2.5 回收率实验
对所制备5组潘糖流分的回收率进行测定,结果见表3.最终算得潘糖的平均回收率为(96.20±0.73)%,RSD为0.73%,,符合2015年版中华人民共和国药典中关于回收率的RSD应小于1%,的要求[10].

表3 回收率实验的结果Tab. 3 Results of recovery ratio experiment
2.6 稳定性检验结果
在2~8,℃保存12个月的不同时间点,每次抽取5个潘糖样本,每个样本检测 2次,评价其稳定性.稳定性检验的结果表明,潘糖在 2~8,℃可稳定至少12个月(图 4,P>0.05).

图4 潘糖的稳定性检验Fig. 4 Evaluation of the stability of panose
随着人们对功能性低聚糖的开发与应用有了更深层次、更高精确度的需求,功能性低聚糖中关键组分的分离与纯化,无疑是低聚糖检测最关键的部分[11].本文通过示差折光检测法对低聚异麦芽糖中的关键组分潘糖进行了分离纯化,实现了潘糖标准品的制备.与于德水等[12]使用的结晶法相比,本方法具有周期短、简便易行、精确性好、灵敏度高以及样品耗费低等优点.并且所得关键组分的纯品亦可有针对性地运用到食品和保健品行业[13].此外,潘糖单组分的纯度与均匀性可满足一般测量的需要,这符合我国标准物质管理委员会关于二级标准物质的规定[7].
3 结 论
本文通过蒸发光散射检测法对低聚异麦芽糖样品中的组分进行了初步的定性分析,接着利用示差折光检测法对潘糖进行了分离纯化,实现了低聚异麦芽糖中潘糖组分标准品的制备.所分离得到的潘糖纯品的纯度为(98.43±0.25)%,;精密度实验和重复性实验中的 RSD 分别为 0.25%,和 0.27%,;平均回收率为(96.20±0.73)%,;并且在 2~8,℃可稳定保存至少 12个月,符合 2015年版中华人民共和国药典以及国家标准物质管理委员会关于二级标准物质的规定.因此,本研究中所制得的潘糖组分可作为二级标准品使用,也为低聚异麦芽糖的进一步开发和功能性探索奠定了基础.
[1] Yen C H,Tseng Y H,Kuo Y W,et al. Long-term supplementation of isomalto-oligosaccharides improved colonic microflora profile,bowel function,and blood cholesterol levels in constipated elderly people:A placebo-controlled,diet-controlled trial[J]. Nutrition,2011,27(4):445–450.
[2] Ojha S,Mishra S,Chand S. Production of isomaltooligosaccharides by cell bound α-glucosidase of Microbacterium sp.[J]. LWT-Food Science and Technology,2015,60(1):486–494.
[3] Bharti S K,Krishnan S,Kumar A,et al. Mechanismbased antidiabetic activity of fructo-and isomaltooligosaccharides:Validation by in vivo,in silico and in vitro interaction potential[J]. Process Biochemistry,2015,50(2):317–327.
[4] Kaulpiboon J,Rudeekul-thamrong P,Watanasatitarpa S,et al. Synthesis of long-chain isomaltooligosaccharides from tapioca starch and an in vitro investigation of their prebiotic properties[J]. Journal of Molecular Catalysis B:Enzymatic,2015,120:127–135.
[5] 李秀琴,杨星惠,安素欣. 低聚果糖的纯化方法[J]. 河北化工,2003(1):4–7.
[6] 武金良. 高纯低聚果糖分离纯化技术的研究[D]. 南宁:广西大学,2008.
[7] 全国标准物质管理委员会. 标准物质定值原则和统计学原理[M]. 北京:中国质检出版社,2011:70–83.
[8] 蒋玲丽,王华梁,王雪亮,等. HCV 核糖核酸国家二级标准物质的研制[J]. 临床检验杂志,2016,34(1):60–63.
[9] 刘若瑜. 大豆糖蜜中功能性成分的分离与制备[D]. 郑州:河南工业大学,2012.
[10] 国家药典委员会. 中华人民共和国药典[M]. 北京:化学工业出版社,2015.
[11] 龚芳红,张德纯. 功能性低聚糖及其检测方法的研究现状[J]. 中国微生态学杂志,2009,21(2):177–180.
[12] 于德水,臧海波,张介弛,等. 利用肠膜明串珠菌诱变株生产潘糖的研究[J]. 生物技术,2000,10(4):27–31.
[13] 赵晋,王娇,阚健全. 低聚异麦芽糖生理功能及应用的研究进展[J]. 食品研究与开发,2007(2):166–170.
