紫红红球菌9α–羟化酶loop对酶活性的影响
2018-02-28申雁冰王九彬
刘 扬,申雁冰,王九彬,王 敏
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
雄甾–4–烯–3,17–二酮(androst-4-ene-3,17-dione,AD)是合成甾体激素类药物的关键中间体,它的 9α羟基化产物9α–羟基雄甾–4–烯–3,17–二酮(9α-hydroxyandrost-4-ene-3,17-dione,9α-OH-AD)是生产9α位上有卤素的多种皮质激素的重要前体[1]. 能够进行 9α–羟化的微生物有很多,目前应用较多的菌种是红球菌(Rhodococcus sp.)和分枝杆菌(Mycobacterium sp.).3–甾 酮 –9α–羟 化 酶 (3-ketosteroid-9α-hydroxylase,KSHAB)负责将 AD 转化生成 9α-OHAD,由末端加氧酶(KSHA)与铁硫还原酶(KSHB)双组分构成.
羟化酶的加氧酶组分 KSHA在底物进出酶活性中心出口处,存在一个 loop,像一个“开关”,将底物阻挡在活性中心通道外[2].在本课题组前期对分枝杆菌转化植物甾醇生成AD的研究中发现,分枝杆菌(Mycobacterium neoaurum)TCCC11028的 3–甾酮–Δ1–脱氢酶靠近底物活性中心处的 loop上的 Ser138突变成性质不同的氨基酸 Leu138后,显著影响了该酶对 AD的活性[3].已有文献证明柔性 loop的开关运动是调控酶催化作用的关键因素,比如磷酸丙糖异构酶与脂肪酶的晶体结构研究表明,柔性 loop 作为“开关”调节底物进入活性位点,进而影响酶对底物的活性[4–6].
尽管目前有2个KSHA的蛋白晶体结构得到解析,但是KSHA的loop与酶活性之间的关系尚不清楚.本研究以已知晶体结构的紫红红球菌(Rhodococcus rhodochrous)DSM43269的 KSHA5 loop为研究对象,应用定点突变技术探究loop对酶活性的影响,解析各氨基酸对 loop开关运动、调节底物通道的重要性,研究成果加深对 9α–羟化酶的认识有着重要意义,同时也为进一步研究其催化机理、改造酶蛋白活性提供理论依据.
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与培养基
2.3.3 5-HT 3RA的应用情况 本研究中患者应用的 5-HT3RA 包括 Tro、Pal和 Ond。“指南”推荐 Tro 只在第1天静脉应用或口服5mg。有59例(53.15%)连续多日应用Tro,疗程过长。应用Pal存在的主要问题与Tro一致,有11例(9.91%)应用Pal疗程过长。有4例将Pal与Tro重复应用,因药物与受体的结合存在饱和现象,重复用药并不能增强疗效,反而会增大不良反应的发生率,两药重复应用为不合理用药。Ond应用主要存在超致吐级别应用、给药剂量偏小和疗程不合理。Ond为短效的5-HT3RA,应用Ond的例数较Pal和Tro少。见表6。
用限制性内切酶 NcoⅠ和 HindⅢ酶切质粒,鉴定重组质粒的正确性,如图2所示.
质粒 pGEM-T Easy购自 Promega公司,质粒pET-28a(+)由本实验室保存.
LB 培养基(g/L):蛋白胨 10,酵母提取物 5,NaCl 10,pH 7.5.固体培养基在此基础上添加2%,的琼脂粉.
1.1.2 试剂
黑龙江省龙江电器集团有限公司成立于1996年,为中小型企业,现有职工370人。龙江电器集团有限公司自2002年起开始推行企务公开工作。近年来,该公司以落实“三个代表”重要思想,贯彻党的依靠方针为指导,着力在规范、巩固、深化、创新、实效上下功夫。随着企务公开的不断开展,企业民主管理渠道不断拓宽,广大职工建功立业、奉献企业的热情不断高涨,该公司保持长周期安全稳定可持续发展。该公司先后荣获国家“五一劳动奖章”、省“厂务公开民主管理先进单位”、省、市“文明单位”等多项荣誉。
限制性内切酶(NcoⅠ、HindⅢ和 DpnⅠ),NEB公司;蛋白质 Marker,北京全式金公司;TaKaRa LA TaqTMwith GC Buffer、DNA Marker,Takara 公司;KOD Plus,Toyobo公司;T4连接酶,Promega公司;质粒小提试剂盒、胶回收试剂盒、基因组提取试剂盒,Omega公司;其他药品和试剂均为分析纯.
1.2 KSHA氨基酸比对与蛋白结构
KSHAB以NADH为辅酶,将来自NADH的电子最终传递到 O2,使底物被羟化.可以通过检测340,nm下 NADH被氧化时吸光度的变化表征KSHA5及其各突变体的活性,摩尔吸光系数 ε采用6.22,mmol/(L·cm).酶活力单位定义为 1,min氧化1,nmol NADH所需要的酶量.KSH测定体系为含终浓度为 105,μmol/L的 NADH 和 250,μmol/L的底物AD(溶于 100%,异丙醇)的 200,μL 酶液.测定时,先向酶标板中加入198,μL蛋白酶液(质量浓度为 60,μg/mL)和 1,μL NADH 溶液(母液浓度为 21,mmol/L),最后加入 1,μL 的底物(母液浓度为 50,mmol/L),启动反应,在酶标仪上(33,℃)实时监测反应.
KSHA5无底物的3D结构(4QDF)与有底物AD的 3D结构(4QDC)从 Protein Data Bank数据库下载,用Discovery Studio 2.5软件分析有无底物存在时KSHA5的结构.
1.3 表达载体的构建
根据 KSHAB的末端加氧酶 kshA5与铁硫还原酶 kshB基因设计特异性引物,引入 NcoⅠ和 HindⅢ两个酶切位点,kshA5的上、下游引物分别为kshA5-TF1:5′-CCATGGTGTCCATCGACACCGCACGG-3′,kshA5-T-R1:5′-AAGCTT GGGGGTCGCGGTGGAGC C-3′;kshB 的上、下游引物分别为 kshB-T-F1:5′-CCATGGTGACAGCCGTCCAGGCACC-3′,kshB-TR1:5′-AAGCTT GAACTCGATGCGCACGTGGT-3′(其中标注下划线的碱基为添加的酶切位点).
另外,通过不同类型的KSHA的比对,还发现在loop上存在两个非常保守的氨基酸,R217与 D219,用软件Discovery Studio 2.5分析了两者的相互作用,发现它们之间存在着盐桥相互作用,这可能起到固定loop位置的作用,使loop能更贴合到底物入口处.因此,将两者之一进行突变,把 R217变成 A217,使盐桥作用丧失,让loop比较松弛地靠近入口,使入口变大,考察其对活性的影响.
在4个组别温度升高的第1天、第3天和第10天,每个组别的每个重复中随机选择1只鸡,选择使用数字体温计测量肉鸡直肠温度。同时,在同一时间内,采集该重复的另1只鸡迅速使其安乐死,在3 min内取出下丘脑组织放入速冻管中-80 ℃保存,20 d内测定下丘脑中热休克蛋白70的浓度[2]。
1.4 loop上氨基酸的定点突变
以重组表达载体pET28-kshA5为模板,采用全质粒 PCR的方法进行突变子的构建,R217的上、下游突变引物分别为 TBR217A-F:5′-ACCGGTGCGGAGG ACGTCATCTCCG-3′,TBR217A-R:5′-GTCCTCCGCA CCGGTCGAGTGCAT-3′;T224的上、下游突变引物分别为 TBT224V-F:5′-TCCGGCGTGAACTACGACG ACCCCAAC-3′,TBT224V-R:5′-GTAGTTCACGCCGG AGATGACGTCC-3′;N225的上、下游突变引物分别为 TBN225L-F:5′-GGCACCCTGTACGACGACCCCA ACG-3′,TBN225L-R:5′-GTCGTACAGGGTGCCGGA GATGACG-3′;Y226的上、下游突变引物分别为TBY226F-F:5′-ACCAACTTTGACGACCCCAACGCC G-3′,TBY226F-R:5′-GTCGTCAAAGTTGGTGCCGGA GATGACG-3′;D227的上、下游突变引物分别为TBD227S-F:5′-AACTACAGCGACCCCAACGCCGAA C-3′,TBD227S-R:5′-GGGGTCGCTGTAGTTGGTGCC GGAGATG-3′;D228的上、下游突变引物分别为TBD228S-F:5′-TACGACAGCCCCAACGCCGAACTG C-3′,TBD228S-R:5′-GTTGGGGCTGTCGTAGTTGGT GCCGGAG-3′(其中斜体部分的碱基为突变位点).PCR 反应体系(50,μL):pET28-KSHA5 模板 1,μL,10×buffer for KOD plus 5,μL,dNTP mixture 6,μL,KOD plus 1,μL,25,mmol/L MgSO43,μL,10,μmol/L上、下游特异性引物各 2,μL,ddH2O 补齐至50,μL.反应条件:94,℃ 5,min;94,℃ 30,s,58,℃45,s,68,℃ 7,min,25 个循环;68,℃ 10,min.反应完毕后,直接向 PCR的反应体系中添加限制性内切酶DpnⅠ及其 buffer,37,℃消化模板 2,h,取 10,μL 消化液转化到 E.coli DH5α 感受态细胞中.挑取阳性克隆,测序正确后,转化E.coli BL21感受态细胞,得到各突变体的工程菌.
1.5 蛋白的诱导表达与纯化
挑取阳性克隆单菌落接种于 5,mL含 50,μg/mL卡那霉素的LB液体培养基中,37,℃、200,r/min过夜培养.取培养液按体积比 1∶50转接于 50,mL含50,μg/mL 卡纳霉素的 LB 液体培养基中,37,℃、200,r/min培养,表达 KSHA5(或其突变体)蛋白的菌液培养至 A600=0.4~0.6,表达 KSHB蛋白的菌液长至 A600=0.2,加入 IPTG 至终浓度 0.5,mmol/L,30,℃、200,r/min 继续培养 24,h.
分别收集含KSHA5(或其突变体蛋白)与 KSHB的重组大肠杆菌菌体,加入破碎缓冲液(50,mmol/L Tris-HCl(pH 7.4),500,mmol/L NaCl,20,mmol/L 咪唑,0.1,mmol/L EDTA)彻底洗去培养基,再用破碎缓冲液重浮菌体,使各突变体细胞浓度保持一致.按体积比 1∶2取 KSHA5(或突变体)细胞悬浮液与KSHB细胞悬浮液,充分混匀,超声破碎细胞17,min(功率 32%,,工作 5,s,间隔 5,s).蛋白纯化的过程参见文献[7].纯化出的蛋白不需要透析(因为透析也会使蛋白的活性受到损失),用 Bradford法定量总蛋白,并用软件 Quantity One分析确定 KSHA与KSHB含量的比值,通过添加纯 KSHB蛋白调整各突变蛋白与KSHB的含量比为4∶1.
1.6 蛋白活性测定
不同类型的KSHA蛋白的氨基酸序列用Clustal X比对.
2 结果与分析
2.1 蛋白分析与突变位点的选择
首先对 R.rhodochrous DSM43269的 5个不同类型KSHA的氨基酸进行了比对,结果如图1所示.

图1 KSHA5的氨基酸比对及结构Fig. 1 Alignment of amino acid of KSHA5 and its structure
从图 1(a)上可以看到,这 5种KSHA呈现高度相似,但loop区的氨基酸差别很大,α5螺旋、部分β折叠,以及二者之间的部分氨基酸也呈现很大差别,对照图1(b)和1(c)可以看到,α5螺旋和这部分β折叠的位置与 loop距离较近,这些位置的氨基酸都位于底物进出活性中心的通道处.每种 KSHA的 loop的氨基酸不同,对应的α5螺旋和这部分 β折叠的氨基酸就不同,推测它们之间可能存在协同变化的关系;而且,loop靠近底物入口处的氨基酸 T224–D228(图1(b)和1(c)中被椭圆形标中的loop区域),在有无底物AD时变动非常明显,那么它可能参与到底物的运送过程进而调控酶活,因此,本研究将对loop的这部分区域进行定点突变,分别突变成性质不同的氨基酸 T224V、N225L、Y226F、D227S与D228S,探究这些氨基酸的作用.
2.2 穿刺结果 所有病例中,28例经穿刺活检病理结合特殊染色直接确诊(见图2),但其中2例仅提示真菌感染,未明确特异病原体,其余26例明确了感染病原体,诊断敏感度、特异度分别为:93.3%、86.7%,诊断时限为送检后1h至1周。确诊的肺真菌病分别为:肺隐球菌病19例,肺曲霉菌病4例,肺接合菌病(倾向毛霉菌病)2例,肺马尔尼菲蓝状菌病1例。2例未确诊,1例提示肉芽肿性炎,经氟康唑治疗有效,临床诊断肺隐球菌病,另1例外科术后病理证实肺毛霉菌。
提取 R.rhodochrous DSM43269基因组作为扩增模板,扩增羟化酶 kshAB基因序列.PCR 反应体系(50,μL):基因组模板 1,μL,2×GC BufferⅠ25,μL,2.5,mmol/L dNTPs 8,μL,LA Taq DNA 聚合酶0.5,μL,10,μmol/L 上、下游特异性引物各 2,μL,ddH2O 补齐至 50,μL.反应条件:94,℃ 5,min;94,℃30,s,60,℃ 45,s,72,℃ 2,min,30 个循环;72,℃10,min.将PCR产物进行回收纯化,与pGEM-T Easy载体连接并送金唯智公司测序,测序正确后,经酶切、连接获得表达载体 pET28-kshA5与 pET28-kshB.胶回收纯化、酶切与连接等参照试剂说明书.
2.2 定点突变结果
紫红红球菌(Rhodococcus rhodochrous)DSM43269购自中国普通微生物菌种保藏管理中心;大肠杆菌(Escherichia coli)DH5α、BL21(DE3)均由本实验室保存.
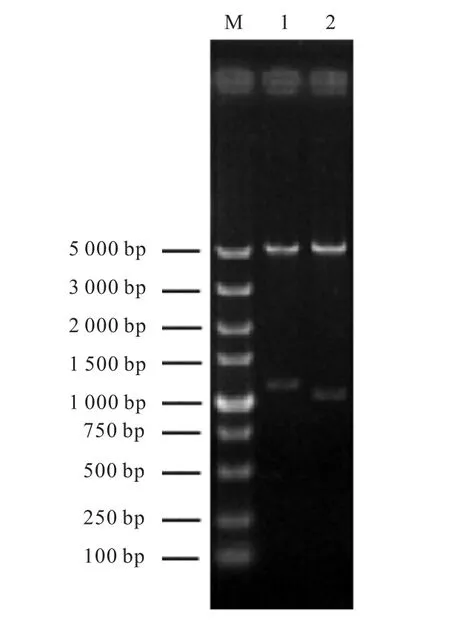
图2 重组质粒pET28-kshA5与pET28-kshB酶切电泳图Fig. 2 Agarose gel electrophoresis of pET28-kshA5 and pET28-kshB treated with restriction endonuclease
突变位点和突变策略确定后,选用全质粒 PCR的方法进行基因突变,均扩增出大约7,000,bp的条带(图3).经测序证明都突变成了相应的目的碱基.
两个泳道在1,000,bp以上位置出现的条带,分别与 kshA5和 kshB基因片段大小一致,证明重组质粒pET28-kshA5与pET28-kshB构建成功.
由于轨缝错台值主要通过第一个测点(间隙信号4)与其他3个测点比较计算得到,因此在悬浮架采集的4路间隙信号中取两端的间隙信号4进行分析。由图6的轨缝错台变化仿真图可知,间隙信号4基本反映了轨道错台情况,通过错台值能够准确表示高低突变。由于监测探头3、4之间有一定距离,因此错台值出现一段平台。
蚌埠市农田水利建设成效明显,为保障农业和农村经济发展发挥了重要基础作用。但农田水利建设基础仍然薄弱,建设滞后、标准偏低、管理粗放的问题不同程度存在,相对滞后的农田水利设施总体上依然是农村经济发展的制约因素,影响农业生产、农民切身利益、水资源节约和国家粮食安全。
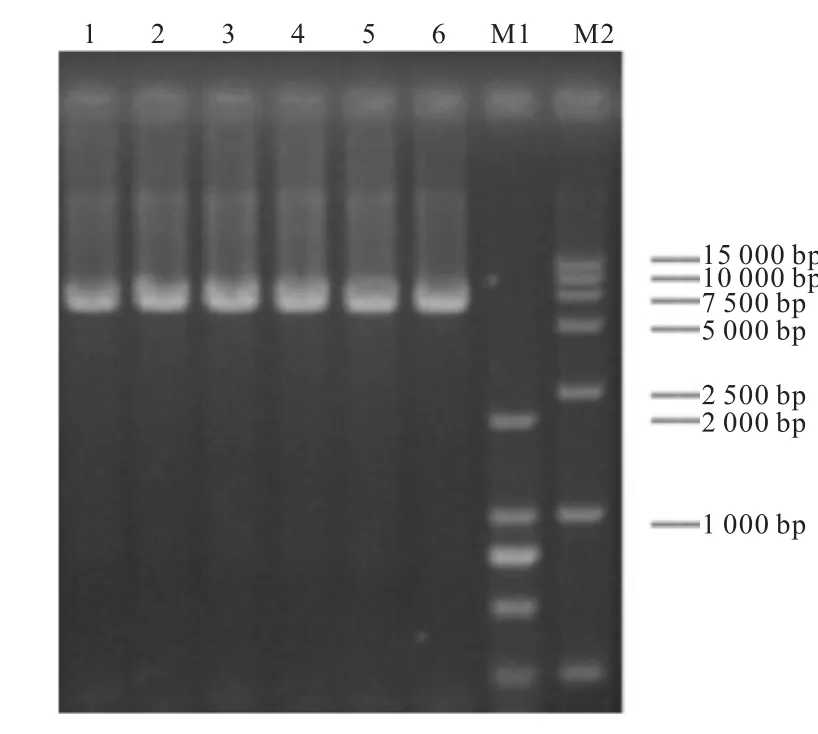
图3 loop的定点突变Fig. 3 Site-directed mutagenesis of the loop
2.3 酶活分析
由于KSHAB酶是由加氧酶成分KSHA与还原酶成分KSHB同时存在才能发挥羟化酶KSHAB的活性,而且已有报道证明加氧酶组分KSHA以O2为最终电子受体,在空气中纯化 KSHA组分,会使KSHA组分失去活性,还原酶组分 KSHB,除了作为KSHAB酶催化体系的关键组分,同时还可以为KSHA的纯化提供还原性的环境,避免在有氧情况下KSHA 酶活性的丢失[7–8].因此,本实验采用 A 组分与 B组分共纯化的方式进行蛋白纯化,蛋白纯化的结果如图4所示.
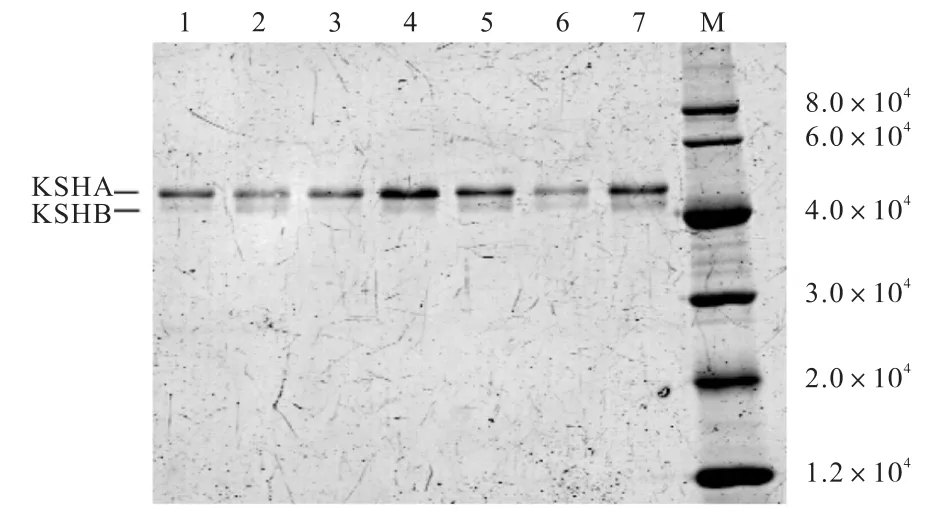
图4 蛋白纯化后的SDS-聚丙烯酰胺凝胶电泳图谱Fig. 4 SDS-polyacrylamide gel electrophoresis of the purified proteins
由图 4可知,所有蛋白均在相对分子质量 4×104以上位置处显示两条带,其大小与 KSHA、KSHB组分的大小一致,证明所有蛋白均纯化成功.用软件Quantity One分析所得各纯化蛋白的A组分与B组分含量的比例,使用Trace Tracking方法以及高斯建模模拟各条带的灰度值来确定A组分与B组分含量的比例.通过添加纯KSHB蛋白,使各纯化蛋白的A组分与 B组分含量的比例一致,测定酶活力的结果见表1.
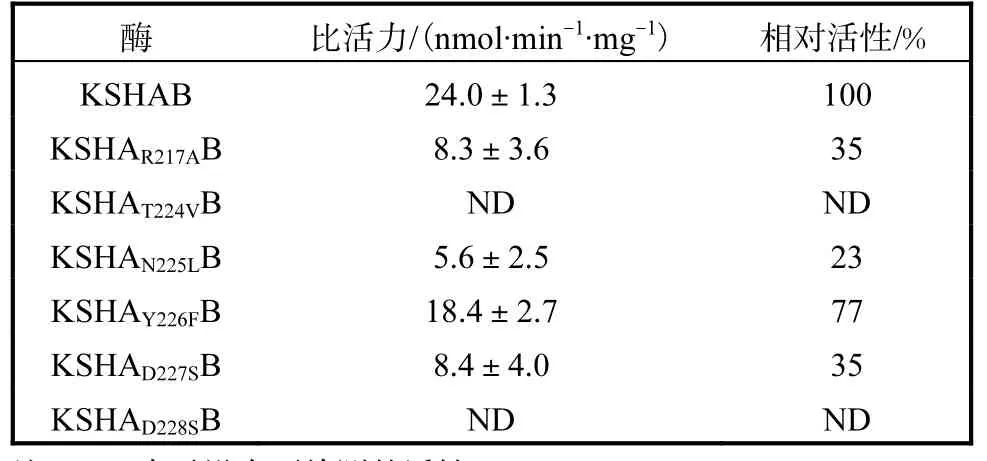
表1 突变体的活性分析Tab. 1 Assessment of the activity of different mutants
loop经突变后的酶的活性较突变前的都有所降低,还有一些突变甚至给酶造成了完全失活的结果.将第217位的 R 变成 A后,活性降低为原来的35%,,碱性氨基酸变化成非极性氨基酸,丧失原来与第219位D之间的盐桥作用,使loop更加松弛地靠在活性中心处,导致 loop上靠近底物入口处的氨基酸与α5螺旋、β折叠等附近区域的相互作用减弱,推送底物进入活性中心的能力下降,可见,KSHA蛋白中该位置上的R高度保守是非常重要的.
T224侧链带有一个羟基,具有形成氢键的能力,从图 5(a)与 5(b)上看,在结构位置上,它更靠近α5螺旋.在底物进入活性通道时,T224有可能与α5螺旋上某个氨基酸作用,能较好地打开底物通道,顺利让底物通过,而其突变成 V后,极性发生较大改变.V是非极性氨基酸,容易埋在疏水性活性中心,不利于 loop打开通道,这可能是突变后监测不到酶活的原因.同样,第 225位 N变为 L后,活性也大大下降,Y226F也有明显下降.突变前两者的氨基酸具有形成氢键的能力,在蛋白质结构中是位于内外部皆可的氨基酸,而突变后的非极性氨基酸更倾向于伸入疏水性活性中心,不利于打开loop这个“盖子”,这也是 loop区该处位置在有无底物存在时发生很大变动的原因.没有底物时,它们可以靠近活性中心,起到保护活性中心的作用;当有底物存在时,这些氨基酸又向外运动,打开活性中心,在与周围区域的相互作用力下,给底物营造合适的环境,推送底物进入活性中心.D227(图5(c)与5(d))和D228从结构上看,有无底物存在时,虽然它们的位置变动较大,但它们的侧链更多地暴露在外面.D227和 D228是酸性氨基酸,可电离产生盐桥,与溶液中离子相互作用,可能起到支撑固定loop结构的作用,让T224–Y226能与其周围的氨基酸产生相互作用,调节底物通道;而突变成丝氨酸后,灵活性增强,丝氨酸可转动到活性中心处,也可暴露在外,削弱了对loop的固定作用.
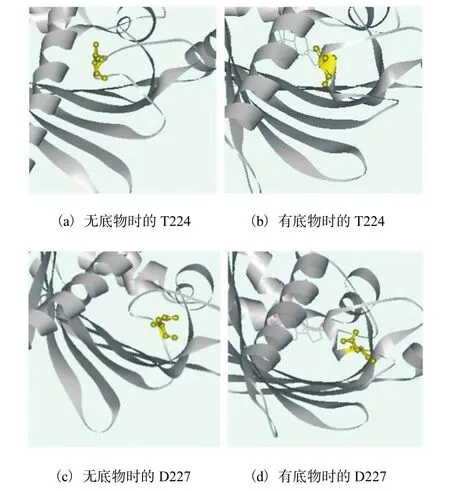
图5 loop上靠近底物进入酶活性中心入口处的氨基酸Fig. 5 Amino acids of the loop near the entrance of the substrate entering the enzyme active center
3 讨 论
本文运用定点突变技术,确定了KSHA5的loop对酶活的重要性;loop上的氨基酸对稳定 loop运动结构和调节底物通道都有着不同的作用,尤其是靠近底物入口处的氨基酸,如 T224、N225和 Y226,它们与周围α5螺旋和β折叠存在一定相互作用,共同调节底物通道与底物运送能力;D227和D228起到支撑固定loop结构的作用.磷酸丙糖异构酶的loop上的A176就与其附近的β折叠上的Y208能产生相互作用,调节 loop的开关运动[4].分枝杆菌(M.neoaurum)TCCC11028的3–甾酮–Δ1–脱氢酶靠近底物活性中心处的loop上的Ser138能形成氢键,在底物AD进入活性中心后,能用氢键固定住 loop,保持活性中心的疏水性;而突变成 Leu后,氢键作用丧失,从而导致活性中心暴露,最终影响了酶对底物的活性[3].
在信息时代的大环境下,仍有许多施工单位的建设项目在管理项目档案时,采用传统的管理办法,在档案资料的收集和整理过程中,单纯依靠人工操作来进行管理,不仅加大了管理人员的工作量,工作效率也受到很大的影响。
由于近年投入不足和管理缺位,面广量大的田间沟渠被填埋、损毁严重,农田灌溉“最后一公里”的问题非常突出,直接影响着河道治理工程的效益。要抓住全市10个县(市、区)列入中央财政小农水重点县的机遇,以县为单位,以耕地灌区化为目标,将所有耕地以灌区为单元进行规划设计、投资建设、运行管理,使之形成由可靠水源和引、输、配水渠道及相应排水沟道组成的灌溉系统,形成田成方、林成网、渠相通、路相连、旱能浇、涝能排的高标准农田建设格局。
loop在蛋白质结构中的运动较为灵活,底物进出活性中心时 loop旋转摆动的动态过程,以及在这个运动过程中 loop上各氨基酸对底物的某种相互作用,还有底物进入活性中心过程中loop与α5螺旋和部分β折叠的相互作用,在目前的晶体结构信息中是无法获知的,仅用无底物或者底物在活性中心时这两个时刻解析的晶体结构,不能准确判断氨基酸的具体作用.而本研究运用定点突变技术揭示了 loop上氨基酸的具体作用,这将使后面的研究工作更加具有针对性.那么,在下一步工作中,我们会把工作重点放到loop的T224、N225和Y226这3个氨基酸上,并结合其附近的α5螺旋与β折叠,进行组合突变,研究三者对底物通道的调控,进而能提高酶的羟化活性.本研究成果有助于理解 9α–羟化酶及其催化机理,也为采用蛋白质工程改造 9α–羟化酶活性提供理论依据.
[1] Angelova B,Mutafov S,Avramova T,et al. Effect of nitrogen source in cultivation medium on the 9αhydroxylation of pregnane steroids by resting Rhodococcus sp. cells[J]. Biotechnology & Biotechnology Equipment,2005,19(3):113–116.
[2] Penfield J S,Worrall L J,Strynadka N C,et al. Substrate specificities and conformational flexibility of 3-ketosteroid 9α-hydroxylases[J]. The Journal of Biological Chemistry,2014,289(37):25523–25536.
[3] Xie R,Shen Y,Qin N,et al. Genetic differences in ksdD influence on the ADD/AD ratio of Mycobacterium neoaurum[J]. Journal of Industrial Microbiology and Biotechnology,2015,42(4):507–513.
[4] Derreumaux P,Schlick T. The loop opening/closing motion of the enzyme triosephosphate isomerase[J]. Biophysical Journal,1998,74(1):72–81.
[5] Jennens M L,Lowe M E. A surface loop covering the active site of human pancreatic lipase influences interfacial activation and lipid binding[J]. The Journal of Biological Chemistry,1994,269(41):25470–25474.
[6] Dugi K A,Dichek H L,Santamarina-Fojo S. Human hepatic and lipoprotein lipase:The loop covering the catalytic site mediates lipase substrate specificity[J]. The Journal of Biological Chemistry,1995,270(43):25396–25401.
[7] 姚抗. 分枝杆菌甾醇代谢机制的解析以及其代谢工程改造应用于制备重要甾药中间体的研究[D]. 上海:华东理工大学,2014.
[8] Petrusma M,Dijkhuizen L,van der Geize R. Rhodococcus rhodochrous DSM43269 3-ketosteroid 9α-hydroxylase,a two-component iron-sulfur-containing monooxygenase with subtle steroid substrate specificity[J].Applied and Environmental Microbiology,2009,75(16):5300–5307.
