儿茶素、槲皮素和葡萄籽原花青素的协同抗辐射作用
2018-02-28吴涛,张倩,刘锐,张民
吴 涛,张 倩,刘 锐,张 民
(天津科技大学新农村发展研究院,食品生物技术教育部工程研究中心,天津科技大学食品工程与生物技术学院,天津 300457)
辐射是一种严重危害人体健康的有害因素,机体受到大剂量辐射会使体内新陈代谢紊乱,诱发各种病态和损伤,如神经衰弱综合症、造血机能受损、抗感染能力下降、心脏损伤、加速衰老、遗传损伤等,严重时还可能诱发癌变[1–2].因此,寻求天然有效的抗辐射防护剂对人体健康有重要意义[3].
近年来关于抗辐射防护剂的研究较多,已发现的天然抗辐射活性成分有多酚类[4–5]、多糖类[6–8]、黄酮类等[9–11],这些物质主要在抵抗射线对健康机体的损伤[12–14]、提高肿瘤细胞对辐射的敏感性[15–16]、修复受损细胞[12,17]、消除自由基等方面起作用[18].但是各种活性物质抗辐射作用的效果比较研究和协同效应研究还很少,有待进一步研究.儿茶素、槲皮素和原花青素隶属于多酚类化合物,均具有与氧自由基反应的作用,能够截断自由基的链式反应,从而具有良好的捕集自由基等抗辐射功效.基于上述原因,本文通过建立体外 AHH-1淋巴细胞辐射损伤模型,探究儿茶素、槲皮素、葡萄籽原花青素之间的协同抗辐射作用,为进一步研究开发抗辐射功能食品奠定基础.
1 材料与方法
1.1 原料、试剂与仪器
槲皮素(98%)、葡萄籽原花青素(95%),陕西浩洋生物科技有限公司;儿茶素(80%),江西绿康天然产物有限责任公司;二甲基亚砜(DMSO),Sigma公司;改良型RPMI-1640培养基,赛默飞世尔生物化学制品有限公司;胎牛血清,杭州四季青生物工程材料有限公司;噻唑蓝(MTT),北京索莱宝科技有限公司;其余试剂均为分析纯.
紫外可见分光光度计,上海菁华科技仪器有限公司;NIKON TS100型相差倒置光学显微镜,日本尼康公司;MCO-18ATC(UV)型二氧化碳培养箱,日本三洋公司;高通大容量台式离心机、全自动酶标分析仪,美国Thermo公司.
1.2 构建AHH-1淋巴细胞辐射损伤模型
在细胞培养瓶中加入 AHH-1淋巴细胞,细胞培养液的细胞浓度为 1×105,mL-1,培养 2,h后,将细胞经137Cs-γ射线一次辐射,辐射剂量分别为0、1、2、4、6、8,Gy.并设正常对照组,辐射结束后,于 CO2培养箱中培养 24,h后,加入 5,mg/mL的 MTT溶液20,µL,继续培养 4,h 后,1,000,r/min 离心 5,min,吸去上清液,加入 150,µL的 DMSO,振荡溶解,待紫色颗粒完全溶解后,用酶标仪检测 490,nm下的吸光度(A),按照式(1)计算细胞存活率.

1.3 儿茶素、槲皮素和原花青素对 γ射线辐射的细胞存活率的影响
将正常培养的细胞分为 3组:正常对照组,采用含 10%,胎牛血清的培养基培养细胞;辐射组,正常培养细胞用 γ射线辐射但不加药物;药物+辐射组,在γ射线辐射前加入不同质量浓度酚类物质孵育 2,h.然后经γ射线一次辐射,辐射结束后置于CO2培养箱中培养 24,h后,1,000,r/min离心 5,min,去掉加药的培养液,用PBS清洗1次,加入5,mg/mL的MTT溶液 20,µL,继续培养 4,h后,1,000,r/min离心 5,min,吸去上清液,加入 150,µL的 DMSO,振荡溶解,待紫色颗粒完全溶解后,用酶标仪检测 490,nm 下吸光度,按照式(1)计算细胞存活率及存活率提高值.
1.4 儿茶素、槲皮素和原花青素之间的作用
对于儿茶素、槲皮素和原花青素,若两种物质联合作用的存活率提高值大于单独作用的相加值,则判定两种物质具有协同作用;若两种物质联合作用的存活率提高值小于单独作用的相加值,则判定两种物质具有拮抗作用;若两种物质联合作用的存活率提高值等于单独作用的相加值,则判定两种物质具有相加作用.
1.4.1 槲皮素与儿茶素之间的作用
槲皮素的质量浓度分别为 5、10、15、20,µg/mL,儿茶素的质量浓度为 10,µg/mL,进行复合,然后进行γ射线的辐射,经 MTT测定,计算存活率,研究是否有协同作用.
1.4.2 原花青素与儿茶素之间的作用
设定原花青素的质量浓度分别为 10、15、20、25、30,µg/mL,儿茶素的质量浓度为 10,µg/mL,进行复合,然后进行γ射线的辐射,经MTT测定,计算存活率,研究是否有协同作用.
1.4.3 原花青素与槲皮素之间的作用
设原花青素的质量浓度分别为 15、20、25,µg/mL,槲皮素的质量浓度分别为 5、10、15,µg/mL,分别进行复合,然后进行 γ射线的辐射,经MTT测定,计算存活率,研究是否有协同作用.
1.5 统计分析
平行实验6次,利用SPSS,19.0对实验数据进行统计学分析.A表示与正常组比较差异显著(P<0.05),a表示与正常组比较差异极显著(P<0.01),b表示与辐射组比较差异极显著(P<0.01).
2 结果与讨论
2.1 γ射线辐射剂量的确定
不同剂量的 γ射线对细胞存活率的影响如图 1所示.随着 γ射线辐射剂量的增加,细胞的存活率下降,当辐射剂量为 6,Gy时,细胞的存活率降到 45%.辐射剂量为 8,Gy时,对细胞的损伤过大,因此选取6,Gy为后续实验的辐射剂量.
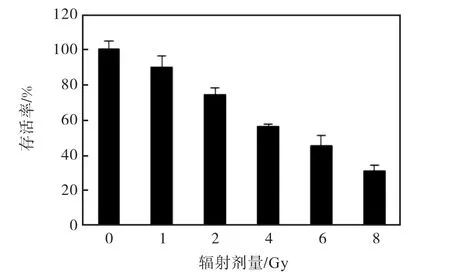
图1 不同剂量的γ射线对细胞存活率的影响Fig. 1 Effect of different gamma-ray irradiation dose on cell survival rate
2.2 原花青素、槲皮素和儿茶素对 γ射线辐射的细胞存活率的影响
原花青素对γ射线辐射的细胞存活率的影响如图2所示.与正常组比较,辐射组的细胞存活率有极显著性差异(P<0.01),原花青素各个剂量组,与辐射组比较均有极显著差异(P<0.01).其中,在200,µg/mL剂量时,与正常组比较,存活率无显著性差异,说明此剂量的原花青素使细胞的存活率达到了正常水平.

图2 原花青素对γ射线辐射的细胞存活率的影响Fig. 2 Effect of procyanidins on cell survival rate after gamma-ray irradiation
槲皮素对γ射线辐射的细胞存活率的影响如图3所示.
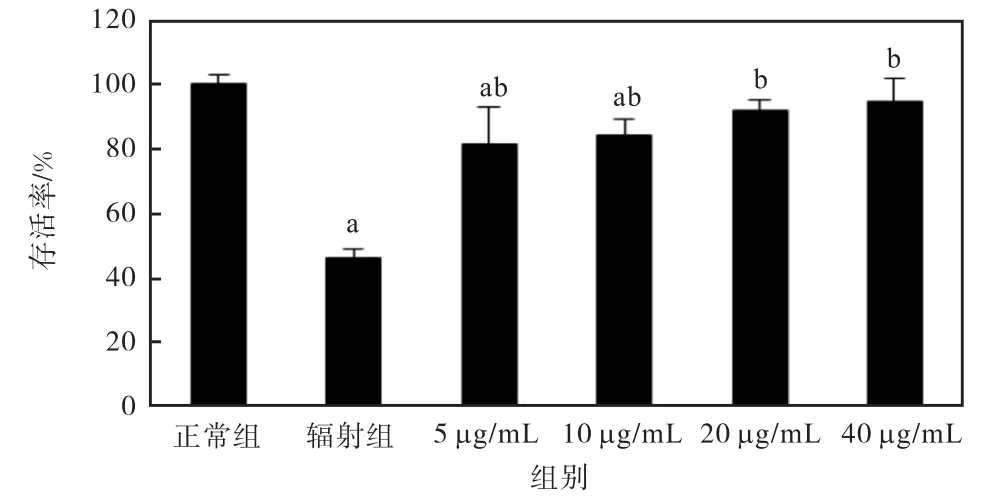
图3 槲皮素对γ射线辐射的细胞存活率的影响Fig. 3 Effect of quercetin on cell survival rate after gamma-ray irradiation
槲皮素 5、10,µg/mL剂量组与正常组比较,细胞存活率有极显著性差异(P<0.01);槲皮素各个剂量组与辐射组比较,细胞存活率均有极显著升高(P<0.01).
儿茶素对γ射线辐射的细胞存活率的影响如图4所示.儿茶素各剂量组与正常组比较,细胞存活率有极显著性差异(P<0.01);儿茶素各剂量组与辐射组相比,细胞存活率显著升高(P<0.01).

图4 儿茶素对γ射线辐射的细胞存活率的影响Fig. 4 Effect of catechin on cell survival rate after gamma-ray irradiation
2.3 槲皮素、儿茶素和原花青素之间的作用
2.3.1 槲皮素与儿茶素之间的作用
槲皮素与儿茶素联合作用的结果见表 1.由表 1可知,当儿茶素质量浓度为 10,µg/mL,槲皮素质量浓度为5,µg/mL时,两物质联合作用的存活率提高值大于两物质单独作用的相加值,说明两物质具有协同作用.随着槲皮素浓度的增加,两物质的作用类型由相加变为拮抗.
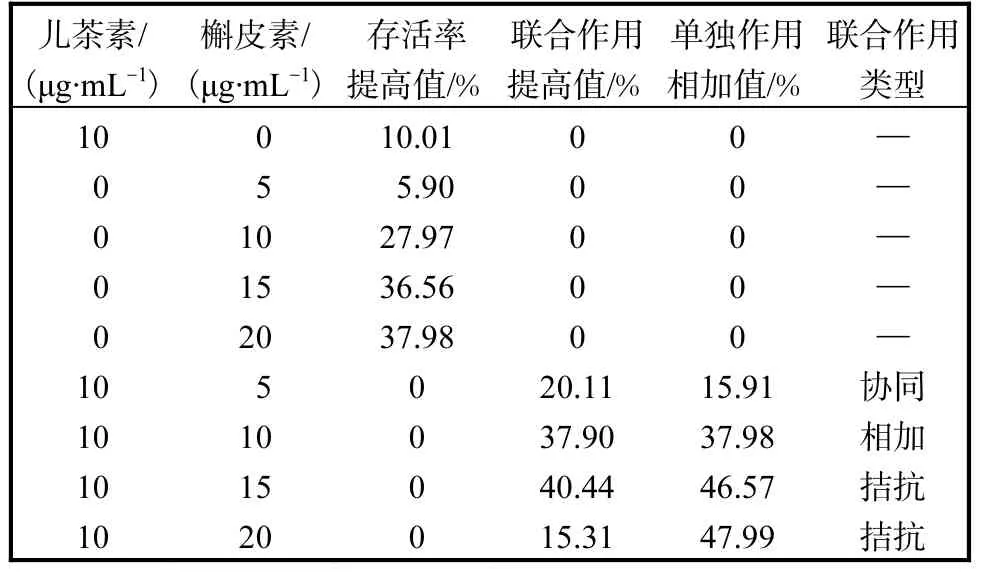
表1 槲皮素与儿茶素联合作用的结果Tab. 1 Joint effect of quercetin and catechin
2.3.2 原花青素与儿茶素之间的作用
原花青素与儿茶素联合作用的结果见表 2.当儿茶素质量浓度为 10,µg/mL时,原花青素质量浓度为15、25、30,µg/mL 时,两物质联合作用的存活率提高值大于两单独作用的相加值,具有协同作用;当原花青素质量浓度为10、20,µg/mL时,两物质联合作用的存活率低于两物质单独作用相加值,具有拮抗作用.
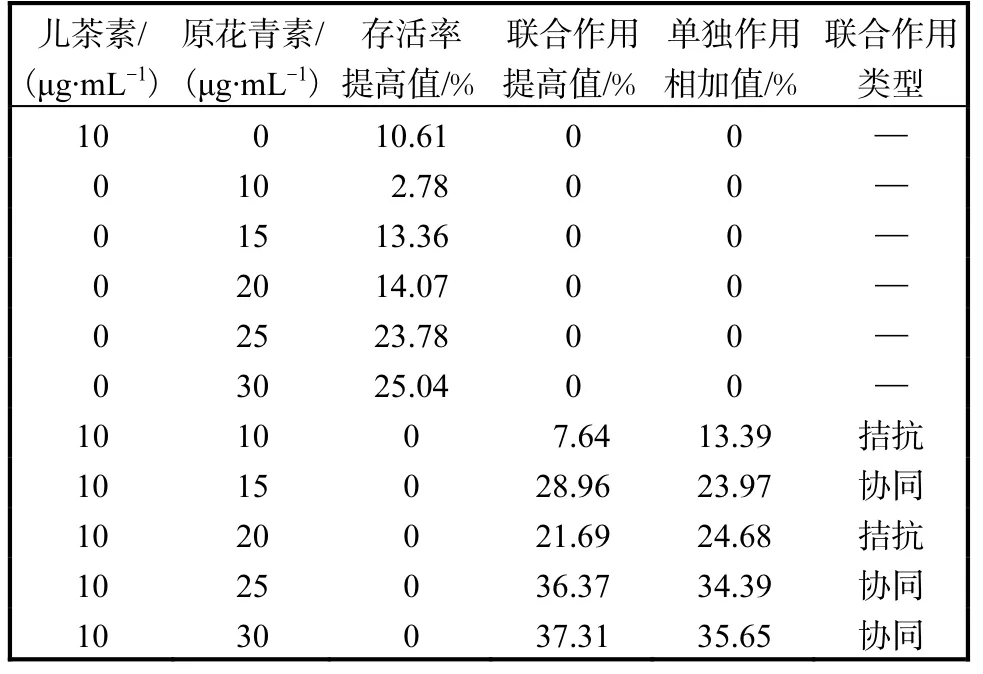
表2 原花青素与儿茶素联合作用的结果Tab. 2 Joint effect of procyanidins and catechin
2.3.3 原花青素与槲皮素之间的作用
原花青素与槲皮素联合作用的结果见表 3.在槲皮素质量浓度为 5,µg/mL和原花青素质量浓度为25,µg/mL时,槲皮素质量浓度为 10,µg/mL和原花青素质量浓度为 20、25,µg/mL时,两物质联合作用的存活率提高值皆大于两物质单独作用的相加值,具有协同作用.

表3 原花青素与槲皮素联合作用的结果Tab. 3 Joint effect of procyanidins and quercetin
2.4 讨论
酚类物质的多元酚羟基均具有与氧自由基反应的作用,截断自由基的链式反应,从而具有良好的捕集自由基等抗辐射功效.孙维琦等[9]研究表明,大豆异黄酮能提高受辐射小鼠的抗氧化能力,在一定程度上减缓由辐射引起的外周血白细胞和骨髓有核细胞数的下降,减少微核的产生,对 γ射线损伤具有良好的防护作用.大豆异黄酮抗辐射损伤的机理主要是抗氧化作用、抑制膜的脂质过氧化、抑制细胞凋亡的发生、调节细胞基因表达这几个方面[19].李德远等[20]研究证明银杏叶黄酮能显著提高辐射小鼠的存活率和平均存活时间,低剂量银杏叶黄酮具有较强的抗辐射作用,其作用机理与提高小鼠免疫力有关. Benkovic等[11]研究抗辐射损伤作用时发现,槲皮素及蜂胶提取物对辐射小鼠白细胞具有激活效应且对其DNA的损伤具有保护作用.Srinivasan等[21]在研究中发现,姜黄素对辐射所致小鼠肝细胞 DNA的损害具有防护作用.吴健全等[10]报道染料木黄酮可以延长受照射小鼠存活时间,提高 30,d活存率,升高血小板、淋巴细胞和脾结节数,降低骨髓嗜多染红细胞微核率,对小鼠有辐射防护作用.因此儿茶素、槲皮素和原花青素可能通过提高受辐照细胞的抗氧化能力、减少DNA的损伤达到协同抗辐射作用.
3 结 语
通过建立体外 AHH-1淋巴细胞辐射损伤模型,研究儿茶素、槲皮素和原花青素之间的协同抗辐射作用.结果表明:当儿茶素质量浓度为 10,µg/mL和槲皮素质量浓度为 5,µg/mL时,儿茶素质量浓度为10,µg/mL 和原花青素质量浓度为 15、25、30,µg/mL时,槲皮素质量浓度为5,µg/mL和原花青素质量浓度为25,µg/mL时,槲皮素质量浓度为10,µg/mL和原花青素质量浓度为 20、25,µg/mL时,两物质间皆具有协同抗辐射作用.当儿茶素质量浓度为 10,µg/mL时,槲皮素质量浓度为 15、20,µg/mL以及原花青素质量浓度为 10、20,µg/mL时,儿茶素分别与槲皮素、原花青素存在拮抗作用.当槲皮素质量浓度为5,µg/mL 和原花青素质量浓度为 20,µg/mL 时,当槲皮素质量浓度为 10,µg/mL和原花青素质量浓度为15,µg/mL时,当槲皮素质量浓度为 15,µg/mL和原花青素质量浓度为 15、20、25,µg/mL时,原花青素与槲皮素皆存在拮抗作用.因此,在适量浓度范围内儿茶素、槲皮素和原花青素之间具有协同或拮抗抗辐射作用,这一研究发现对开发抗辐射功能食品具有指导意义.
[1] Simmons J H W. Radiation Damage in Graphite[M]Oxford:Pergamon Press,1965:243.
[2] 高月,马增春. 辐射损伤防治药物发展历史与展望[J].辐射防护通讯,2009,29(5):30-35.
[3] Wang Q,Han T,Sun L,et al. Progress on anti-radiation natural medicines[J]. Journal of Pharmaceutical Practice,2012,5:171-177.
[4] Bao L,Zhang Z,Dai X,et al. Effects of grape seed proanthocyanidin extract on renal injury in type 2 diabetic rats[J]. Molecular Medicine Reports,2015,11(1):645-652.
[5] Duan Y,Chen F,Yao X,et al. Protective effect of Lycium ruthenicum Murr. against radiation injury in mice[J]. International Journal of Environmental Research &Public Health,2015,12(7):8332-8347.
[6] Jiang S,Shen X,Liu Y,et al. Radioprotective effects of Sipunculus nudus L. polysaccharide combined with WR-2721,rhIL-11 and rhG-CSF on radiation-injured mice[J]. Journal of Radiation Research,2015,56(3):515-522.
[7] Luo Q,Li J,Cui X,et al. The effect of Lycium barbarum polysaccharides on the male rats’ reproductive system and spermatogenic cell apoptosis exposed to low-dose ionizing irradiation[J]. Journal of Ethnopharmacology,2014,154(1):249-258.
[8] 王楠,张民,李茜,等. 裸燕麦多糖酶解产物 OP-1 纯化组分结构分析[J]. 天津科技大学学报,2016,31(1):8-12.
[9] 孙维琦,郭英,张义全,等. 大豆异黄酮与大豆皂甙抗辐射作用的实验研究[J]. 中国辐射卫生,2007,16(3):273-274.
[10] 吴健全,金宏,许志勤,等. 染料木黄酮抗辐射作用的实验研究[J]. 中国辐射卫生,2004,13(3):170-172.
[11] Benkovic V,Knezevic A H,Dikic D,et al. Radioprotective effects of propolis and quercetin in γ-irradiated mice evaluated by the alkaline comet assay[J].Phytomedicine International Journal of Phytotherapy &Phytopharmacology,2008,15(10):851-858.
[12] Oyagbemi A A,Omobowale T O,Akinrinde A S,et al.Lack of reversal of oxidative damage in renal tissues of lead acetate-treated rats[J]. Environmental Toxicology,2015,30(11):1235-1243.
[13] Ma B,Zhu L,Zang X,et al. Coptis chinensis inflorescence and its main alkaloids protect against ultraviolet-B-induced oxidative damage[J]. Journal of Functional Foods,2013,5(4):1665-1672.
[14] Rodríguez-Pérez C,Quirantes-Piné R,Contreras M M,et al. Assessment of the stability of proanthocyanidins and other phenolic compounds in cranberry syrup after gamma-irradiation treatment and during storage[J]. Food Chemistry,2015,174:392-399.
[15] Wang L,Li X,Wang Z. Whole body radioprotective effect of phenolic extracts from the fruits of Malus baccata(Linn.)Borkh[J]. Food & Function,2016,7(2):975-981.
[16] 张英,吴聪俊. 生物黄酮作为天然辐射防护剂的研究进展[J]. 天然产物研究与开发,2015,27(3):552-557.
[17] 王丽,王振宇,张浩,等. 天然化合物的电离辐射防护作用研究[J]. 食品工业科技,2012,33(16):372-376.
[18] Zhao L,Wang Y,Wang Y,et al. Advances in research on radioprotective effects of natural active components[J]. Pharmaceutical Care and Research,2012,12(2):86-89.
[19] Dixit A K,Bhatnagar D,Kumar V,et al. Antioxidant potential and radioprotective effect of soy isoflavone against gamma irradiation induced oxidative stress[J].Journal of Functional Foods,2012,4(1):197-206.
[20] 李德远,周韫珍,余应利,等. 银杏叶黄酮抗辐射效应研究[J]. 营养学报,2004,26(3):220-222.
[21] Srinivasan M,Prasad N R,Menon V P. Protective effect of curcumin on γ-radiation induced DNA damage and lipid peroxidation in cultured human lymphocytes[J].Mutation Research,2006,611(1/2):96-103.
