响应面法优化金蝉花多糖提取工艺及抗氧化活性分析
2018-02-09宋佳敏王鸿飞王凯凯邵兴锋李和生
宋佳敏,王鸿飞*,孙 朦,王凯凯,许 凤,邵兴锋,李和生
(宁波大学食品科学与工程系,浙江 宁波 315211)
金蝉花(Cordyceps cicadae)亦称蝉花、蝉蛹草、蝉茸草,为麦角菌科真菌蝉草及其寄主山蝉的幼体干燥体,属虫草类药食两用真菌,主要分布于浙江、安徽、四川、福建等地。据报道,金蝉花作为优质虫草,其活性成分与冬虫夏草相似[1],有望成为冬虫夏草的替代品,近年来受到许多学者的关注。金蝉花主要活性成分为多糖、核苷、甘露醇、麦角甾醇等[2-3],其中多糖为其主要有效成分。
多糖类化合物广泛存在于动植物细胞膜和细胞壁中,主要由醛基和酮基通过苷键连接的高分子聚合物,被称为构成生命的四大基本物质[4]。研究发现,金蝉花多糖具有抗肿瘤[5]、降血糖[6]、免疫调节[7-9]和抗惊厥[10]等重要作用。采用水提法探索金蝉花多糖较适宜的提取工艺条件,并研究金蝉花多糖的抗氧化活性,为金蝉花多糖的开发及综合利用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
金蝉花产自浙江绍兴。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)、浓硫酸(均为分析纯) 和光纯药工业株式会社;羟甲基氨基甲烷(Tris) 台湾生工有限公司;茯苓多糖口服液(国药准字B20050015) 湖南补天药业有限公司;蒽酮、葡聚糖、无水乙醇、磷酸二氢钠、磷酸氢二钠、三氯乙酸、三氯化铁、铁氢化钾、硫酸亚铁、水杨酸、邻苯三酚(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Cary 50 Scan紫外分光光度计 美国瓦里安技术(中国)有限公司;WK-200B高速药物粉碎机 山东青州市精诚机械有限公司;H1650型高速台式离心机长沙湘仪离心机设备有限公司;SHZ-D(Ⅲ)型循环水真空泵 巩义市英峪予华仪器厂;FD-ID-80冷冻干燥机北京博医康实验仪器有限公司;UH-S2超声波仪 天津奥特赛恩斯仪器有限公司。
1.3 方法
1.3.1 金蝉花多糖的提取
参考杨娜等[11]方法:金蝉花→烘干→粉碎过筛(40目)→加水搅匀→超声波辅助处理→热水浸提→过滤→浓缩→Sevag法去蛋白[12]→醇沉→冷冻干燥→金蝉花粗多糖。
1.3.2 金蝉花多糖含量测定
参考张惟杰等[13]硫酸-蒽酮法,以葡聚糖为标准品,绘制标准曲线,并测定样品多糖含量。
1.3.2.1 标准曲线的绘制
配制质量浓度为10、20、30、40、50 μg/mL的葡萄糖溶液,分别取1 mL于各试管中,加4 mL硫酸蒽酮溶液反应,迅速放入冰水中冷却,沸水浴10 min,取出放入自来水中冷却10 min,以蒸馏水代替葡萄糖溶液为空白对照,在620 nm波长处测定其吸光度。绘制标准曲线得回归方程y=0.007 9x+0.008 2,R2=0.998 3。
1.3.2.2 金蝉花多糖含量的测定
准确称取按1.3.1节方法得到的金蝉花粗多糖粉末,配得质量浓度为1 mg/mL的粗多糖溶液,取1.0 mL样品溶液加入4 mL硫酸蒽酮溶液,按1.3.2.1节方法测得吸光度,根据公式(1)计算金蝉花多糖含量:

式中:W为金蝉花多糖含量/(mg/g);C为样品溶液多糖质量浓度/(μg/mL);V为样品定容体积/mL;m为原料质量/g。
1.3.3 单因素试验
按照1.3.1节的方法分别考察超声功率(60、90、120、150、180、200 W)、超声时间(10、20、30、40、50、60 min)、浸提温度(50、60、70、80、90、100 ℃)、浸提时间(30、60、90、120、150、180 min)以及液料比(20∶1、30∶1、40∶1、50∶1、60∶1、70∶1(mL/g))5 个因素对金蝉花多糖提取的影响。
1.3.4 响应面试验
在单因素试验的基础上,确定超声波辅助处理的功率和时间,对其余3 个因素利用响应面分析法对提取工艺条件进行进一步的优化。根据Box-Behnken试验设计原理[14],选取浸提时间(A)、浸提温度(B)、液料比(C)3 个因素为自变量,以金蝉花多糖含量为响应值(Y),进行三因素三水平的响应面试验分析,得到金蝉花多糖提取的适宜工艺参数。试验因素与水平设计见表1。

表1 响应面分析因素与水平Table1 Coded levels and corresponding actual levels of independent variables used for Box-Behnken design
1.3.5 金蝉花多糖抗氧化活性实验
1.3.5.1 金蝉花多糖还原力的测定
样品还原能力的测定采用普鲁士蓝法[15],具体操作参照Pan Yingming等[16]方法:准确吸取1.0 mL不同质量浓度多糖溶液,分别加入2.5 mL磷酸盐缓冲溶液(pH 6.6,0.2 mol/L)和2.5 mL 1%铁氰化钾溶液,50 ℃反应20 min,随后加入2.5 mL 10%三氯乙酸溶液终止反应。3 000 r/min离心10 min,取上清液2.5 mL,加2.5 mL无水乙醇和0.5 mL 0.1% FeCl3溶液,混匀,于700 nm波长处测定吸光度,平行测定3 次,以VC和茯苓多糖作为对照。测得吸光度越大说明样品还原力越强。
1.3.5.2 金蝉花多糖清除DPPH自由基能力的测定[17]
分别在不同质量浓度的多糖溶液中加入2 mL DPPH-乙醇溶液(0.2 mmol/L),振荡混匀,避光静置30 min,于517 nm波长处测定吸光度Ai。同时,用无水乙醇代替DPPH-乙醇溶液,测得吸光度Aj,并测得2 mL DPPH-乙醇溶液和2 mL无水乙醇混合液的吸光度A0。以无水乙醇为参比,以VC和茯苓多糖作为对照,DPPH自由基清除率按公式(2)计算:
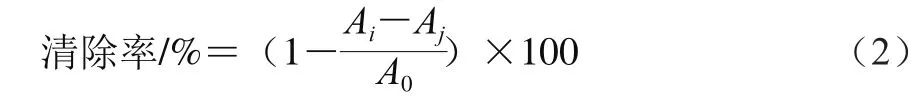
式中:A0为2 mL DPPH-乙醇溶液+2 mL无水乙醇吸光度;Ai为2 mL DPPH-乙醇溶液+2 mL样品溶液吸光度;Aj为2 mL无水乙醇+2 mL样品溶液吸光度。
1.3.5.3 金蝉花多糖清除·OH能力的测定
采用Fenton反应体系法[18-19]:分别往试管中加入不同浓度的多糖溶液1.0 mL,再分别加入1 mL 6 mmol/L的FeSO4溶液,1 mL 6 mmol/L的H2O2溶液和1 mL 6 mmol/L的水杨酸-乙醇溶液,37 ℃水浴1 h,在510 nm波长处测定其吸光度Ai。用蒸馏水代替样品溶液测得A0,用蒸馏水代替双氧水溶液测得吸光度Aj,按照公式(3)计算·OH清除率:

式中:A0为1 mL FeSO4溶液+1mL蒸馏水+1mL H2O2溶液+1mL水杨酸-乙醇溶液吸光度;Ai为1 mL FeSO4溶液+1 mL样品溶液+1 mL H2O2溶液+1 mL水杨酸-乙醇溶液吸光度;Aj为1 mL FeSO4溶液+1 mL样品溶液+1 mL蒸馏水+1 mL水杨酸-乙醇溶液吸光度。
参考朱月等[20-21]使用的邻苯三酚自氧化法:取4.5 mL的Tris-HCl缓冲溶液(pH 8.2,50 mmol/L)于试管中37 ℃水浴预热20 min,加入4 mL蒸馏水,37 ℃水浴20 min,取出加入0.5 mL 3 mmol/L的邻苯三酚溶液37 ℃水浴预热20 min,计时1 min后迅速摇匀倒入比色皿,以10 mmol/L的HCl溶液作为对照,利用US-Vis Analyst软件,设置波长为325 nm,测定时间间隔为30 s,测定其吸光度,以时间、吸光度为坐标作图,斜率即为邻苯三酚自氧化速率v0。用4 mL多糖溶液代替4 mL蒸馏水,按上述同样方法进行实验,以VC和茯苓多糖作对照,斜率为加有相应浓度样品溶液的邻苯三酚氧化速率v1,按公式(4)计算·清除率:
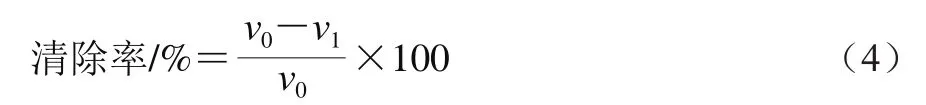
式中:v0为邻苯三酚自氧化速率;v1为加入样品溶液作为抑制剂后邻苯三酚氧化速率。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声时间对金蝉花多糖含量的影响
在液料比50∶1(mL/g)、超声功率150 W、浸提温度80 ℃、浸提时间90 min条件下,考察超声时间对金蝉花多糖提取的影响,如图1所示。

图1 超声时间对金蝉花多糖含量的影响Fig. 1 Effect of ultrasonic treatment time on polysaccharide yield
由图1可以看出,在超声时间小于20 min时,金蝉花多糖含量随着超声时间的延长而增加;在20 min时,多糖含量较高,此时多糖含量为26.77 mg/g。在超声时间大于20 min时,金蝉花多糖含量呈现下降,这可能是随着超声时间的延长,多糖降解所致[22]。
2.1.2 超声功率对金蝉花多糖含量的影响
在超声时间20 min、浸提温度80 ℃、浸提时间90 min、液料比50∶1(mL/g)条件下,考察超声功率对金蝉花多糖提取的影响。由图2可知,超声功率在60~120 W时,多糖含量随功率的增加而增加;当超过120 W时,多糖含量随着超声功率的增加而下降。当超声功率为120 W时,多糖含量较高,可达26.72 mg/g。

图2 超声功率对金蝉花多糖含量的影响Fig. 2 Effect of ultrasonic power on polysaccharide yield
2.1.3 浸提时间对金蝉花多糖含量的影响
在超声时间20 min、超声功率120 W、浸提温度80 ℃、液料比50∶1(mL/g)的条件下,考察浸提时间对金蝉花多糖提取的影响。由图3可知,当浸提时间达到120 min时,金蝉花多糖含量较高,为27.15 mg/g;随后随着时间延长多糖含量开始下降,这可能是多糖在水中浸提时间过长后结构遭到破坏导致的[23]。
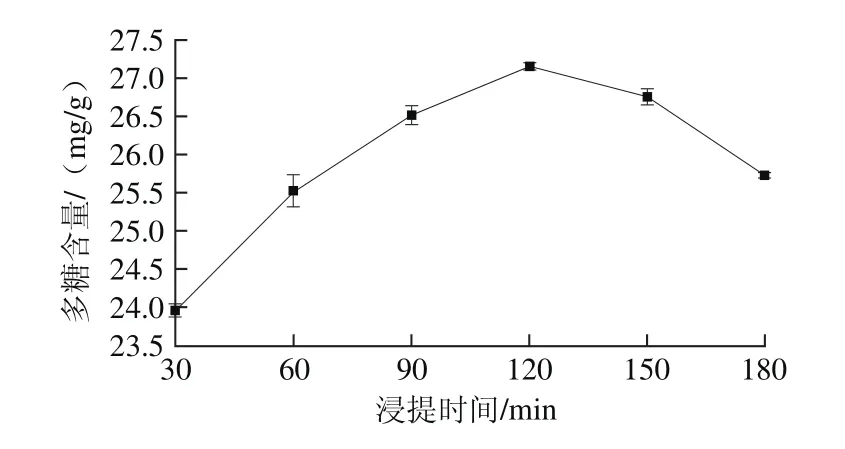
图3 浸提时间对金蝉花多糖含量的影响Fig. 3 Effect of extraction time on polysaccharide yield
2.1.4 浸提温度对金蝉花多糖含量的影响
在超声时间20 min、超声功率120 W、浸提时间120 min、液料比50∶1(mL/g)的条件下,考察浸提温度对金蝉花多糖含量的影响。从图4可看出,当浸提温度小于80 ℃,随着浸提温度升高,金蝉花多糖含量不断的增加;但当浸提温度大于80 ℃时,随着浸提温度的升高金蝉花多糖含量反而明显下降,这一现象可能是由于温度不断升高,从而使得多糖部分水解[24]。因此,金蝉花多糖提取温度可控制在80 ℃左右。
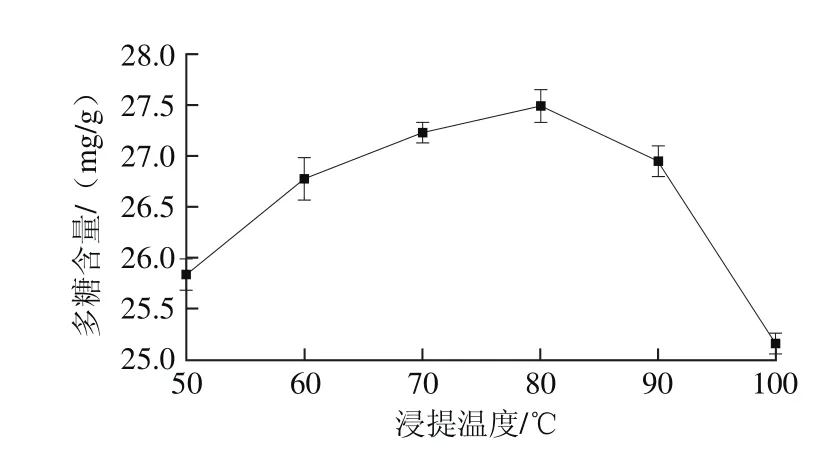
图4 浸提温度对金蝉花多糖含量的影响Fig. 4 Effect of extraction temperature on polysaccharide yield
2.1.5 液料比对金蝉花多糖含量的影响
当超声时间20 min、超声功率120 W、浸提温度80 ℃、浸提时间120 min条件下,考察液料比对金蝉花多糖提取的影响。由图5可知,液料比对金蝉花多糖浸提有一定的影响,金蝉花多糖含量随着液料比的增大呈现出先增加后降低的趋势。当液料比达到50∶1(mL/g)时,金蝉花多糖含量较高,达27.32 mg/g。
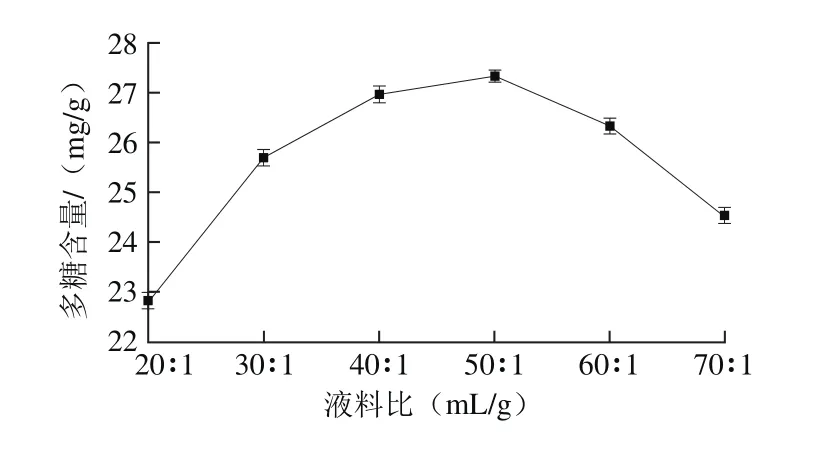
图5 液料比对金蝉花多糖含量的影响Fig. 5 Effect of solvent-to-solid ratio on polysaccharide yield
2.2 金蝉花多糖提取工艺条件的优化
2.2.1 模型方程建立与显著性检验
在单因素试验基础上,选用响应面分析法对金蝉花多糖的提取工艺条件进行优化。试验方案设计及结果见表2。

表2 响应面优化试验设计与结果Table2 Experimental design with experimental values of polysaccharide yield for response surface analysis
利用Design-Expert 8.0软件,建立浸提时间、浸提温度及液料比三因子数学回归模型为:Y=27.54-1.06A-0.072B-0.36C-0.24AB-0.19AC-0.035BC-1.12A2-0.45B2-1.0C2。

表3 回归模型的方差分析Table3 Analysis of variance of regression model
从表3可看出,一次项中,A(浸提时间)对多糖含量的线性效应极显著(P<0.001),C(液料比)对多糖含量的线性效应显著(P<0.05),B(浸提温度)对多糖含量的线性效应不显著(P>0.05),二次项中,A2、C2影响均极显著(P<0.001),B2影响显著(P<0.05),AB、AC、BC影响不显著(P>0.05)。此模型显著性检测P值为0.000 4,极显著,失拟项P值为0.055 3,不显著,校正模型的相关系数R2值为0.962 0,决定系数值为0.913 1,说明选用的模型与实际情况拟合较好、误差小,能较好反应出各因素与金蝉花多糖含量之间关系。由F值可知,在试验范围内各因素对多糖含量的影响大小依次为A(浸提时间)>C(液料比)>B(浸提温度)。
2.2.2 交互作用影响结果
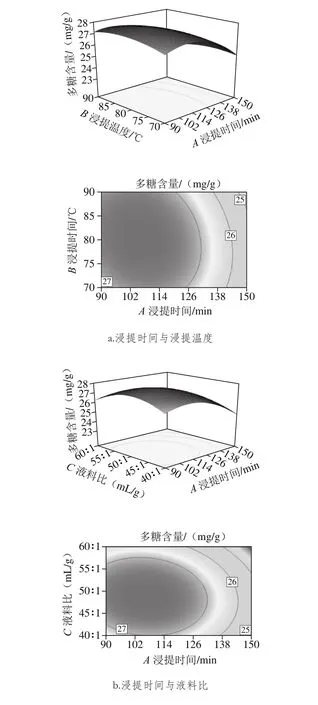
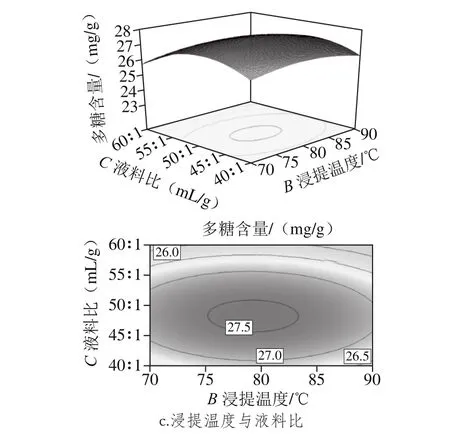
图6 各因素交互作用对多糖含量影响的响应面图Fig. 6 Response surface plots showing the interactive effects of various factors on polysaccharide yield
由图6可知,浸提时间、浸提温度和液料比对金蝉花多糖的提取都有着显著的影响。其中,浸提时间影响最为显著,图中曲面陡峭,随着浸提时间延长金蝉花多糖含量增加;液料比的影响相对显著,曲面较为陡峭;浸提温度影响次之,表现为曲面平缓。
通过回归模型的分析,以多糖含量为评价指标,金蝉花多糖适宜的提取工艺参数为浸提时间136.33 min、浸提温度77.80 ℃、液料比47.84∶1(mL/g)。在此条件下,模型预测金蝉花多糖含量为26.71 mg/g。考虑到实际应用过程中操作简便,将工艺条件修正为浸提时间130 min、浸提温度80 ℃、液料比50∶1(mL/g);在此条件下,得到金蝉花多糖含量为26.14 mg/g,误差为0.57 mg/g,实际值与理论值基本相符,说明模型对金蝉花多糖提取工艺条件参数优化可靠可行,具有一定的实用价值。
2.3 金蝉花多糖抗氧化活性的测定结果
2.3.1 总还原能力

图7 不同质量浓度多糖的总还原能力Fig. 7 Total reducing capacity of WSP as a function of its concentration
如图7所示,在质量浓度0.2~1.2 mg/mL范围内,金蝉花多糖和VC还原能力均随着质量浓度增加而增强,两者还原能力相近,而茯苓多糖还原力明显低于金蝉花多糖和VC。表明金蝉花多糖具有良好的还原能力,此结果与封燕等[25]的研究结果相一致。
2.3.2 清除DPPH自由基的能力

图8 多糖对DPPH自由基清除能力Fig. 8 Scavenging effect of WSP on DPPH
由图8可知,金蝉花多糖清除DPPH自由基能力较强。在质量浓度10~100 μg/mL范围内,金蝉花多糖和VC随着溶液质量浓度的增加,对DPPH自由基的清除能力先增强后趋于稳定,其中当质量浓度大于60 μg/mL,金蝉花多糖对DPPH自由基的清除率趋于平缓,基本保持在82%以上,而此质量浓度范围内,茯苓多糖对DPPH自由基的清除率基本在10%以下,明显低于金蝉花多糖。经线性拟合,金蝉花多糖对DPPH自由基的IC50值为28.99 μg/mL。
2.3.3 对·OH的清除作用

图9 多糖对·OH的清除能力Fig. 9 Scavenging effect of WPS on ·OH
由图9可知,在质量浓度0.1~0.6 mg/mL范围内,金蝉花多糖随着质量浓度的增加,对·OH的清除能力逐渐增强;金蝉花多糖溶液质量浓度从0.1 mg/mL增加到0.6 mg/mL,对·OH的清除率从29.02%增加到87.56%;此时,VC的清除率基本保持在96%以上,较金蝉花多糖清除能力强,但茯苓多糖的清除率基本保持在10%以下,明显低于金蝉花多糖。根据清除率拟合曲线y=1.228 7x+0.223 2,R2=0.922 9,经线性拟合,金蝉花多糖对·OH的IC50值为0.19 mg/mL。
由图10可知,在质量浓度0.1~0.5 mg/mL范围内,蝉花多糖对·清除能力随着溶液质量浓度的增加而增强,金蝉花多糖质量浓度从0.1 mg/mL增加到0.5 mg/mL,清除率从18.78%增加到67.40%。经线性拟合,金蝉花多糖对·的IC50值为0.30 mg/mL。
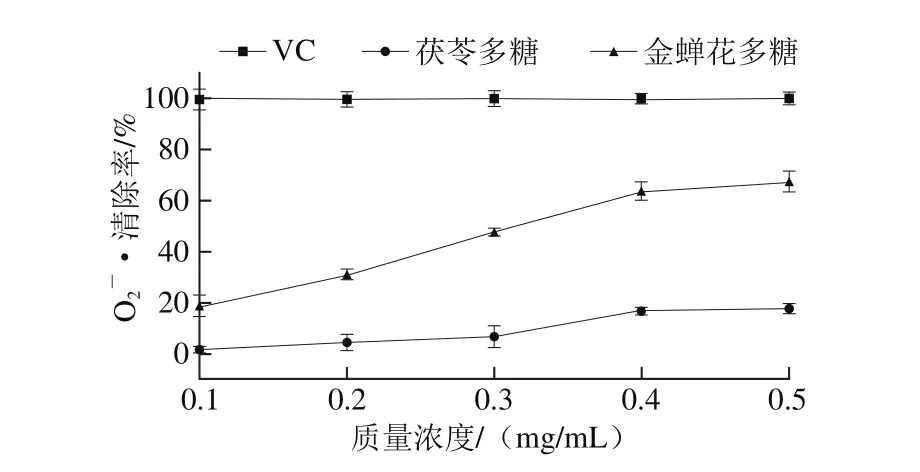
图10 多糖对·的清除能力Fig. 10 Scavenging effect of WSP on
3 结 论
采用超声波辅助水提醇沉法提取了金蝉花多糖,并利用响应面分析法进行优化,得到金蝉花多糖提取工艺参数为浸提时间130 min、浸提温度80 ℃、液料比50∶1(mL/g),在此条件下金蝉花多糖含量实际值为26.14 mg/g。
通过测定金蝉花多糖总还原力、清除DPPH自由基、·OH、·能力等多项指标评价金蝉花多糖抗氧化活性,结果显示金蝉花多糖对DPPH自由基、·OH、·的IC50分别为28.99 μg/mL、0.19 mg/mL、0.30 mg/mL,表明金蝉花多糖具有较强的抗氧化能力。研究结果与鲁吉珂[26]、Zhu Zhenyuan[27]等相一致。此外,金蝉花多糖对DPPH等自由基的清除能力与文献[28-29]对冬虫夏草多糖抗氧化活性的研究结果相似,这也说明金蝉花多糖具有较好的抗氧化活性。
[1] 温鲁, 唐玉玲, 张平. 蝉花与有关虫草活性成分检测比较[J]. 江苏中医药, 2006, 27(1): 45-46.
[2] 葛飞, 夏成润, 李春如, 等. 蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J]. 菌物学报, 2007, 26(1): 68-75. DOI:10.13346/j.mycosystema.2007.01.012.
[3] 于士军, 柴新义, 樊美珍. 蝉花菌质主要营养成分和活性成分分析[J]. 食品与机械, 2015, 31(1): 155-158. DOI:10.13346/j.mycosystema.2007.01.012.
[4] 蒋玉蓉, 袁俊杰, 孙雪婷, 等. 藜麦叶片多糖最佳提取工艺及抗氧化性研究[J]. 中国食品学报, 2017, 17(2): 110-117. DOI:10.16429/j.1009-7848.2017.02.015.
[5] 谢飞, 李伟, 陈美珍, 等. 野生蝉花多糖抗肿瘤活性及其作用机制[J].食品科学, 2016, 37(13): 209-213. DOI:10.7506/spkx1002-6630-201613038.
[6] 宋捷民, 忻家础, 朱英. 蝉花对小鼠血糖及造血功能影响[J].中华中医药学刊, 2007, 25(6): 1144-1145. DOI:10.13193/j.archtcm.2007.06.57.songjm.022.
[7] SHU C, WEN G, CHENG J, et al. Immunomodulatory functions of extracts from the Chinese medicinal fungus Cordyceps cicadae[J].Journal of Ethnopharmacology, 2002, 83: 79-85. DOI:10.1016/S0378-8741(02)00212-X.
[8] HYUNG S K, YEON J K, HONG K L, et al. Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4[J]. Food and Chemical Toxicology, 2012,50: 3190-3197. DOI:10.1016/j.fct.2012.05.051.
[9] LUO X P, DUAN Y Q, YANG W Y, et al. Structural elucidation and immunostimulatory activity of polysaccharide isolated by subcritical water extraction from Cordyceps militaris[J]. Carbohydrate Polymers,2017, 157: 794-802. DOI:10.1016/j.carbpol.2016.10.066.
[10] 朱碧纯, 柴一秋, 章思思, 等. 蝉花虫草活性成分的抗惊厥作用[J]. 菌物学报, 2016, 35(5): 619-627. DOI:10.13346/j.mycosystema.150197.
[11] 杨娜, 王鸿飞, 郝艳佳, 等. 裂褶菌多糖提取工艺及抗氧化活性研究[J]. 中国食品学报, 2014, 14(8): 92-98. DOI:10.16429/j.1009-7848.2014.08.007.
[12] QU C, YU S, JIN H, et al. The pretreatment effects on the antioxidant acitivity of jujube polysaccharides[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2013, 114: 339-343.DOI:10.1016/j.saa.2013.05.084.
[13] 张惟杰. 复合多糖生化研究技术[M]. 上海: 上海科学技术出版社,1987: 7.
[14] 丁宏伟. 超声波结合微波辅助提取米糠多糖的研究[J]. 核农学报,2013, 27(3): 329-333.
[15] DOU J, MENG Y, LIU L, et al. Purification,characterization and antioxidant activities of polysaccharides from thinned-young apple[J].International Journal of Biological Macromolecules, 2015, 72: 31-40.DOI:10.1016/j.ijbiomac.2014.07.053.
[16] PAN Y M, WANG K, HUANG S, et al. Antioxidant activity of microware-assisted extract of longan (Dimocarpus longan Lour.)peel[J]. Food Chemistry, 2008, 106(3): 1264-1270.
[17] 陈晋明, 冯翠萍. 白灵菇多糖抗氧化活性研究[J]. 食品科技, 2015,40(2): 239-242. DOI:10.13684/j.cnki.spkj.2015.02.049.
[18] 贾之慎, 邬建敏. 比色法测定Fenton法产生的羟基自由基[J]. 生物化学与生物物理进展, 1996, 23(2): 184-186.
[19] 朱燕, 程东庆. 蝉花多糖抗氧化活性的测定[J]. 中华中医药学刊, 2009,27(7): 1552-1554. DOI:10.13193/j.archtcm.2009.07.209.zhuy.066.
[20] 朱月, 马金莲. 真菌多糖对氧自由基的清除作用[J]. 赤峰学院学报,2013, 29(9): 9-12. DOI:10.13398/j.cnki.issn1673-260x.2013.18.004.
[21] 马赟, 索菲娅, 卢帅, 等. 不同产地新疆虫草体外抗氧化作用[J]. 中国医院药学杂志, 2014, 14(34): 1145-1148. DOI:10.13286/j.cnki.chinhosppharmacyj.2014.14.01.
[22] 杨娜, 王鸿飞, 宋佳敏, 等. 超声波辅助提取裂褶菌多糖及分离纯化的研究[J]. 核农学报, 2014, 28(11): 2015-2024.
[23] 杨文雅, 李长征, 张海晖, 等. 蛹虫草多糖的亚临界水萃取及其抗氧化活性研究[J]. 食品工业科技, 2016(5): 252-253. DOI:10.13386/j.issn1002-0306.2016.05.041.
[24] 王吉标, 欧阳臻, 赵明, 等. 响应面分析法优化金蝉花多糖的提取工艺[J]. 天然产物研究与开发, 2014, 26(3): 438-443. DOI:10.16333/j.1001-6880.2014.03.031.
[25] 封燕, 贡小辉, 韦德群, 等. 金蝉花多糖的抗氧化活性及结构分析[J].食品科学, 2016, 37(12): 19-24. DOI:10.7506/spkx1002-6630-201613004.
[26] 鲁吉珂, 古国峰, 汪瑞, 等. 蝉花多糖提取工艺优化研究[J].食品工业科技, 2013, 34(22): 196-199. DOI:10.13386/j.issn1002-0306.2013.22.040.
[27] ZHU Z Y, LIU F, GAO H, et al. Synthesis, characterization and antioxidant activity of selenium polysaccharide from Cordyceps militaris[J]. International Journal of Biological Macromolecules, 2016,93: 1090-1099. DOI:10.1016/j.ijbiomac.2016.09.076.
[28] DONG C H, YAO Y J. In vitro evaluation of antioxidant activities of aqueous extracts from natural and cultured mycelia of Cordyceps sinensis[J]. Science Direct, 2008, 41(4): 669-677. DOI:10.1016/j.lwt.2007.05.002.
[29] WANG J J, KAN L J, NIE S P, et al. A comparison of chemical composition, bioactive components and antioxidant activity of natural and cultured Cordyceps sinensis[J]. LWT-Food Science and Technology, 2015, 63(1): 2-7. DOI:10.1016/j.lwt.2015.03.109.
