藏灵菇牦牛酸乳发酵过程中乳酸菌和酵母菌对品质的作用
2018-02-09龙兴瑶王洪伟索化夷
龙兴瑶,李 键,谢 婕,赵 欣,王洪伟,张 玉,索化夷,*
(1.西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715;2.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067;3.西南民族大学生命科学与技术学院,四川 成都 610041)
藏灵菇是由数种乳酸菌、酵母菌、醋酸菌和霉菌共生而成的西藏特有酸乳发酵剂[1],其发酵的酸乳具有改善肠道菌群,增强胃肠道功能[2]、降低血清总胆固醇和甘油三酯、保护肝脏[3]、清除自由基[4],抗氧化[5],延缓衰老[6]、预防改善动脉粥样硬化[7]等功能,其分泌的胞外多糖能抑制癌细胞增殖,具有抗肿瘤作用[8]。且藏灵菇发酵的酸乳与普通酸乳在口感和风味上具有较大差别,因为藏灵菇发酵酸乳是酵母菌和乳酸菌共同发酵而成,所以藏灵菇发酵酸乳中有其特有的醇香味及起泡性[9]。
作为发酵剂,藏灵菇中的乳酸菌和酵母菌在发酵过程中发挥了主要作用,目前有针对乳酸菌和酵母菌的种类和发酵特性的研究,其研究结果表明,藏灵菇中的乳酸菌主要为乳杆菌属、乳球菌属、双歧杆菌属、微球菌属,酵母菌主要为假丝酵母属、鲁维酵母属和酵母属[10]。藏灵菇发酵酸乳过程中,乳酸菌和酵母菌的新陈代谢产物能抑制有害菌的生长,酵母菌能分解乳糖,产生维生素促进乳酸菌生长,同时产生的半乳糖能保护乳酸菌细胞免受乳酸浓度的阻碍。乳酸菌能促进酿酒酵母和马克斯克鲁维酵母的生长,酿酒酵母和乳酸菌共同接种有利于保持产品冷藏期间活菌数的稳定,菌株之间可能存在共生作用[11]。藏灵菇作为发酵剂的发酵过程中,乳酸菌和酵母菌各自发挥的作用还尚未研究清楚。为研究藏灵菇发酵酸乳中乳酸菌和酵母菌的发酵特性,明确乳酸菌和酵母菌在酸乳发酵过程中各自对品质、口感所产生的影响,选用实验室保藏藏灵菇进行发酵。在发酵过程中,用放线菌酮和青链霉素分别抑制发酵过程中的酵母菌和乳酸菌,测定并比较正常发酵酸乳、抑制乳酸菌和酵母菌发酵酸乳的酸度、乙醇含量、氨基酸态氮、质构、游离氨基酸、有机酸、VB1和VB2含量等相关指标。结果可指导藏灵菇发酵酸乳标准的制定,也可保证藏区牧民家庭式藏灵菇发酵酸乳的品质,对藏灵菇发酵酸乳产业起到推动作用。
1 材料与方法
1.1 材料与试剂
藏灵菇菌粒为实验室保藏,采样于西藏。
牦牛奶粉 红原牦牛乳业有限责任公司;放线菌酮、青链霉素、茚三酮 北京索莱宝科技有限公司;盐酸、乙酸钠、甲酸、乙酸、磷酸二氢铵、溴百里香酚蓝、氢氧化钠、重铬酸钾、甲醛 成都市科龙化工试剂厂。
1.2 仪器与设备
L-8800氨基酸分析仪 日立(中国)有限公司;DY-09 PHS-3C酸度计 成都世纪方舟科技有限公司;LC-20A高效液相色谱仪 日本岛津公司;XDB-C18高效液相色谱柱 安捷伦科技有限公司;TA-XT2i质构仪英国SMS公司。
1.3 方法
1.3.1 发酵工艺
将3.6 g牦牛奶粉加入30 mL水中混匀,30 ℃预热,巴氏杀菌(63 ℃、30 min),冷却至室温,接种5%的发酵剂在37 ℃条件下发酵10 h后放入4 ℃冷库,后熟24 h。
1.3.2 抑制发酵条件
按照不同发酵时间(2、6、10、22、34 h)和发酵方式分别发酵藏灵菇酸乳。分别取0.001、0.002、0.004、0.006 g的放线菌酮溶解于100 mL的原料乳中,按1.3.1节方法进行发酵,取发酵10 h的发酵乳,按GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》[12],GB 4789.35—2010《食品微生物学检验 乳酸菌检验》[13]分别对酸乳中的酵母菌和乳酸菌计数,并计算酵母菌的抑制率。吸取0.3、0.5、1.0、1.5 mL的青链霉素混合液(青霉素10 kU/mL,链霉素10 mg/mL)溶于100 mL的原料乳中进行发酵,然后取发酵10 h的发酵乳,按GB 4789.15—2010、GB 4789.35—2010分别对酸乳中的酵母菌和乳酸菌计数,并计算乳酸菌的抑制率。
1.3.3 滴定酸度的测定
根据GB 5413.34—2010《乳和乳制品酸度的测定》[14],进行滴定酸度的测定。
1.3.4 氨基酸态氮含量的测定
根据GB 5009.30—2003《酱油卫生标准的分析方法测定》[15],进行氨基酸态氮含量的测定。
1.3.5 乙醇含量测定
根据GB/T 12143—2008《饮料通用分析方法的测定》[16],进行乙醇含量的测定。
1.3.6 质构特性测定
选用A/BE探头对藏灵菇发酵牦牛酸乳的硬度、稠度、黏聚性和黏性指数等质构特性进行测定[17]。其中探头选择直径为35 mm压力盘,设定下降速率为10 mm/s,测试和提升速率为1 mm/s,测试深度为发酵酸奶总高度的70%,记录速率为200 mg/kg。
1.3.7 游离氨基酸含量的测定
准确称取样品400 mg于18 mm×180 mm试管中,向盛有样品的试管中加入7 mL的盐酸(6 mol/L),振荡混匀。用酒精喷灯把该试管口下1/3处拉细到4~6 mm,抽真空10 min后封管。处理过的试管置(110±1)℃恒温烘箱中沙浴水解22 h,拿出冷至室温,摇匀过滤,取1 mL滤液于50 mL烧杯中,用60 ℃恒温水浴蒸干滤液,加入0.02 mol/L盐酸稀释6 倍,用0.22 μm滤膜过滤上机分析。
分析周期为53 min;分离柱(4.6 mm×60 mm)柱温设为70 ℃,柱压7.678 MPa,洗脱液以0.4 mL/min流速流经此柱;反应柱柱温135 ℃、柱压0.982 MPa,茚三酮及茚三酮缓冲液以0.35 mL/min流速流经此柱;进样体积为20 μL。
1.3.8 乳酸、乙酸、柠檬酸含量的测定[18]
称取发酵乳试样约5 g(精确到0.000 1 g)于50 mL容量瓶中,用超纯水稀释至刻度,超声5 min,摇匀,滤纸过滤后,吸取滤液过0.45 μm滤膜后作为样液,供高效液相色谱测定。
色谱柱选用Agilent XDB-C18柱(4.6 mm×250 mm,5 μm);流动相为0.1 mol/L磷酸二氢铵溶液(用磷酸调节pH 2.4,过0.45 μm滤膜)和甲醇;流速为甲醇0.03 mL/min,磷酸二氢铵溶液0.57 mL/min;检测波长220 nm;色谱柱温度35 ℃;进样体积10 μL。
1.3.9 VB1含量的测定[19]
称取5~10 g(精确至0.01 g)试样于100 mL三角瓶中,加60 mL的0.1 mol/L盐酸充分摇匀,用棉花塞和牛皮纸封口,放入高压灭菌锅内,在121 ℃保持30 min,待冷却至40 ℃以下后取出,轻摇数次;用2.0 mol/L乙酸钠溶液调pH值至4.0左右,加入2.0 mL混合酶液,摇匀后置于37 ℃的培养箱中过夜;将酶解液转移至100 mL容量瓶中,用水定容至刻度,滤纸过滤,取滤液备用。取上述滤液10.00 mL于25 mL具塞比色管中,加入5 mL碱性铁氰化钾,充分混匀后,加10.00 mL正丁醇,强烈振荡后静置约10 min,充分分层,吸取正丁醇相(上层)于4 000~6 000r/min离心5 min,取上清液经有机微孔滤膜过滤,供进样用。
选用C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相为0.05 mol/L乙酸钠溶液和色谱级甲醇,体积比为65∶35;流速为1.0 mL/min;检测波长:激发波长375 nm,发射波长435 nm;进样量20 μL。
1.3.10 VB2含量的测定[20]
称取5~10 g(精确至0.01 g)试样于100 mL三角瓶中,加60 mL 0.1 mol/L盐酸充分摇匀,用棉花塞和牛皮纸封口,放入高压灭菌锅内,在121 ℃保持30 min,待冷却至40 ℃以下后取出,轻摇数次;用2.0 mol/L乙酸钠溶液调pH值至4.0左右,加入2.0 mL混合酶溶液摇匀后,置于37 ℃培养箱中过夜;将酶解液转移至100 mL容量瓶中,用水定容至刻度,用定量滤纸过滤,取滤液再经0.45 μm滤膜过滤,取滤液备用。
选用C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相为0.05 mol/L乙酸钠溶液和甲醇,体积比为65∶35;流速设为1.0 mL/min;检测波长:激发波长为462 nm,发射波长为522 nm;进样量20 μL。
2 结果与分析
2.1 酵母菌和乳酸菌的抑制率结果

表1 添加青链霉素发酵酸乳的菌落计数Table1 Colony counts of Lactobacillus and yeast in yoghurt with penicillin
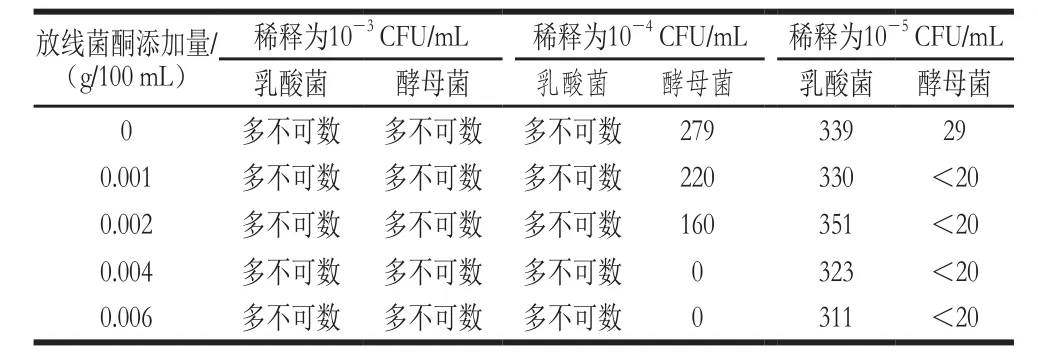
表2 添加放线菌酮发酵酸乳的菌落计数Table2 Colony counts of yoghurt with cycloheximide
通过对正常发酵和添加不同量抑制剂发酵酸奶的菌落计数分析,由表1、2可以发现,添加0.004 g/100 mL放线菌酮的发酵酸乳,对其进行酵母菌计数,抑制率达到100%,在相同条件下对酸乳中的乳酸菌进行计数,对乳酸菌无明显的抑制作用。添加0.5 mL/100 mL青链霉素的发酵酸乳,对乳酸菌进行计数,抑制率达到89.7%,在相同条件下对酸乳中的酵母菌进行计数,对酵母菌无明显的抑制作用。因此选择0.004 g/100 mL的放线菌酮抑制酵母菌,0.5 mL/100 mL的青链霉素抑制乳酸菌。
2.2 3 种发酵条件对滴定酸度的影响
酸乳的酸度是衡量发酵剂发酵性能的主要指标之一,当酸度达到一定的数值之后,酸乳便会凝固。对比图1中3 种不同发酵方式,在整个发酵过程中,抑制酵母菌发酵的样品与正常发酵样品的变化趋势基本无差别,而抑制乳酸菌发酵的样品,其滴定酸度明显低于前两种。藏灵菇酸乳在2~10 h的发酵过程中,正常发酵和抑制酵母菌发酵样品的滴定酸度由21 °T增加至60 °T,而抑制乳酸菌的样品只由18 °T增加至22 °T,最终滴定酸度为正常发酵滴定酸的1/3,这说明乳酸菌是影响酸乳发酵过程中滴定酸度最主要的因素。
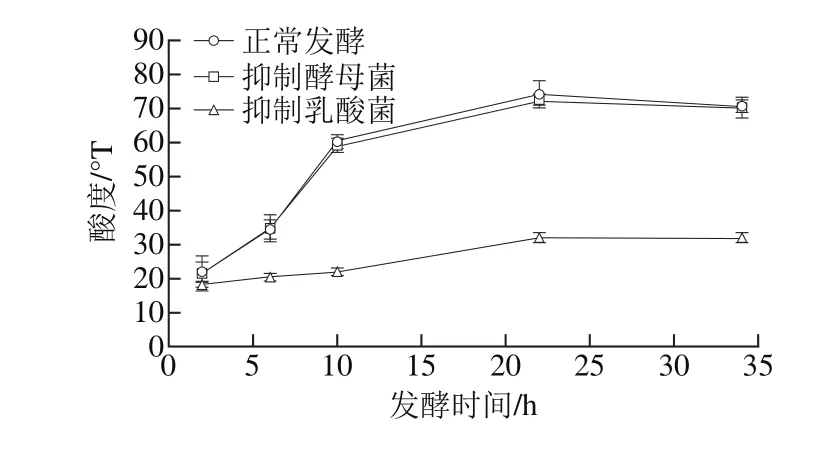
图1 不同发酵方式藏灵菇酸乳发酵过程中滴定酸度变化Fig. 1 Changes in titratable acidity of yogurt during fermentation under different conditions
2.3 3 种发酵条件对乙醇含量的影响

图2 不同发酵方式藏灵菇酸乳发酵过程中乙醇含量变化Fig. 2 Changes in alcohol content of yogurt during fermentation under different conditions
藏灵菇牦牛发酵乳属于Ⅳ型发酵乳[21],其独特的醇香味可能是与酵母菌发酵产生乙醇有关。而乙醇主要是酵母在无氧状态下,由乙醇脱氢酶还原乙醛生成[22]。对比图2中3 种发酵方式,抑制酵母菌生长的发酵酸乳,其乙醇含量值明显低于正常发酵和抑制乳酸菌发酵的发酵样品。藏灵菇3 种发酵方式样品终点的乙醇含量分别为4.44、3.68、2.77 g/kg,抑制酵母菌发酵的酸乳其乙醇含量约为正常发酵组的1/2,因此,酵母菌对酸乳发酵过程中乙醇的产生发挥了主要的作用。但抑制乳酸菌发酵的酸乳乙醇含量略低于正常发酵,说明乳酸菌可能会影响酵母菌产生乙醇。
2.4 3 种发酵条件对氨基酸态氮含量的影响
蛋白质在微生物水解酶的作用下分解成各种氨基酸,从而使酸乳获得更丰富的香味,因此氨基酸态氮的含量在一定程度上可代表酸乳的感官品质。如图3所示,在前发酵过程的终点10 h时,藏灵菇的氨基酸态氮含量分别为223.18、202.99、73.56 mg/100 g,说明抑制酵母菌和抑制乳酸菌的发酵方式对样品中氨基酸态氮的含量是有影响的。对比整个发酵过程,抑制酵母菌的发酵方式,其氨基酸态氮含量的变化趋势与正常发酵的一致,但抑制了乳酸菌发酵的样品,其氨基酸态氮含量明显降低,由65 mg/100 g下降为53 mg/100 g,约为正常发酵的30%,说明蛋白酶主要来源于乳酸菌,乳酸菌对氨基酸态氮的产生起到了关键的作用。

图3 不同发酵方式藏灵菇酸乳发酵过程中氨基酸态氮含量变化Fig. 3 Changes in nitrogen amino acid content of yogurt during fermentation under different conditions
2.5 发酵条件对质构特性的影响
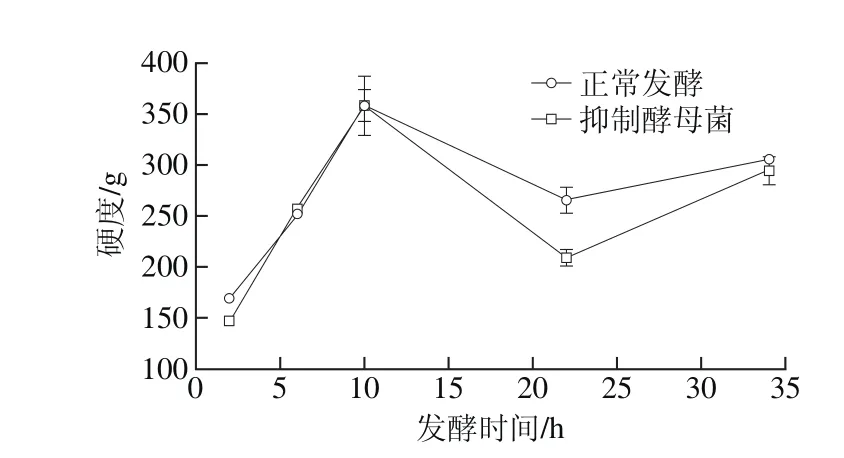
图4 不同发酵方式藏灵菇酸乳发酵过程中硬度特性变化Fig. 4 Changes in firmness of yogurt during fermentation under different conditions
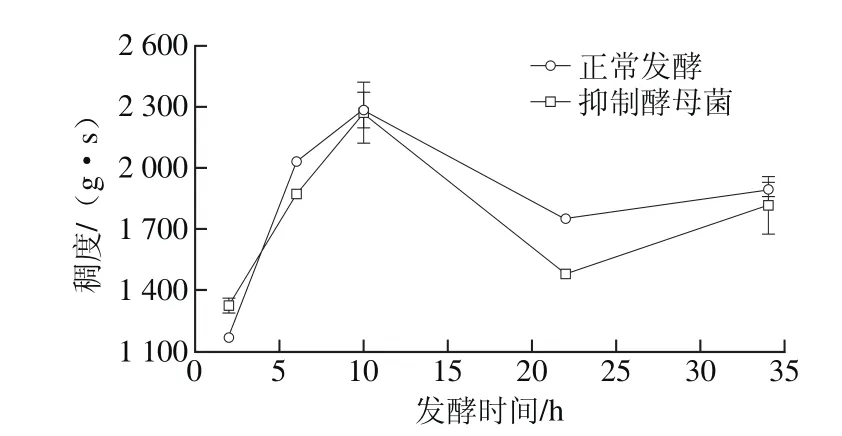
图5 不同发酵方式藏灵菇酸乳发酵过程中稠度特性变化Fig. 5 Changes in consistency of yogurt during fermentation under different conditions
硬度和稠度反映了酸乳的爽滑性及细腻度,而黏聚性和黏性指数则代表探头在离开酸乳时的附着力,一般情况下稠度越大的酸乳,其黏着力也较大。通过对发酵酸乳硬度、稠度、黏聚性和黏性指数的测定(图4~7),可以模拟酸乳的口感,使酸乳在咀嚼特性方面有更好的量化指标[23-24]。在进行酸奶质构的测定时,抑制乳酸菌活性的发酵方式,在整个发酵过程中发酵酸乳都未凝乳,因此未对其进行质构测定。可能原因为抑制乳酸菌的繁殖,使酸乳产酸量不足,酸乳中的蛋白质达不到凝固的酸度等电点,凝胶结构无法形成。

图6 不同发酵方式藏灵菇酸乳发酵过程中黏聚性变化Fig. 6 Changes in cohesiveness of yogurt during fermentation under different conditions

图7 不同发酵方式藏灵菇酸乳发酵过程中黏性指数变化Fig. 7 Changes in viscosity index of yogurt during fermentation under different conditions
综合分析抑制酵母菌活性和正常发酵两种发酵方式下各样品的硬度、稠度、黏聚性和黏性指数,可以发现抑制酵母菌活性后,酸奶在质构特性方面并没有出现太大的变化,质构各项指数变化趋势的曲线几乎相同,但各项指标均与正常发酵组存在一些差别。这说明虽然酵母菌对发酵酸乳的质构存在一些影响,但乳酸菌才是酸乳发酵过程中最重要的影响因素。
2.6 3 种发酵条件对游离氨基酸含量的影响
游离氨基酸可直接被人体吸收,吸收速率快,利用率高[25]。如表3所示,在3 种发酵方式中,含量最高的氨基酸为脯氨酸和丝氨酸,而非高薇等[26]实验结果中的谷氨酸、脯氨酸和赖氨酸。单抑制酵母菌发酵的条件下,藏灵菇发酵酸乳的氨基酸总含量与正常发酵方式相差较小,单抑制乳酸菌的发酵方式所产生的游离氨基酸与正常发酵方式相比相差较大,特别是赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸7 种必需氨基酸在抑制乳酸菌以后含量明显下降,只有正常发酵组的一半左右。说明乳酸菌在发酵过程中对游离氨基酸的产生起主要作用,酵母菌影响较小。

表3 不同发酵条件藏灵菇酸乳发酵过程中游离氨基酸含量变化Table3 Changes in free amino acid content of yogurt during fermentation under different conditions
2.7 3 种发酵条件对有机酸含量的影响

图8 不同发酵方式藏灵菇酸乳发酵过程中各有机酸含量变化Fig. 8 Changes in organic acid contents of yogurt during fermentation under different conditions
有机酸作为乳酸风味的重要来源,其中乳酸与滴定酸呈正相关,乙酸和柠檬酸也可分解为相关的酯、氨基化合物或某些醇类物质,为酸乳带来丰富而清爽的口感[27]。从图8结果来看,抑制乳酸菌之后的酸乳其乳酸、乙酸在整个发酵过程中几乎没有产生,柠檬酸也逐渐减少,这与根据周剑忠等[28]的研究结果相似,说明乳酸菌是影响乳酸和乙酸生成的重要因素。乳酸菌和酵母菌对柠檬酸的影响并没有明显的规律,但总量都低于正常发酵。
2.8 3 种发酵条件对VB1、VB2含量的影响
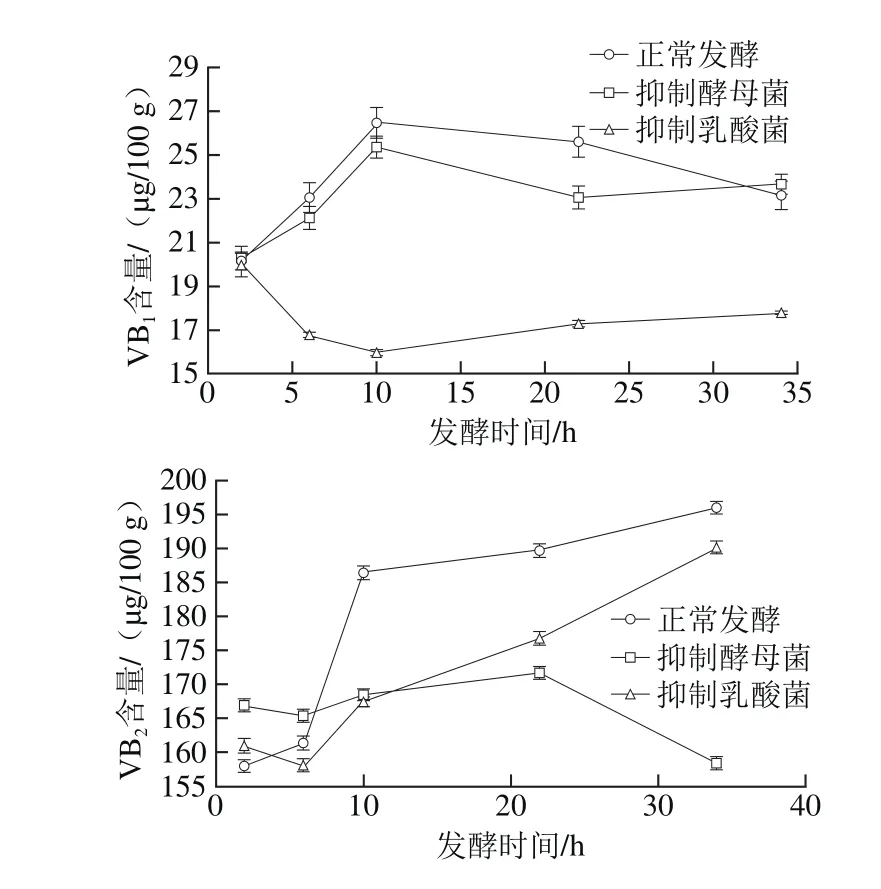
图9 不同发酵方式藏灵菇酸乳发酵过程中VB1和VB2变化Fig. 9 Changes in VB2 content of yogurt during fermentations under different conditions
如图9所示,抑制乳酸菌后,VB1明显下降,由20 μg/100 g下降为18 μg/100 g;VB2含量在后期有小幅提升,且趋势与正常发酵相似。抑制酵母菌活性的酸乳,其VB2含量相对较低,特别是在发酵后期VB2更明显降低,由168 μg/100 g下降为157 μg/100 g。说明乳酸菌与VB1的生成有关,酵母菌与VB2的生成有关。
3 讨 论
藏灵菇作为藏区特有的发酵剂,其发酵的酸乳风味独特,适口性良好,对身体有益。但现阶段的开发利用和发酵研究程度不够。本实验采用抑制酵母菌和乳酸菌的方式研究乳酸菌和酵母菌分别对发酵的影响。测定结果中正常发酵酸乳滴定酸度最高值为60 °T,与Zhang Heping等[29]报道的市售酸奶滴定酸度一致。与王则臻等[30]和贾磊[31]的研究所得结果类似,使用乳酸菌进行发酵在前几个小时内酸度值会明显增加,而用酵母菌发酵时滴定酸度值变化不大,说明在发酵前期,乳酸菌迅速生长,分解乳糖产生乳酸等一系列酸性物质,使酸乳滴定酸度急剧升高,但环境酸度过低会抑制乳酸自身生长[32],所以到发酵后期,酸乳的滴定酸度保持相对稳定,可见乳酸菌是提高酸乳酸度的主要微生物。Cheirsilp等[33]研究也发现,乳糖阳性酵母菌和乳糖阴性酵母菌的存在会促进乳糖继续代谢,能使产品的pH值有所上升,这也能够解释在抑制乳酸菌的发酵酸乳中酵母菌能够增加滴定酸度的原因。
藏灵菇发酵酸乳中含有的酵母菌在进行无氧呼吸产生乙醇的同时可以为产品带来特殊的香气和风味[34],在抑制乳酸菌生长的样品中,酵母菌有更充足的生长环境,活性更高,产生乙醇的速率增加,到发酵后期,高含量的乙醇会抑制酵母菌的活性,因此前10 h乙醇含量增加迅速到后期乙醇含量相对稳定,相反,在抑制酵母菌生长的样品中乙醇含量明显减少,因此在藏灵菇发酵酸乳中所产生的醇香物质来源为酵母菌。此结果与贾磊[31]前4 h快速产乙醇存在一些差别,分析原因可能为本实验中发酵酸乳环境中含氧量较低,酵母菌从最开始便进行无氧呼吸产生乙醇,而没有进行有氧呼吸大量繁殖。虽然酵母菌是乙醇的主要来源,但抑制酵母菌发酵的酸乳乙醇含量略低于正常发酵酸乳的乙醇含量,可能原因是放线菌酮的添加对酵母菌也有部分抑制。
氨基酸态氮含量为判断发酵程度的一项指标,实验中发现抑制乳酸菌发酵后酸乳中的氨基酸态氮明显减少,可能因为乳酸菌能产生更多分解蛋白质的酶类,这些酶能将蛋白质分解为肽和氨基酸,氨基酸态氮的含量就会增加。3 种条件的发酵酸乳10 h后氨基酸态氮含量都略有下降,可能原因是菌株自身增殖又利用了生成的氨基酸作为氮源所致[35]。
乳酸菌对酸乳的质构起到至关重要的作用,因为抑制乳酸菌发酵酸乳产酸不够,无法达到蛋白质的等电点,无法形成凝乳状态。但也能发现酵母菌对发酵酸乳的质构起到一定的作用,可能原因是酵母菌会影响乳酸菌和明串珠菌胞外多糖的产生来影响发酵酸乳的质构[36-37]。与祝静[38]测定的羊酸奶发酵酸乳相比,藏灵菇发酵酸乳在质构指标上有明显的优势,说明藏灵菇中蕴含的乳酸菌和酵母菌在发酵过程中产生的物质对质构的贡献优于其他发酵剂。Soukoulis等[39]的研究表示,较高的pH值能使酸乳质构更加稳定,这与本实验有类似的结果,在发酵酸乳达到10 h,滴定酸度不断积累,pH值不断降低的情况下,质构的稳定性出现波动,尤其是硬度和稠度出现明显转折。
游离氨基酸通过脱羧、脱氨、氨基转移和硫酸化等代谢途径形成短链脂肪酸、酯类、醛类及其他成分。本研究中抑制乳酸菌发酵后7 种必需氨基酸含量下降,可能原因是乳酸菌所生成的酶对必需氨基酸的影响较大,抑制乳酸菌发酵后这些酶类无法产生,因此无法形成相对应的氨基酸。
有机酸影响着酸乳酸爽的口感,乳酸菌通过HMP途径产生乳酸和乙酸,因此抑制乳酸菌生长后酸乳中乙酸与乳酸明显降低。抑制酵母菌活性后乙酸含量略微高于正常发酵组,可能原因是酵母菌生长过程中会消耗乙酸。田辉等[40]利用高效液相色谱法测定酸奶中的有机酸,乳酸的含量显著多于乙酸、柠檬酸且乳酸含量与滴定酸度呈明显的正相关与本实验结果相同。发酵酸乳的乙酸含量在整个发酵过程中是呈下降趋势的,这是由于乙酸是乙酸乙酯等各类风味物质的前体物质,在发酵过程中,乙酸被不断利用以合成各类风味物质,因此在整个发酵过程中乙酸的含量显示为下降状态。柠檬酸的含量也有所下降,这是由于柠檬酸是很多风味物质的前体物质[41],在酸乳后发酵时期柠檬酸转化形成其他风味物质,使得柠檬酸的含量有所下降。
B族维生素是许多活性酶的辅酶,VB1、VB2可以调节糖类和蛋白质的代谢。从本研究的结果可以看出,抑制乳酸菌后VB1损失较大,抑制酵母菌后VB2损失较大,特别是发酵后期,这与陆婧[42]的研究类似。乳酸菌影响VB1可能的原因为VB1是乳酸菌活动所产生的,虽然VB1会因为阳光和乳酸菌的消耗有一定量的损失,但是某些乳酸菌也会合成和促进B族维生素的合成,如乳酸乳球菌和双歧杆菌[43-44]。而酵母菌的各种生理代谢与VB2的产生有关,特别是在发酵后期,VB2明显减少,一方面是因为酵母菌是影响VB2的主要微生物,另一方面是缺乏酵母菌的竞争性生长,乳酸菌消耗掉一部分VB2。
国内外大量的研究以发酵酸乳的发酵特性作为研究基础,例如酸度、质构特性、香气物质等,结合感官评价综合评价酸乳的品质。特别是Han Xue等[45]研究中发酵酸乳的酸度、硬度、黏度、黏聚性均与本实验中酸乳相似。赵欣[46]和陈洁[47]等研究发现,氨基酸态氮和游离氨基酸的含量直接影响发酵产品感官评价中的香气评分。
综上,在藏灵菇发酵酸乳过程中,酵母菌对酸乳中乙醇和VB2的生成起到关键作用,乳酸菌对酸乳酸度、氨基酸态氮含量、质构、游离氨基酸、乳酸和乙酸含量、VB1含量起到关键作用。酵母菌和乳酸菌可以互相促进生长,酵母菌可以促进乳酸菌产生乳酸,乳酸菌能促进酵母菌产生乙醇。
[1] 邵东燕. 西藏灵菇乳的发酵机制及其纯种复合发酵剂研究[D]. 杨凌:西北农林科技大学, 2008.
[2] MAN G V, SPOERRY A. Studies of a surfactant and cholesterolemia in the Maasai[J]. American Journal of Clinical Nutrition, 2004, 27(4): 64-69.
[3] 刘慧, 王世平, 冉冉, 等. 藏灵菇源酸奶复合菌发酵剂对肠道菌群平衡的作用[J]. 中国食品学报, 2011, 11(6): 8-12. DOI:10.3969/j.issn.1009-7848.2011.06.002.
[4] 屈长青, 杜召风, 韦兵, 等. 藏灵菇发酵乳乳清的抗氧化及免疫学活性研究[J]. 天然产物研究与开发, 2014(26): 1117-1119. DOI:10.16333/j.1001-6880.2014.07.030.
[5] YUE L H, CHENG G D, WANG C P, et al. Study on anti-oxidative effect of Tibet Linggu fungus yogurt on subacute aging model mice[J].Journal of Jiamusi University, 2008.
[6] 米兰, 赵小元, 张炎. 藏灵菇酸乳的抗氧化性研究[J]. 食品科技, 2014,39(1): 78-83.
[7] 刘慧, 王世平, 冉冉, 等. 藏灵菇源酸奶复合菌发酵剂对大鼠脂质过氧化的影响[J]. 中国食品学报, 2010, 3(10): 27-31. DOI:10.3969/j.issn.1009-7848.2010.03.004.
[8] DINIZ R O, GARLA L K, SCHNEED J M, et al. Study of antiinflammatory activity of Tibetan mushroom, a symbiotic culture of bacteria and fungiencapsulated into a polysaccharide matrix[J]. Pharmacological Research,2003(47): 49-52. DOI:10.1016/S1043-6618(2)00240-2.
[9] 黄颖, 杜娜, 张堃, 等. 藏灵菇发酵乳中乳酸菌的分离纯化与鉴定[J]. 中国实验诊断学, 2010, 14(4): 517-519. DOI:10.3969/j.issn.1007-4287.2010.04.014.
[10] 刘变芳, 孔庆学, 郭蔼光. 自然发酵剂“西藏雪莲”的初步研究与菌种鉴定[J]. 中国酿造, 2004, 23(11): 11-15. DOI:10.3969/j.issn.0254-5071.2004.11.004.
[11] 李先胜, 姜铁民, 陈历俊. 发酵乳中酵母菌和乳酸菌生长的相互影响[J]. 食品工业科技, 2012, 33(17): 139-141. DOI:10.13386/j.issn1002-0306.2012.17.077.
[12] 卫生部. 食品微生物学检验 霉菌和酵母计数: GB 4789.15—2010[S].北京: 中国标准出版社, 2010.
[13] 卫生部. 食品微生物学检验 乳酸菌检验: GB 4789.35—2010[S]. 北京:中国标准出版社, 2010.
[14] 卫生部. 乳和乳制品酸度的测定: GB 5413.34—2010[S]. 北京: 中国标准出版社, 2010.
[15] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[16] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饮料通用分析方法: GB/T 12143—2008[S]. 北京: 中国标准出版社, 2010.
[17] BEDANI R, CAMPOS M M, CASTRO I A, et al. Incorporation of soybean by-product okara and inulin in a probiotic soy yoghurt: texture profile and sensory acceptance[J]. Journal of the Science of Food and Agriculture, 2014, 94(1): 119-125. DOI:10.1002/jsfa.6212.
[18] 国家质量监督检验检疫总局. 进出口果汁中乳酸、柠檬酸、富马酸含量检测方法 高效液相色谱法: SN/T 2007—2007[S]. 北京: 中国标准出版社, 2010.
[19] 卫生部. 婴幼儿食品和乳制品中的维生素B1的测定: GB 5413.11—2010[S]. 北京: 中国标准出版社, 2010.
[20] 卫生部. 婴幼儿食品和乳制品中的维生素B2的测定: GB 5413.12—2010[S]. 北京: 中国标准出版社, 2010.
[21] SERAFINI F, TURRONI F, RUAS-MADIEKO P, et a1.Kefir fermented milk and kefiran promote growth of Bifidobacterium bifidum PRL2010 and modulate its gene expression[J]. Intemadonal Joumal of Food Microbiology, 2014, 178: 50-59. DOI:10.1016/j.ijfoodmicro.2014.02.024.
[22] 包怡红. 乳清多肽及其发酵制品的研究[D]. 哈尔滨: 东北农业大学,2001.
[23] LUTCHMEDIAL M, RAMLAL R, BADRIE N, et al. Nutritional and sensory quality of stirred soursop (Annona muricata L.) yoghurt[J].International Journal of Food Sciences & Nutrition, 2004, 55(5): 407.DOI:10.1080/09637480400002800.
[24] RASDHARI M, PAREKH T, DAVE N, et al. Evaluation of various physico-chemical properties of Hibiscus sabdariffa and L. casei incorporated probiotic yoghurt[J]. Pakistan Journal of Biological Sciences Pjbs, 2008, 11(17): 2101. DOI:10.3923/pjbs.2008.2101.2108.
[25] 马嵬, 金素钰, 郑玉才. 酸奶中游离氨基酸含量及乳清蛋白组成分析[J]. 中国乳品工业, 2006, 34(6): 20-25. DOI:10.3969/j.issn.1001-2230.2006.06.005.
[26] 高薇. 西藏灵菇发酵乳微生物多样性研究及优势菌群分离鉴定[D].哈尔滨: 哈尔滨工业大学, 2013.
[27] 孙荣, 王燕, 杨平平. 柠檬酸发酵现状及展望[J]. 中国调味品, 2011,36(1): 90-92. DOI:10.3969/j.issn.1000-9973.2011.01.026.
[28] 周剑忠, 董明盛, 江汉湖, 等. 藏灵菇发酵奶发酵特性的研究[J]. 食品科学, 2006, 26(8): 29-33. DOI:10.3321/j.issn:1002-6630.2006.08.002.
[29] ZHANG H P, XU J, WANG J G, et al. A survey on chemical and microbiological composition of kurut, naturally fermented yak milk from Qinghai in China[J]. Food Control, 2008, 19(6): 578-586. DOI:10.1016/j.foodcont.2007.06.010.
[30] 王则臻, 陈朝晖, 李敏杰. 乳酸菌的抑菌作用及其发酵性能研究[J].食品科技, 2012, 37(1): 2-6. DOI:10.13684/j.cnki.spkj.2012.01.028.
[31] 贾磊. 酵母与乳酸菌发酵特性研究及混合乳开菲尔的研制[D].天津: 天津科技大学, 2011.
[32] 赵辉. 高产L-(+)- 乳酸植物乳杆菌工程菌的构建与应用[M]. 哈尔滨:黑龙江大学出版社, 2010.
[33] CHEIRSILP B, SHIMIZU H, SHIOYA S. Enhanced kefiran production by mixed culture of Lactobacillus kefiranofaciens and Saccharomyces cerevisiae[J]. Journal of Biotechnology, 2003, 100(1): 43-53.DOI:10.1016/S0168-1656(2)00228-6.
[34] 谢婕, 赵欣, 骞宇, 等. 传统发酵牦牛酸乳中酵母菌的分子生物学鉴定[J]. 食品科学, 2015, 36(11): 114-118. DOI:10.7506/spkx1002-6630-201511022.
[35] 鲍志宁. 干酪乳杆菌GBHM-21鉴定、中试制备及发酵技术研究[D].广州: 华南理工大学, 2015.
[36] 袁祎琳, 李云飞, 梅俊, 等. 藏灵菇发酵纯牛奶过程中的物性变化[J]. 食品工业科技, 2013, 34(10): 208-211; 224. DOI:10.13386/j.issn1002-0306.2013.10.051.
[37] BENSMIRA M, NSABIMANA C, JIANG B. Effects of fermentation conditions and homogenization pressure on the rheological properties of Kefir[J]. LWT-Food Science and Technology, 2010, 43(8): 1180-1184.DOI:10.1016/j.lwt.2010.04.005.
[38] 祝静. 羊酸奶发酵工艺及其质构特性和风味成分研究[D]. 杨凌: 西北农林科技大学, 2011.
[39] SOUKOULIS C, BIASIOLI F, APREA E, et al. PTR-TOF-MS analysis for influence of milk base supplementation on texture and headspace concentration of endogenous volatile compounds in yogurt[J]. Food &Bioprocess Technology, 2012, 5(6): 2085-2097. DOI:10.1007/s11947-010-0487-1.
[40] 陈永福, 孙志宏, 包秋华, 等. 高效液相色谱法测定发酵乳中的维生素[J]. 中国乳品工业, 2008, 36(10): 55-57. DOI:10.3969/j.issn.1001-2230.2008.10.015.
[41] 陈能飞, 李卫华, 张书敏, 等.食用香精的制备新技术及其控释系统的开发[J]. 肉类研究, 2008, 22(5): 18-21. DOI:10.3969/j.issn.1001-8123.2008.05.007.
[42] 陆婧. 藏灵菇酸奶及酸奶粉的制作工艺优化[D]. 兰州: 甘肃农业大学, 2013.
[43] 杨晓春, 王玉堂, 霍贵成. 乳酸乳球菌 KLDS4.0325的B族维生素生物合成途径分析[J]. 食品科学, 2014, 35(7): 86-89. DOI:10.7506/spkx1002-6630-201407018.
[44] 郭抗萧, 周赛男, 曾奥, 等. 酵母菌的微生态调节作用[J]. 中国微生态学杂志, 2013, 25(1): 94-96. DOI:10.13381/j.cnki.cjm.2013.01.003.
[45] HAN X, ZHANG L W, YU P, et al. Potential of LAB starter culture isolated from Chinese traditional fermented foods for yoghurt production[J]. International Dairy Journal, 2014, 34(2): 247-251.DOI:10.1016/j.idairyj.2013.09.007.
[46] 赵欣, 李贵节. 牦牛酸乳分离乳杆菌发酵豆浆理化特性的研究[J]. 食品工业科技, 2014, 35(10): 224-227; 233. DOI:10.13386/j.issn1002-0306.2014.10.042.
[47] 陈洁, 赵建新, 陈卫, 等. 中温发酵酸乳的游离氨基酸、脂肪酸和感官特性的研究[J]. 食品与发酵工业, 2008, 34(7): 28-33. DOI:10.13995/j.cnki.11-1802/ts.2008.07.012.
