双向单因素与田口法优化屎肠球菌产谷氨酸脱羧酶培养基
2018-02-09杨胜远
杨胜远,李 云
(1.岭南师范学院化学化工学院,热带与南海资源协同创新中心,广东 湛江 524048;2.韩山师范学院生命科学与食品科技学院,广东 潮州 521041)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种具有4 个碳原子的非蛋白质组成氨基酸,为哺乳动物中枢神经系统主要的抑制性神经递质,具有利尿、降血脂、抗糖尿病、抗氧化、抗炎、抗癌、降血压和镇静作用,已成为备受关注的药品和保健品成分[1-3]。由于可以通过内酰胺化作用形成2-吡咯烷酮,再通过化学转化生成聚酰胺4,因此GABA还是生产生物塑料的重要原料[4-5]。
生物合成GABA是一种环境友好和安全的方式,主要可采用微生物发酵法[5-12]、微生物全细胞转化法[13-18]和酶催化合成法[19-22]3 种方法进行生产。但是,无论采用何种生物合成法,其实质都是利用谷氨酸脱羧酶(glutamate decarboxylase,GAD;编号为EC4.1.1.15)。依赖于磷酸吡哆醛的GAD是生物催化L-谷氨酸的α-羧基发生脱羧反应生成GABA的唯一酶[23],微生物细胞的GAD活性大小与GABA的产量密切相关。培养条件对微生物产GAD具有重要的影响,适宜的培养基不仅可以提高细胞的GAD活力,而且可以从原料的经济性和配制简捷性角度降低GABA的生产成本。
GAD广泛分布于生物活细胞中,从单细胞到哺乳动物细胞均有存在GAD的报道[24]。乳酸菌通常被认为是安全的微生物,可作为益生菌,因此在乳酸菌GAD和利用乳酸菌合成GABA方面备受关注[25]。近些年,利用屎肠球菌(Enterococcus faecium)GAD合成GABA的研究也备受青睐。Divyashri等[26]通过动力学和热力学模型对屎肠球菌分批发酵法生产GABA的条件进行了探讨,GABA的产量较优化前提高了2.9 倍;Pham等[10]模拟胃肠条件,对屎肠球菌游离细胞和海藻酸钙包埋细胞产GABA的传质特性进行了研究,海藻酸钙包埋细胞产GABA能力显著高于游离细胞;朱泉等[27]也筛选到一株GABA高产屎肠球菌菌株;李云等[15,28]对屎肠球菌的GAD酶学特性、细胞转化法制备GABA也进行了报道。然而,目前关于屎肠球菌适宜产GAD培养基尚鲜见报道。
实验比较了4 种已报道用于乳酸菌产GAD的培养基,结果屎肠球菌以蛋白胨-蔗糖-牛肉膏(peptonesucrose-beef extract,PSB)培养基产GAD活力最高,在此基础上进一步通过双向单因素和田口试验设计法作进一步优化,以期为屎肠球菌GAD的研究和生产提供更为简单、高效而经济的培养基。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与试剂
屎肠球菌(E. faecium)LNSF2为岭南师范学院绿色生物制造研究室保藏菌株,分离自泡菜。
GABA(质量分数≥99%)、异硫氰酸苯酯(phenylisothiocyanate,PITC) 美国Sigma公司;乙腈、乙酸和三乙胺(均为色谱纯) 美国TEDIA公司;其余试剂均为国产分析纯。
1.1.2 培养基
MRS培养基[29]:各成分用量分别为蛋白胨10.0 g/L、牛肉膏10.0 g/L、酵母膏5.0 g/L、葡萄糖20.0 g/L、吐温80 1.0 g/L、柠檬酸铵2.0 g/L、乙酸钠5.0 g/L、MgSO40.1 g/L、MnSO40.05 g/L、K2HPO42.0 g/L、谷氨酸一钠(monosodium glutamate,MSG)10.0 g/L。
GYP培养基[16]:各成分用量分别为葡萄糖10.0 g/L、酵母膏10.0 g/L、蛋白胨5.0 g/L、乙酸钠2.0 g/L、MgSO4·7H2O 20.0 mg/L、MnSO4·4H2O 1.0 mg/L、FeSO4·7H2O 1.0 mg/L、NaCl 1.0 mg/L、MSG 10.0 g/L。
TYG培养基[30]:各成分用量分别为胰蛋白胨5.0 g/L、酵母膏5.0 g/L、葡萄糖10.0 g/L、MSG 10.0 g/L。
PSB培养基[8]:各成分用量分别为蛋白胨15.0 g/L、牛肉膏12.5 g/L、蔗糖12.5 g/L、柠檬酸铵2.0 g/L、乙酸钠5.0 g/L、K2HPO41.03 g/L、CaCl22.12 g/L、吐温80 1.0 g/L、MSG 10.0 g/L。
培养基pH值均调节到6.8,配制100 mL于250 mL三角瓶中,121 ℃灭菌15 min。
1.2 仪器与设备
1200 Series高效液相色谱仪(配置G1354A四元梯度泵、G1316A柱温箱、G1314B可变波长紫外检测器、Chemstation工作站等) 美国Agilent公司;PSH-200生化培养箱 中科生命科技股份有限公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;VX-200旋涡混合仪美国Labnet公司;AUW120电子分析天平 日本Shimadzu公司。
1.3 方法
1.3.1 种子液的制备
从4 ℃保藏的E. faecium LNSF2斜面挑取1 环,接入PSB培养基中,37 ℃静置培养12 h,然后按1%(体积分数,下同)的接种量接入PSB培养基,于37 ℃静置培养12 h作为种子液。
1.3.2 E. faecium LNSF2发酵
将E. faecium LNSF2种子液按2%的接种量分别接入实验设计的培养基,各接种9 瓶,于37 ℃静置培养24 h,作为发酵醪。发酵结束后,按同种培养基随机分成3 组,每组3 瓶,分别将同组的发酵醪合并,每组3 个平行实验,每个平行300 mL发酵醪。
1.3.3 不同培养基对E. faecium LNSF2产GAD的影响
分别以文献报道用于研究Lactobacillus plantarum[29]、L. brevis[16]、Lactococcus lactis[30]和Streptococcus salivarius subsp. thermophilus[8]产GABA或GAD的MRS[29]、GYP[16]、TYG[30]和PSB[8]培养基进行发酵实验,比较等体积发酵醪菌体的GAD活力。发酵按照1.3.2节方法进行。
1.3.4 双向单因素试验设计
正向单因素试验培养基设计:以PSB培养基中的蛋白胨15 g/L、牛肉膏12.5 g/L和蔗糖12.5 g/L作为基础培养基,在基础培养基中分别添加CaCl22.12 g/L、K2HPO41.03 g/L、柠檬酸铵2.0 g/L、乙酸钠5.0 g/L、吐温80 1.0g/L、MSG 10.0g/L作为实验组培养基。以仅由蛋白胨、牛肉膏和蔗糖组成的基础培养基作为对照组的培养基。
反向单因素试验培养基设计:以PSB培养基为基础,分别去除配方中的CaCl2、K2HPO4、柠檬酸铵、乙酸钠、吐温80、MSG作为实验组培养基。以PSB培养基作为对照组的培养基。
培养基均调节pH 6.8,分装100 mL于250 mL三角瓶,121 ℃灭菌15 min。发酵方法按照1.3.2节进行。
1.3.5 田口试验设计
在双向单因素优化结果基础上,选择用量较大的蛋白胨、牛肉膏、蔗糖、乙酸钠和MSG为主要影响因素,以原PSB相应因素的20%为步长,采用Minitab 15软件选择田口试验设计法进行优化,田口试验设计法的因素与水平见表1。各组试验培养基中非考察因素吐温80的用量均为1.0 g/L,初始pH值为6.8,分装100 mL于250 mL三角瓶,121 ℃灭菌15 min。发酵方法按照1.3.2节进行。田口试验分析采用2 批次的重复试验结果作为响应值,选择望大法分析均值和信噪比,从而选择各因素的最优水平。
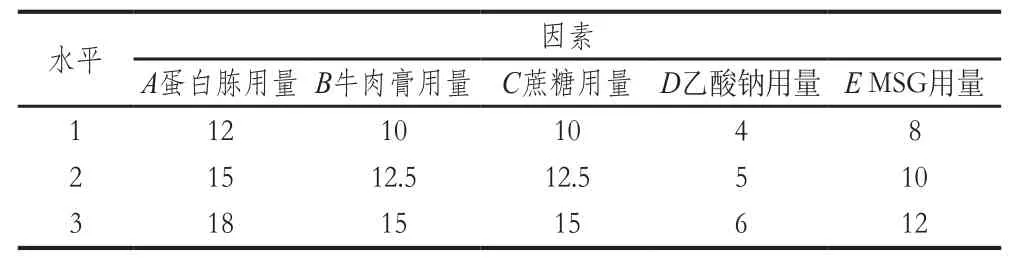
表1 田口试验设计因素与水平Table1 Level and code of independent variables used for Taguchi design g/L
1.3.6 验证实验
分别以原PSB培养基及经田口试验优化的改良PSB培养基作为培养基,按照1.3.2节的发酵方法进行发酵。比较不同培养基对屎肠球菌的产GAD能力。培养基的pH值均为6.8,装液量均为100 mL于250 mL三角瓶,灭菌条件为121 ℃灭菌15 min。
1.3.7 GAD活力测定
将300 mL发酵醪于4 ℃、8 500 r/min离心20 min,收集菌体。分别在含菌体的离心管中加入50 mL生理盐水,混匀,然后于4 ℃、8 500 r/min离心20 min,收集菌体。分别加入15 mL 0.2 mol/L乙酸-乙酸盐缓冲液(pH 4.4),冰浴中500 W超声波破碎3 min(工作5 s,间隔5 s),作为粗酶液。
取粗酶液1 mL,加入1 mL 0.2 mol/L MSG溶液(0.2 mol/L、pH 4.4乙酸-乙酸盐缓冲液),混匀后于40 ℃水浴恒温反应6 h,立即加入-20 ℃预冷的无水乙醇8 mL,混匀,取1.0 mL于4 ℃、14 000 r/min离心15 min,收集上清液作为酶反应终止液。以1 mL不含MSG的0.2 mol/L乙酸-乙酸盐缓冲液(pH 4.4)替代底物按同样操作获得的反应液作为空白对照。
将酶反应终止液经适当稀释后,采用高效液相色谱法测定GABA含量。
GAD活力单位定义为:在上述测定条件下1 h生成1 μmol GABA所需要的酶量为1 个酶活力单位(U)。以300 mL发酵醪的菌体GAD总活力作为各实验条件下产GAD的响应值。GAD总活力的计算见下式:
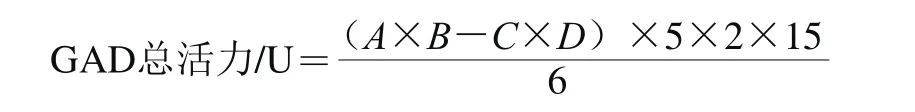
式中:A为实验组酶反应终止液GABA浓度/(μmol/mL);B为测定实验组反应终止液GABA浓度时样品的稀释倍数;C为空白组酶反应终止液GABA浓度/(μmol/mL);D为测定空白组反应终止液GABA浓度时样品的稀释倍数;5为无水乙醇终止酶反应产生的稀释倍数;2为酶反应液的总体积/mL;15为以300 mL发酵醪的菌体所制备的GAD酶液总体积/mL;6为酶反应时间/h。
1.3.8 GAD反应终止液GABA测定
1.3.8.1 色谱条件
参照文献[31],略有改变。色谱柱:ZORBAX Eclipse XDB C18(4.6 mm×250 mm,5 μm);检测波长254 nm;进样量20 μL,柱温25 ℃。采用流动相A与流动相B体积比80∶20,以0.6 mL/min线性等梯度洗脱。流动相A:称取8.205 g乙酸钠,溶于900 mL超纯水,加入三乙胺0.5 mL、乙酸0.7 mL和乙腈 5.0 mL,调节至pH 5.8,定容至1 000 mL。流动相B:60%乙腈溶液。
1.3.8.2 衍生化方法
衍生化方法参照文献[32],略作改进。取100 μL标准溶液或GAD反应终止液注入1.5 mL的锥形离心管,加入50 μL乙腈-水-三乙胺-PITC(7∶1∶1∶1,V/V),混匀,室温下放置1 h 后,加入150 μL流动相A-流动相B(80∶20,V/V),旋涡混合器振荡1 min,然后加入600 μL正己烷,旋涡混合器振荡1 min,静置10 min。用注射器吸取下层溶液,经0.22 μm滤膜过滤备测。
1.4 数据分析
双向单因素试验结果采用IBM SPSS Statistics 19.0软件以独立样本t检验进行统计分析,田口试验结果采用Minitab 15软件选择田口试验设计法分析工具进行分析。
2 结果与分析
2.1 不同培养基对E. faecium LNSF2产GAD的影响
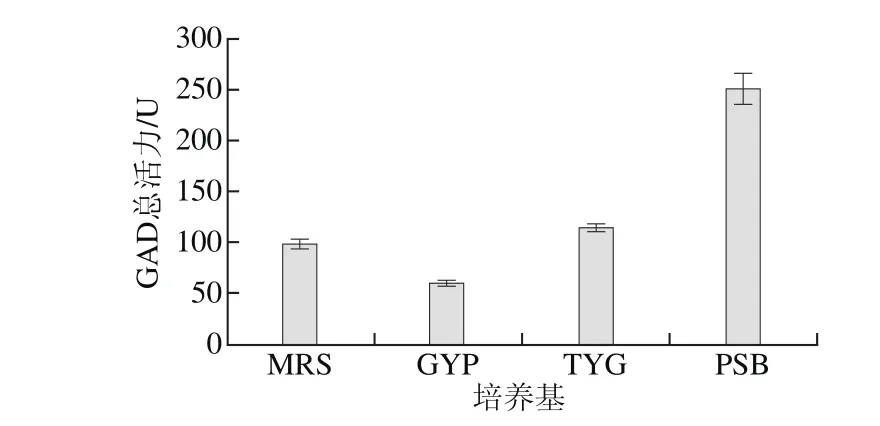
图1 不同培养基对E. faecium LNSF2产GAD的影响Fig. 1 Effect of different media on GAD production
从图1可知,PSB培养基最有利于E. faecium LNSF2产GAD,总活力为(249.96±14.54)U。经t检验,E. faecium LNSF2在MRS、GYP和TYG培养基中产GAD活力与其在PSB培养基中产GAD活力差异极显著(P<0.01),因此选择PSB培养基作为E. faecium LNSF2的产酶培养基进行优化。
2.2 双向单因素试验结果
2.2.1 CaCl2对E. faecium LNSF2产GAD的影响
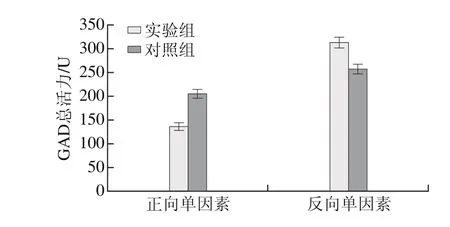
图2 CaCl2对E. faecium LNSF2产GAD的影响Fig. 2 Effect of CaCl2 on GAD production
由图2可知,在正向单因素试验中,添加CaCl2实验组的GAD总活力为(135.48±8.52)U,低于对照组的GAD总活力(203.52±9.34)U,经t检验分析,实验组与对照组差异极显著(P<0.01),说明CaCl2对E. faecium LNSF2产GAD不利。在反向单因素试验中,去除CaCl2实验组的GAD总活力为(311.98±11.43)U,高于对照组的GAD总活力(257.64±10.48)U,实验组与对照组差异极显著(P<0.01),结果也表明CaCl2对E. faecium LNSF2产GAD不利。因此,综合正向和反向单因素试验结果,选择不添加CaCl2。
2.2.2 K2HPO4对E. faecium LNSF2产GAD的影响
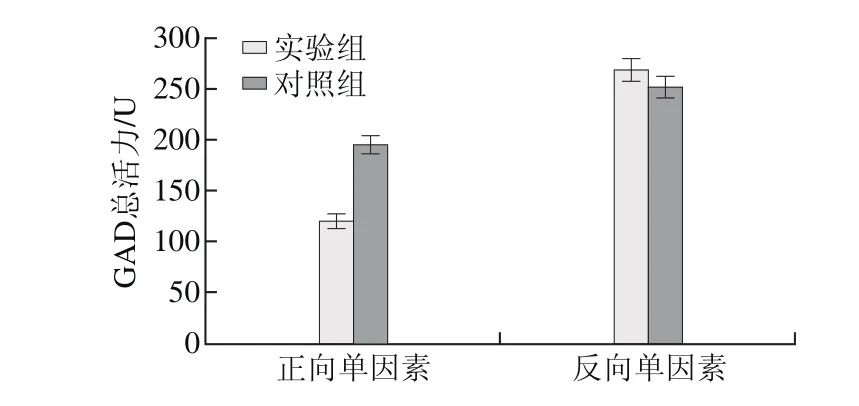
图3 K2HPO4对E. faecium LNSF2产GAD的影响Fig. 3 Effect of K2HPO4 on GAD production
由图3可知,添加K2HPO4实验组的GAD总活力为(119.67±6.82)U,低于对照组的GAD总活力(195.71±8.63)U,经t检验分析,实验组与对照组差异极显著(P<0.01),说明K2HPO4对E. faecium LNSF2产GAD不利。虽然实验组去除K2HPO4后,GAD总活力为(268.09±10.38)U,略高于对照组的GAD总活力(251.83±11.31)U,但是t检验表明实验组与对照组无显著性差异(P>0.05),结果表明K2HPO4对E. faecium LNSF2产GAD影响不大。
从结果分析可见,正反两向的单因素试验结果并不显著。由于反向单因素试验中,培养基组分多,实验组和对照组的培养基中均存在CaCl2,K2HPO4容易同CaCl2形成磷酸盐沉淀,从而减弱了对照组中K2HPO4对E. faecium LNSF2产GAD的不利影响;而且实验组去除K2HPO4后,CaCl2无法再通过形成磷酸盐沉淀而消除,从而造成CaCl2对E. faecium LNSF2产GAD的影响作用增强。
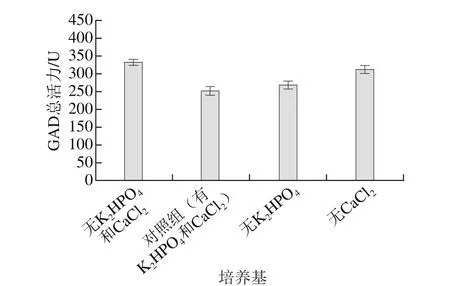
图4 K2HPO4和CaCl2对E. faecium LNSF2产GAD的综合影响Fig. 4 Combined impact of K2HPO4 and CaCl2 on GAD production
为了验证上述分析的正确性,参照反向单因素试验设计思路,同时去除PSB培养基的CaCl2和K2HPO4进行进一步实验,由图4可知,实验组GAD总活力为(332.17±8.13)U,较对照组、只含K2HPO4和CaCl2之一实验组的GAD总活力均显著提高(P<0.05)。因此考虑CaCl2与K2HPO4的关系,采信正向单因素试验的结果,选择不添加K2HPO4。
2.2.3 柠檬酸铵对E. faecium LNSF2产GAD的影响
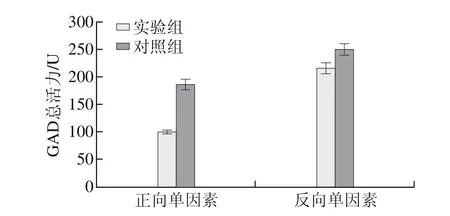
图5 柠檬酸铵对E. faecium LNSF2产GAD的影响Fig. 5 Effect of ammonium citrate on GAD production
由图5可知,添加柠檬酸铵实验组GAD总活力为(101.42±3.18)U,低于对照组GAD总活力(186.55±10.12)U,经t检验分析,实验组与对照组差异极显著(P<0.01),说明柠檬酸铵对E. faecium LNSF2产GAD不利。然而,反向单因素试验结果却显示,去除PSB培养基的柠檬酸铵后,GAD总活力只有(215.94±10.38)U,低于含有柠檬酸铵对照组(249.72±10.33)U(P<0.05),与正向单因素试验结果矛盾。
上述结果表明CaCl2对E. faecium LNSF2产GAD不利,在原PSB培养基的配方中同时存在着柠檬酸铵和CaCl2,由于柠檬酸酸根对金属离子具有一定的螯合作用,可能柠檬酸铵与Ca2+形成螯合物,从而可减小柠檬酸铵和CaCl2对E. faecium LNSF2产GAD不利影响;去除柠檬酸铵后,造成CaCl2的负面作用突显,从而造成E. faecium LNSF2产GAD能力下降。在正向单因素试验中,培养基不存在CaCl2的影响,柠檬酸铵对E. faecium LNSF2产GAD的影响更直接,结果更可信,因此采信正向单因素试验结果,选择不添加柠檬酸铵。
2.2.4 乙酸钠对E. faecium LNSF2产GAD的影响
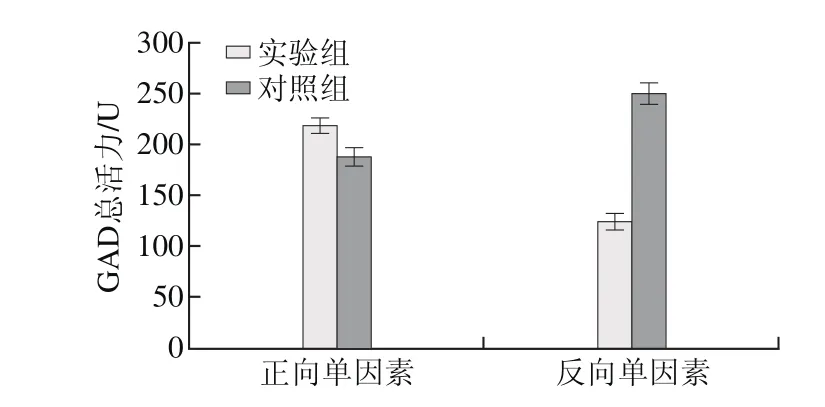
图6 乙酸钠对E. faecium LNSF2产GAD的影响Fig. 6 Effect of sodium acetate on GAD production
由图6可知,在正向单因素试验结果中,添加乙酸钠实验组的GAD总活力为(218.78±7.91)U,高于对照组的GAD总活力(186.55±10.12)U,实验组与对照组有显著性差异(P<0.05);在反向单因素试验结果中,去除乙酸钠实验组的GAD总活力为(124.51±6.84)U,低于对照组的GAD总活力(249.72±10.33)U,实验组与对照组差异极显著(P<0.01)。正反双向的单因素结果均表明培养基中添加乙酸钠更有利于E. faecium LNSF2产GAD,因此选择添加乙酸钠。
2.2.5 吐温80对E. faecium LNSF2产GAD的影响
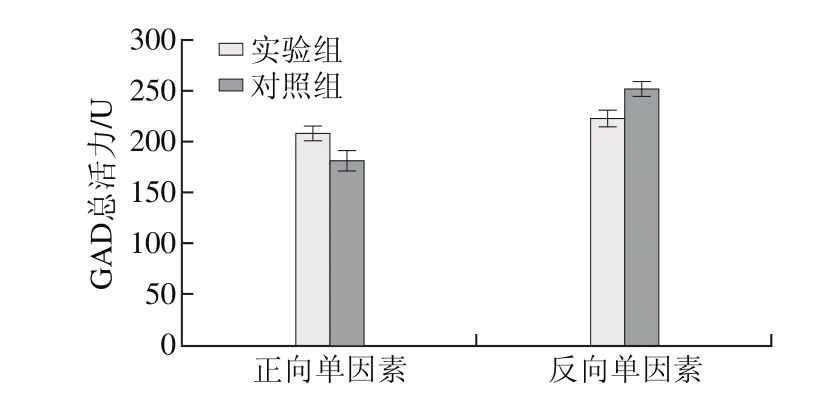
图7 吐温80对E. faecium LNSF2产GAD的影响Fig. 7 Effect of Tween 80 on GAD production
由图7可知,在正向单因素试验结果中,添加吐温80实验组GAD总活力为(208.52±7.63)U,高于对照组GAD总活力(181.46±9.71)U,实验组与对照组差异显著(P<0.05);在反向单因素试验结果中,去除吐温80实验组GAD总活力为(223.26±8.22)U,低于对照组GAD总活力(251.37±7.86)U,实验组与对照组差异显著(P<0.05)。正反双向的单因素试验结果均表明培养基中添加吐温80更有利于E. faecium LNSF2产GAD,因此选择添加吐温80。
2.2.6 MSG对E. faecium LNSF2产GAD的影响
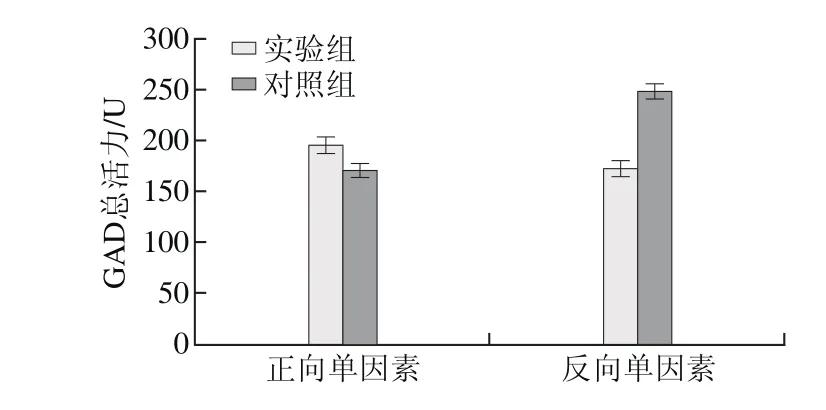
图8 MSG对E. faecium LNSF2产GAD的影响Fig. 8 Effect of MSG on GAD production
由图8可知,在正向单因素试验结果中,添加MSG实验组GAD总活力为(196.77±8.14)U,显著高于对照组GAD总活力(171.12±6.68)U(P<0.05);在反向单因素试验中,去除MSG实验组GAD总活力为(173.22±6.58)U,显著低于对照组GAD总活力(247.36±8.35)U(P<0.01)。结果表明培养基中添加MSG有利于E. faecium LNSF2产GAD,因此选择添加MSG。
2.3 田口试验结果
田口试验设计及结果如表2所示。采用田口分析的望大法对各因素水平的均值情况和信噪比情况进行分析,结果显示各因素的均值残差(图9)和信噪比残差(图10)与模型拟合性较好,符合正态分布。
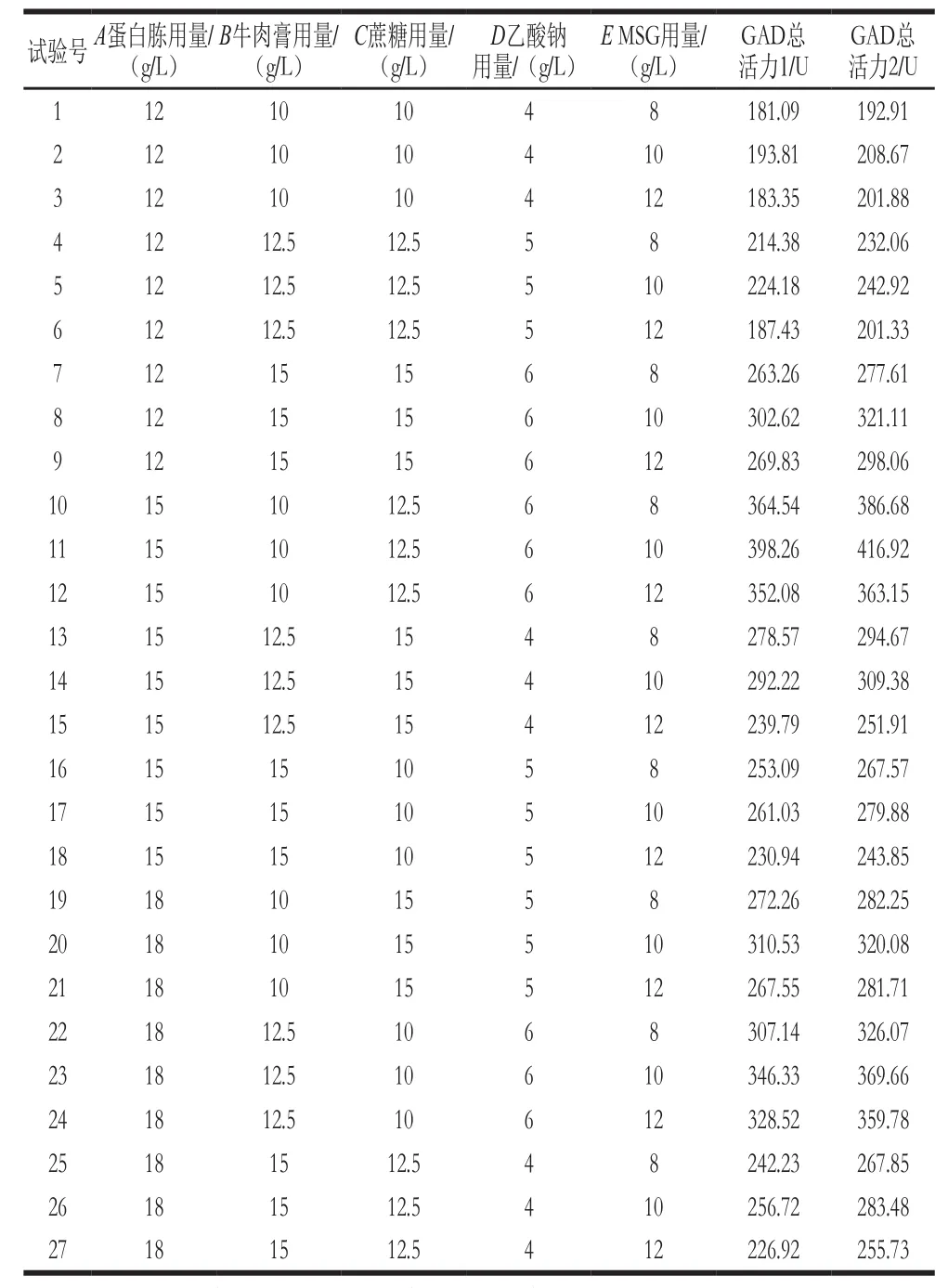
表2 田口试验设计及结果Table2 Taguchi design matrix with experimental values of GAD activity
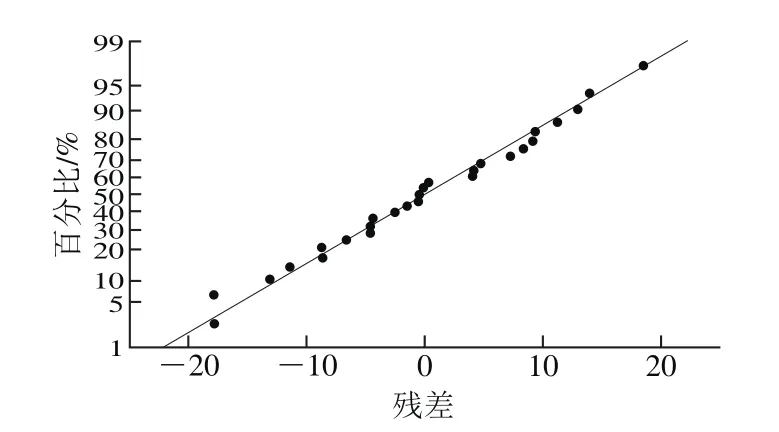
图9 均值残差正态概率图Fig. 9 Normal probability pot for mean residual
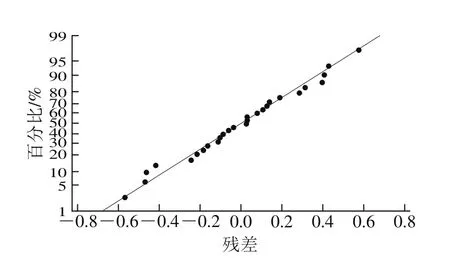
图10 信噪比残差正态概率图Fig. 10 Normal probability pot for residual of signal-to-noise ratio
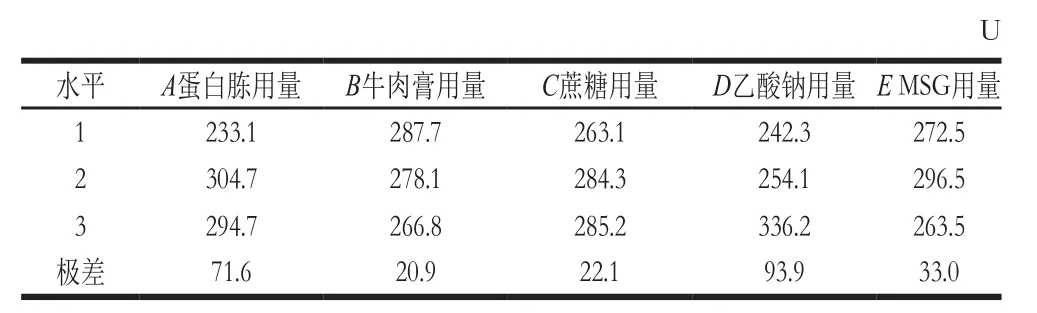
表3 所选因素水平的均值响应Table3 Mean response of factors
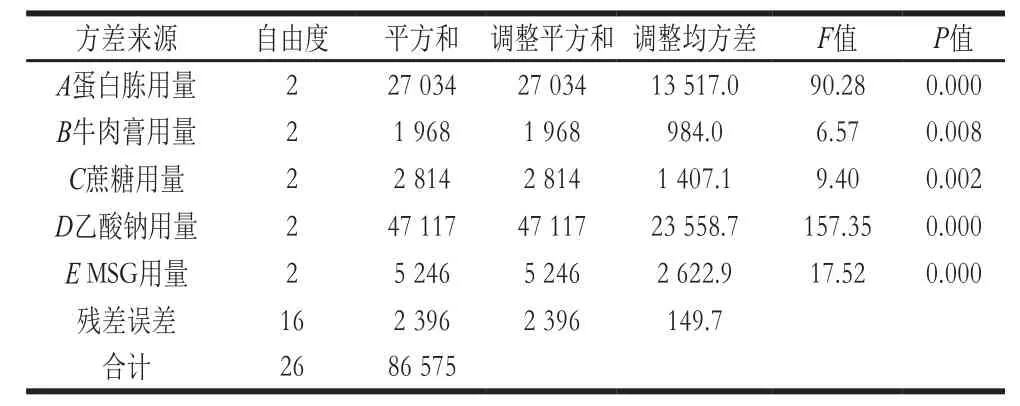
表4 均值方差分析Table4 Analysis of variance of mean values
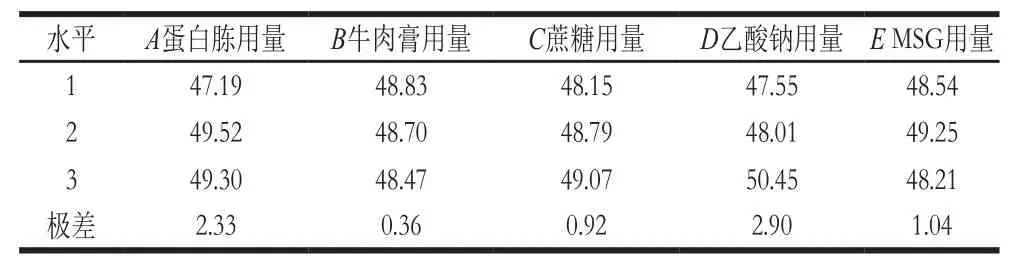
表5 所选因素水平的信噪比响应Table5 Signal-to-noise ratio response of factors
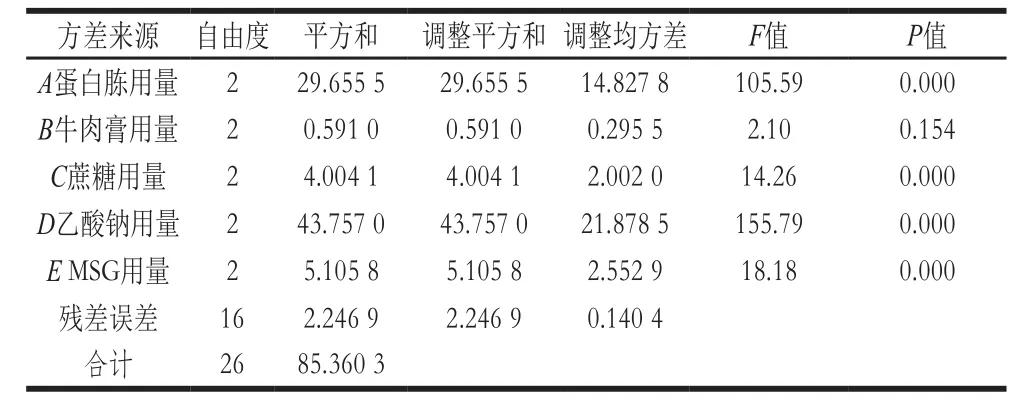
表6 信噪比方差分析Table6 Analysis of variance of signal-to-noise ratio
由表3可知,各因素的均值响应情况为D>A>E>C>B;由表4可知,A、B、C、D、E均为极显著因素(P<0.01)。由表5可知,各因素信噪比响应情况也为D>A>E>C>B;从表6可知,A、C、D和E为极显著因素(P<0.01),B为不显著因素(P>0.10)。
因此,综合考虑影响均值和信噪比的显著性因素,确定A、C、D和E为位置因素,B为散度因素。首先根据图11选择位置因素的水平使均值最大,即A2C2D3E2,再根据图12选择非位置因素的散度因素B的第1水平,使散度最小化,即B1,最终得出最优培养基的组合为A2B1C2D3E2,与非考察因素吐温80(1.0 g/L)即可得出优化后的PSB培养基(称为改良PSB培养基)组成为蛋白胨15 g/L、牛肉膏10 g/L、蔗糖 12.5 g/L、乙酸钠6.0 g/L、MSG 10 g/L、吐温80 1.0 g/L。
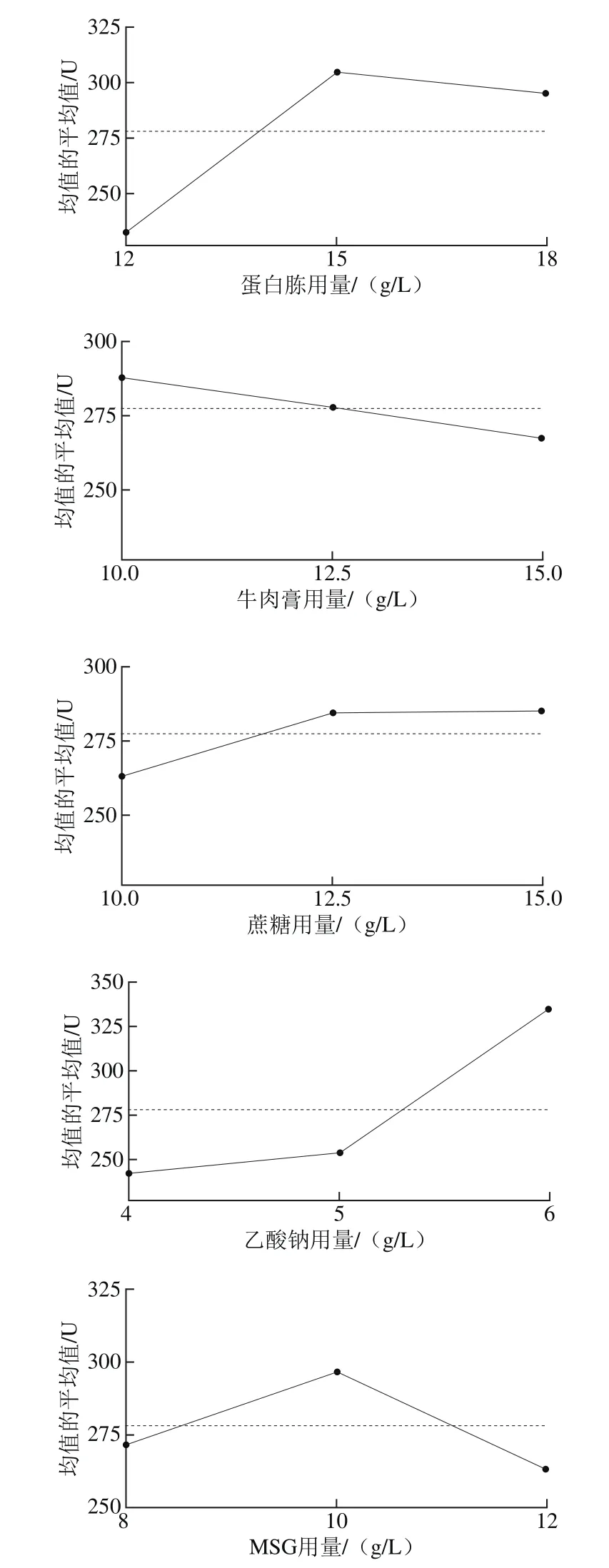
图11 均值主效应图Fig. 11 Main effect of mean values
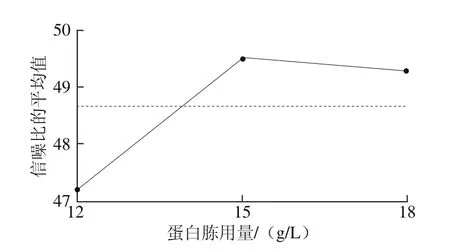
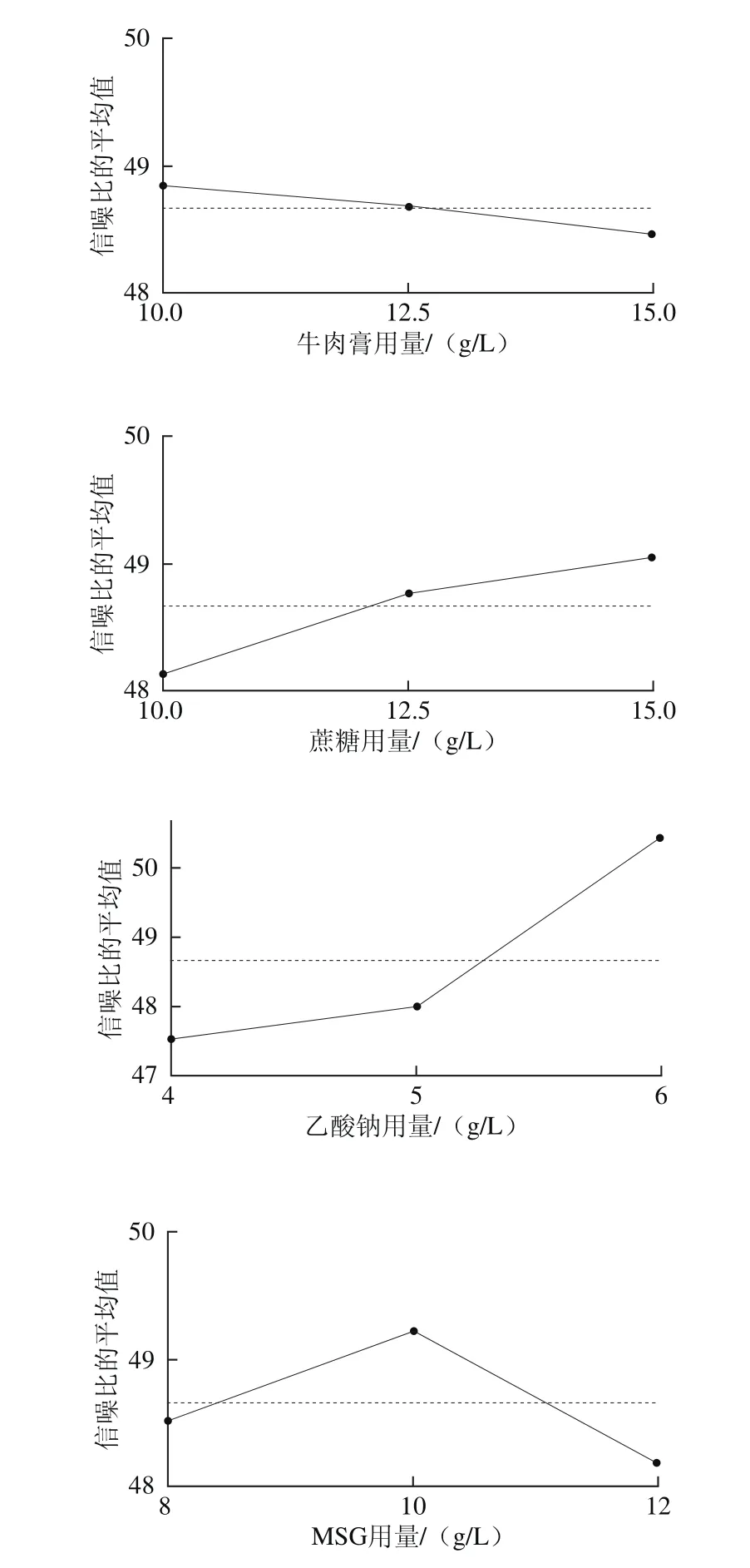
图12 信噪比主效应图Fig. 12 Main effect of signal-to-noise ratio
2.4 验证性实验结果
将优化的主要因素的最优水平A2B1C2D3E2采用软件中的“预测田口结果”功能进行预测,预测结果GAD总活力均值为399.30 U,标准差为12.51 U。
以经田口优化的改良PSB培养基作为发酵培养基,进行验证性实验,结果GAD总活力为(384.26±10.32)U,与预测值接近。经t检验,验证实验结果与预测值没有显著性差异(P>0.05)。
当以原PSB培养基进行发酵时,GAD总活力仅为(263.71±9.37)U。采用优化后的改良PSB培养基发酵制备的GAD总活力较优化前的PSB培养基提高了45.71%。从表7可知,改良PSB培养基的组分显著减少,成本更低,配制更简捷。

表7 优化前后PSB的配方Table7 PSB medium components before and after optimization
3 讨 论
单因素试验法可针对性地考察某一因素的作用,已经广泛应用于各种因素筛选的研究中。然而,由于传统单因素试验设计是在基础条件上单向增加或减少某一因素,未考虑因素间的交互作用,容易产生因改变某一因素而致使与之存在交互作用的另一因素的作用凸显,从而导致误判。这种情况在多因素共存的研究中尤为普遍。在多因素共存的情况下,各因素功能不同,可能是有利的或有害作用,而有的因素则本身的作用既无益也无害,但可能与其他因素发生作用而表现出有益或有害的影响。在多因素共存的系统中,甚至可能存在有害因素之间发生多种形式的相互作用,从而产生有益的表观现象或表观参数。例如,本实验中CaCl2和K2HPO4对屎肠球菌LNSF2产GAD都是不利的,但是二者却可发生反应形成磷酸盐沉淀,从而减弱彼此的有害作用。如果试验只是考察单一方向上的增加或去除CaCl2或K2HPO4,则会因改变了原有交互作用而产生误判。
乳酸菌GAD与细胞生长的耐酸机制有关,可在酸性条件下诱导合成[33]。屎肠球菌是一种乳酸菌,在其生长代谢过程中因产酸而造成培养基pH值下降,从而对其生长和GAD的诱导合成产生影响。乙酸-乙酸钠缓冲液在pH 3.6~5.8范围内具有较好的缓冲能力,乙酸钠在培养基中可以起到缓冲盐的作用,能在更长时间内维持培养基的偏酸性环境,对菌体生长和GAD合成更为有利。吐温80是一种表面活性剂,能起到乳化剂作用,可增加培养基的均匀性和细胞膜的通透性,促进细胞生长。GAD是一种诱导酶,杨胜远等[34]在唾液链球菌嗜热亚种Y-2产GAD影响因素的研究表明,添加MSG对GAD的合成并没有明显的诱导作用,而本研究结果表明添加MSG有利于屎肠球菌产GAD。由此可见,培养基中添加MSG对唾液链球菌嗜热亚种和屎肠球菌产GAD的影响不同,其原因可能是:1)培养基中的蛋白胨和牛肉膏中存在L-谷氨酸,不同微生物对蛋白胨和牛肉膏的水解活性、蛋白酶的作用位点以及细胞对水解形成的L-谷氨酸利用情况不一致,从而导致起诱导作用的游离L-谷氨酸在培养基中的浓度存在差异,因而诱导能力存在差异;2)不同微生物合成GAD的底物诱导作用与底物浓度有一定相关性。具体诱导机制尚待进一步研究。上述分析表明,乙酸钠、吐温80和MSG对屎肠球菌产GAD是有利的,这在本研究的双向单因素试验中也得到了证实,理论分析与实验结果相符。
杨胜远等[35]在解淀粉芽孢杆菌抗菌物质发酵培养基的优化中设计了双向单因素试验法,在判断MgSO4对解淀粉芽孢杆菌产抗菌物质作用方面起到了至关重要的作用。本实验采用双向单因素试验设计法,也成功突破了CaCl2、K2HPO4和柠檬酸铵组分因交互作用而产生的假象。本实验再次表明,虽然双向单因素试验法会增加实验组数,增加工作量,但实验结果能够起到相互验证的作用,更有利于对因素作用作出正确判断,是一种非常有效的因素筛选方法。
田口法是田口玄一于20世纪50年代初在费歇尔多元配制法试验设计的基础上开发的正交试验技术,研究表明该方法高效、稳健[36-38]。本实验采用双向单因素试验法结合田口法,在PSB培养基的基础上对屎肠球菌产GAD培养基进行了优化,结果表明培养基组分减少而GAD总活力显著提高,说明采用的试验设计方法合理、可靠。
[1] SCHULLER H M, AL-WADEI H A, MAJIDI M. Gammaaminobutyric acid, a potential tumor suppressor for small airwayderived lung adenocarcinoma[J]. Carcinogenesis, 2008, 29(10): 1979-1985.DOI:10.1093/carcin/bgn041.
[2] DHAKAL R, BAJPAI V K, BAEK K H. Production of gaba(γ-aminobutyric acid) by microorganisms: a review[J]. Brazilian Journal of Microbiology, 2012, 43(4): 1230-1241. DOI:10.1590/S1517-83822012000400001.
[3] 杨胜远, 陆兆新, 吕凤霞, 等. γ-氨基丁酸的生理功能和研究开发进展[J]. 食品科学, 2005, 26(9): 546-551. DOI:10.3321/j.issn:1002-6630.2005.09.149.
[4] KAWASAKI N, NAKAYAMA A, YAMANO N, et al. Synthesis,thermal and mechanical properties and biodegradation of branched polyamide 4[J]. Polymer, 2005, 46(33): 9987-9993. DOI:10.1016/j.polymer.2005.06.092.
[5] PARK S J, KIM E Y, NOH W, et al. Synthesis of nylon 4 from gammaaminobutyrate (GABA) produced by recombinant Escherichia coli[J]. Bioprocess and Biosystems Engineering, 2013, 36(7): 885-892.DOI:10.1007/s00449-012-0821-2.
[6] JORGE J M P, LEGGEWIE C, WENDISCH V F. A new metabolic route for the production of gamma-aminobutyric acid by Corynebacterium glutamicum from glucose[J]. Amino Acids, 2016,48(11): 2519-2531. DOI:10.1007/s00726-016-2272-6.
[7] LI H, QIU T, HUANG G, et al. Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation[J]. Microbial Cell Factories, 2010, 9(10): 85-92. DOI:10.1186/1475-2859-9-85.
[8] YANG S Y, LÜ F X, LU Z X, et al. Production of γ-aminobutyric acid by Streptococcus salivarius subsp. thermophilus Y2 under submerged fermentation[J]. Amino Acids, 2008, 34(3): 473-478. DOI:10.1007/s00726-007-0544-x.
[9] DIVYASHRI G, PRAPULLA S G. An insight into kinetics and thermodynamics of gamma-aminobutyric acid production by Enterococcus faecium CFR 3003 in batch fermentation[J]. Annals of Microbiology, 2015, 65(2): 1109-1118. DOI:10.1007/s13213-014-0957-1.
[10] PHAM V D, LEE S H, PARK S J, et al. Production of gammaaminobutyric acid from glucose by introduction of synthetic scaffolds between isocitrate dehydrogenase, glutamate synthase and glutamate decarboxylase in recombinant Escherichia coli[J]. Journal of Biotechnology, 2015, 207: 52-57. DOI:10.1016/j.jbiotec.2015.04.028.
[11] CHOI J W, YIM S S, LEE S H, et al. Enhanced production of gammaaminobutyrate (GABA) in recombinant Corynebacterium glutamicum by expressing glutamate decarboxylase active in expanded pH range[J].Microbial Cell Factories, 2015, 14(1): 21-32. DOI:10.1186/s12934-015-0205-9.
[12] SHI F, JIANG J, LI Y, et al. Enhancement of gamma-aminobutyric acid production in recombinant Corynebacterium glutamicum by coexpressing two glutamate decarboxylase genes from Lactobacillus brevis[J]. Journal of Industrial Microbiology, 2013, 40(11): 1285-1296.DOI:10.1007/s10295-013-1316-0.
[13] 杨胜远, 陆兆新, 吕凤霞, 等. 唾液链球菌嗜热亚种Y-2细胞转化法制备γ-氨基丁酸[J]. 食品科学, 2011, 32(1): 162-167.
[14] 李云, 杨胜远, 陈郁娜, 等. 戊糖片球菌HS2细胞制备γ-氨基丁酸的研究[J]. 湖北农业科学, 2010, 49(6): 1450-1453. DOI:10.14088/j.cnki.issn0439-8114.2010.06.010.
[15] 李云, 杨胜远, 陈郁娜, 等. 屎肠球菌HS3细胞转化法生物合成γ-氨基丁酸的研究[J]. 广东农业科学, 2010, 37(6): 12-14. DOI:10.16768/j.issn.1004-874x.2010.06.025.
[16] CHOI S I, LEE J W, PARK S M, et al. Improvement of gammaaminobutyric acid (GABA) production using cell entrapment of Lactobacillus brevis GABA 057[J]. Journal of Microbiology and Biotechnology, 2006, 16(4): 562-568.
[17] PLOKHOV A Y, GUSYATINER M M, YAMPOLSKAYA T A, et al.Preparation of γ-aminobutyric acid using E. coli cells with high activity of glutamate decarboxylase[J]. Applied Biochemistry and Biotechnology,2000, 88: 257-265.
[18] KE C, YANG X, RAO H, et al. Whole cell conversion of L-glutamic acid into gamma aminobutyric acid by metabolically engineered Escherichia coli[J]. Springer Plus, 2016, 5: 591-598. DOI:10.1186/s40064-016-2217-2.
[19] DINH T H, HO N A T, KANG T J, et al. Salt-free production of γ-aminobutyric acid from glutamate using glutamate decarboxylase separated from Escherichia coli[J]. Journal of Chemical Technology and Biotechnology, 2014, 89: 1432-1436. DOI:10.1002/jctb.4251.
[20] KANG T J, HO N A, PACK S P. Buffer-free production of gammaaminobutyric acid using an engineered glutamate decarboxylase from Escherichia coli[J]. Enzyme & Microbial Technology, 2013, 53(3): 200-205.
[21] LAMMENS T M, DE BIASE D, FRANSSEN M C R, et al. The application of glutamic acid α-decarboxylase for the valorization of glutamic acid[J]. Green Chemistry, 2009, 11(10): 1562-1567.
[22] 焦阳, 汪建敏, 杨胜远, 等. 固定化唾液链球菌生产γ-氨基丁酸的研究[J]. 核农学报, 2009, 23(6): 1026-1031.
[23] TAKAHASHI C, SHIRAKAWA J, TSUCHIDATE T, et al.Robust production of gamma-amino butyric acid using recombinant Corynebacterium glutamicum expressing glutamate decarboxylase from Escherichia coli[J]. Enzyme & Microbial Technology, 2012, 51(3): 171-176. DOI:10.1016/j.enzmictec.2012.05.010.
[24] MATSUKAWA S, UENO H. Analysis of intron-exon positioning on glutamate decarboxylase and its relation with evolution[J]. Journal of Biological Macromolecules, 2007, 7(3): 35-48.
[25] GREWAL J, KHARE S K. 2-Pyrrolidone synthesis from γ-aminobutyric acid produced by Lactobacillus brevis under solid-state fermentation utilizing toxic deoiled cottonseed cake[J]. Bioprocess & Biosystems Engineering, 2017, 40(1): 145-152. DOI:10.1007/s00449-016-1683-9.
[26] DIVYASHRI G, PRAPULLA S G. Mass transfer characterization of gamma-aminobutyric acid production by Enterococcus faecium CFR 3003: encapsulation improves its survival under simulated gastrointestinal conditions[J]. Bioprocess & Biosystems Engineering, 2015,38(3): 569-574. DOI:10.1007/s00449-014-1296-0.
[27] 朱泉, 程金龙, 朱元召, 等. 产γ-氨基丁酸屎肠球菌的筛选及γ-氨基丁酸的定量[J]. 动物营养学报, 2016, 28(8): 2504-2511. DOI:10.3969/j.issn.1006-267x.2016.08.022.
[28] 李云, 杨胜远, 杨韵晴, 等. 产γ-氨基丁酸屎肠球菌的鉴定及其谷氨酸脱羧酶酶学性质[J]. 生物技术, 2010, 20(1): 27-30. DOI:10.16519/j.cnki.1004-311x.2010.01.006.
[29] RATANABUREE A, KANTACHOYE D, CHARERNJIRATRAKUL W, et al. Enhancement of GABA in a fermented red seaweed beverage by starter culture Lactobacillus plantarum DW12[J]. Electronic Journal of Biotechnology, 2011, 14(3): 1-14. DOI:10.2225/vol14-issue3-fulltext-2.
[30] NOMURA M, NAKAJIMA I, FUJITA Y, et al. Lactococcus lactis contains only one glutamate decarboxylase gene[J]. Microbiology, 1999,145(6): 1375-1380. DOI:10.1021/jp045667c.
[31] ROSSETTI V, LOMBARD A. Determination of glutamate decarboxylase by high-performance liquid chromatography[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1996, 681(1):63-67. DOI:10.1016/0378-4347(96)88202-8.
[32] 杨菁, 孙黎光, 白秀珍, 等. 异硫氰酸苯酯柱前衍生化反相高效液相色谱法同时测定18 种氨基酸[J]. 色谱, 2002, 20(4): 269-371.DOI:10.3321/j.issn:1000-8713.2002.04.022.
[33] CHRISTENSEN J E, DUDLEY E G, PEDERSEN J A, et al.Peptidases and amino acid catabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1999, 76: 217-246.
[34] 杨胜远, 陆兆新, 余勃, 等. 唾液链球菌嗜热亚种Y-2产谷氨酸脱羧酶的影响因子确立[J]. 食品科学, 2008, 29(12): 457-464.
[35] 杨胜远, 韦锦, 郑燮茹. 解淀粉芽孢杆菌抗菌物质发酵培养基的优化[J]. 食品科学, 2015, 36(11): 150-156. DOI:10.7506/spkx1002-6630-201511029.
[36] 曾凤章, 赵霞. 田口方法及其标准化设计[J]. 机械工业标准化与质量, 2003(11): 7-9.
[37] TENG Y, XU Y. Culture condition improvement for whole cell lipase production in submerged fermentation by Rhizopus chinensis using statistical method[J]. Bioresource Technology, 2008, 99(9): 3900-3907.
[38] 赵玉萍, 徐岩, 朱春. 田口设计优化耶氏酵母生产γ-癸内酯[J].食品工业科技, 2012, 33(22): 326-330. DOI:10.13386/j.issn1002-0306.2012.22.080.
