胡柚汁益生菌发酵挥发性风味特征
2018-02-09束文秀吴祖芳刘连亮翁佩芳
束文秀,吴祖芳*,刘连亮,翁佩芳
(宁波大学海洋学院,应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
1 材料与方法
1.1 材料与试剂
胡柚、白砂糖 市售;MRS固体培养基、MRS液体培养基 杭州微生物试剂有限公司;植物乳杆菌L1(Lactobacillus plantarum L1,Lp L1)、发酵乳杆菌L2(L. fermentum L2,Lf L2)由宁波大学海洋学院食品生物技术实验室保存。
1.2 仪器与设备
MX-GX1011搅拌机 厦门建松电器有限公司;5417R高速冷冻离心机 德国Eppendorf公司;QP-2010 Plus GC-MS联用仪 日本岛津公司;SPME装置、二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取纤维头 美国Supelco公司;微量进样器(10 μL)美国安捷伦公司;GC-O嗅探器 荷兰ATAS&GL公司。
1.3 方法
1.3.1 样品的处理
挑选新鲜无虫害的胡柚并清洗表面杂质,90 ℃水中煮10 min,再将煮过的胡柚去皮,去囊衣,去籽,得胡柚果肉,加水榨汁,经过滤获得胡柚汁;向胡柚汁中添加白砂糖搅拌均匀,90 ℃灭菌15 min,冷却至25 ℃;将不同乳酸菌发酵菌剂按3%接种后发酵,37 ℃发酵36 h;然后置于8 ℃冰箱中静置12 h进行后熟,得到样品。样品分别为对照组(未接菌)、发酵组1(Lp L1)、发酵组2(Lf L2)、发酵组3(Lp L1∶Lf L2=1∶1)。
1.3.2 HS-SPME测定
将50/30 μm DVB/CAR/PDMS萃取头在GC进样口老化,老化温度为270 ℃,载气体积流量为1.2 mL/min,老化时间为1 h。准确移取10 mL样品于25 mL螺口进样瓶中,加入3.6 g NaCl,促进香气成分的挥发,用聚四氟乙烯隔垫密封,于水浴锅中平衡,平衡温度为40 ℃,平衡时间为15 min。平衡后将SPME萃取头通过隔垫插入进样瓶,插入深度为1 cm,推出纤维头,使纤维头置于样品瓶顶空进行吸附,吸附时间为40 min,随后取出萃取头,并立即将萃取头插入GC仪的进样口,插入深度为2 cm,推出纤维头,解吸5 min,同时启动仪器收集数据。
1.3.3 GC-MS联用分析
GC条件:HP-5(5% diphenyl-95% dimethlpolysiloxane)弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);He流量为1.2 mL/min;无分流进样;进样口温度250 ℃;升温程序:起始柱温40 ℃,保持3 min,以3 ℃/min的速率升到160 ℃,保持2 min,然后以8 ℃/min的速率升至220 ℃,保持3 min[27]。
MS条件:电子电离源;电子能量70 eV;灯丝发热电流0.25 mA;电子倍增器电压1 000 V;离子源温度230 ℃;接口温度280 ℃;质量扫描范围35~350 u。
1.3.4 电子鼻测定条件
徐天水今年六十多岁,是大徐庄老住户。老两口就一闺女,十几年前到苏州打工,谈个外县小伙子,徐天水死活不同意,谁知闺女更倔,硬是跟人跑了,让徐天水在庄上挺丢人。老伴儿本来就是病病歪歪的,这下气得更是成了药罐子。
量取2 mL胡柚汁样品于10 mL样品瓶中,并加入用保鲜膜密封,静置10 min后测量。采用顶空抽样的方法用电子鼻进行检测,检测时间250 s,传感器清洗时间200 s,电子鼻传感器及其性能见表1。用稳定状态下的信号进行分析,取70 s的信号作为电子鼻分析的时间点。每个样品重复5 次。
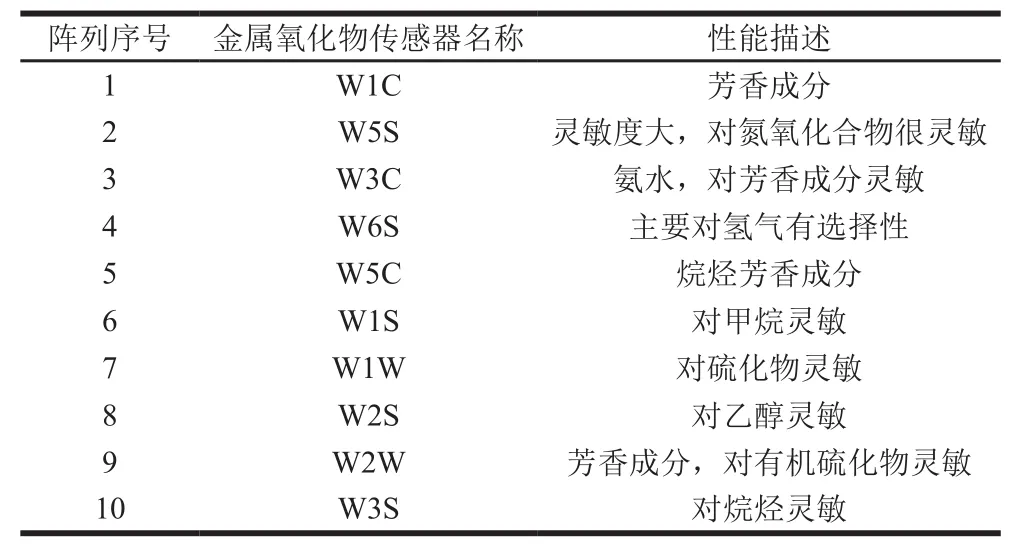
表1 电子鼻对不同物质的响应类型Table1 Chemical sensors used in electronic nose corresponding to different types of volatile substances
1.4 数据统计
定性方法:挥发性风味物质成分实验数据处理由GC-MS分析软件系统完成,通过计算机谱库(NIST/STEROL/Wiley)进行化合物的质谱鉴定,再结合文献进行人工谱图解析,检测出挥发性成分匹配度大于85(最大值为100)的化合物,确定挥发性风味物质的各个化学组成。定量方法:按峰面积归一化进行相对定量,计算挥发性风味物质的相对含量。利用SPSS 19.0对挥发性风味物质数据进行主成分分析。电子鼻的数据利用PEN3内部Win Muster软件进行线性判别分析(linear discriminant analysis,LDA)。
2 结果与分析
2.1 乳酸菌发酵胡柚汁色谱分析与风味种类分析
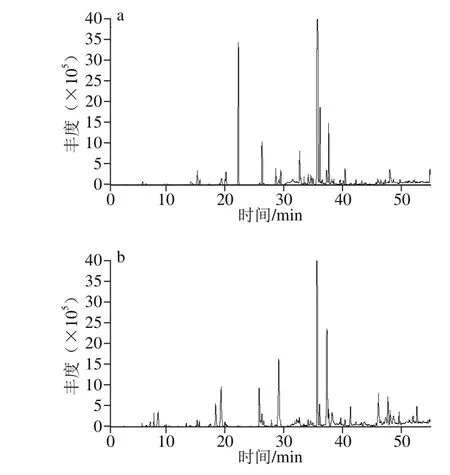
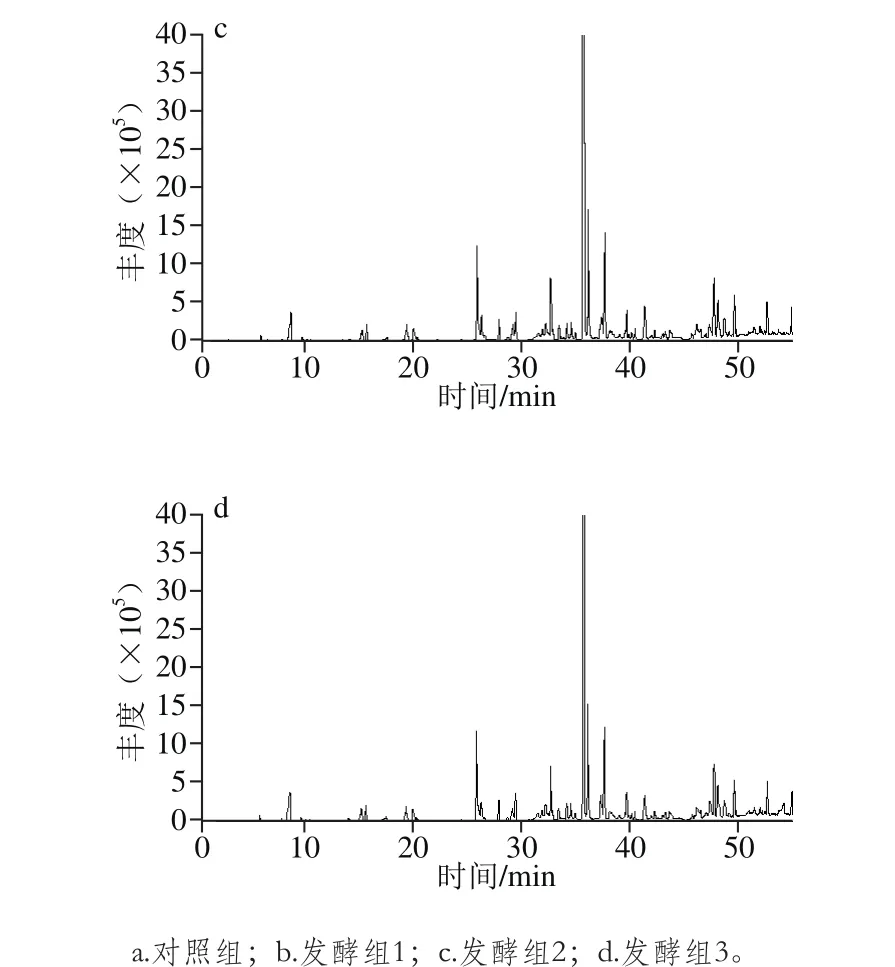
图1 不同胡柚汁样品的总离子流图Fig. 1 Total ion current (TIC) chromatograms of grapefruit juice samples
利用HS-SPME-GC-MS对不同的胡柚汁样品(对照组、发酵组1、发酵组2、发酵组3)进行分析,对总离子流色谱图,如图1所示,结合文献最终确定各挥发性风味物质,面积归一化法计算各物质的相对含量,结果如表2所示。
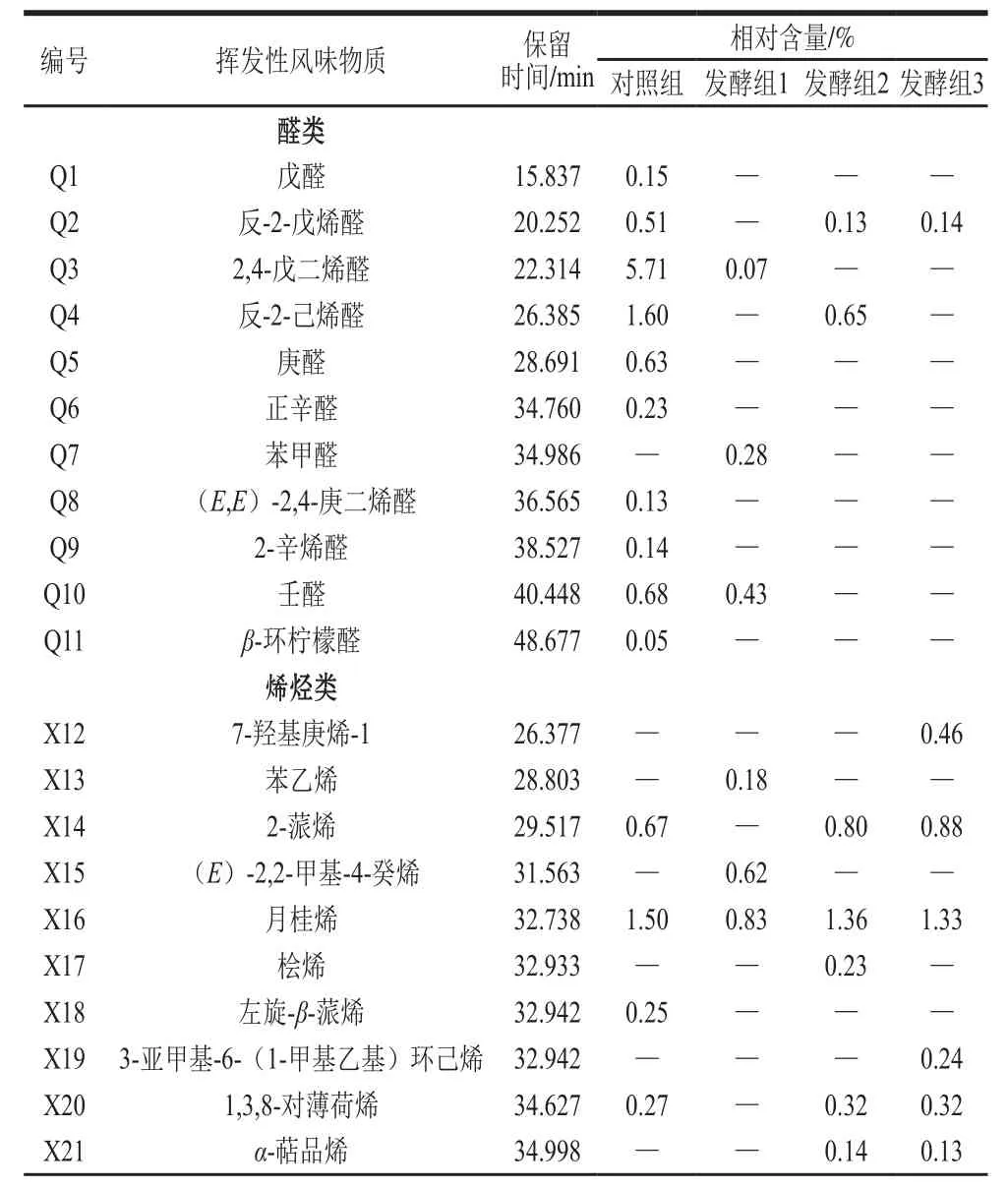
表2 胡柚汁样品挥发性成分的鉴定结果Table2 Identification of the volatile components of grapefruit juice samples
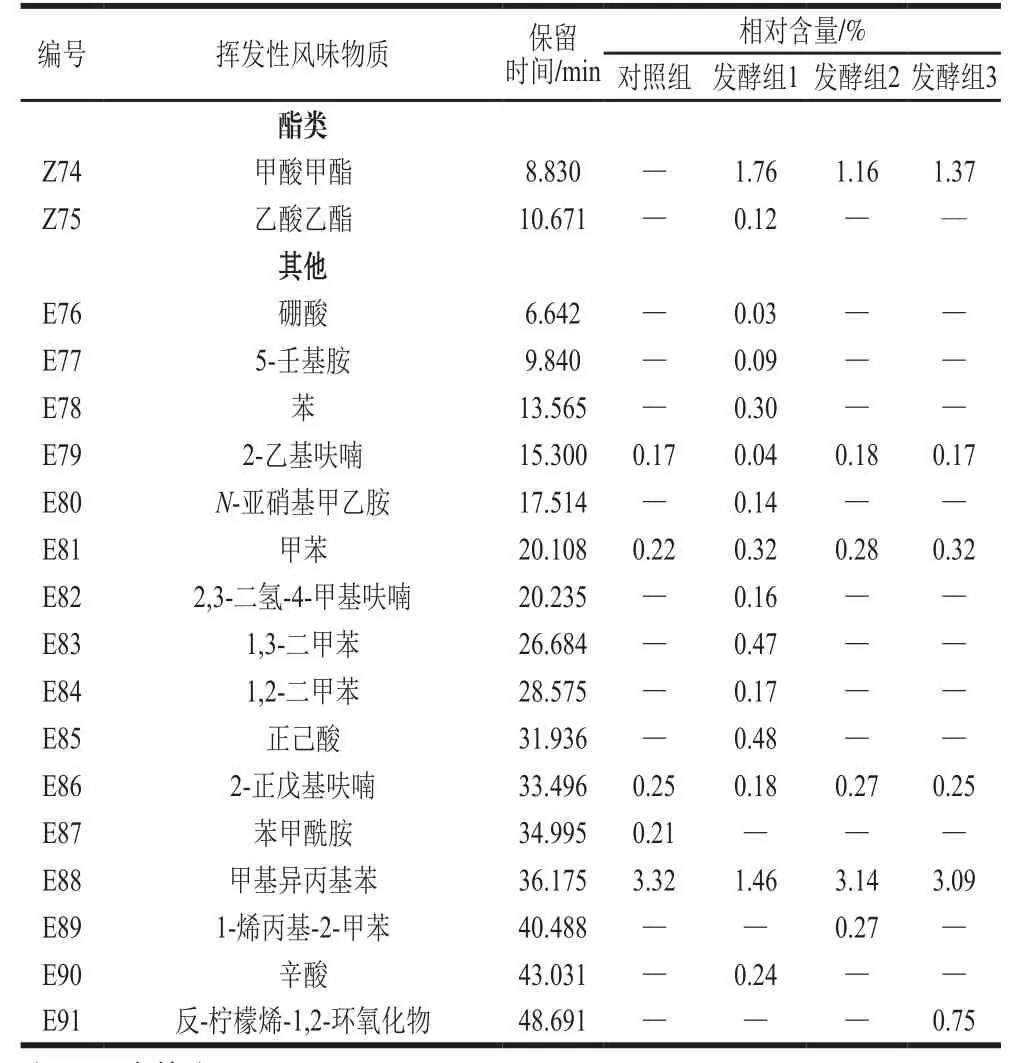
续表2
如图1所示,与对照组的总离子图相比,接入不同菌种发酵胡柚汁的色谱图区分明显。3 种乳酸菌发酵样品共鉴定出79 种挥发性风味物质(表2),其中醇类20 种、烯烃类15 种、烷烃类12 种、酮类10 种、醛类5 种、酯类2 种、其他类15 种,挥发性风味物质分别为59、36 种和35种。从挥发性成分种类的数量来看,胡柚汁经不同乳酸菌接种发酵后挥发性风味物质种类均增加,如图2所示,与对照组相比,接种Lf L2挥发性物质增加了3 个,接种混菌增加了2 个,增幅并不大。从挥发性风味物质种类来看,与对照组相比,检测到了新的种类为酯类化合物。
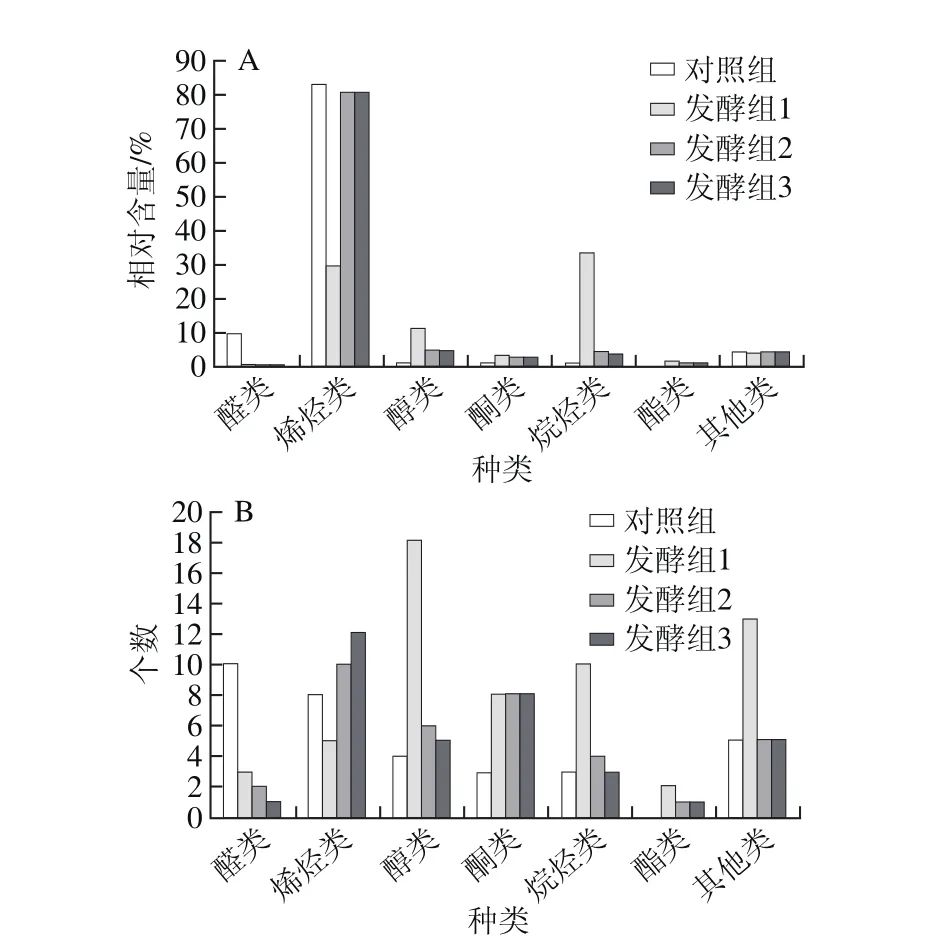
图2 乳酸菌发酵胡柚汁挥发性风味物质的相对含量(A)和种类(B)Fig. 2 Volatile flavor composition of fermented grapefruit juice
2.2 乳酸菌发酵胡柚汁挥发性风味组分相对含量变化
由表2和图2可以看出,胡柚汁经接种乳酸菌Lp L1发酵后,烷烃类化合物的总相对含量大量增加,达到33.48%,是对照组的33 倍,其中对照组中微量存在的八甲基环四硅氧烷相对含量增加显著,相对含量达11.09%;检测到许多对照组中未被检测到的烷烃类物质,其中相对含量较高的为十甲基环五硅氧烷(11.00%)、六甲基环三硅氧烷(4.98%)和十二甲基环六硅氧烷(3.98%);而对照组中相对含量最高的十一烷未被检测到。醇类化合物总相对含量大量增加,是对照组的11倍,其中L-香芹醇相对含量提高至3.29%,其他共有成分相对含量均提高到一半以上,同时检测到大量新的醇类化合物,其相对含量较高的为正己醇(2.53%)、柏木烯醇(1.32%)、1-庚醇(0.91%)和1-壬醇(0.68%),对照组中存在的β-小茴香醇未被检测到。酮类化合物总相对含量大量增加,其中包括相对含量较高的新酮类物质如甲基壬基甲酮(0.79%)、6-甲基-5-庚烯-2-酮(0.57%)和2-壬酮(0.45%),对照组中相对含量最高的1-戊烯-3-酮相对含量降低至0.40%,而对照组中存在的甲基庚烯酮和右旋香芹酮未被检测到。烯烃类化合物的总相对含量大幅降低了52.96%,其中对照组中相对含量最高的左旋柠檬烯相对含量降低至26.96%,松油烯相对含量降低至1.01%,并出现了新的烯烃类物质苯乙烯和(E)-2,2-甲基-4-癸烯。醛类化合物的总相对含量降低了9.05%,2,4-戊二烯醛在对照组中相对含量最高,经Lp L1发酵后相对含量降低至0.07%,对照组中存在的除2,4-戊二烯醛和壬醛外均未被检测到,检测到对照组中不存在的苯甲醛。酯类化合物的总相对含量达到1.88%,其中甲酸甲酯(1.76%)的相对含量最高。其他类的总相对含量降低了0.09%,与对照组较为接近,其中甲基异丙基苯相对含量最高,与对照组相比,相对含量降低到1.46%。
Lf L2以及混菌接种后发酵汁中的风味成分相似,但与对照组和接种Lp L1发酵相比,风味物质差异显著。烯烃类化合物总相对含量最高,与对照组相比,Lf L2和混菌接种分别降低了2.23%和2.24%,胡柚汁原料本身的特征烯烃类风味物质左旋柠檬烯、松油烯、月桂烯均被检测到。醇类物质的总相对含量仅次于烯烃类化合物,2 种样品的增幅都在4%的范围内,经Lf L2发酵后出现新的醇类物质顺-2-己烯-1-醇和顺香芹醇,这2 个物质在Lp L1的发酵液中并未发现,混菌发酵液中存在Lf L2发酵液中不存在的环己醇。烷烃类化合物的总相对含量也显著提高,分别为4.58%和3.90%,其中4 种样品中所共有的八甲基环四硅氧烷相对含量最高,分别达到2.23%和2.16%,与另外2 个样品比较相对含量差别较大;六甲基环三硅氧烷和十甲基环五硅氧烷在对照组中未被检测到,而在Lp L1、Lf L2以及混菌发酵组中有检测到,且相对含量均在0.5%以上。酮类化合物相对含量增加,除3-辛酮、甲基庚烯酮、6-甲基-5-庚烯-2-酮和左旋香芹酮外,其他检测到的物质与Lp L1发酵组相似,1-戊烯-3-酮是4 种样品所共有的,其相对含量在Lf L2以及混菌发酵组中均有所降低。醛类化合物相对含量分别降低了9.05%和9.65%。总体来看,乳酸菌发酵胡柚汁样品中醛类物质相对含量大量降低,醇类、酮类和烷烃类相对含量显著提高。与对照组相比,乳酸菌发酵后的胡柚汁的风味物质更加丰富。
2.3 主成分分析结果
利用SPSS 19.0软件对4 种胡柚汁样品中的91 种挥发性风味化合物进行主成分分析,所得的主成分的特征值和贡献率如表3所示,所得的载荷矩阵图如图3所示。
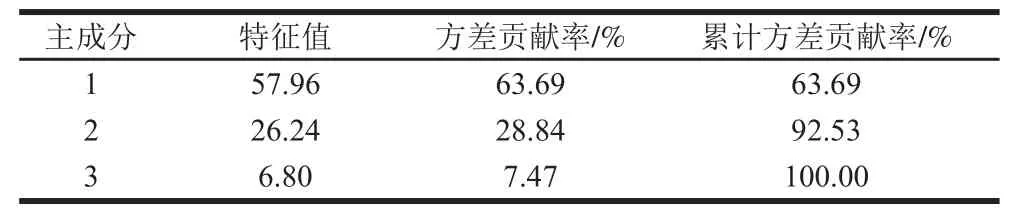
表3 3 个主成分的特征值和贡献率Table3 Eigenvalues of three principal components and their variance contributions and cumulative contributions
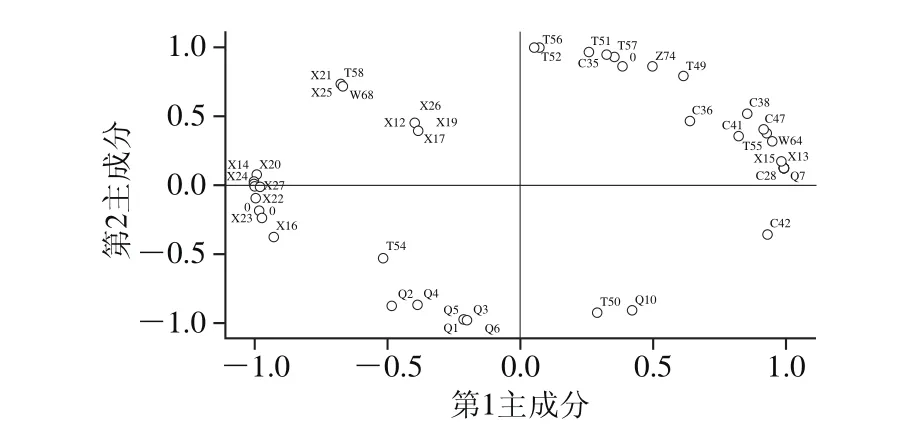
图3 主成分载荷矩阵图Fig. 3 PCA loading plot
以91 种风味物质的第1主成分载荷值为横坐标,第2主成分的载荷值为纵坐标,由图3可知,第1主成分中正影响挥发性物质载荷系数达到0.9以上有39 种,主要为醇类、烷烃类和酯类,这些成分与第1主成分有高的相关性,八甲基环四硅氧烷(0.999)、6-异丙烯基-3-甲基-1-环己烯-1-醇(0.993)、L-香芹醇(0.991)、六甲基环三硅氧烷(0.989)是第1主成分中正影响挥发性物质的典型代表;负影响挥发物质载荷系数达到0.9以上有10 种,大部分为烯烃类,甲基异丙基苯(0.999)、月桂烯(0.995)、左旋柠檬烯(0.995)、松油烯(0.993)是第1主成分中负影响挥发性物质的典型代表。第2主成分中载荷较高的正影响挥发性物质主要为醛类,壬醛(0.989)、1-戊烯-3-酮(0.971)、2,4-戊二烯醛(0.883)较高,与第2主成分有高度相关性;负影响挥发物质载荷较高的主要为酮类,其中2-庚酮(0.939)、2-壬酮(0.936)、左旋香芹酮(0.897)较高。第1主成分代表烯烃类、酯类、烷烃类、醇类和其他类,第2主成分代表酮类和醛类,将影响胡柚汁样品风味的7 种物质降维到2 种主成分。烯烃类是4 种样品所共有的,主要集中在第2、3象限内,是对照组、Lf L2和混菌发酵组中相对含量最高的挥发性成分。醛类主要集中在第3象限内,在对照组中相对含量仅次于烯烃类。除烯烃类外,Lp L1、Lf L2和混菌发酵胡柚汁的主要挥发性成分烷烃类和醇类,大部分集中在第1象限内。发酵样品能够在这2 个主成分中被区分开来,Lp L1主要挥发性物质集中在第1、2象限,Lp L2和混菌集中在第1、2、3象限,分布差异性显著。
2.4 电子鼻分析结果
LDA是将高维的模式样本投影到最佳鉴别矢量空间,投影后保证模式样本在新的子空间有最小的类内距离和最大的类间距离的一种统计分析方法,能够最大限度地区分不同的样品集,降低数据空间维度。对4 种胡柚汁样品进行电子鼻分析,并利用电子鼻自带软件对数据进行LDA,如图4所示。
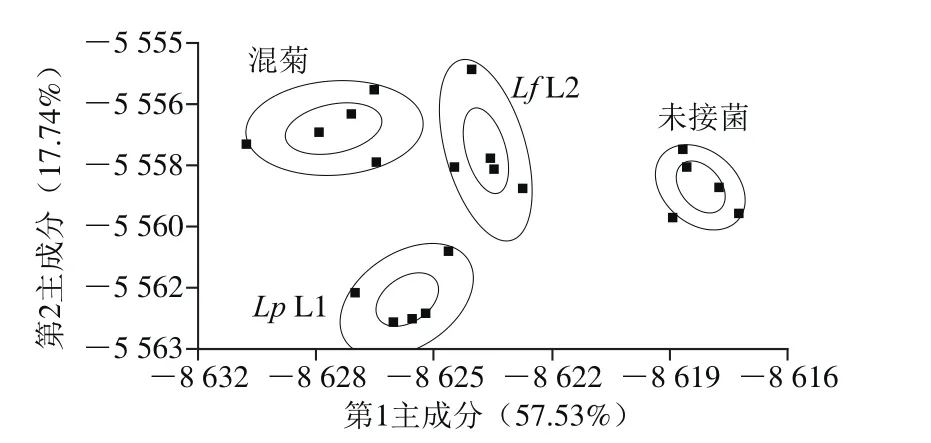
图4 电子鼻检测的LDA图Fig. 4 LDA plot of electronic nose data
由图4可知,LD1和LD2的方差贡献率分别为57.53%和17.74%,两判别式的总贡献率达75.27%,能较好地反映总体信息。4 种样品无重叠部分,数据点均分布在各自的区域内,能够被很好地区分开来,说明电子鼻能较好地识别乳酸菌发酵胡柚汁样品的香气物质,4 种样品的香气之间差异性显著。从各样品两两之间的椭圆距离来看,未接种的胡柚汁样品与接种乳酸菌的样品距离较大,说明接种乳酸菌对胡柚汁香气的影响较大;接种Lf L2和接种混菌的距离更为接近,说明这2 种样品的风味更为接近,这与挥发性风味物质的检测结果一致。
3 讨 论
乳酸菌发酵胡柚汁的挥发性风味物质主要来源于胡柚原料的本身和乳酸菌发酵代谢的成分。烯烃类化合物阈值较低,多呈现果香和花香[28],加热易促使其分解,在3 种发酵样品中相对含量丰富,除接种Lp L1外,与对照组相近;本实验检测结果左旋柠檬烯是胡柚汁原料所特有的呈味物质,这与洪鹏等[29]研究3 种柚子精油最主要的成分均为柠檬烯和β-月桂烯的结果一致,烯烃类化合物也是发酵组的主要呈味物质。醛类化合物多为果香及花香,阈值较低,赋予香气能力较强[28]。高含量的醛类物质可能会引起异味[30]。对照组中醛类物质相对含量较高,原因可能是胡柚汁在接菌之前进行了高温的处理,加热过程可能导致醛类物质的增加[24],如对照组中有检测到的戊醛具有煮熟的风味[30]。乳酸菌发酵后代谢分解了大部分醛类物质,Lp L1发酵组中检测到的苯甲醛具有樱桃味和甜味,对风味起到加强作用。醇类通常具有芳香、植物香,其阈值一般很低,对风味的形成有不容忽视的作用。胡柚汁发酵后醇类物质的种类均增加,正己醇、1-庚醇是乳酸菌发酵所独有的,接种Lp L1醇类物质增加明显,可能与Lp L1的代谢特性有关。醇类一般由相应的醛通过脱氢酶催化的还原反应形成,乳糖的代谢、甲基酮的还原、氨基酸的代谢都可生成相应的醇,特别是在乳酸菌的作用下,这些反应更加强烈[31-32]。酯类是一类影响风味的重要化合物低分子质量的酯类一般具有芳香气味或特定水果香味[33],发酵组均发现了对照组没有的酯类物质,这是由于酯类物质是在乳酸菌的作用下由醇类和有机酸等生成的一类化合物[34]。酮类化合物香味优异持久,一般贡献花香和果香风味[31],其阈值要高于其同分异构体醛,其中不饱和酮类具有较高的挥发性[29]。乳酸菌发酵后酮类物质增加,对风味起到加强作用,且随着菌种不同增加的种类和相对含量不同,原因可能是酮类物质是氧化反应的最终产物,而乳酸菌的加入对氧化反应起到促进作用。烷烃类主要来源于脂肪酸烷氧自由基的断裂[35],由于香味阈值较高,对胡柚汁风味的贡献较小,为Lp L1发酵的主要挥发性风味物质。对样品香气成分的电子鼻检测并结合LDA方法可对发酵胡柚汁样品挥发性风味差异性的判别,与GC-MS分析结果具有较好的互补性。
从单一菌种与混合菌种发酵产物差异性结果比较,个别组分在单菌种发酵未能检出(如3-亚甲基-6-(1-甲基乙基)环己烯)而混合菌发酵中产生,或者在混合菌发酵中未能检出(如2,4-戊二烯醛)而单菌种发酵中检测到,这可能是由于不同的2 种菌其所含酶系的差异性及其代谢特性存在差别,相比单菌种发酵,混合菌发酵体系中,一种菌的代谢产物可能是另一种菌的代谢底物,同时也存在发酵产物间或发酵底物与产物之间等复杂的反应。相似机理已有相关文献报道,例如,保加利亚乳杆菌和嗜热链球菌的互惠共生作用,保加利亚乳杆菌代谢产物氨基酸为后者提供氮源,也为后者提供嘌呤类物质和嘌呤类物质前体[36]等。混合菌发酵品质组分的差异性的机制有待进一步通过基因组学、代谢组学等手段进一步阐明。
4 结 论
胡柚汁经接种乳酸菌(Lp L1、Lf L2和混合菌)发酵后其挥发性风味物质分别为59、36 种和35 种,挥发性风味化合物的种类均增加,并产生了新的风味物质酯类,醛类物质相对含量显著降低,醇类、酮类和烷烃类相对含量显著提高。通过乳酸菌发酵后风味物质得到了调整并呈现一定协同效应,使胡柚汁的果香与乳酸菌的发酵香浑然一体,赋予了发酵胡柚汁独特的风味。主成分分析选取了2 个主成分代表4 种样品92.53%的原始信息,其中八甲基环四硅氧烷、甲基异丙基苯、月桂烯、6-异丙烯基-3-甲基-1-环己烯-1-醇、L-香芹醇、壬醛、1-戊烯-3-酮和2-庚酮对挥发性风味物质相对含量影响较大,找出了影响4 个样品的特征风味组分在主成分中的差异,表明主成分分析法可实现对益生菌发酵胡柚汁特征风味差异性的评价。电子鼻分析表明乳酸菌发酵胡柚汁后风味改变显著,LDA能够区分出4 种胡柚汁样品存在显著性差异,且不同乳酸菌发酵胡柚汁其风味也有较显著的差异。
[1] 吴元锋, 毛建卫, 刘士旺, 等. 胡柚汁乳酸菌发酵脱苦工艺研究[J]. 浙江科技学院学报, 2011, 23(6): 473-476. DOI:10.3969/j.issn.1671-8798.2011.06.008.
[2] 张韵冰. 中国柑桔属植物一新种[J]. 植物研究, 1991, 11(2): 5-7.
[3] 仲山民, 田荆祥. 常山胡柚果实营养成分分析[J]. 经济林研究, 1995,13(2): 23-26. DOI:10.14067/j.cnki.1003-8981.1995.02.007.
[4] 仲山民. 常山胡柚研究现状及存在的问题[J]. 经济林研究, 2004,22(1): 64-67. DOI:10.3969/j.issn.1003-8981.2004.01.023.
[5] ORTUNO A, REYNALDO I, FUSTER M D, et al. Citrus cultivars with high flavonoid contents in the fruits[J]. Scientia Horticulturae,1997, 68(1/2/3/4): 231-236. DOI:10.1016/S0304-4238(96)00988-0.
[6] 唐仁龙, 林敏, 吴界, 等. 常山胡柚开发现状及进展[J]. 科技创新导报, 2014(28): 250-251. DOI:10.3969/j.issn.1674-098X.2014.28.178.
[7] 曾凡坤, 邹连生, 焦必林. 柑桔中类柠檬苦素含量及分布研究[J]. 中国食品学报, 2003, 3(4): 79-81. DOI:10.3969/j.issn.1009-7848.2003.04.018.
[8] 徐小忠, 赵四清, 汪丽霞. 常山胡柚果皮中所含功能性成分与作用[J]. 浙江柑桔, 2014, 31(1): 10-12. DOI:10.3969/j.issn.1009-0584.2014.01.004.
[9] 刘春荣, 王登亮, 郑雪良. 胡柚果实的营养与功能性组分研究进展[J]. 浙江农业科学, 2015, 56(2): 253-257. DOI:10.16178/j.issn.0528-9017.20150234.
[10] 刘玉梅. 胡柚皮膳食纤维的提取及理化性质的研究[D]. 株洲: 中南林业科技大学, 2013.
[11] 张九凯. 瓯柑和胡柚果实黄酮类化合物组分鉴定、分离纯化及生物活性研究[D]. 杭州: 浙江大学, 2013.
[12] 方博文, 齐睿婷, 张英. 常山胡柚果实不同部位有效成分含量及其抗氧化活性比较[J]. 食品科学, 2015, 36(10): 158-163. DOI:10.7506/spkx1002-6630-201510032.
[13] BOMBARDELLI E, MORAZZONI P. The flavonoids: new perspectives in biological activities and therapeutics[J]. Chimica Oggi,1993, 11(7/8): 25-28.
[14] KANNO S, TOMIZAWA A, HIURA T, et al. Inhibitory effects of naringenin on tumor growth in human cancer cell lines and sarcoma S-180-implanted mice[J]. Biological & Pharmaceutical Bulletin, 2005,28(3): 527-530. DOI:10.1248/bpb.28.527.
[15] 陈源, 黄贤贵, 余亚白, 等. 金柑果实功能成分研究进展[J]. 中国南方果树, 2014, 43(1): 28-31. DOI:10.13938/j.issn.1007-1431.2014.01.020.
[16] ZHANG J, SUN C, YAN Y, et al. Purification of naringin and neohesperidin from Huyou (Citrus changshanensis) fruit and their effects on glucose consumption in human HepG2 cells[J].Food Chemistry, 2012, 135(3): 1471-1478. DOI:10.1016/j.foodchem.2012.06.004.
[17] 仲山民, 田荆祥, 林海萍, 等. 常山胡柚脯的加工技术[J]. 经济林研究, 2000, 18(3): 49-50. DOI:10.3969/j.issn.1003-8981.2000.03.019.
[18] 仲山民, 林海萍. 常山胡柚果酱的加工研制[J]. 食品科学, 2003,24(2): 99-102. DOI:10.3321/j.issn:1002-6630.2003.02.023.
[19] 陆胜民, 刘欠欠, 杨颖, 等. 胡柚果醋的研究现状及其进展[J].食品与发酵科技, 2009, 45(4): 19-21. DOI:10.3969/j.issn.1674-506X.2009.04-007.
[20] 杨黎明. 胡柚果粒饮料及胡柚果皮软糖的研究[D]. 武汉: 华中农业大学, 2011.
[21] 池广友, 方修贵. 胡柚茶的研制[J]. 浙江柑桔, 2006, 23(4): 27.DOI:10.3969/j.issn.1009-0584.2006.04.013.
[22] 仲山民. 常山胡柚果汁饮料的加工研制[J]. 食品工业科技, 2004,25(9): 93-95. DOI:10.3969/j.issn.1002-0306.2004.09.033.
[23] 曹振辉, 刘永仕, 潘洪彬, 等. 乳酸菌的益生功能及作用机制研究进展[J]. 食品工业科技, 2015, 36(24): 366-370. DOI:10.13386/j.issn1002-0306.2015.24.072.
[24] DI CAGNO R, FILANNINO P, GOBBETTI M. Lactic acid fermentation drives the optimal volatile flavor-aroma profile of pomegranate juice[J]. International Journal of Food Microbiology, 2017,248: 56-62. DOI:10.1016/j.ijfoodmicro.2017.02.014.
[25] 胡友栋. 超高压处理对胡柚汁的杀菌灭酶效果及品质影响[D]. 杭州: 浙江工商大学, 2009: 53-58.
[26] 傅若农. 固相微萃取(SPME)近几年的发展[J]. 分析试验室, 2015,34(5): 602-620. DOI:10.13595/j.cnki.issn1000-0720.2015.0134.
[27] 乔宇. 柑橘汁香气活性化合物的鉴定及其在加工和储藏中的变化[D].武汉: 华中农业大学, 2008: 64-65.
[28] 唐鑫, 夏延斌, 吴灿. 辣椒汁发酵过程中挥发性成分的变化[J].食品科学, 2014, 35(16): 197-201. DOI:10.7506/spkx1002-6630-201416038.
[29] 洪鹏, 陈峰, 杨远帆, 等. 三种柚子精油的香味特征及挥发性成分[J]. 现代食品科技, 2014, 30(10): 274-281. DOI:10.13982/j.mfst.1673-9078.2014.10.046.
[30] SERVILI M, SELVAGGINI R, TATICCHI A, et al. Relationships between the volatile compounds evaluated by solid phase microextraction and the thermal treatment of tomato juice: optimization of the blanching parameters[J]. Food Chemistry, 2000, 71(3): 407-415. DOI:10.1016/S0308-8146(00)00187-4.
[31] 周春丽, 刘伟, 李慧, 等. 混合菌株发酵南瓜汁及其香气分析[J]. 现代食品科技, 2014, 30(5): 301-310. DOI:10.13982/j.mfst.1673-9078.2014.05.047.
[32] CAGNO R D, SURICO R F, PARADISO A, et al. Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J]. International Journal of Food Microbiology, 2009, 128(3):473-483 DOI:10.1016/j.ijfoodmicro.2008.10.017.
[33] 韩江雪, 丁筑红, 李仲军, 等. 不同乳酸菌强化接种发酵辣椒挥发性风味成分分析[J]. 食品科学, 2012, 33(10): 179-183.
[34] 赵福利, 钟葵, 佟立涛, 等. 燕麦发酵饮料乳酸菌菌种的筛选[J]. 现代食品科技, 2015, 31(11): 263-270. DOI:10.13982/j.mfst.1673-9078.2015.11.040.
[35] 孙圳, 韩东, 张春晖, 等. 定量卤制鸡肉挥发性风味物质剖面分析[J]. 中国农业科学, 2016, 49(15): 3030-3045. DOI:10.3864/j.issn.0578-1752.2016.15.017.
[36] 包维臣, 陈霞, 邵玉宇, 等. 保加利亚乳杆菌与嗜热链球菌共生机理的研究进展[J]. 中国乳品工业, 2011, 39(12): 20-23.DOI:10.3969/j.issn.1001-2230.2011.12.005.
