妊娠期合并珠蛋白生成障碍性贫血患者鉴别方程的建立与临床应用
2018-01-30杨渝伟徐少华廖茂杉
杨 涛,宋 娟,杨渝伟,徐少华,廖茂杉,应 军△
(1.四川省绵阳市三台县人民医院检验科 621100;2.四川省绵阳市中心医院检验科 621000)
缺铁性贫血(IDA)是妊娠期最常见的并发症,我国妊娠期妇女IDA的发生率为19.1%[1]。IDA治疗前须与珠蛋白生成障碍性贫血相鉴别,二者同属于小细胞低色素性贫血,但后者为常染色体不完全显性遗传病[2],妊娠期因受到病理性及生理性贫血因素共同影响,贫血症状则会加重,对孕妇及胎儿的危害远远高于前者,更易引起母婴死亡[3]。因此,在产前检查准确鉴别珠蛋白生成障碍性贫血与IDA,对保障母婴安全有着重要的意义。由于重症珠蛋白生成障碍性贫血患者的胎儿多于宫内或幼年期死亡,因此以轻症珠蛋白生成障碍性贫血孕妇多见,最常见的是轻型α-珠蛋白生成障碍性贫血(α-TT)和轻型β-珠蛋白生成障碍性贫血(β-TT)[4]。目前,针对β-TT和α-TT的产前基因分析已成为妊娠期珠蛋白生成障碍性贫血诊断的“金标准”,但由于基因分析不是强制检测项目,而且检测费用昂贵,所以有很大部分妇女并未进行致病基因的产前诊断。为此,笔者参考国外基于红细胞(RBC)参数建立鉴别指数[5-8]的经验,以孕妇产前检查时RBC和网织红细胞(Ret)参数为基础,建立了妊娠期IDA和珠蛋白生成障碍性贫血、α-TT和β-TT的鉴别方程,以便患者选择性地进行基因诊断,现报道如下。
1 资料与方法
1.1一般资料 收集2014-2016年四川省绵阳市三台县人民医院和绵阳市中心医院收治的13~28孕周,同时进行RBC和Ret分析的贫血孕妇425例,包括IDA患者177例、α-TT患者105例(静止型21例、标准型84例)和β-TT患者143例(CD41-42型45例、CD654型34例、CD71-72型7例、CD28型20例和CD17型37例)。所有病例均符合相关诊断标准[1-2,9]:(1)以血红蛋白(Hb)<110 g/L作为贫血诊断标准;(2)以铁蛋白<20 μg/L作为IDA诊断标准;(3)以基因分析作为珠蛋白生成障碍性贫血的确诊依据。然后按照分层随机分组原则,将所有患者分成开发组和验证组,其中开发组174例,包括IDA患者75例、α-TT患者42例和β-TT患者57例;验证组251例,包括IDA患者102例、α-TT患者63例和β-TT患者86例。两组患者年龄、孕周等一般资料以及RBC参数和Ret参数比较差异均无统计学意义(P>0.05),具有可比性。
1.2仪器与试剂 XE2100型全自动血细胞分析仪(Sysmex,日本)及配套试剂。
1.3方法
1.3.1检测方法 采用乙二胺四乙酸二钾(EDTA-K2)真空抗凝管抽取受试者空腹静脉血2.0 mL,充分混匀,2 h内在Sysmex XE2100型全自动血细胞分析仪上进行RBC参数及Ret参数检测。RBC参数包括6项指标:红细胞计数(RBC#)、Hb、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)和红细胞分布宽度 (RDW-CV)。Ret参数包括7项指标:网织红细胞绝对值(Ret#)、网织红细胞百分比(Ret%)、未成熟网织红细胞比率(IRF)、低荧光强度网织红细胞比率(LFR)、中等荧光强度网织红细胞比率(MFR)、高荧光强度网织红细胞比率(HFR)和网织红细胞血红蛋白含量(Ret-He)。
1.3.2鉴别方程建立 采用Logistic回归建立鉴别方程模型。(1)为区分IDA与珠蛋白生成障碍性贫血,将IDA者设为0,而α-TT或β-TT者均设为1;(2)为区分α-TT与β-TT,舍去IDA者,将α-TT者设为0,而β-TT者设为1。然后采用步进法Logistic回归分析,从13项RBC和Ret参数中筛选出优势参数,区分IDA与珠蛋白生成障碍性贫血时为RBC#、Ret%和IRF(Wald=4.738~12.225,P<0.05),区分α-TT与β-TT时为MCHC、Ret%和MRF(Wald=10.711~12.433,P<0.05)。由此,建立Logit-P1(鉴别IDA与珠蛋白生成障碍性贫血)和Logit-P2(鉴别α-TT与β-TT)鉴别方程如下:
Logit-P1=-10.14+1.64×RBC#+0.85×Ret%+0.07×IRF
Logit-P2=-45.11+0.10×MCHC#+1.41×Ret%+0.65×MRF
1.3.3血液学指数 选择自国外最先报道至今、应用较广范、基于RBC参数建立的共计12个血液学指标:England & Fraser指数(EFI)、Mentzler指数(MI)、Srivastava指数(SriI)、Shine & Lal指数(SLI)、RDW指数(RDWI)、Ricerca指数(RI)、Green & King指数(GKI)、Huber-Herklotz指数(HHI)、Ehsani指数(EI)、Sirdah指数(SirI)、Sehgal指数(SehI)和Matos & Carvalho指数(MCI)。计算出验证组患者Logit-P1、Logit-P2和以上血液学指数的诊断结果,采用受试者工作特征曲线(ROC曲线)分析进行诊断性能比较。
1.3.4补充标准的设定 随后的调查发现上述鉴别方程对α-TT患者的漏诊率仍较高,鉴于珠蛋白生成障碍性贫血患者RBC显著增加[10]的特征,进一步采用ROC曲线分析开发组患者RBC#结果,建立了上述鉴别方程的补充标准(RBC#≥4.1×1012/L),用于经Logit-P1方程初步判断为IDA的贫血孕妇进一步鉴别。
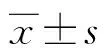
2 结 果
2.1鉴别方程的ROC曲线分析 经ROC曲线分析,开发组Logit-P1的ROC曲线下面积(AUC)为0.760,最大约登指数为0.429,最佳判断界值为0.84,此时其灵敏度和特异度在开发组分别为86.9%和56.0%(图1A),在验证组分别为85.9%和55.9%(表1);Logit-P2的AUC为0.910,最大约登指数为0.752,最佳判断界值为0.41,此时其灵敏度和特异度在开发组分别为89.5%和85.7%(图1B),在验证组分别为88.4%和85.7%(表2)。
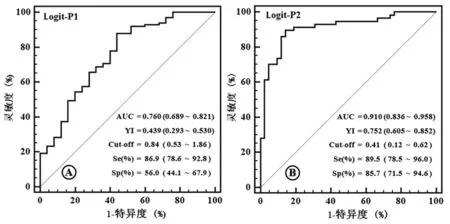
注:Se为灵敏度,Sp为特异度,AUC为曲线下面积,YI为约登指数,Cut-off为最佳判断界值
图1开发组Logit-P1和Logit-P2的ROC曲线分析
2.2鉴别方程与其他血液学指数的诊断性能 在验证组中,当鉴别IDA与珠蛋白生成障碍性贫血时(表1),Logit-P2和HHI无诊断价值(P>0.05),而Logit-P1诊断价值最高,其AUC明显高于其他文献血液学指数(z=2.699~4.684,P<0.01);当鉴别α-TT与β-TT时(表2),EFI、SLI、SirI、SehI和MCI无诊断价值(P>0.05),而Logit-P2诊断价值最高,其AUC显著高于其他文献血液学指数(z=4.263~7.667,P<0.01)。此外,验证组中Logit-P1、Logit-P2都有新的最佳临界值,而且血液学指数的最佳临界值与公布阈值几乎均不相同;该最佳临界值与公布阈值(或开发组最佳临界值)分别用于鉴别IDA与珠蛋白生成障碍性贫血时,仅Logit-P1和SLI在2个判断界值下,其灵敏度和特异度的差异无统计学意义(P>0.05);当分别用于鉴别α-TT与β-TT时,仅Logit-P2和RI在两个判断界值下,其灵敏度和特异度的差异无统计学意义。
2.3鉴别方程诊断结果与临床诊断的一致性 使用或未使用补充标准的两种方式判断结果分布见表3,单独使用鉴别方程,α-TT患者误诊为IDA的比例达27.0%,联合使用补充标准后降低至6.3%。经Kappa一致性检验,联合RBC#鉴别结果与临床诊断的一致性高于单独鉴别方程鉴别结果(Kappa=0.540vs.0.479,P<0.01),最终IDA、α-TT和β-TT正确检出率分别为52.0%、79.4%和81.4%。
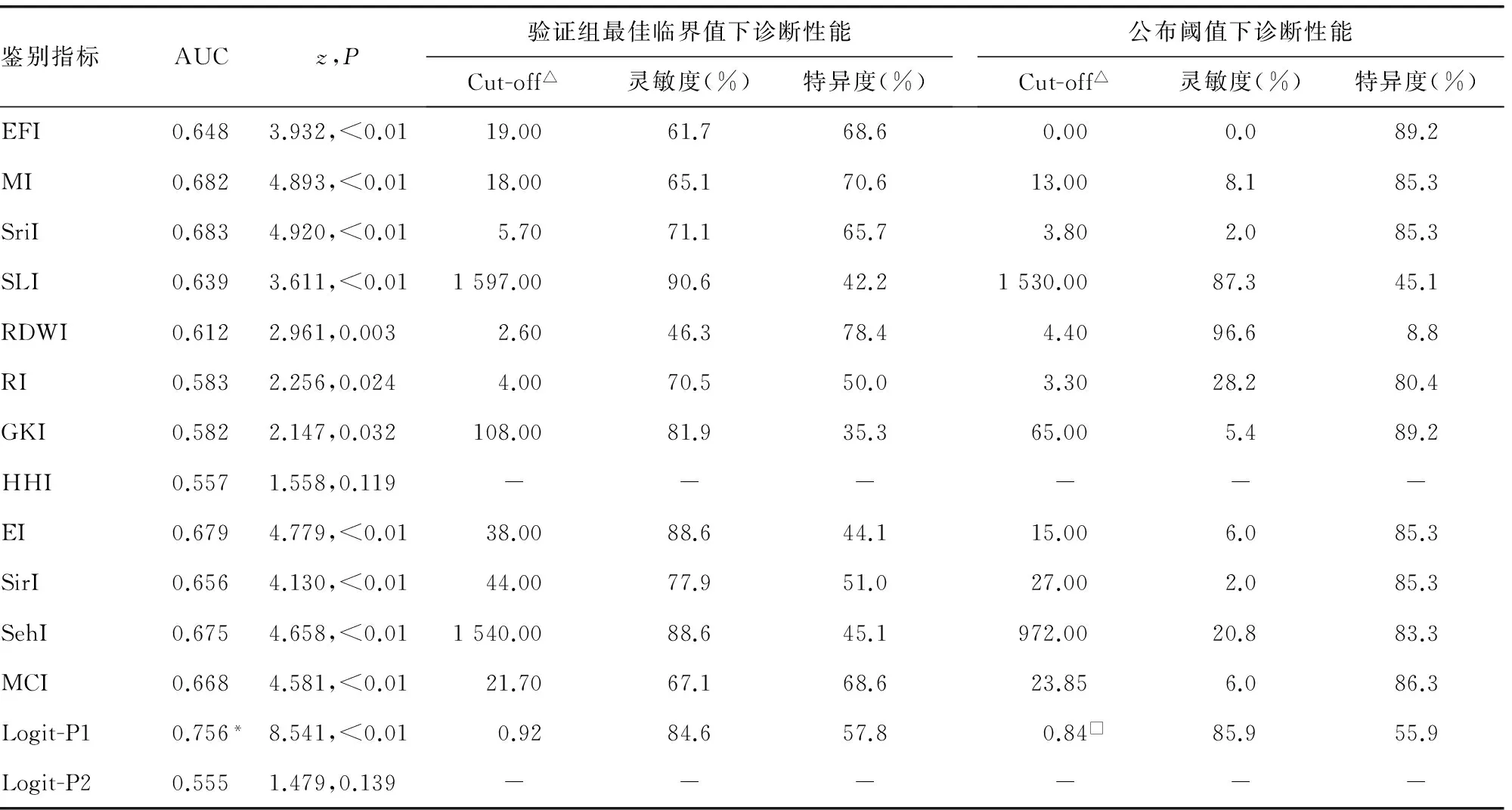
表1 鉴别方程与其他血液学指数在鉴别IDA与珠蛋白生成障碍性贫血的诊断性能(n=251)
注:△表示国外血液学指数的单位为任意单位;与其他血液学指数相比,*P<0.01;□表示开发组最佳临界值;-表示因无诊断价值而未提供
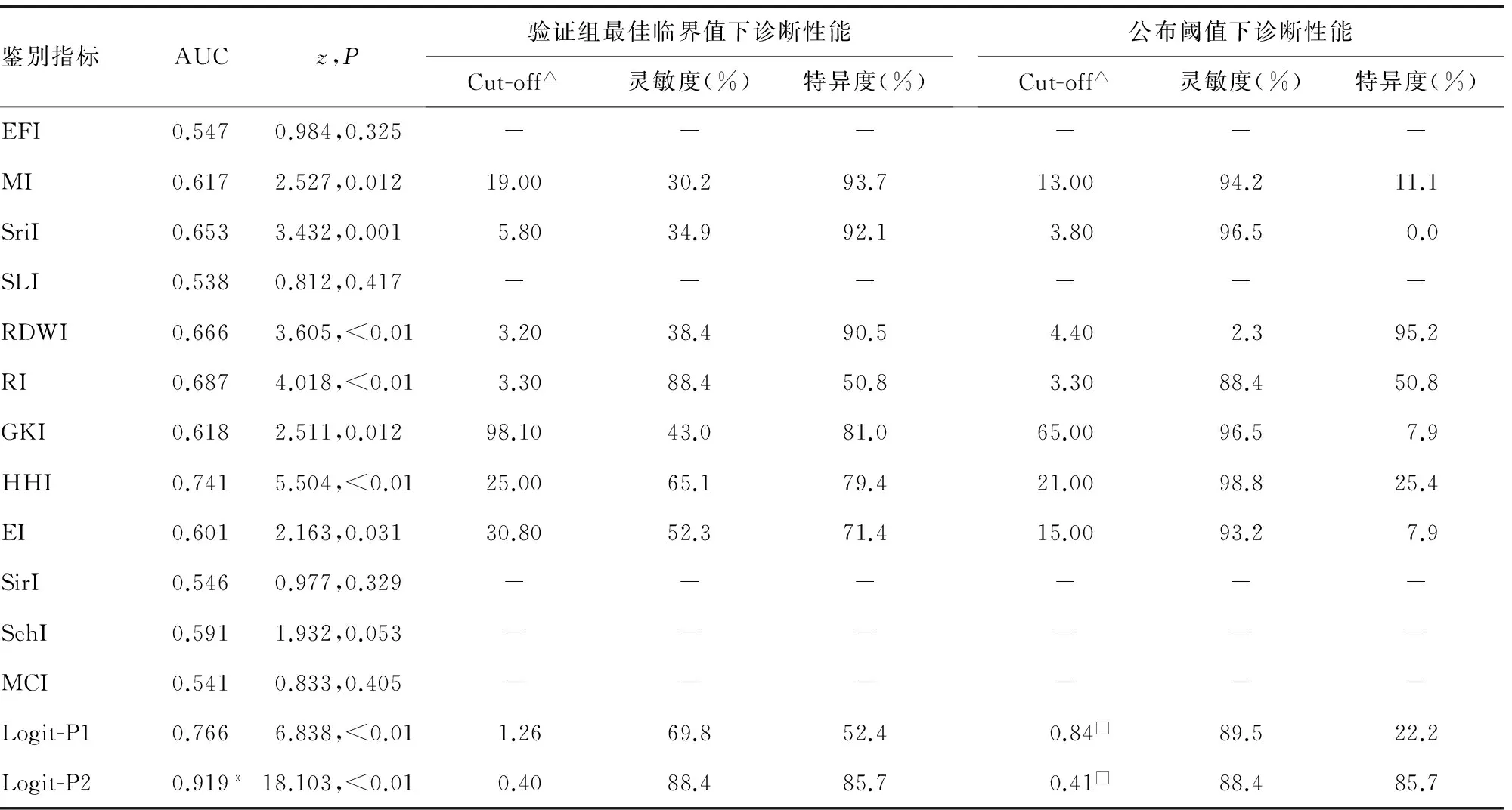
表2 鉴别方程与其他血液学指数在鉴别α-TT(n=86)与β-TT(n=63)的诊断性能
注:△表示国外血液学指数的单位为任意单位;与其他血液学指数相比,*P<0.01;□表示开发组最佳临界值;-表示因无诊断价值而未提供

表3 验证组患者鉴别方程鉴别诊断结果与临床诊断的一致性[n(%)]
3 讨 论
自1973年England and Fraser方程、Mentzer方程和Srivastava方程相继建立后,至今国内外已报道不少根据RBC参数计算的鉴别指数[5-8],以便用于珠蛋白生成障碍性贫血的大规模筛查,但其适用性存在种族差异[11]。此外,在不同生长发育时期,造血系统代谢活跃程度存在差异,RBC参数水平随之波动,上述鉴别指数的适用性可因人群不同略有差异。而妊娠期由于造血系统负担加重,RBC系统常表现出铁缺乏或IDA的特征,因此,孕妇的血液学特征与同龄健康人群略有差异,可能导致鉴别指数的适用性不佳。目前,国内外学者提倡以MCV≤75 fL或MCH≤27 pg作为妊娠期轻型珠蛋白生成障碍性贫血的警示标准[12-13],但此举并未有效区分IDA与珠蛋白生成障碍性贫血。为此,本试验基于先筛查是否珠蛋白生成障碍性贫血再区分珠蛋白生成障碍性贫血类型的思路,建立了在贫血孕妇中筛查珠蛋白生成障碍性贫血的Logit-P1方程和进一步区分珠蛋白生成障碍性贫血类型的Logit-P2方程。结果显示,2个鉴别方程以开发组获得的临界判断值为标准(0.706和0.471),在验证组患者中用Logit-P1方程筛查珠蛋白生成障碍性贫血的灵敏度达84.6%,用Logit-P2方程检出β-TT的灵敏度达88.4%,其诊断结果与临床诊断的Kappa一致性为0.479(P<0.01),表明这2个鉴别方程能够有效鉴别妊娠合并IDA、α-TT或β-TT,以便于指导临床医生或患者进一步选择β-TT或α-TT产前基因分析。
将本试验建立的2个鉴别方程的诊断性能与国内外应用较多的12个利用RBC参数的鉴别方程比较,结果发现,对验证组患者采用Logit-P1方程筛查珠蛋白生成障碍性贫血(AUC=0.765vs.0.557~0.683),以及采用Logit-P2方程判断是β-TT还是α-TT(AUC=0.919vs.0.538~0.741),其诊断性能均明显高于所选择的12个鉴别方程,差异有统计学意义(P<0.01)。原因在于12个鉴别方程仅利用了RBC参数来区分IDA和珠蛋白生成障碍性贫血,而所建立的鉴别方程还纳入了Ret参数。有研究证实,RBC增多、小红细胞增多、幼稚RBC伴IRF增加,是β-珠蛋白生成障碍性贫血的特征,而RBC大小不一且着色不均,与IDA关系更为密切[14-15]。而在建立Logit-P1方程时发现,13项RBC和Ret参数中优势参数仅为RBC#、Ret#和IRF,不仅再次证明了上述结论,同时也提示Ret参数对二者鉴别诊断具有重要的应用价值。若是仅用RBC参数来建立二者的鉴别方程,难免会丢失Ret参数这一重要特征。因此,产前检查宜联合检测RBC和Ret水平,以提供充分的鉴别信息,从而减少对珠蛋白生成障碍性贫血的漏诊以及IDA的误诊。
此外,在进行临床诊断一致性验证时发现,该试验建立的鉴别方程对β-TT的筛查正确率高达81.4%,而对α-TT仅58.7%;同时仅4.7%β-TT患者误诊为IDA,但α-TT患者中误诊比例达27.0%,原因在于α-TT和β-TT的血液学特征略有差异。据报道,与IDA相比,珠蛋白生成障碍性贫血患者RBC明显增加,但Ret仅在β-TT患者中明显增加,而在α-TT患者中则无明显差异[10]。这正是Logit-P1方程对IDA与α-TT鉴别效果相对不佳的原因。本试验验证组中,经Logit-P1方程初步判断为IDA的孕妇,若再通过珠蛋白生成障碍性贫血患者RBC明显增加的这一特征来区分,最终α-TT和β-TT患者漏诊率分别为6.3%和4.7%,正确检出率分别为79.4%和81.4%。联合RBC计数结果进行筛查,尽管IDA患者近一半被错误地诊断为珠蛋白生成障碍性贫血,但有利于α-TT和β-TT筛查,对防止不良妊娠结局以及减少珠蛋白生成障碍性贫血患儿的出生有着重要意义。
综上所述,基于RBC和Ret参数的鉴别方程Logit-P1和Logit-P2,联合RBC计数,在鉴别妊娠期合并IDA、α-TT和β-TT时更具优势,值得临床推广应用。
[1]中华医学会围产医学分会.妊娠期铁缺乏和缺铁性贫血诊治指南[J].中华围产医学杂志,2014,17(7):451-454.
[2]CAPPELLINI M D,COHEN A,ELEFTHERIOU A,et al.Guidelines for the Clinical Management of Thalassaemia[M].2 nd Revised edition.Nicosia (CY):Thalassaemia International Federation,2008.
[3]潘石蕾,黄郁馨.妊娠合并地中海贫血[J/CD].中华产科急救电子杂志,2015,4(1):28-31.
[4]ROTH C K,PUTTBRESE A,OTTLEY C.Thalassemia Syndromes in Pregnancy[J].Nurs Women Health,2016,20(4):415-420.
[5]ZAGHLOUL A,AL-BUKHARI T A,BAJUAIFER N,et al.Introduction of new formulas and evaluation of the previous red blood cell indices and formulas in the differentiation between beta thalassemia trait and Iron deficiency anemia in the Makkah region[J].Hematology,2016,21(6):351-358.
[6]HOFFMANN J J,URRECHAGA E,AGUIRRE U.Discriminant indices for distinguishing thalassemia and Iron deficiency in patients with microcytic anemia:a meta-analysis[J].Clin Chem Lab Med,2015,53(12):1883-1894.
[7]SEHGAL K,MANSUKHANI P,DADU T,et al.Sehgal index:A new index and its comparison with other complete blood count-based indices for screening of beta thalassemia trait in a tertiary care hospital[J].Indian J Pathol Microbiol,2015,58(3):310-315.
[8]MATOS J F,DUSSE L M,BORGES K B,et al.A new index to discriminate between Iron deficiency anemia and thalassemia trait[J].Rev Bras Hematol Hemoter,2016,38(3):214-219.
[9]GODDARD A F,MCINTYRE A S,SCOTT B B,et al.Guidelines for the management of Iron deficiency anaemia[J].Gut,2000,46(4):1-5.
[10]WINICHAGOON P,KUMBUNLUE R,SIRANKAPRACHA P,et al.Discrimination of various thalassemia syndromes and Iron deficiency and utilization of reticulocyte measurements in monitoring response to Iron therapy[J].Blood Cells Mol Dis,2015,54(4):336-341.
[11]SIRDAH M,TARAZI I,AL NAJJAR E,et al.Evaluation of the diagnostic reliability of different RBC indices and formulas in the differentiation of the beta-thalassaemia minor from Iron deficiency in Palestinian population[J].Int J Lab Hematol,2008,30(4):324-330.
[12]BENCAIOVA G,BURKHARDT T,KRAFFT A,et al.Screening for beta-thalassaemia trait in anaemic pregnant women[J].Gynecol Obstet Invest,2006,62(1):20-27.
[13]LIAO C,XIE X M,ZHONG H Z,et al.Proposed screening criteria for beta-thalassemia trait during early pregnancy in southern China[J].Hemoglobin,2009,33(6):528-533.
[14]URRECHAGA E,BORQUE L,ESCANERO J F.Erythrocyte and reticulocyte parameters in Iron deficiency and thalassemia[J].J Clin Lab Anal,2011,25(3):223-228.
[15]WAGNER S C,GRANDO A C,DE CASTRO S M.Reticulocytes indices in β thalassemia trait individuals[J].Rev Bras Hematol Hemoter,2011,33(5):396-397.
