微小RNA对β-地中海贫血中γ-珠蛋白基因的调控机制研究进展
2022-03-07张艳泓黄海龙徐两蒲
张艳泓,黄海龙,徐两蒲
地中海贫血是一种严重威胁人类健康的可致死、致残的遗传性血液病。根据受累珠蛋白的不同分为不同类型,主要包括α-地中海贫血(α-地贫)与β-地中海贫血(β-地贫)。β-地贫主要是由于人第11号染色体短臂1区5带3亚带位点上的β-珠蛋白基因发生突变,导致β-珠蛋白合成减少或缺如,引起α 与β 链比例失衡,多余的α-珠蛋白沉积在红细胞膜上,造成红细胞破坏,最终引发无效造血和溶血性贫血[1]。临床大多数β-地贫患者表现为慢性进行性贫血,表型严重程度与基因型相关,根据患者的临床表征将其分为轻型、中间型、重型三种类型,重型β-地贫患者往往表现为严重贫血、溶血和大量无效红细胞生成。除造血干细胞移植是明确能够根治β-地贫的疗法外,目前暂无其他特异性治疗方法。已有大量研究证实,通过激活内源性γ-珠蛋白基因的表达可以提高胎儿血红蛋白含量,从而改善β-地贫患者临床症状[2]。随着表观遗传学研究的不断深入,发现微小RNA(microRNA,miRNA)在γ-珠蛋白基因转录与转录后水平发挥重要的调控作用。本文就miRNA 对γ-珠蛋白基因的调控机制展开综述。
1 miRNA在β-地贫中异常表达
miRNA 是一类长度约为19~25 nt 的内源性非编码RNA 分子,是人类基因组中约40%~70%基因的关键调控因子。大部分miRNA 在细胞核中由RNA 聚合酶Ⅱ转录形成初级转录物(pri-miRNA),pri-miRNA 经由RNase-Ⅲ酶Drosha 和双链RNA 结合结构域蛋白组成的多蛋白复合物剪切形成长度约为70 nt 的miRNA 前体(pre-miRNA),pre-miRNA由Exportin5 识别,通过RNA-GTP 依赖途径转运至细胞质,在细胞质中进一步剪切加工成为成熟的miRNA。研究发现,miRNA在组织特异性或发育阶段以特异性的方式表达,并在细胞的生长、发育、增殖、分化及凋亡过程中都有一定的影响,其表达的变化与人类疾病发生发展息息相关[3]。在调控机制上,miRNA 通过与其他蛋白质形成miRNA 诱导的沉默复合物(miRICS),进而与靶基因mRNA3′-UTR 序列完全或不完全匹配来发挥作用,导致miRNA降解或抑制翻译表达[4]。
miRNA 是表观遗传调控中重要的一环,主要在转录后水平进行调节。部分miRNA 与红系特异性转录因子相结合来影响γ-珠蛋白的表达,同时miRNA 也会对红系细胞的发育及成熟产生影响,进而影响β-地贫患者的临床症状。随着研究深入,发现β-地贫患者中多种miRNA 存在表达失衡,miRNA 通过与红系特异性转录因子相结合来影响γ-珠蛋白的表达,同时也对红系细胞的发育及成熟产生影响,从而影响β-地贫患者的临床症状。最近的研究表明,miR-155 与miR-125b 在β-地贫患者中的表达水平可能与单核细胞的吞噬活性相关,miR-155 能够通过靶向转录因子BACH1增强单核细胞吞噬活性[5-6]。此外,单核细胞中的miR-125b的表达水平与β-地贫患者的贫血严重程度也有一定的关联。miRNA 不仅能反映出β-地贫的严重程度,也能够调控γ 珠蛋白基因的表达,并在β-地贫的发生发展中有着不可或缺的作用[7]。因此,深入了解miRNA 在地贫中的调控机制,能更好的对β-地贫进行预防及精准治疗。
2 γ-珠蛋白与β-地贫的关系
血红蛋白是由4 条珠蛋白肽链所组成的四聚体分子,在不同发育阶段血红蛋白的种类及组成也不同(表1),其主要成分为α 类珠蛋白肽链和β 类珠蛋白肽链。α 类珠蛋白肽链由位于16 号染色体上的α 珠蛋白基因簇所合成,其产物有ζ 珠蛋白链和α 珠蛋白链。β 基因簇位于11 号染色体短臂15.5 上,有ε、γ、δ、β 基因和一个伪基因,随着人体发育的不同阶段开启和关闭,按照基因簇顺序从5′~3′方向依次转录翻译ε 珠蛋白链、γ 珠蛋白链、δ 珠蛋白链和β 珠蛋白链。

表1 人体不同发育时期的血红蛋白及其组成
β-珠蛋白基因在妊娠10周时开始表达,在出生后表达逐渐增强,因此β-地贫患者在胚胎发育期直至出生时,突变对β-珠蛋白基因的抑制作用几乎不显示,只有在出生后当β-珠蛋白基因开放,突变使β-珠蛋白基因受到明显抑制时,受累纯合子患儿才表现出贫血相关的临床症状。此外,β 类珠蛋白基因簇中的γ-珠蛋白基因的表达及其调节因素也是β-地贫病理学机制的重要因素,在β-地贫中合并遗传性持续性胎儿血红蛋白综合征(hereditary persistence of fetal hemoglobin,HPFH)突变的病例中,γ-珠蛋白基因的重新开放使胎儿血红蛋白(fetal hemo‐globin,HbF)升高降低珠蛋白链的不平衡性,可显著改变β-地贫的表型,其临床症状有不同程度的减轻。γ-珠蛋白基因在β-地贫中的临床治疗的重要性不言而喻。目前,已有利用药物或通过慢病毒基因治疗去诱导γ-珠蛋白再激活,提高HbF 表达,减少异常HbA表达,减轻患者的临床症状[8]。
3 转录因子调控γ-珠蛋白基因表达
血红蛋白在发育过程中的转换受到多种转录因子的影响,这些转录因子通过招募相应的辅助因子,形成转录因子复合物,与β-珠蛋白基因簇上游的基因座控制区(LCR)增强子和珠蛋白基因启动子相互作用,在特定的发育阶段开启和关闭珠蛋白基因[9],如B 细胞淋巴瘤11A(B-cell lymphoma,BCL11A)、Krüppel 样 转 录 因 子(Krüppel-like transcription factors,KLFs)和MYB等转录因子复合物直接或间接参与调节γ-珠蛋白转换为β 珠蛋白,这些转录因子复合物共同调控γ-珠蛋白,影响其转录后表达,从而实现对γ-珠蛋白表达的精细调控。miRNA 可靶向BCL11A、KLFs、MYB等转录因子间接作用于γ-珠蛋白基因,影响胎儿血红蛋白的转录后表达,改善或加速β-地贫进展(表2和图1),下面将以此为切入点来阐述miRNA对γ-珠蛋白基因的调控机制。

表2 目前已报道miRNA对γ-珠蛋白基因的调控作用
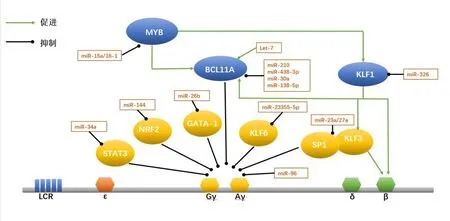
图1 目前已报道miRNA对γ-珠蛋白基因的调控模式图
3.1 miRNA 通过调控BCL11A参与γ-珠蛋白基因调节 转录因子BCL11A基因编码产物为锌指蛋白,主要在脑和造血组织中表达。BCL11A 主要作为转录阻遏物发挥作用,在大脑、造血系统发育以及胎儿-成人血红蛋白转换中至关重要。经全基因组关联分析发现地贫患者中BCL11A基因的rs11886868 位点单核苷酸多态性与其胎儿血红蛋白异常表达密切相关[10]。Liu 等[11]利用CUT&RUN方法绘制出红细胞蛋白结合位点,证明BCL11A 能优先占据远端基序,并通过结合γ-珠蛋白基因启动子区域来破坏远端基序,从而抑制γ-珠蛋白的表达。另外,最近的一项研究通过利用CRISPR-Cas9基因编辑技术对β-地贫及SOD 患者进行基因编辑,通过敲除BCL11A红系特异性增强子,成功提高了患者体内胎儿血红蛋白的表达水平[12]。上述研究表明,BCL11A是胎儿血红蛋白转录阻遏物,能够直接抑制γ-珠蛋白启动子从而抑制其表达,是β-地贫基因治疗的一个强有力靶点。
目前,已知靶向BCL11A的miRNA主要有miR-210、miR-138-5p、miR-486-3p、let-7、miR-30a等。其中miR-210 与红细胞表型密切相关,miR-210 在低氧条件下参与促成红系分化,而且miR-210 在HPFH 患者的红系前体细胞以及丝裂霉素治疗的β-地贫患者中都有较高的表达[13]。研究人员利用生物大分子相互作用分析技术确定了miR-210 和BCL11AmRNA 结合位点之间的相互作用,当miR-210 表达增强时红细胞中BCL11AmRNA 含量下降,γ-珠蛋白mRNA含量增加,miR-210通过直接结合BCL11AmRNA 的编码序列调节BCL11A基因表达,从而参与γ-珠蛋白基因的调节[14]。另外,let-7成熟序列在多个物种中高度保守,在胎儿及成人的网织红细胞中存在差异性表达且受发育调控[15]。let-7a 和let-7b 是外周血细胞中主要表达的家族成员,在成熟红细胞中集中抑制let-7a 和let-7b 可以引起发育特异性相关的成红细胞基因的变化,包括γ-珠蛋白mRNA 表达和HbF 的增加[16]。研究发现,LIN28B 靶向let-7,作为BCL11A基因的上游调节因子来影响HbF的表达[17]。
近来有研究提出LIN28B 能够直接结合BCL11AmRNA 并阻止其有效翻译,不依赖于典型的let-7 通路[18]。当let-7 下降时,BCL11A 也随之下降,HMGA2含量增加,进而提高γ-珠蛋白转录水平。Lulli等[19]发现miR-486-3p通过与BCL11A3'-UTR直接结合负性调控BCL11A的表达,提高地贫患者中γ-珠蛋白的含量,并在参与血红蛋白的转换开关发挥着重要作用。与此相似的还有miR-30a 与miR-138-5p,能直接靶向BCL11A,并上调γ-珠蛋白的表达[20-21]。此外,研究人员还发现miR-30a 不仅是BCL11A表达的直接调节因子,而且在β-地贫患者的红系前体细胞中miR-30a也与铁蛋白水平存在负相关,miR-30a 可能在β-地贫患者应激红细胞生成过程中控制珠蛋白转换、HbF诱导和铁超载状态中起着关键作用[20]。上述结果说明,不同的miRNA能够靶向同一个转录因子协同参与γ-珠蛋白的调节,在诱导HbF生成中有着不可忽视的重要作用。
3.2 miRNA 通过调控KLFs参与γ-珠蛋白基因调节 KLFs 是一类高度保守的具有锌指结构的转录因子,其中Krüppel 样因子1(KLF1)能与DNA 序列基序结合,启动下游基因转录进而参与调节红系细胞的生长及发育过程。KLF1 是从γ 珠蛋白到β珠蛋白转换的关键调节因子,能够调节胎儿和成人血红蛋白的发育转换[22]。KLF1 能够直接与β-珠蛋白基因启动子结合,使得β-珠蛋白在成年期处于高表达的水平。在重型β-地贫患者中具有KLF1杂合突变的患者HbF水平较其他患者高,临床症状较轻[23]。进一步研究发现,KLF1 通过直接上调转录因子BCL11A的表达,促进其与其他伴侣分子结合成为转录复合体,间接抑制γ-珠蛋白的表达[24]。此外,KLF1 还存在由胚胎珠蛋白抑制因子ZBTB7A/LRF 介导的第二种γ-珠蛋白抑制机制,表现为KLF1在红细胞中通过与其近端启动子结合直接驱动ZBTB7A,进而影响BCL11A及γ-珠蛋白基因表达[25]Krüppel 样因子3 (KLF3) 在体内可以取代KLIF1与关键的红系基因启动子和增强子结合,并在红细胞生成过程能被KLF1 激活并反馈抑制Krüppel 样因子8(KLF8)的表达[26]。研究人员通过构建KLF3与KLF8敲除小鼠模型,发现KLF3 在γ-珠蛋白启动子也具有一定的占据率,但并不直接结合启动子,可能是通过珠蛋白基因座内的远端位点影响胚胎珠蛋白基因表达[27]。KLF3 与KLF8 可能相互作用共同参与发育过程中抑制γ-珠蛋白的表达,但其具体机制暂不明确。
研究发现,miR-326 直接靶向结合KLF1的3′-UTR 在转录后下调KLF1 的表达,使BCL11A表达下降,从而提高γ-珠蛋白基因的表达[28]。KLF3 是促红细胞生成的负性调节剂,能够抑制γ-珠蛋白和miR-23a 的表达,与SP1 同属于β 类珠蛋白基因转录调控因子,miR-23a、miR-27a 分别靶向结合SP1和KLF3,抑制SP1 及KLF3 与β 类球蛋白基因座的结合,促进β 类球蛋白的转录,提高了γ 球蛋白的表达[29]。最近,有研究团队[30]对KLFs表达谱进行分析,认为KLF6也是潜在的红细胞生成调节剂,当抑制KLF6的表达可显著提高红系细胞系HUDEP-2和CD34+细胞中的γ-珠蛋白mRNA 和蛋白质水平,miR-2355-5p 通过抑制KLF6的表达使得γ-球蛋白的合成增加,说明miR-2355-5p和KLF6之间的相互作用会影响γ-珠蛋白的表达,为β-地贫患者的临床治疗提供更多信息。
3.3 miRNA 通过调控MYB参与γ-珠蛋白基因调节 MYB 是一种广泛存在的转录因子,在造血细胞、胸腺和神经组织中高度表达,并在淋巴细胞和红细胞发育过程中发挥关键作用。全基因组关联分析发现HBSL1和MYB基因的单核苷酸多态性与非贫血人群HbF 表达变异性相关,其中MYB上游的-84kb 和-71 kb 区域的单核苷酸多态性可妨碍MYB与红系增强子的结合,抑制MYB基因的表达,进而影响红系细胞发育过程及HbF 表达水平[31]。Suzuki 等[32]通 过 建 立HBSL1-MYB突 变 的HPFH 小鼠模型,发现MYB 可以正向调控KLF1及BCL11A,间接抑制γ-珠蛋白的表达。MYB的表达水平一方面受HBS1L-MYB基因区间基因多态性的影响,另一方面miRNA 也能影响其功能。如miR-15a 和miR-16-1 可以与MYB 3′-UTR直接结合,降低转录因子MYB的表达水平,进而促进γ-珠蛋白表达[33]。
3.4 miRNA 通过调控其他转录因子参与γ-珠蛋白基因调节 转录激活因子4(ATF4)是一种应激诱导的转录因子,能够控制多种适应性基因的表达,并参与应激反应的相关调节。Huang 等[34]通过CRISPR-Cas9 技术确定ATF4 是一种新的γ-珠蛋白阻遏物,能够特异性结合BCL11A+55增强子来调节BCL11A 进而抑制γ-珠蛋白的表达。ATF4 还参与了β-地贫的压力性造血[35]。进一步研究发现,ATF4突变的细胞中BCL11A和MYB水平表达均降低,γ-珠蛋白表达增加,ATF4 可能与HBS1L-MYB基因间增强子区域结合并调节MYB的表达,因而影响γ-珠蛋白的表达。目前,ATF4 虽未被证实与miRNA 直接结合来调控γ-珠蛋白基因,但现有的研究显示其可通过直接结合γ-珠蛋白基因相关转录因子进而参与γ-珠蛋白调控。
转录因子GATA-1 也是红系特异性激活剂,参与红系分化及血红蛋白的转换调节,GATA-1 还可抑制STAT3 活性,在γ-珠蛋白5'-UTR 中与STATS3竞争结合,且过表达GATA1通过STAT3 逆转对γ-珠蛋白的沉默。miRNA 能够结合这些转录因子进而参与调控γ-珠蛋白基因表达,如miR-26b 可特异性激活GATA-1 转录因子,使其表达显著增加,提高K562 细胞中的γ-珠蛋白表达水平[36]。miR-34a可与STAT3相互作用,通过STAT3基因沉默来对γ球蛋白进行调控,使γ-珠蛋白表达增加[37]。miRNA还能通过参与细胞应激反应的NRF2 转录因子调节红系细胞的氧化应激耐受性及γ-珠蛋白的表达[38]。Li等[39]对镰状细胞性贫血患者的网织红细胞中的RNA 进行miRNA 表达谱分析,发现患者中HbF 含 量 差 异 与miR-144 相 关,miR-144 可 介 导NRF2基因沉默,从而抑制γ-珠蛋白表达。血红蛋白的表达主要是通过转录后修饰来调节,miRNA除了与转录因子形成复合物外,还能直接与γ-珠蛋白mRNA 相结合来影响其表达。Azzouzi 等[40]在脐带和外周血网织红细胞进行miRNA 筛选,证明miR-96 直接靶向结合γ-珠蛋白mRNA 的开放阅读框,以使γ-珠蛋白表达沉默。
4 miRNA在β-地贫中的治疗作用
目前,γ-珠蛋白基因的再激活能有效改善β-地贫患者临床症状,羟基脲是至今为止唯一获得FDA批准的HbF 诱导剂,能够有效诱导β-地贫患者体内γ-珠蛋白基因的表达,抑制无效红细胞生成,从而减轻患者的临床症状。羟基脲诱导HbF 的具体机制仍不明确,据已有的研究推测,羟基脲可能是通过调节GATA-1 和GATA-2 表达,延缓红细胞的成熟并刺激γ-球蛋白的表达,促进血红蛋白向HbF的转换[41]。最近研究发现另一种通过羟基脲介导γ-珠蛋白基因表达的新途径,是通过miRNA 介导的转录后调控。Mnika等[42]发现经羟基脲处理后22个miRNA 的表达发生了改变,而这些差异表达的miRNA 的分子靶标大多数与γ-珠蛋白基因调控相关,包括BCL11A(miR-148b-3p,miR-32-5p,miR-340-5p 和miR-29c-3p),MYB(miR-105-5p)和KLF3(miR-106b-5)和SP1(miR-29b-3p,miR-625-5p,miR-324-5p,miR-125a-5p,miR-99b-5p,miR-374b-5p 和miR-145-5p),它们在成人胎儿血红蛋白沉默中起重要作用。另一项研究在羟基脲的应答者中发现高水平表达的miR-210 和miR-486-3p,表明上述miRNA可能与羟基脲的最大耐受剂量相关联[43]。
5 总结与展望
目前,已经确定参与调控γ-珠蛋白基因的转录因子,如BCL11A、MYB、KLFs、ATF4、GATA-1等,对γ-珠蛋白基因调控机制有了新的认识。随着对miRNA 研究的深入及γ-珠蛋白基因调控网络的完善,发现miRNA 可靶向转录因子进而影响γ-珠蛋白表达,如miR-210、LIN28B、miR-438-3p、miR-30a和miR-138-5p 靶向BCL11A促进γ-珠蛋白基因的表达,另外,如miR-326、miR-15a、miR-16-1、miR-26b、miR-34a、miR-23a、miR-27a、miR-23355-5p 和miR-144 也可与相应的转录因子结合促进γ-珠蛋白的表达。除此之外,miRNA 也可直接结合γ-珠蛋白基因,抑制其表达,如miR-96。尽管现在已有对β-地贫患者进行基因治疗的相关研究,但存在操作难度大,有一定的治疗风险及费用高昂等问题,暂时无法在临床上大力推广。目前为止,内源性γ-珠蛋白基因的激活依然是可行性较高的治疗方向,我们可根据miRNA 对其的调控作用,制定相应靶向miRNA的抑制剂或导入外源性miRNA激活γ-珠蛋白基因,从而提高患者体内胎儿血红蛋白含量。但是,miRNA 的种类繁多,具有不同的调控途径,仍有许多miRNA 暂未探明其具体机制,相信在未来科研人员的努力下,miRNA 对γ-珠蛋白基因的调控研究将更加明朗,对β-地贫的发生发展的机制研究也会更加明确,这些都将为以后β-地贫的早期诊断及治疗提供巨大的帮助。
