细胞内白细胞介素17A和白细胞介素6测定在不稳定型心绞痛中的临床意义
2018-01-26陈晨胡佳云戴红芬罗雪亭刘旭光徐庆吕永楠徐红梅
陈晨,胡佳云,戴红芬,罗雪亭,刘旭光,徐庆,吕永楠,徐红梅
不稳定型心绞痛(UAP)的病理基础主要是冠状动脉(冠脉)内皮下不稳定斑块破裂、出血及继发血栓形成,也是冠状动脉粥样硬化性心脏病(冠心病)发展中一个不可预测的原因[1-5]。UAP的发生与冠脉狭窄程度无关,而与斑块的不稳定性和继发血栓形成密切相关。近年来越来越多的研究表明炎症反应与UAP的斑块不稳定性密切相关,动脉粥样硬化斑块(AS)中炎症细胞的浸润及其分泌的炎性细胞介质,特别是一些细胞因子在局部的相互诱生、协同作用,促进不稳定斑块的破裂[6-11]。最近研究显示,UAP受检者血清白介素-6(IL-6),白介素-17A(IL-17A)水平高于正常,提示IL-6,IL-17A可作为UAP斑块破裂的血清学标志物,有利于急性冠脉综合征(ACS)的早期识别和干预[12-17]。但目前对于这些细胞因子的检测,大部分在发病24 h后采集受检者血清,采用酶联免疫吸附法测定(ELISA),对于急性受检者,发病24 h后采集检测,并不能反映出早期检测,早期诊断,同时由于使用ELISA检测,又要耗时24 h以上,因此本文建立了一种更快捷、简单、有效的检测方法,通过流式细胞仪或者实时定量PCR检查胞内细胞因子的变化,不但能准确的检测到细胞因子(IL-6,IL-17A)在UAP受检者中升高,同时更早检测到IL-6,IL-17A在急性心肌梗死(AMI)和不稳定型心绞痛(UAP)受检者的变化,真正为UAP的早期识别和早期干预提供依据。
1 资料与方法
1.1 研究对象 选取湖北中医药大学心内科2016年5月~12月收治的心绞痛受检者135例,其中UAP受检者85例、稳定型心绞痛(SAP)受检者50例,另选择同期非冠心病受检者37例为对照组。入组标准:根据中华医学会心血管分会制定的UAP诊断和治疗建议确诊UAP受检者[18];SAP受检者根据慢性SAP诊断治疗指南确诊,并且受检者病情稳定;对照组均经冠脉造影排除冠心病。所有受检者除外肿瘤、肝肾功能不全、近期感染及其他免疫性疾病。所有受检者均签署知情同意。
1.2 实验试剂 APC-anti-human IL-6 mAbs,APC-anti-human IL-17A mAbs,PE-anti-human CD4,PE-anti-human CD14 mAbs,流式细胞仪用破膜剂、穿孔剂购自eBioscience公司;RPMI 1640,DMEM细胞基础培养基购自Gbico BRL公司;RNA提取试剂盒购子QIAGEN公司。
1.3 实验方法 ①血清采集及细胞因子测定:UAP、SAP受检者及对照者均在就医后冠状动脉造影前6 h和12 h各取10 ml外周静脉血,室温静置1 h,离心后收集上清血清液贮存于-80℃冰箱内备用。应用双抗体夹心ELISA法测定IL-6、IL-17A(ELISA试剂盒购自美国Biolegend公司)。②外周血单个核细胞(PBMC)的制备:抽取静脉血20 ml,肝素抗凝,将抗凝血加到人淋巴细胞分层液上(保持界面清晰),2000 rpm,离心20 min;用毛细吸管轻轻吸出乳白色的单个核细胞,加入适量PBS,混匀,室温1500 rpm,离心10 min,弃上清,重复洗涤一次;用基础RPMI-1640 1ml定容,计数细胞,调整细胞浓度至1×106/ml。③流式细胞仪检测胞内细胞因子IL-6和IL-17A的分泌:制备的单个核细胞接种到24孔板,1×106细胞/孔,加2ml RPMI-1640完全培养基。加入PMA(50 ng/ml),ionomycin(1 ug/ml)和golgiplug(1:1000)培养5 h,收获细胞然后用PE-anti-human CD4,PE-anti-human CD14 mAbs分别与细胞在4℃孵育0.5 h,洗去未结合的抗体3次。破膜剂37℃孵育20 min,离心收集细胞,洗去破膜剂。分别加入穿孔剂稀释的APC-anti-human IL-6,APC-anti-human IL-17A孵育30 min,收集细胞,洗3次,上机检测荧光细胞百分比。④RT-PCR检测IL-6和IL-17A的表达:用制备的单个核细胞,依照RNA提取试剂说明书,提取RNA,然后逆转录成cDNA,以合成的cDNA为模版,进行实时定量PCR检测。根据GenBank上发表的IL-17,IL-6序列设计荧光定量PCR引物,同时以GAPDH作为内参。序列如下:GAPDH-F:5'-ACCACAGTCCATGCCATCAC-3'GAPDH-R5'-TCCACCACCCTGTTGCTGTA-3';IL-17-F:5'-TGCCCCAACTCCTTCCGGCT-3',IL-17-R:5'-GGGTTCCTGAGGGGCTGGGT-3';IL-6-F:5'-GGCTCATTCTGCCCTCGAGCC-3',IL-6-R:5'-GGACCGAAGGCGCTTGTGGAG-3',退火温度56℃。
1.4 统计学方法 采用SPSS 11.0统计软件进行统计学处理。指标行正态性检验符合近似正态分布。计量资料采用(±s)表示,多组间比较采用单因素方差分析,组内两两比较采用q检验;计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组受检者一般资料比较 三组受检者在年龄、性别比、吸烟史、高血压、糖尿病、慢性肺脏疾病病史、血脂水平方面比较差异均无统计学意义(P>0.05),表1。
2.2 ELISA法检测结果 在受检者发病6 h,可以看出UAP组IL-6,IL-17A具有升高趋势,但没有统计学差异(P>0.05)。与对照组相比,发病12 h UAP组细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05);与SAP组相比,发病12h UAP组细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05),表2。
2.3 流式细胞仪检测结果 与对照组相比,发病6h SAP组与UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05);与SAP组相比,发病6h UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05)。与对照组相比,发病12h SAP组与UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05)。与对照组相比,发病12h UAP组细胞内细胞因子IL-17A,IL-6水平均升高,差异均有统计学意义(P<0.05);与对照组相比,发病12h SAP组细胞内细胞因子IL-17A,IL-6水平均升高,差异均有统计学意义(P<0.05),图1~2。
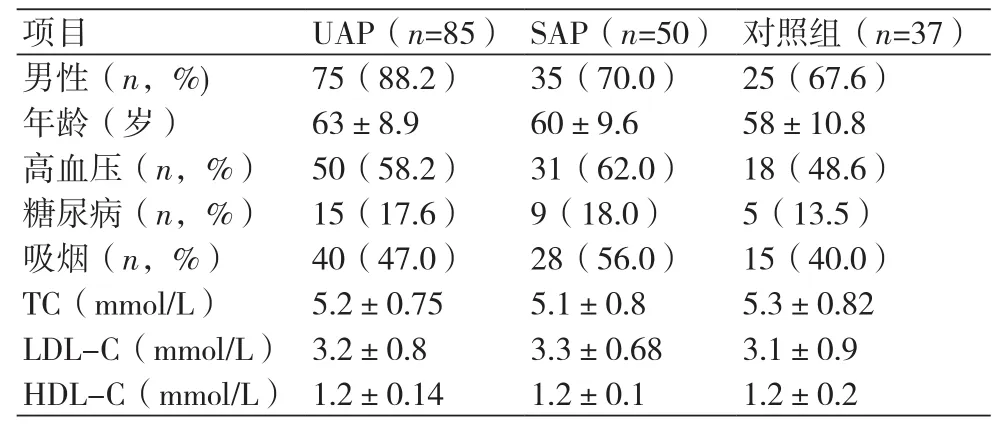
表1 三组受检者的一般情况表
表2 三组受检者不同时间血清中IL-6、IL-17A的水平(±s)

表2 三组受检者不同时间血清中IL-6、IL-17A的水平(±s)
注:IL-6:白介素-6;IL-17A:白介素-17A;与对照组相比,aP<0.05; 与SAP组相比,bP<0.05
组别 IL-6 IL-17A 6 h 12 h 6 h 12 h对照组(n=37) 20±9.6 11±4.8 4±1.9 6.2±1.6 SAP(n=50) 22±9.6 18±6.2 4±2.6 7±2.4 UAP(n=85) 24±9.6 45±8.8ab 5±1.3 14±3.2ab
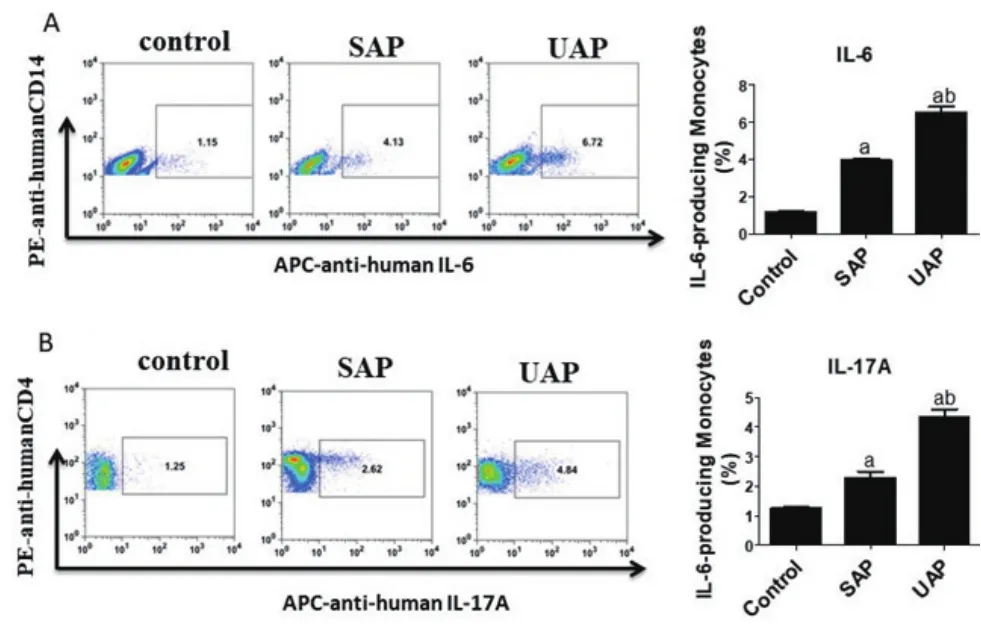
图1 流式细胞以检测三组受检者发病6 h后外周血单个核细胞中IL-6、IL-17A的水平(注:与对照组相比,aP<0.05; 与SAP组相比,bP<0.05)

图2 流式细胞以检测三组受检者发病12 h后外周血单个核细胞中IL-6、IL-17A(注:与对照组相比,aP<0.05; 与SAP组相比,bP<0.05)
2.4 RT-PCR检测结果 结果与流式细胞仪检测结果相似,与对照组相比,发病6h SAP组与UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05);与SAP组相比,发病6h UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05)。与对照组相比,发病12h SAP组与UAP组细胞内细胞因子IL-17A,IL-6水平都明显升高,差异均有统计学意义(P<0.05)。与对照组相比,发病12h UAP组细胞内细胞因子IL-17A,IL-6水平均升高,差异均有统计学意义(P<0.05);与对照组相比,发病12h SAP组细胞内细胞因子IL-17A,IL-6水平均升高,差异均有统计学意义(P<0.05),图3A、1B。
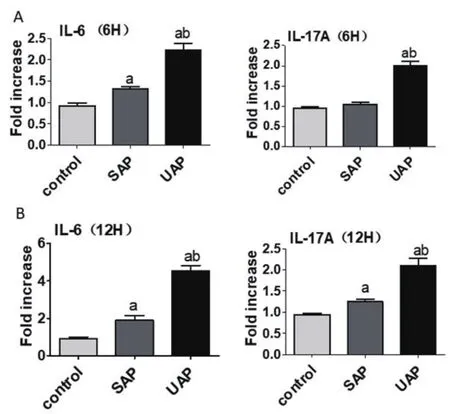
图3 实时定量PCR检测四组受检者发病6 h、12 h后外周血单个核细胞中IL-6、IL-17A的水平(注:与对照组相比,aP<0.05; 与SAP组相比,bP<0.05)
3 讨论
研究表明炎症可以通过炎症分子促进动脉粥样硬化。作为炎症分子,白细胞介素6(IL-6)在炎症发生,发展中扮演重要作用[7,14-16]。IL-6主要由单核巨噬细胞产生,能够促进动脉粥样硬化斑块处的血管新生,促进肉芽肿的形成,在粥样硬化斑块的脂质条纹单纯纤维斑块中能检出高浓度的IL-6[16,19-21],当斑块有炎症反应或破裂时,血中IL-6浓度升高[6,7,16,17,22,23],因此IL-6被认为是冠脉局部斑块和外周血循环的炎症标志物之一。另有研究表明UAP受检者的IL-6血浆浓度与严重冠脉事件的风险相关, 可作为UAP受检者疾病突发的血清标志物[14,19]。
IL-17A是新近发现的细胞因子,它由激活的CD4+T淋巴细胞分泌,目前研究表明它可参与T淋巴细胞与造血系统的相互作用,其主要生物学功能是可刺激多种其他细胞因子的产生,如IL-6、白介素-8(IL-8)、粒细胞集落刺激因子(G-CSF)和前列环素2(PGE2)。它通过刺激IL-6和PGE2的产生,加强局部炎症反应。特别诱导细胞间黏附因子(ICAM)产生促进T细胞反应。IL-17A通过上述作用参与炎症反应过程[24]。IL-17A受体在体内的广泛存在,也提示IL-17A具有比较重要和广泛的生物学活性。由此可见IL-6,IL-17A都在炎症的发生和形成中起到重要作用,同时已经有报道,发现在UAP受检者血清中IL-6,IL-17A浓度升高,但这些报道都没有明确血清中细胞因子升高的时间点,很难作为UAP诊断识别的依据。
本研究利用流式细胞仪和实时定量PCR的方法,通过严格的时间点限制,发现在UAP受检者中,发病6 h,细胞因子IL-6,IL-17A已经明显升高,而此时血清中细胞因子的浓度并没有明显变化,当血清中细胞因子升高时,胞内细胞因子升高的更加明显,同时我们首次发现对于SAP受检者,在发病早期,其细胞因子IL-6也有明显的升高,由此可以推断细胞因子IL-6,IL-17A在炎症发生过程中,作为标志物能更早的反应出来炎症变化的程度,也更能灵敏的反映出受检者的病情,同时说明通过胞内细胞因子和RT-PCR的方法检测比传统ELISA法更敏感,特异性也更好。当然在检测中我们并没有明确这些细胞因子的升高是由于细胞本身受到炎症刺激分泌增高,还是由于受到其他细胞的相互作用导致的升高,同时这些分泌细胞的细胞因子是外周血循环的细胞还是由于斑块破裂释放到外周血的细胞,这是后面需要通过纯化细胞,细胞迁移实验,以及动物模型进一步明确的问题。
[1] 蒋世亮,张运,季晓平,等. 我国急性心肌梗死诊断和治疗指南对住院受检者治疗和后的影响[J]. 中华心血管病杂志,2005,33(9):779-81.
[2] Kuznetsova MA,Vaulin NA,Masenko VP,et al. Non-ST-elevation acute coronary syndrome.Comparison of effects of atorvastatin and rosuvastatin on blood levels of lipids and markers of inflammation[J].Kardiologiia, 2010,50(7):21-5.
[3] Kirbis S,Breskvar UD,Sabovic M,et al. Inflammation markers in patients with coronary artery disease--comparison of intracoronary and systemic levels[J]. Wien Klin Wochenschr,2010,122(Suppl 2):31-4.
[4] Wu Y,Zhang W,Liu W,et al. The double-faced metabolic and inflammatory effects of standard drug therapy in patients after percutaneous treatment with drug-eluting stent[J]. Atherosclerosis,2011,215(1):170-5.
[5] Radovic VV. [Predictive value of inflammation and myocardial necrosis markers in acute coronary syndrome[J]. Med Pregl,2010,63(9-10):662-7.
[6] Tanaka A,Imanishi T,Kitabata H,et al. Distribution and frequency of thin-capped fibroatheromas and ruptured plaques in the entire culprit coronary artery in patients with acute coronary syndrome as determined by optical coherence tomography[J]. Am J Cardiol,2008,102(8):975-9.
[7] Qian JY. Detection of vulnerable plaques rather than the culprit lesions in patients with acute coronary syndrome using virtual histology intravascular ultrasound imaging[J]. Chin Med J (Engl),2009,122(6):610-11.
[8] Motoyama S,Sarai M,Harigaya H,et al. Computed tomographic angiography characteristics of atherosclerotic plaques subsequently resulting in acute coronary syndrome[J]. J Am Coll Cardiol,2009,54(1):49-57.
[9] Sato K,Nuki T,Gomita K,et al. Statins reduce endothelial cell apoptosis via inhibition of TRAIL expression on activated CD4 T cells in acute coronary syndrome[J]. Atherosclerosis, 2010,213(1):33-9.
[10] Yan J,Gong J,Chen G,et al. Evaluation of serum soluble OX40 ligand as a prognostic indicator in acute coronary syndrome patients[J]. Clin Chim Acta, 2010,411(21-22):1662-5.
[11] Hibi K,Kimura T,Kimura K,et al. Clinically evident polyvascular disease and regression ofcoronary atherosclerosis after intensive statin therapy in patients with acute coronary syndrome: serial intravascular ultrasound from the Japanese assessment of pitavastatin and atorvastatin in acute coronary syndrome (JAPAN-ACS) trial[J].Atherosclerosis,2011,219(2):743-49.
[12]Ammirati E,Cianflone D,Banfi M,et al. Circulating CD4+CD25hiCD127lo regulatory T-Cell levels do not reflect the extent or severity of carotid and coronary atherosclerosis[J].Arterioscler Thromb Vasc Biol,2010,30(9):1832-41.
[13] Fragoso JM,Delgadillo H,Juarez-Cedillo T,et al. The interleukin 6-572 G>C (rs1800796) polymorphism is associated with the risk of developing acute coronary syndrome[J]. Genet Test Mol Biomarkers,2010,14(6):759-63.
[14] Blagodatskikh KA,Evdokimova MA,IuV A,et al. [Gene IL6 G(-174)C and gene IL10 G(-1082)A polymorphisms are associated with unfavourable outcomes in patients with acute coronary syndrome[J].Mol Biol (Mosk),2010,44(5):839-46.
[15] Zhu F,Wang Q,Guo C,et al. IL-17 induces apoptosis of vascular endothelial cells: a potential mechanism for human acute coronary syndrome[J]. Clin Immunol,2011,141(2):152-60.
[16] Souza JR,Oliveira RT,Blotta MH,et al. Serum levels of interleukin-6(Il-6), interleukin-18 (Il-18) and C-reactive protein (CRP) in patients with type-2 diabetes and acute coronary syndrome without ST-segment elevation[J]. Arq Bras Cardiol,2008,90(2):86-90.
[17] Correale M,Brunetti ND,De Gennaro L,et al. Acute phase proteins in atherosclerosis (acute coronary syndrome)[J]. Cardiovasc Hematol Agents Med Chem,2008,6(4):272-7.
[18] 李历. 不稳定型心绞痛诊断和治疗现状[J]. 医学综述, 2001,7(7):410.[19] Nishida H,Horio T,Suzuki Y,et al. Interleukin-6 as an independent predictor of future cardiovascular events in high-risk Japanese patients:comparison with C-reactive protein[J]. Cytokine,2011,53(3):342-6.
[20] Methe H,Kim JO,Kofler S,et al. Expansion of circulating Tolllike receptor 4-positive monocytes in patients with acute coronary syndrome[J]. Circulation,2005,111(20):2654-61.
[21] Guo M,Mao X,Ji Q,et al. miR-146a in PBMCs modulates Th1 function in patients with acute coronary syndrome[J]. Immunol Cell Biol,2010,88(5):555-64.
[22] Andrie RP,Bauriedel G,Braun P,et al. Increased expression of C-reactive protein and tissue factor in acute coronary syndrome lesions: Correlation with serum C-reactive protein, angioscopic findings, and modification by statins[J]. Atherosclerosis,2009,202(1):135-43.
[23] Imazu M,Ono K,Tadehara F,et al. Plasma levels of oxidized low density lipoprotein are associated with stable angina pectoris and modalities of acute coronary syndrome[J]. Int Heart J, 2008,49(5):515-24.
[24] Zhu F,Wang Q,Guo C,et al. IL-17 induces apoptosis of vascular endothelial cells: a potential mechanism for human acute coronary syndrome[J]. Clin Immunol,2011,141(2):152-60.
