黑龙江省水稻褐变穗病病原鉴定及生物学特性研究
2018-01-25张俊华李云鹏韩雨桐杨明秀钟庆艳
张俊华,李云鹏,韩雨桐,杨明秀,宋 爽,钟庆艳,范 琳
(东北农业大学农学院,哈尔滨 150030)
水稻(Oryza sativa L.)是黑龙江省重要粮食作物之一。近年,受水稻种植面积增大、种植品种单一及环境条件等因素影响,水稻病害种类增多,危害逐年加重,成为限制黑龙江省水稻高产稳产主因[1]。
水稻褐变穗病是我国水稻生产中新型病害,病害发生与温度和降雨密切相关,已成为影响粳稻产量和品质主要因素之一[2],全国各水稻产区均有该病发生[3]。感染褐变穗病后,水稻稻粒变色、霉烂、空粒及稻米畸形,影响稻谷外观,降低稻米品质和产量[4]。相关研究表明,水稻穗部病害致病菌较多,不同地区病原菌种类不同。黄世文等研究表明,引起水稻穗腐病原主要为镰孢菌属(Fu⁃sarium sp.)、链格孢菌属(Alternaria sp.)、蠕孢菌属(Bipolaris sp.)、弯孢菌属(Curvularia sp.)[5-6]。水稻褐变穗病又称为稻谷霉斑病(Pecky rice)、谷粒斑点病(Kernel spotting)或脏穗(Dirty paincle)[7],发病原因为:①稻椿象取食使水稻稻粒变色且真菌从伤口侵入[8];②由多种真菌混合侵染造成[9-10];③由颍壳伯克氏菌(Burkholderiaglumae)引起[11]。
水稻褐变穗病症状与稻瘟病中谷粒瘟相似,病原菌尚无定论,致病机理尚不清楚,缺乏该病害循环和发病规律认知[12]。本试验对采自黑龙江省14个市县水稻产区具有典型症状水稻褐变穗病样作病原菌分离,利用形态学及分子生物学技术结合方法鉴定病原菌,测定病原菌生物学特性,为水稻褐变穗病防控提供科学依据。
1 材料与方法
1.1 材料
2016年7~9月采集黑龙江省14个县市(哈尔滨、虎林、方正、饶河、鸡西、海林、尚志、庆安、密山、牡丹江等)水稻主产区水稻田中典型病样,置于采样箱内带回实验室分离。
1.2 方法
1.2.1 病原菌的分离及纯化
采用周而勋等快速分离真菌方法[13],将采集水稻褐变穗病样本用自来水冲洗干净、晾干。剥离发病颖壳,病健交界处剪取0.2 cm×0.2 cm病组织。浸泡在75%乙醇中表面消毒30 s,放入0.1%升汞中3 min,无菌水洗涤3次,用无菌滤纸将病组织水分吸干。将处理好病组织放入PDA培养基中,每板培养基中十字交叉对称放入四块病组织,置于25℃恒温箱中培养。待病组织周围长出菌丝后,挑出边缘菌落放入新PDA培养基中,25℃恒温培养5 d后,观察菌落特征是否一致,单孢分离和纯化[14]。将纯化后菌株放入PDA斜面培养基中,25℃恒温培养7 d后,于4℃冰箱中冷藏保存备用。共获得119个纯化菌株。
1.2.2 病原菌致病性测定
种植水稻感病品种空育131(水稻种子由东北农业大学水稻研究所提供),将水稻催芽后种植于直径20 cm塑料桶内,每个塑料桶留苗10株,常规管理,待水稻长到抽穗期备用。选取来自不同地区3种具有代表性20个链格孢属菌株,5个镰孢菌属菌株,2个青霉菌属菌株作致病力测定。用灭菌后无菌水将纯化后菌株配制浓度为1×106个·mL-1孢子悬浮液。将孢子悬浮液均匀喷洒在处于抽穗期健康水稻穗上,覆盖塑料膜保湿24 h,对照组喷洒无菌水。10 d后观察植株发病情况,根据柯赫氏法则,分离发病植株,观察其生物学形态是否与原菌株相同[15]。
1.2.3 病菌形态学鉴定
将分离纯化后菌株接种在PDA培养基上,待菌株长满培养基。观察菌株在PDA培养基上菌落形态、质地和色泽、分生孢子与分生孢子梗形态[16-18]。
1.2.4 分子生物学鉴定
根据致病性测定结果,在3类菌株中,仅链格孢属(Alternaria sp.)菌株具有致病性,对链格孢属代表菌株作分子生物学鉴定。
1.2.4.1 DNA提取
选取链格孢菌代表性菌株接种于马铃薯葡萄糖琼脂培养基(PDA)中,在25℃恒温箱中培养7 d后,转至PDB液体培养基,28℃,250 r·min-1振荡培养4 d,过滤收集菌丝,-20℃保存备用,参考文献[19]方法,采用CTAB法提取病菌基因组DNA。
1.2.4.2 PCR扩增体系及反应程序
用真菌核糖体rDNA区通用引物ITS1(5'TCCG TAGGTGAACCTGCGG 3')和 ITS4(5'TCCTCCGCT TATTGATATGC 3')[19]作PCR扩增。
PCR扩增反应体系为:2.0 μL模板DNA(10 ng),0.6 μL上游引物(5 μmol),0.6 μL下游引物(5 μmol),2.0 μL dNTP (2.5mmol·L-1),0.3 μL Taq DNA聚合酶(5 U·μL-1),2.5 μL 10×buffer缓冲液, 3.0 μL Mg2+(25 mmol·L-1),14 μL ddH2O ,总体积为25 μL。
PCR扩增反应程序为:94℃下预变性3 min;94℃变性40 s、55℃退火30 s,72℃延伸1.5 min,30个循环,72℃延伸8 min,4℃保存[19-20]。
1.2.4.3 电泳检测及测序
PCR扩增结束后,取5 μL与2 μL溴酚蓝混合,加入加样孔,于1%琼脂糖凝胶、1×TBE电泳缓冲液环境下,以6 V·cm-1电泳检测,30 min后取出凝胶于凝胶成像系统拍照,记录结果。胶回收得到纯化PCR产物,送上海生工生物公司测定序列[21]。
1.2.5 病原菌生物特性
根据致病性测定结果,在3类菌株中,仅链格孢属(Alternaria sp.)菌株具有致病性,研究链格孢属代表菌株生物学特性。
1.2.5.1 培养基对病原菌菌丝生长、产孢量影响
采用生长速率法[22]。从培养5 d的菌落边缘取5 mm菌碟,分别接种到大米煎汁培养基(RA)、大米马铃薯煎汁培养基(PRA)、胡萝卜煎汁培养基(CA)、胡萝卜马铃薯煎汁培养基(PCA)、白菜煎汁培养基(CCA)、白菜马铃薯煎汁培养基(PCCA)、马铃薯葡萄糖琼脂培养基(PDA)、马铃薯蔗糖琼脂培养基(PSA)平板上,置于25℃恒温培养。5 d后利用十字交叉法测量菌落直径。15 d后用无菌水冲洗平板中孢子,利用血球计数板计算孢子浓度,每个处理3次重复。
1.2.5.2 温度对病原菌菌丝生长、产孢量及孢子萌发影响
从培养5 d的菌落边缘取5 mm菌碟,接种于PDA 平板上,分别于 4、10、15、20、22、25、27、30℃条件下培养。5 d后利用十字交叉法测量菌落直径[23-24]。15 d后洗下平板中孢子,利用血球计数板计算孢子浓度。每个处理3次重复。挑取病原菌分生孢子,无菌水配制浓度为1×104个·mL-1孢子悬浮液。将孢子悬浮液滴于凹玻片上,置于铺有湿润滤纸培养皿中保湿,分别置于4、10、15、20、25、30、32和35℃环境下培养,6 h后镜检300个分生孢子,统计分生孢子萌发率。孢子萌发以芽管长度超过孢子直径一半为标准。每个处理3次重复。
1.2.5.3 pH对病原菌菌丝生长、产孢量及孢子萌发影响
用1 mol·L-1NaOH 和 1 mol·L-1HCl将PDA培养基pH 调整为4、5、5.5、6、6.5、7、7.5、8、9、10、12。从培养5 d菌落边缘取5 mm菌碟,接种于不同pH的PDA平板上,25℃下恒温培养。5 d后利用十字交叉法测量菌落直径。15 d后洗下平板中孢子,利用血球计数板计算孢子浓度。每个处理3次重复。挑取病原菌的分生孢子,用无菌水配制浓度为1×104个·mL-1的孢子悬浮液。调整pH,6 h后镜检300个分生孢子,统计分生孢子萌发率。每个处理3次重复。
1.2.5.4 光照对病原菌菌丝生长、产孢量及孢子萌发影响
从培养5 d菌落边缘取约5 mm菌碟,接种于PDA平板上,分别置于12 h光暗交替、24 h全黑暗、24 h全光照环境下。25℃环境下恒温培养。5 d后利用十字交叉法测量菌落直径。15 d后洗下平板中孢子,利用血球计数板计算孢子浓度。每个处理3次重复。挑取病原菌分生孢子,用无菌水配制浓度为1×104个·mL-1孢子悬浮液。并置于上述光照环境下。6 h后镜检300个分生孢子,统计分生孢子萌发率。每个处理3次重复。
1.2.5.5 碳源对病原菌菌丝生长及产孢量影响
取在PDA培养基上生长5 d后水稻褐变穗病菌菌落,在菌落边缘用打孔器打取5 mm菌饼,接种到以查氏培养基为基本培养基,分别以等量葡萄糖、蔗糖、麦芽糖、乳糖、果糖、可溶性淀粉、甘油、甘露醇配制的各种碳源培养基,以不加碳源查氏培养基为对照组。
25℃恒温培养,5 d后采用十字交叉法测量各处理组菌落直径。15 d后用10 mL无菌水洗下平板中孢子,血球计数板计算孢子浓度。每个处理3次重复。
1.2.5.6 氮源对病原菌菌丝生长及产孢量影响
取在PDA培养基上生长5 d水稻褐变穗病菌菌落,在菌落边缘用打孔器打取5 mm菌饼,接种到以查氏培养基为基本培养基,分别以等量硫酸铵、硝酸铵、蛋白胨、硝酸钠、酵母膏、牛肉膏、氯化铵、胰蛋白胨配制的各种氮源培养基上,以不加氮源查氏培养基为对照。25℃条件下恒温培养,5 d后采用十字交叉法测量各处理组菌落直径。15 d后用10 mL无菌水洗下平板中孢子,血球计数板计算孢子浓度。每个处理3次重复。
2 结果与分析
2.1 病原菌分离结果
采集黑龙江省14个市县水稻病样,经过分离纯化与单孢分离,共得到119个菌株,根据菌株在PDA平板中菌落形态特征与分生孢子形态,归类相似形态菌株3类,经鉴定后编号,A~C,其中A类112株,均为链格孢属(A.alternata);B类5株,均为镰孢菌属(Fusarium sp.);C类2株,均为青霉菌(Penicillium sp.)。
2.2 病原菌致病性测定
由图1可知,A类20个菌株在接种后均引起水稻穗部产生褐色病斑,发病症状与田间自然发病症状相同。从发病稻穗上再分离得到菌株接种在PDA平板上,培养特性及镜检观察形态特征与分离纯化后A类菌株一致。B类与C类菌株均未引起水稻发病。

图1 水稻接种病菌发病情况Fig.1 Disease symptoms of rice after inoculation
2.3 病原菌形态学鉴定
由图2可知,供试菌株在25℃恒温、PDA培养基上初期菌落形态为圆形灰白色,随后逐渐转为墨绿色。菌落边缘菌丝为灰白色,气生菌丝发达。显微观察,菌落菌丝发达,具有隔膜,淡褐色,常分枝。
分生孢子梗单生,直立或略弯,45~70.5 μm×3.5~5.5 μm。分生孢子单生或成短链状。形状多为棍棒形、卵形、近椭圆形或倒梨形,褐色,横隔3~8个,纵膈1~4个,分隔处略缢缩,(21~38.5)μm×(8.5~13.5)μm。顶端喙状细胞为短喙柱状或锥状,(0~35)μm×(2.5~4)μm(见图2)。

图2 病菌形态特征Fig.2 Morphology Characteristic of Alternaria alternata
2.4 病原菌的分子生物学鉴定
挑选代表性菌株A98送至上海生工生物公司作分子生物学鉴定。其PCR产物琼脂糖凝胶电泳检测结果如图3所示。

图3 水稻褐变穗病病菌(Alternaria alternata)rDNA-ITS的PCR扩增结果Fig.3 rDNA-ITS PCR amplification of rice brown panicle disease(A.alternat)
测序分析扩增产物,结果如下:
ACCTGCGGAGGGATCATTACACAAATATGAA GGCGGGCTGGAACCTCTCGGGGTTACAGCCTTGCT GAATTATTCACCCTTGTCTTTTGCGTACTTCTTGTT TCCTTGGTGGGTTCGCCCACCACTAGGACAAACAT AAACCTTTTGTAATTGCAATCAGCGTCAGTAACAA ATTAATAATTACAACTTTCAACAACGGATCTCTTG GTTCTGGCATCGATGAAGAACGCAGCGAAATGCG ATAAGTAGTGTGAATTGCAGAATTCAGTGAATCA TCGAATCTTTGAACGCACATTGCGCCCTTTGGTAT TCCAAAGGGCATGCCTGTTCGAGCGTCATTTGTAC CCTCAAGCTTTGCTTGGTGTTGGGCGTCTTGTCTCT AGCTTTGCTGGAGACTCGCCTTAAAGTAATTGGCA GCCGGCCTACTGGTTTCGGAGCGCAGCACAAGTC GCACTCTCTATCAGCAAAGGTCTAGCATCCATTAA GCCTTTTTTTCAACTTTTGACCTCGGATCAGGTAG GGATACCCGCTGAACTTAAGCATATCAATAA
在GenBank上比对测序结果,表明供试菌株rDNA-ITS序列与菌株 A.alternata(GenBank ID:gb|HQ645083.1|)物种同源性最高达99.9%。由序列对比结果可知,结合传统形态学鉴定结果,确定该菌株为链格孢(Alternaria alternata)。
2.5 病原菌的生物学特性
2.5.1 培养基对病原菌菌丝生长、产孢量影响
水稻褐变穗病病原菌在不同培养基上均可生长,但生长速率不同(见图4),第5天菌落直径59.60~80.94 mm,70 mm以上培养基有大米煎汁培养基、大米马铃薯煎汁培养基、PSA培养基、白菜马铃薯煎汁培养基,60~70 mm培养基有胡萝卜马铃薯煎汁培养基、胡萝卜煎汁培养基和PDA培养基,病原菌在白菜煎汁培养基中生长速率最慢,菌落直径<60 mm。病原菌在大米煎汁培养基和大米马铃薯煎汁培养基中菌落直径差异不显著,在马铃薯蔗糖琼脂培养基和白菜马铃薯煎汁培养基中菌落直径差异不显著。
水稻褐变穗病病原菌在不同培养基上均可产孢,但不同培养基中产孢量差异显著(见图5)。其中,病原菌在大米马铃薯煎汁培养基中第15天时产孢量最高,且显著高于其他处理,产孢量分别为白菜马铃薯煎汁培养基产孢量1.1倍、胡萝卜马铃薯煎汁培养基产孢量1.7倍、白菜煎汁培养基产孢量1.8倍、胡萝卜煎汁培养基产孢量3.4倍、PDA培养基产孢量5.4倍、PSA培养基中产孢量8.4倍、大米煎汁培养基产孢量12.6倍。

图4 不同培养基对水稻褐变穗病病菌(Alternaria alternata)菌丝生长影响Fig.4 Influence of different culture medium on mycelial growth of rice brown panicle disease(A.alternat)

图5 不同培养基对水稻褐变穗病病菌(Alternaria alternata)产孢量影响Fig.5 Influence of different culture medium on sporulation of rice brown panicle disease(A.alternat)
2.5.2 温度对病原菌菌丝生长、产孢量及孢子萌发影响
病原菌在4~30℃时均可生长,但不同温度下生长差异显著(见图6)。最适生长温度为22~27℃,最适培养温度为27℃,第5天时菌落直径可达68.69 mm。在4℃低温下,菌丝生长极为缓慢,几乎不生长。温度高于30℃时菌丝生长缓慢,菌落直径变小。
病原菌在10~30℃时可产孢,但不同温度下差异显著(见图7)。其中,病原菌在27℃下产孢量最高,第15天时产孢量为6.50×104个·mL-1,产孢量分别为30℃产孢量1.3倍、25℃产孢量1.7倍、22℃产孢量2.3倍、20℃产孢量3.1倍、15℃产孢量4.1倍、10℃产孢量7.6倍。病原菌在4℃时无法产孢,第15天时产孢量为0。
病原菌孢子在10~35℃时均可萌发,不同温度下差异显著(见图8)。最适萌发温度为25~32℃,分生孢子萌发率达65%以上,最适培养温度为30℃,分生孢子萌发率最高,为99.89%。30℃下病原菌分生孢子萌发率分别为25℃下分生孢子萌发率1.2倍、32℃下分生孢子萌发率1.4倍、35℃下分生孢子萌发率1.5倍。病原菌孢子在20和15℃时,分生孢子萌发率较低,分别为30℃下病原菌分生孢子萌发率0.5倍和0.3倍;病原菌孢子在10℃时,分生孢子萌发率最低,仅8.67%;病原菌孢子在4℃时,分生孢子无法萌发。

图6 不同温度对水稻褐变穗病病菌(Alternaria alternata)菌丝生长影响Fig.6 Influence of different temperature on mycelial growth of rice brown panicle disease(A.alternat)

图7 不同温度对水稻褐变穗病病菌(Alternaria alternata)产孢量影响Fig.7 Influence of different temperature on sporulation of rice brown panicle disease(A.alternat)

图8 不同温度对水稻褐变穗病病菌(Alternaria alternata)分生孢子萌发影响Fig.8 Influence of different temperature on spore germination of rice brown panicle disease(A.alternat)
2.5.3 pH对病原菌菌丝生长、产孢量及孢子萌发影响
病原菌在pH 4~12范围均可生长,但不同pH下生长差异显著(见图9)。最适培养pH为6.5,第5天时菌落直径可达77.23 mm。此外相应递减,但在酸性条件下生长量减少幅度大于碱性,说明病原菌对碱性条件适应力更强。
病原菌在pH 4~12范围可产孢,但不同pH下差异显著(见图10)。其中,病原菌在pH为6.5时产孢量最高,第15天时产孢量为5.32×104个·mL-1。在偏碱性环境下,产孢量略大于偏酸性环境,说明中性偏碱环境更利于产孢。病原菌在pH为4时产孢量最低,第15天时产孢量为pH 6.5时产孢量0.14倍。
病原菌孢子在pH 4~11范围均可萌发,不同pH下差异显著(见图11)。最适pH 6~8,分生孢子萌发率达60%以上,最适培养pH为7,分生孢子萌发率最高,为99.67%;病原菌孢子在pH为4、5、9、10和11时,分生孢子萌发率较低,均低于55%。说明病原菌处于中性偏酸、中性或中性偏碱条件下更利于孢子萌发,强酸强碱条件下,分生孢子无法萌发。

图9 不同pH对水稻褐变穗病病菌(Alternaria alternata)菌丝生长影响Fig.9 Influence of different pH on mycelial growth of rice brown panicle disease(A.alternat)

图10 不同pH对水稻褐变穗病病菌(Alternaria alternata)产孢量影响Fig.10 Influence of different pH on sporulation of rice brown panicle disease(A.alternat)

图11 不同pH对水稻褐变穗病病菌(Alternaria alternata)分生孢子萌发影响Fig.11 Influence of different pH on spore germination of rice brown panicle disease(A.alternat)
2.5.4 光照对病原菌菌丝生长、产孢量及孢子萌发影响
病原菌在不同光照条件下均可生长,但在不同光照条件下生长差异显著(见图12)。最适光照条件为24 h黑暗,第5天时菌落直径达69.74 mm,为病原菌在12 h光照12 h黑暗光照条件下菌落直径的1.02倍;病原菌在24 h光照条件下生长速率最慢,第5天时菌落直径为24 h黑暗条件下0.95倍。说明黑暗条件有利于菌丝生长,光照条件对病原菌生长有抑制作用。
病原菌在不同光照条件下均可产孢,但在不同光照条件下差异显著(见图13)。其中,病原菌在24 h黑暗条件下产孢量最高,第15天时产孢量为7.56×104个·mL-1,产孢量为12 h光照12 h黑暗条件1.7倍,是24 h光照条件2.3倍。光照对菌落直径影响与产孢量结果趋势一致。
病原菌孢子在不同光照条件下均可萌发,在不同光照条件下差异显著(见图14)。最适光照条件为24 h光照,分生孢子萌发率最高,为98.67%;病原菌孢子在其他两个处理条件下,萌发率达90%以上。光照对分生孢子萌发影响与菌落直径和产孢量结果相反。

图12 不同光照条件对水稻褐变穗病病菌(Alternaria alternata)菌丝生长影响Fig.12 Influence of different illumination on mycelial growth of rice brown panicle disease(A.alternat)

图13 不同光照条件对水稻褐变穗病病菌(Alternaria alternata)产孢量影响Fig.13 Influence of different illumination on sporulation of rice brown panicle disease(A.alternat)

图14 不同光照条件对水稻褐变穗病病菌(Alternaria alternata)分生孢子萌发影响Fig.14 Influence of different illumination on spore germination of rice brown panicle disease(A.alternat)
2.5.5 碳源对病原菌菌丝生长及产孢量影响
水稻褐变穗病菌在不同碳源培养基中菌丝生长速率(见图15),病原菌在各处理碳源培养基中均可生长。病菌菌丝生长速率最快碳源为葡萄糖。病原菌在对照组不加碳源查氏培养基中生长时,5 d后菌落直径为65.71 mm;当碳源为葡萄糖、果糖、甘油和蔗糖时,菌丝生长速率均高于对照组,5 d后各处理菌落直径分别是对照1.2倍、1.1倍、1.05倍、1.05倍和1.0倍,说明碳源为葡萄糖、果糖、甘油和蔗糖时,促进菌丝生长;而当碳源为麦芽糖、乳糖和甘露醇时,菌丝生长速率均低于对照组,菌落生长直径分别为对照0.99倍、0.97倍和0.84倍。
水稻褐变穗病菌在不同碳源培养基中产孢量(见图16),病原菌在各处理中均可产孢。对照组中,病原菌15 d后产孢量为1.58×104个·mL-1;碳源为麦芽糖时,病原菌15 d后产孢量最多,为对照8.7倍,与其他处理间差异显著;碳源为果糖和蔗糖时,病原菌15 d后产孢量较多,产孢量分别为对照5.0倍和4.9倍,且两组间差异不显著;碳源为可溶性淀粉、甘露醇、乳糖时,病原菌15 d后产孢量较少,分别为对照1.5倍、1.3倍和1.1倍;碳源为葡萄糖和甘油时,病原菌15 d后产孢量最少,分别为对照0.75倍和0.34倍。碳源为麦芽糖、果糖、蔗糖、可溶性淀粉、甘露醇和乳糖时,比对照组产孢量多,说明这6种碳源对病原菌产孢有促进作用;而碳源为葡萄糖与甘油时,比对照组产孢量少,说明2种碳源对病原菌产孢有抑制作用。不同碳源对病原菌菌丝生长影响不大,但对病菌产孢量影响较大。
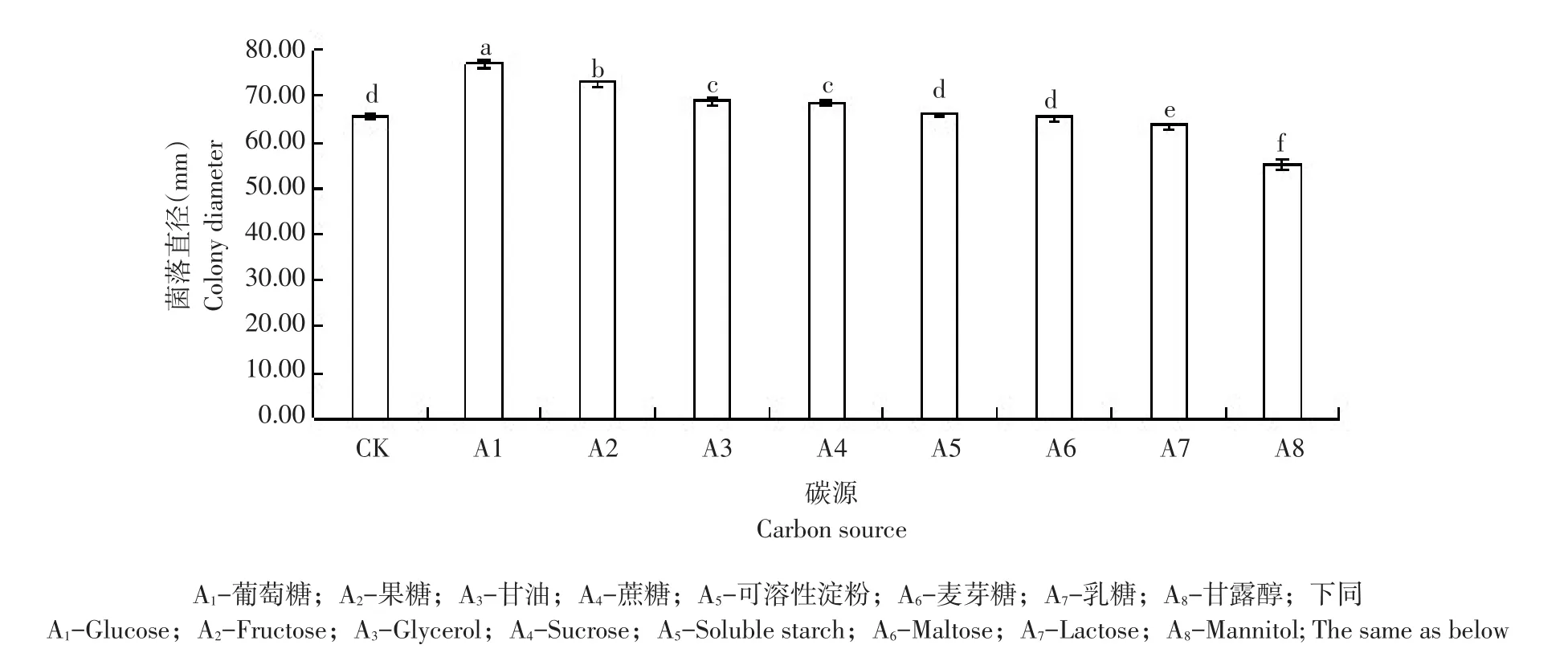
图15 不同碳源对水稻褐变穗病菌(Alternaria alternata)菌丝生长影响Fig.15 Influence of different carbon source on mycelial growth of rice brown panicle disease(A.alternat)

图16 不同碳源对水稻褐变穗病菌(Alternaria alternata)产孢量影响Fig.16 Influence of different carbon source on sporulation of rice brown panicle disease(A.alternat)
2.5.6 氮源对病原菌菌丝生长及产孢量影响
水稻褐变穗病菌在不同氮源培养基中菌丝生长速率(见图17),病菌菌丝在各处理中均可生长。氮源为胰蛋白胨时,病菌菌丝生长速率最快,与各处理间差异显著。病菌在对照组培养基中生长时,5 d后菌落直径为65.71 mm。氮源为胰蛋白胨、牛肉膏和蛋白胨时,菌丝生长速率高于对照组,5 d后各处理菌落直径分别为对照1.3倍、1.2倍和1.2倍,说明氮源为胰蛋白胨、牛肉膏和蛋白胨时,促进菌丝生长;而氮源为硝酸钠、酵母膏、硝酸铵、硫酸铵和氯化铵时,菌丝生长速率低于对照组,菌落生长直径分别为0.85倍、0.78倍、0.47倍、0.35倍和0.30倍。
水稻褐变穗病菌在不同氮源培养基中产孢量(见图18),病原菌在各氮源中均可产孢。病原菌在氮源为酵母膏时产孢量最多,产孢量为1.96×105个·mL-1,与其他处理间差异显著。病原菌在对照组查氏培养基中的产孢量为2.38×104个·mL-1,与氮源为蛋白胨产孢量差异不显著,但与其他处理间差异显著。氮源为牛肉膏、胰蛋白胨、硝酸钠、氯化铵和蛋白胨时,病原菌产孢量比对照组多,产孢量分别为对照的7.0倍、5.5倍、1.3倍、1.3倍和1.1倍,对病原菌产孢有促进作用;氮源为硝酸铵和硫酸铵时,产孢量比对照组少,分别为对照的0.1倍和0.1倍,对病原菌产孢有抑制作用。

图17 不同氮源对水稻褐变穗病菌(Alternaria alternata)菌丝生长影响Fig.17 Influence of different nitrogen source on mycelial growth of rice brown panicle disease(A.alternat)

图18 不同氮源对水稻褐变穗病菌(Alternaria alternata)产孢量影响Fig.18 Influence of different nitrogen source on sporulation of rice brown panicle disease(A.alternat)
3 讨论
水稻褐变穗病影响水稻产量,导致谷粒变色,影响米粒品质,病原菌可产生毒素,威胁人畜健康[25]。乔金玲等采用传统形态学方法鉴定黑龙江省褐变穗病原物,但未开展致病性测定[24,26]。本文采用组织分离法分离与纯化黑龙江省14个市县的典型水稻褐变穗病样,经过形态学鉴定分为链格孢属(Alternaria sp.)、镰孢菌属(Fusarium sp.)及青霉菌(Penicillium sp.)三类菌株,选择代表性菌株测定致病性,发现只有链格孢属(Alternaria sp.)菌株可引起水稻穗部产生褐色病斑,而其他两类菌株不致病。说明镰孢菌属(Fusarium sp.)及青霉菌(Penicillium sp.)菌株属于非致病菌,或是伴生在水稻上的腐生菌。经分子生物学鉴定发现引起水稻发病的链格孢菌为链格孢(Alternaria alternata(Fr.)Keissl),链格孢(Alternaria alternata(Fr.)Keissl)是引起黑龙江省水稻褐变穗病主要病原,与乔金玲等研究结果一致[24,26]。本研究在黑龙江省14个市县取样分离得到119个菌株,每市县分离得到菌株数量相对较少,是否存在其他导致水稻褐变穗症状病菌尚待确定,后续将继续增加取样数量,以期获得更多菌株,揭示黑龙江省水稻褐变穗病原种类。
了解病菌生物学特性对掌握病害发生规律及防治具有重要意义,但目前黑龙江省水稻褐变穗病菌生物学特性缺乏系统研究。本文研究营养和环境条件影响菌丝生长及产孢量情况,结果表明,大米煎汁培养基最适宜病菌菌丝生长,而大米马铃薯煎汁培养基最适宜病菌产孢。大米煎汁培养基中病菌菌丝生长速度高于大米马铃薯煎汁培养基,但在大米煎汁培养基中菌落边缘菌丝稀薄,而大米马铃薯培养基中菌落浓密。温度对病菌菌丝生长、产孢量及分生孢子萌发影响较大,27℃时病菌菌丝生长速率最快,产孢量最多,与张亚玲研究结果一致[27]。试验测定表明30℃最合适病菌分生孢子萌发,与黑龙江省水稻褐变穗发病高峰期(7月末~8月初)环境温度一致[25],说明当温度达27~30℃时,适宜病原菌繁殖,促进病害流行。当病原菌在强酸或强碱条件下培养时,菌丝无法生长,当病原菌处于中性偏酸、中性或中性偏碱条件下时,菌丝生长速率较快,分生孢子在pH为中性偏碱环境下易萌发,但分生孢子在强酸或强碱条件下无法萌发,说明pH对该菌分生孢子萌发有重要影响,与张乐对A.alternata生物学特性研究结果[28]基本一致。生产中可通过喷施酸性或碱性物质抑制病菌分生孢子萌发,控制病害。水稻褐变穗病菌菌丝生长及产孢量受光照条件影响显著。在光暗交替情况下,菌丝生长速率最快且利于病菌产孢。全光照条件下对于病菌分生孢子萌发有利,与李鹏等研究结果一致[29]。葡萄糖、果糖、胰蛋白胨、牛肉膏和蛋白胨可促进病菌菌丝生长,麦芽糖、果糖、蔗糖、牛肉膏和胰蛋白胨促进病原菌产孢,与解溥等研究结果一致[30]。确定黑龙江省水稻褐变穗病病原菌种类及其生物学特性,了解水稻褐变穗病发病规律,可为制定防治措施奠定理论基础。
[1] 张俊华,常浩,牟明,等.黑龙江省水稻纹枯病菌菌丝融合群判定及遗传多样性分析[J].东北农业大学学报,2017,48(2):20-28.
[2] 庄同春.寒地水稻“褐变穗”发生规律及预防措施[J].作物杂志,2006(1):66-67.
[3] 侯恩庆,张佩胜,王玲,等.水稻穗腐病病菌致病性、发生规律及防控技术研究[J].植物保护,2013,39(1):121-127.
[4] 常浩,韩雨桐,牟明,等.15种杀菌剂对黑龙江省水稻褐变穗病菌的室内毒力测定[J].黑龙江农业科学,2016(10):61-63.
[5] 黄世文,王玲,刘连盟,等.水稻穗腐病病原分离、鉴定及生物学特性[J].中国水稻科学,2012,26(3):341-350.
[6] 马盾,王奉斌,吴强,等.新疆水稻穗腐病病原菌种类鉴定及防控研究[J].新疆农业科学,2017,54(6):1093-1098.
[7] Patel D T,Stout M J,Fuxa J R.Effects of rice panicle age quantitative and qualitative injury by the rices stink bug(Hemiptera:Pentatomidae)[J].Florida Entomologist,2006,89(3):321-327.
[8] Lee F N,Tugwell N P,Fannah S J,et al.Role of fungi vectored by rice stink bug(Heteroptera:Pentatomidae)in discoloration of rice kernels[J].Journal of Economic Entomology,1993,86(2):549-556.
[9] Marchetti M A,Petersen H D.The role of Bipolaris oryzae in floral abortion and kernel discoloration in rice[J].Plant Disease,1984,68(1):288-291.
[10] Tullis B C.Fungi isolated from discolored Rice kernels[J].Technical Bulletins,1936.
[11] Suzuki F,Sawada H,Azegami K,et al.Molecular characterization of the tox,operon involved in toxoflavin biosynthesis of Burkholde⁃ria glumae[J].Journal of General Plant Pathology,2004,70(2):97-107.
[12] 林立娟,董国志.寒地水稻褐变穗防治药剂效果研究[J].北方水稻,2011,41(1):36-38.
[13] 周而勋,杨媚.从植物组织中分离立枯丝核菌的快速简便技术[J].华南农业大学学报,1998,19(2):125-126.
[14] 张桂寅,吴立强,李志坤.不同抗性品种对棉花黄萎病菌致病力的影响[J].棉花学报,2015,24(6):529-534.
[15] Huang S W,Wang L,Liu L M,et al.Rice spikelet rot disease in China-2 Pathogenicity tests assessment of the importance of the disease,and preliminary evaluation of control options[J].Crop protection,2011,30(1):10-17.
[16] 戴芳澜.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[17] 张天宇.中国真菌志·第十六卷链格孢属[M].北京:科学出版社,2003.
[18] 孙霞.链格孢属真菌现代分类方法研究[D].泰安:山东农业大学,2006.
[19] 张俊华,刘扬,孙洪利,等.黑龙江省稻瘟病菌遗传多样性研究[J].东北农业大学学报,2013,44(1):34-38.
[20] Huang S W,Wang L,Liu L M,et al.Rice spikelet rot disease in China-1 Characterization of fungi associated with the disease.Crop protection,2011,30(1):1-9.
[21] 张艳菊,赵珊,杨森,等.黑龙江省弯孢霉叶斑病病原鉴定[J].东北农业大学学报,2017,48(6):17-23.
[22] 杨焕青,王开运,范昆.草莓枯萎病菌的生物学特性及7种杀菌剂对其抑制作用[J].植物保护学报,2008,35(2):169-174.
[23] 费丹,檀根甲,罗道宏.安徽省水稻穗腐病病原鉴定及生物学特性研究[J].安徽农业大学学报,2014,41(5):777-782.
[24] 乔金玲,台莲梅,王平.水稻褐变穗病原菌生物学特性的研究[J].现代化农业,2010(4):9-10.
[25] 穆娟微,李鹏,李德萍.寒地水稻主要病害调查研究[J].北方水稻,2009,39(3):19-21.
[26] 穆娟微,李鹏,李德萍.水稻新病害——水稻褐变穗[J].现代化农业,2005(10):1-2.
[27] 张亚玲,周万福,靳学慧.水稻褐变穗病原菌生物学特性研究[J].安徽农业科学,2010(28):15683-15684.
[28]张乐.烟草赤星病生物学特性研究及同工酶技术在链格孢分类中的应用[D].合肥:安徽农业大学,2006.
[29] 李鹏,穆娟微,马德全,等.水稻褐变穗病原菌生物学特性研究[J].现代化农业,2006(5):1-2.
[30] 解溥,李鹏,穆娟微.碳源对水稻褐变穗病原菌分生孢子萌发的影响[J].北方水稻,2012,41(5):21-22.
