干旱胁迫及复水对大豆抗坏血酸-谷胱甘肽循环的影响
2018-01-25董守坤马玉玲刘丽君
董守坤,马玉玲,李 爽,董 娜,刘丽君
(东北农业大学农学院,哈尔滨 150030)
活性氧(ROS)是一类由O2转化的自由基或具有高反应活性的离子或分子[1],低浓度时,ROS作为第二信使在细胞信号转导途径中介导多种应答反应,高浓度时,引起细胞损伤甚至死亡[2-4]。植物生长过程中,干旱等胁迫诱导植物体相关氧化胁迫反应,产生大量活性氧(ROS)[5],为防御ROS毒害作用,植物激活抗氧化系统对胁迫作应答反应,维持或重建氧化还原平衡[6-8]。抗氧化系统包括抗坏血酸-谷胱甘肽循环系统(ASA-GSH)和抗氧化酶类(超氧化物歧化酶、过氧化物酶和过氧化氢酶)等[9-11],其中抗坏血酸-谷胱甘肽循环系统是植物体内清除ROS重要途径。抗氧化系统通过调节活性氧水平,影响生物功能;通过各种酶类和非酶类抗氧化剂参与反应,调节植物生理机能[12]。目前,干旱胁迫下植物抗氧化系统研究多集中于抗氧化酶防御系统,而ASA-GSH循环研究较少。
黑龙江省作为我国农业大省,是大豆主产区,6~9月份降雨量可达全年降雨量60%~80%,区域和四季降雨量分布不均[13]。近年,春旱发生频率增高,夏秋季干旱时有发生,夏季连续干旱逐渐增多。2016年,东北地区7月份以来,持续高温,降雨量减少,土地失墒严重,影响农作物生长。因此,明确大豆在水分最敏感时期(开花期)的耐旱机制具有重要意义。
本文以种子萌发期耐旱性不同大豆品种黑农44和黑农65为试验材料,开花期干旱胁迫处理,测定抗坏血酸-谷胱甘肽循环系统相关指标,探讨干旱胁迫条件下ASA-GSH循环清除ROS机制,以期为深入研究大豆响应干旱胁迫机理提供理论依据。
1 材料与方法
1.1 试验材料
供试大豆品种为黑农44(HN44)和黑农65(HN65)。黑农44为耐旱型品种,黑农65为敏感型品种(本课题组于2011年鉴定筛选)[14]。
1.2 试验设计
试验于2017年5月13日东北农业大学校内玻璃防雨棚内开展,盆栽选用塑料桶(直径28 cm,高33 cm),底部打孔,装土量13 kg,每盆保苗3株,EM-50水分测定仪监测土壤水分。为保持大豆植株生长时间相同,形成不同干旱梯度,具体处理方法如下:R1期以前保持土壤适宜水分,从R1期开始,第1组连续断水(干旱)7 d;第2组从第1组断水1 d后开始断水,断水(干旱)6 d;第3组从第1组断水2 d后开始,断水(干旱)5 d;第4组从第1组断水3 d后开始断水,断水(干旱)4 d;第5组从第1组断水4 d后开始断水,断水(干旱)3 d;第6组从第1组断水5 d后开始断水,断水(干旱)2 d;第7组从第1组断水6 d后开始断水,断水(干旱)1 d;第8组为对照(CK),保持适宜水分,即断水(干旱)0 d。R1期后7 d形成干旱0、1、2、3、4、5、6和7 d,共8个处理。于处理完成后8:00~9:00取大豆倒2和倒3叶片混匀(以每盆为单位),5次重复,液氮中速冻,储存于-80℃超低温冰箱中待测,记录当天各干旱处理土壤含水率。
复水处理:干旱胁迫取样完成后对各处理复水,复水期间土壤含水率控制与对照相同。于复水后第7天上午8:00~9:00取大豆倒2和倒3叶片混匀(以每盆为单位),5次重复,液氮中速冻,-80℃超低温冰箱待测。
1.3 测定指标与方法
1.3.1 丙二醛(MDA)含量的测定
采用硫代巴比妥酸法[15],于532、600和450 nm波长测量消光度。
1.3.2 抗氧化物质含量测定
还原型抗坏血酸(ASA):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于265 nm波长记录30和150 s吸光值。
脱氢抗坏血酸(DHA):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于265 nm比色,记录10和130 s吸光值。
还原型谷胱甘肽(GSH):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于412 nm测定吸光值。
氧化型谷胱甘肽(GSSG):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于412 nm比色,测定30和150 s吸光值。
1.3.3 抗氧化酶活性测定
抗坏血酸过氧化物酶(APX):采用比色法于290 nm比色,记录吸光值,计算。
谷胱甘肽还原酶(GR):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于340 nm迅速测定初始吸光度和180 s吸光度。
单脱氢抗坏血酸还原酶(MDHAR):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于340 nm比色,记录30 s和150 s吸光值。
脱氢抗坏血酸还原酶(DHAR):根据试剂盒说明书(购自苏州科铭生物技术有限公司)于265 nm比色,记录30 s和150 s吸光值。
1.3.4 总抗氧化能力(T-AOC)
根据试剂盒说明书(购自苏州科铭生物技术有限公司)于593 nm测定吸光值。
土壤含水率测定:EM-50探针插入桶内土壤中部,测土壤含水率。
2 结果与分析
2.1 干旱胁迫对大豆叶片膜脂过氧化程度的影响
由图1可知,随土壤含水率降低,HN44和HN65中MDA含量呈升高趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44中MDA含量变化不大,但当土壤含水率降至15.5%时,HN44中MDA含量迅速上升1.65倍。HN65中MDA含量基本处于匀速上升趋势,HN65中MDA含量始终高于HN44,除对照组外,其余处理HN44和HN65中MDA含量差异均呈显著水平。当土壤含水率降低至14.5%,即干旱持续7 d时,HN65中MDA含量相比HN44高13.52%。
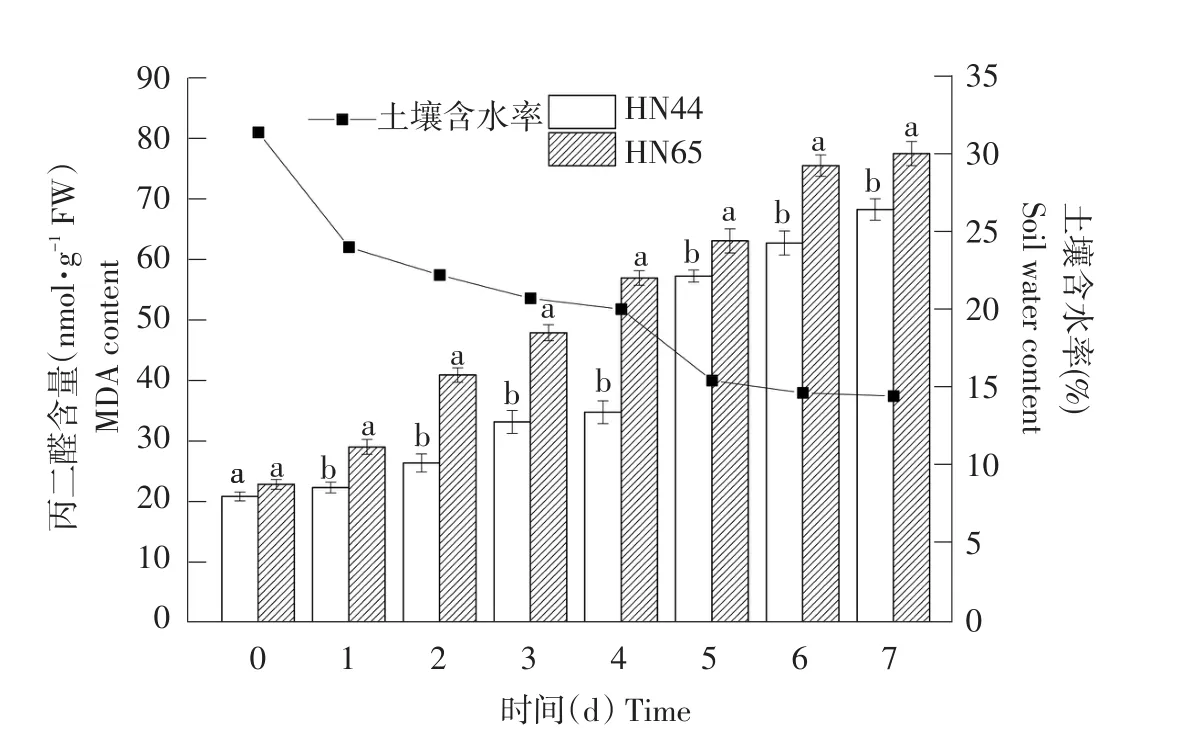
图1 不同土壤含水率对MDA含量的影响Fig.1 Effect on MDA content under different soil water content
2.2 干旱胁迫对大豆叶片ASA-GSH循环的影响
2.2.1 ASA-GSH循环中抗氧化物质含量
由图2A可知,随土壤含水率降低,HN44和HN65中ASA含量呈先升后降趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44和HN65中ASA含量变化不大,但当土壤含水率下降至15.5%时,HN44和HN65中ASA含量迅速上升12.11倍,6.19倍,两品种间ASA含量差异显著,当干旱持续至第6~7天时,HN44中ASA含量略高于HN65,差异不显著。HN44中ASA含量在土壤含水率为15.5%时到达峰值,HN65在土壤含水率为14.7%时到达峰值。
由图2B可知,随土壤含水率降低,HN44和HN65中DHA含量变化趋势呈升高趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44和HN65中DHA含量变化不大,但当土壤含水率下降至15.5%时,HN44和HN65中DHA含量迅速上升12.77倍、7.58倍。当干旱持续至第6和7天时,HN44中DHA含量略高于HN65,差异不显著,与第5天相比,含量变化不明显。
ASA/DHA可反映细胞氧化还原状态,由图2C可知,ASA/DHA随土壤含水率降低,两品种ASA/DHA呈先升后降趋势,第4天达峰值,随后下降,两品种间差异显著。
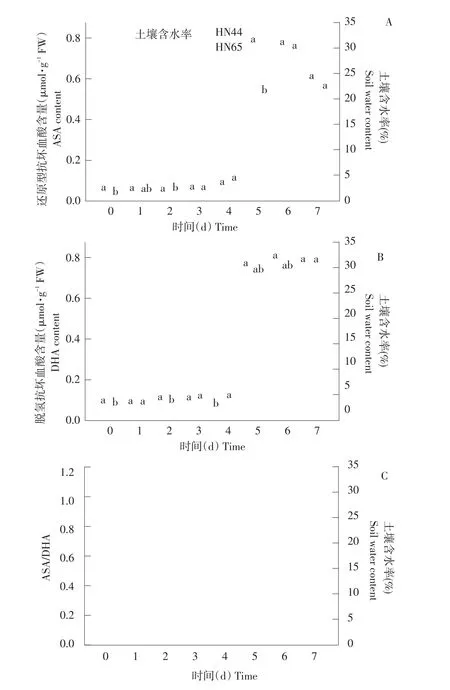
图2 不同土壤含水率对ASA、DHA含量及ASA/DHA影响Fig.2 Effect on ASA,DHA contents and ASA/DHA ratio under different soil water content
由图3A可知,随土壤含水率降低,HN44和HN65中GSH含量呈先升后降趋势。当土壤含水率为24.1%和22.3%时,HN44和HN65中GSH含量变化不大,当土壤含水率为20.8%和20.1%时,HN44和HN65中GSH含量上升明显,当土壤含水率降低至15.5%,即干旱持续5 d时,GSH含量迅速上升,上升幅度为干旱持续4 d的6.47倍、2.27倍。当干旱持续至第6~7天时,两品种GSH含量降低,差异显著。
由图3B可知,随土壤含水率降低,HN44和HN65中GSSG含量呈升高趋势。当土壤含水率为24.1%和22.3%时,HN44和HN65中GSSG含量变化较小,当土壤含水率为20.8%和20.1%时,HN44和HN65中GSSG含量显著上升,HN44上升幅度大于HN65。当土壤含水率降低至14.5%时,两品种GSSG含量达到最大值。除干旱胁迫第5天,其余处理天数内,HN44和HN65中GSSG含量差异显著。
由图3C可知,随土壤含水率降低,HN44和HN65中GSH/GSSG基本呈降-升-降趋势,且两品种GSH/GSSG差异显著。
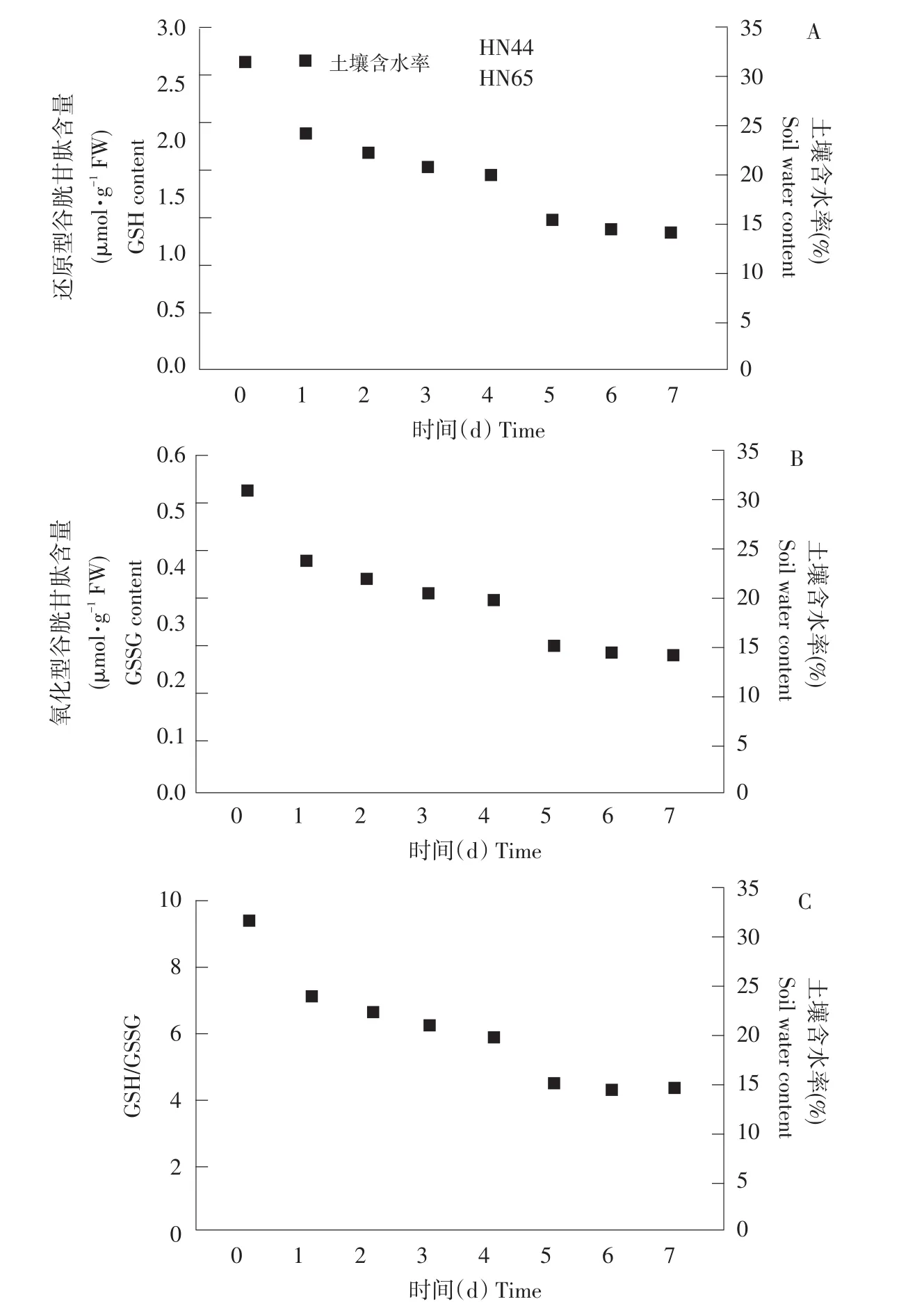
图3 不同土壤含水率对GSH、GSSG含量及GSH/GSSG的影响Fig.3 Effect on GSH,GSSG contents and GSH/GSSG ratio under different soil water content
2.2.2 ASA-GSH循环中抗氧化酶活性
由图4A可知,随土壤含水率降低,HN44和HN65的APX活性呈先升后降趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44的APX活性变化不大,HN65在干旱6 d时,APX活性略升高。HN44的APX活性在土壤含水率降低至14.7%,即干旱持续6 d时达到峰值,HN65的APX在土壤含水率降低至15.5%,即干旱持续5 d时,达到峰值,HN44的APX峰值活性较HN65高40.62%。在处理时间内,HN44的APX活性均高于HN65,且差异显著。由图4B可知,随土壤含水率降低,HN44的GR活性呈先升后降趋势,HN65的GR活性呈升高趋势。在土壤含水率降低至15.5%,即干旱持续5 d时,HN44的GR活性达到峰值。除干旱胁迫第4天,其余处理天数内,HN44和HN65 GR活性差异显著。
由图5A可知,随土壤含水率降低,HN44的MDHAR活性呈先升后降趋势,HN65的MDHAR呈缓慢上升趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44的MDHAR活性变化不大,当土壤含水率降低至14.7%时,HN44的MDHAR活性显著上升,达到峰值。HN44的MDHAR活性上升幅度高于HN65,在处理时间内,两品种间MDHAR活性差异显著。由图5B可知,随土壤含水率降低,HN44的DHAR活性基本呈先升后降趋势,HN65的DHAR活性呈升高趋势。当土壤含水率为24.1%、22.3%、20.8%和20.1%时,HN44和HN65的DHAR活性变化不大,土壤含水率降低至15.5%,即干旱持续5 d时,DHAR活性迅速升高4.66、4.35倍,差异显著。
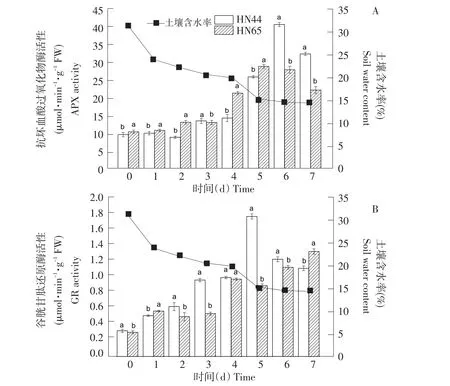
图4 不同土壤含水率对APX、GR活性的影响Fig.4 Effect on APX and GR activities under different soil water content
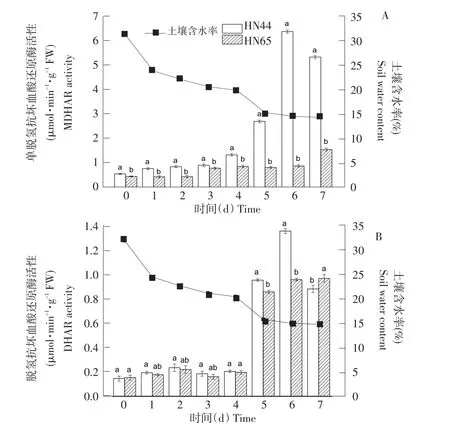
图5 不同土壤含水率对MDHAR、DHAR活性的影响Fig.5 Effect on MDHAR and DHAR activities under different soil water content
2.3 干旱胁迫对大豆叶片T-AOC的影响
由图6可知,随土壤含水率降低,HN44和HN65的T-AOC呈升高趋势。当土壤含水率为24.1%、22.3%、20.8%、20.1%、15.5%和14.7%时,HN44和HN65的T-AOC变化不大,当土壤含水率为14.5%,即干旱持续7 d时,HN44和HN65的TAOC显著上升,HN44较HN65高48.59%。在处理时间内,两品种间T-AOC差异显著。
2.4 干旱胁迫复水后对大豆叶片ASA-GSH循环的影响
由表1可知,随干旱程度加剧,复水后两品种ASA、GSH含量呈递增趋势。ASA、GSH含量在干旱处理前4 d,复水后两品种变化不大,第5天时,显著升高。复水后DHA量呈先升后降趋势,但两品种均未恢复至对照水平。复水后GSSG含量呈先升后降趋势,第5天开始下降,两品种均恢复至对照以下。
由表2可知,随干旱程度加剧,复水后HN44的APX活性呈先升后降趋势,各处理APX活性未恢复至对照水平,HN65的APX活性在复水期间呈递增趋势,各处理与对照相比,差异显著,即复水期间HN65的APX活性未恢复至对照水平。复水期间,两品种GR活性呈升高趋势,各处理间GR活性差异显著,未恢复至对照水平。MDHAR、DHAR活性呈递增趋势,与对照相比,差异显著,第5天时,活性显著上升。
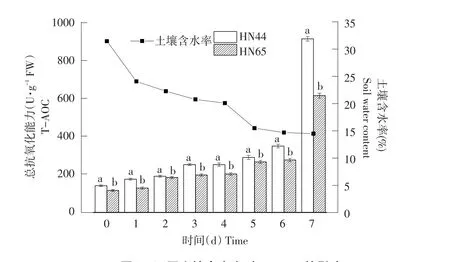
图6 不同土壤含水率对T-AOC的影响Fig.6 Effect on T-AOC under different soil water content
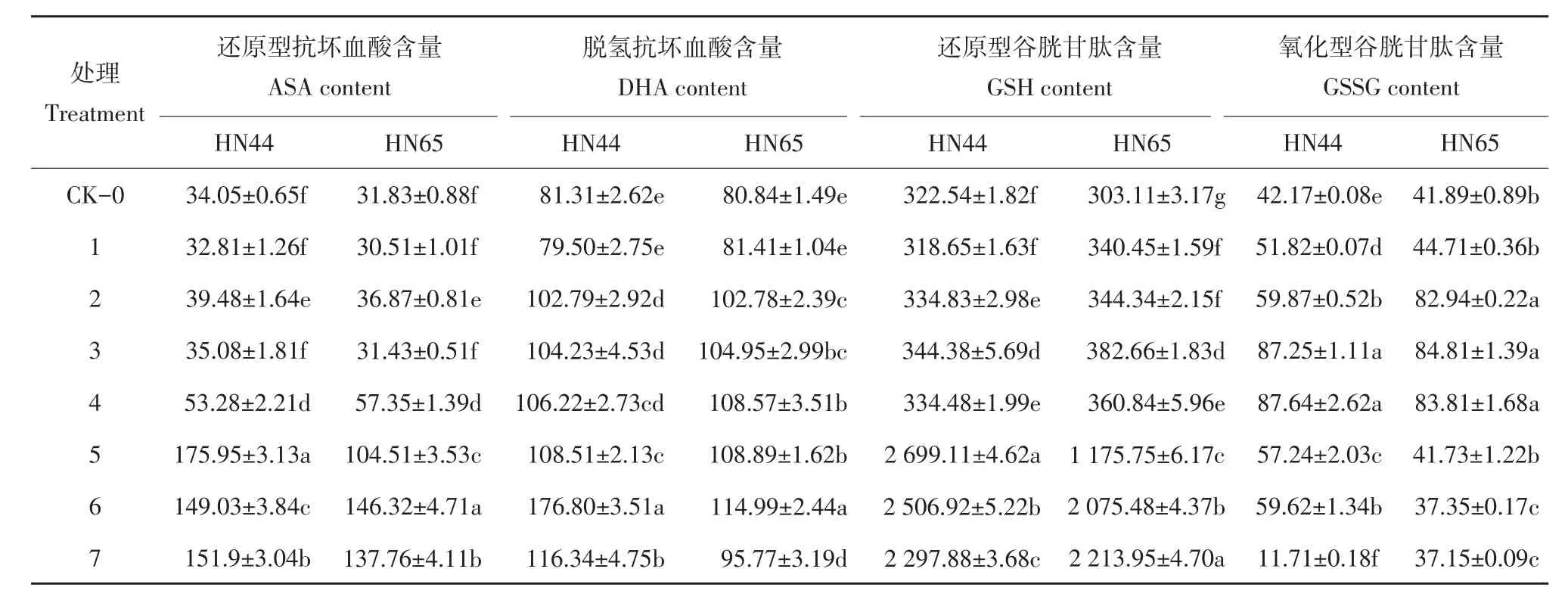
表1 复水后ASA、DHA、GSH、GSSG含量的变化Table1 Changes of ASA,DHA,GSH and GSSG content after re-watering(nmol·g-1FW)
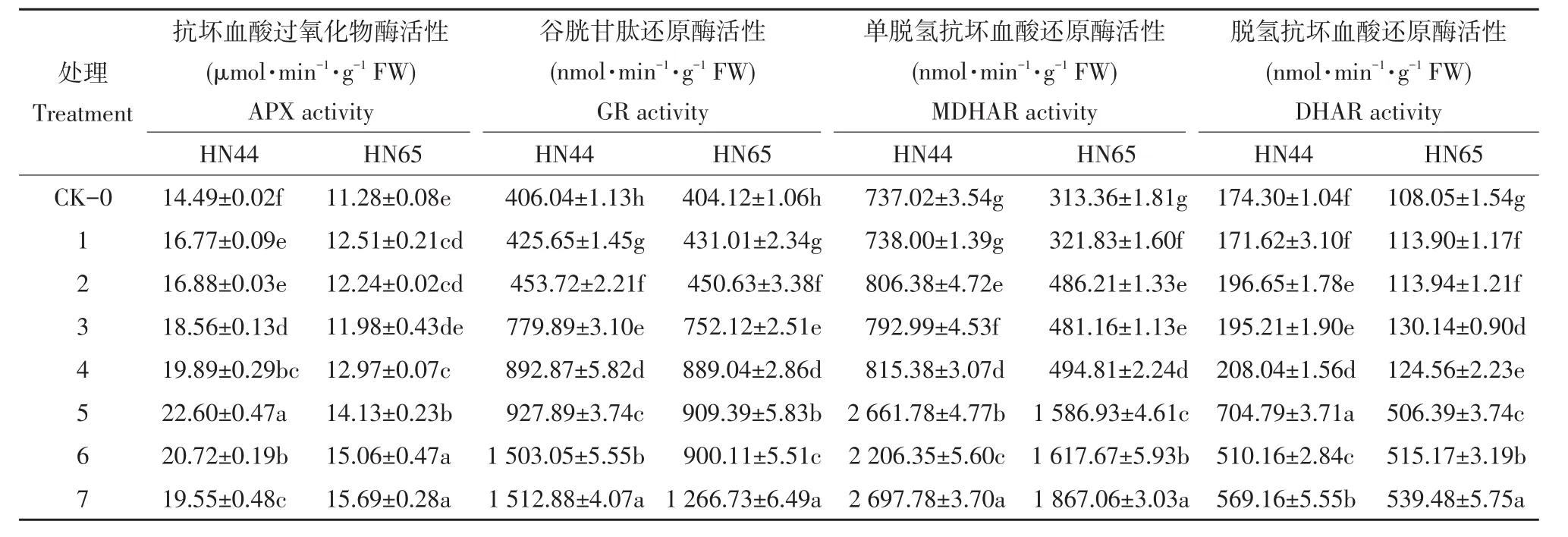
表2 复水后APX、GR、MDHAR、DHAR活性变化Table2 Changes of APX,GR,MDHAR,DHAR activity after re-watering
3 讨论与结论
MDA是膜脂过氧化主要产物,MDA含量变化可衡量逆境胁迫对植物伤害程度,本试验结果表明,干旱迫使大豆叶片MDA含量增加,加剧过氧化和细胞膜破坏程度,敏感型品种破坏程度显著大于耐旱型品种,说明耐旱型品种承受干旱能力更强,与杜彩艳研究结果一致[16-18]。
ASA-GSH循环中相关的抗氧化酶活性及抗氧化物质含量变化可反映大豆品种耐旱能力。发生胁迫时,植物体内保护酶活性增加,清除多余活性氧,植物抗性增强[19];APX、MDHAR、DHAR和GR作为ASA-GSH循环主要酶类,共同清除H2O2,并使ASA和GSH再生[20-21]。本研究结果表明,干旱胁迫时,HN44的APX、MDHAR、DHAR和GR活性呈先升后降趋势,HN65的APX、MDHAR、DHAR和GR活性呈升高趋势,升高幅度低于HN44,且APX活性水平远高于MDHAR、DHAR及GR,表明耐旱型品种清除活性氧能力显著大于敏感型品种,与Tubeileh等研究结果一致[22]。在干旱胁迫前期,酶活性缓慢升高,当土壤含水率达15.5%,即干旱胁迫5 d时,酶活性迅速上升,表明当大豆遭受严重干旱胁迫时,抗氧化酶活性急剧增加,此为大豆适应性反应,但当胁迫程度过大时,活性氧积累过多,产生与清除机制失衡时,酶活性降低。复水后两品种APX、GR、MDHAR、DHAR活性呈升高趋势,干旱5 d处理复水时显著升高,原因为当土壤含水量下降至15.5%以下时,继续干旱对大豆造成伤害较大,短期复水难以恢复正常生理状态。不同作物对氧化胁迫反应不同,赵宏伟等研究表明,干旱胁迫使水稻APX、DHAR、GR等酶活性显著增加,复水后APX活性迅速下降,而后活性提高[23-24]。
ASA-GSH循环参与植物胁迫反应,ASA和GSH是ASA-GSH循环中两种重要抗氧化物质,在抵御活性氧使植物免受伤害方面具有重要作用[25]。在ASA-GSH循环中,APX利用ASA作为电子供体,将H2O2还原为H2O,清除H2O2毒害。由于ASA氧化时形成MDHA不稳定,一部分被MDHAR还原成ASA,另一部分被氧化成DHA[26]。本研究结果表明,干旱程度增加导致APX活性增强,加快ASA转换为DHA速率;MDHAR活性升高,增加细胞ASA供应。当土壤含水率为15.5%,即持续干旱5 d时,抗氧化物质含量迅速升高,HN44抗氧化物质含量高于HN65,说明黑土条件下土壤含水率到达15.5%时,大豆叶片细胞受损,H2O2含量增加,导致氧化损伤;耐旱型品种调节能力较强,抵御干旱胁迫能力优于敏感型品种。复水后两品种ASA、DHA、GSH含量升高,而GSSG含量下降至对照以下。玉米[27]、水稻[28-29]等作物相关研究表明,植物体内GSH含量随干旱胁迫程度加重呈下降趋势,复水后GSH含量上升,可能为大豆对水分敏感性高于其他作物所致。
通过HN44和HN65总抗氧化能力测定,也明HN44抗氧化能力优于HN65,为大豆抗旱品种筛选提供理论依据。大豆体内抗氧化系统间的相互作用机制、不同胁迫下生理变化及抗氧化分子机制尚待深入研究。
干旱胁迫使大豆叶片中MDA含量、抗氧化物质含量、抗氧化酶活性和总抗氧化能力升高。耐旱型品种MDA含量低于敏感型品种,抗氧化物质含量及抗氧化酶活性高于敏感型品种。复水后ASA、DHA、GSH含量,APX、GR、MDHAR、DHAR活性呈升高趋势,GSSG含量下降至对照以下。
[1] 张梦如,杨玉梅,成蕴秀,等.植物活性氧的产生及其作用和危害[J].西北植物学报,2014,34(9):1916-1926.
[2] Apel K,Hirt H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[3] Scheler C,Durner J,Astier J.Nitric oxide and reactive oxygen species in plant biotic interactions[J].Current Opinion in Plant Biology,2013,16(4):534-539.
[4] Baxter A,Mittler R,Suzuki N.ROS as key players in plant stress signalling[J].Journal of Experimental Botany,2014,65(5):1229-1240.
[5] 张怡,路铁刚.植物中的活性氧研究概述[J].生物技术进展,2011,1(4):242-248.
[6] Quan L J,Zhang B,Shi WW,et al.Hydrogen peroxide in plants:A versatile molecule of the reactive oxygen species network[J].Journal of Integrative Plant Biology,2008,50(1):2-18.
[7] Sinhababu A,Kar R K.Response of four fuel-wood yielding seedlings to water stress[J].Plant physiol,2002,7(1):88-91.
[8] Sinhababu A,Kar R K.Comparative responses of three fuel wood yielding plants to PEG-induced water stress at seedling stage[J].Acta Physiologiae Plantarum,2003,25(4):403-409.
[9] Drazkiewicz M,Skorzynska-Polit E,Krupa Z.The redox state and activity of superoxide dismutase classes in Arabidopsis thaliana,under cadmium or copper stress[J].Chemosphere,2007,67(1):188-193.
[10] Scandalios J G.The rise of ROS[J].Trends Biochem.Science,2002,27(9):483-486.
[11] Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.
[12] 孙全贵,龙子,张晓迪,等.抗氧化系统研究新进展[J].现代生物医学进展,2016,16(11):2197-2200.
[13] 于红贤,孙家言,覃雪波.黑龙江省水资源现状与可持续利用对策研究[J].东北农业大学学报,2006,37(3):427-432.
[14] 王利彬,刘丽君,裴宇峰,等.大豆种质资源芽期抗旱性鉴定[J].东北农业大学学报,2012,43(1):36-43.
[15] 王学奎.植物生理生化实验原理技术[M].北京:高等教育出版社,2000.
[16] 杜彩艳,段宗颜,潘艳华,等.干旱胁迫对玉米苗期植株生长和保护酶活性的影响[J].干旱地区农业研究,2015,33(3):124-129.
[17] 芮海英,王丽娜,金铃,等.苗期干旱胁迫对不同大豆品种叶片保护酶活性及丙二醛含量的影响[J].大豆科学,2013,32(5):647-649.
[18] 卜令铎,张仁和,韩苗苗,等.干旱复水激发玉米叶片补偿效应的生理机制[J].西北农业学报,2009,18(2):88-92.
[19] 崔秀妹,刘信宝,李志华,等.不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响[J].草业学报,2012,21(6):82-93.
[20] Li Y L,Liu Y F,Zhang J G.Advances in the research on the AsAGSH cycle in horticultural crops[J].Frontiers of Agriculture in China,2010,4(1):84-90.
[21] Foyer CH,Noctor G.Ascorbate and glutathione:The heart of the redox hub.[J].Plant Physiol,2011,155(1):2-18.
[22] Tubeileh A,Groleau-Renaud V,Plantureux S.Effect of soil compaction on photosynthesis and carbon partitioning within a maizesoil system[J].Soil and Tillage Research,2003,7(1):151-161.
[23] 赵宏伟,王新鹏,于美芳,等.分蘖期干旱胁迫及复水对水稻抗氧化系统及脯氨酸影响[J].东北农业大学学报,2016,47(2):1-7.
[24] Rao A S V C,Reddy A R.Ascorbate-glutathione cycle enzymes in rice leaves coordinately respond to drought stress[J].Journal of Plant Biology,2008,1:39-46.
[25] Nagalakshmi N,Prasad M N V.Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmus bijugatus[J].Plant Science,2001,160(2):291-299.
[26] 王俊力,王岩,赵天宏,等.臭氧胁迫对大豆叶片抗坏血酸-谷胱甘肽循环的影响[J].生态学报,2011,31(8):2068-2075.
[27] 王娟,李德全,谷令坤.不同抗旱性玉米幼苗根系抗氧化系统对水分胁迫的反应[J].西北植物学报,2002,22(2):285-290.
[28] 王泽杰,陈永军,谢崇华.不同干旱程度及复水对水稻B优827开花期的生理影响[J].河南农业科学,2008(9):34-38.
[29] 王贺正,马均,李旭毅,等.水分胁迫对水稻结实期活性氧产生和保护系统的影响[J].中国农业科学,2007,40(7):1379-1387.
