染料木素对运动疲劳大鼠脏器指数及NO/NOS的影响*
2018-01-25麻海娟黎晓陈良龙赖雪琴曹性玲黄志华黄诚江西中医药大学05级硕士研究生南昌0004赣南医学院基础医学院江西赣州4000赣南医学院05级本科生江西赣州4000
★ 麻海娟 黎晓 陈良龙 赖雪琴 曹性玲 黄志华 黄诚**(.江西中医药大学05级硕士研究生 南昌 0004;.赣南医学院基础医学院 江西 赣州4000;.赣南医学院05级本科生 江西 赣州 4000)
随着现代社会的快速发展,疲劳已成为社会常态,严重影响着人们的生活质量。运动疲劳是疲劳的一种,现代医学已尝试采用一些方式来改善身体力量和提高康复疲劳效率,包括使用兴奋剂,但这对身体会造成长期的伤害[1]。传统中药多是天然植物,副作用小,有着天然的自身优势[2]。有研究表明从中药提取的植物雌激素类具有良好的抗运动疲劳作用[3-4]。染料木素(Genistein,Gen)又称金雀异黄素、染料木黄酮、5,7,4′-三羟基异黄酮,主要来源于大豆、三叶草、葛根、槐花和槐角等,是一种天然的植物雌激素,具有抗氧化、免疫调节和提高抗氧化酶活性等功效[5-6],我们前期的研究发现染料木素可升高运动疲劳大鼠全血中红细胞、白细胞、血小板和淋巴细胞计数,升高红细胞压积、红细胞分布宽度和血红蛋白浓度[7],提示染料木素具有抗运动疲劳的功效。为进一步阐明其可能作用机制,本研究拟以游泳力竭大鼠为模型,通过检测运动疲劳大鼠的脏器指数、血清NO及NO合成酶的含量,从血管内皮功能的角度探讨染料木素的抗疲劳作用。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SPF级SD大鼠32只,体重(180±20)g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2013-0004,合格证号:43004700027319。实验前适应性饲养7天,自由饮水、进食。
1.1.2 药物与试剂 Gen由沈阳药科大学中医药学院植化教研室提供,纯度为99%,实验前用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解,使用时用生理盐水稀释至所需浓度。一氧化氮(nitric oxide,NO)和一氧化氮合成酶(nitric oxide synthetase,NOS)分型测试盒购自南京建成生物工程研究所。
1.1.3 仪器 连续光谱多功能酶标仪(美国热电);BS224S电子天平(北京赛多利斯天平有限公司);中佳KLC-2046型低速冷冻离心机(科大创新股份有限公司中佳分公司);LB801型超级恒温水浴箱(湖北黄石市医疗器械厂)。
1.2 方法
1.2.1 动物模型复制及分组 32只雄性SPF级SD大鼠,随机分为正常对照组、运动疲劳模型组、染料木素低剂量组(0.1µmol/kg)、染料木素高剂量组(0.3µmol/kg)组,每组8只。运动疲劳模型制备参照马海峰等建立的方法[8],简述如下:将大鼠置于120×90×60 cm恒温水箱(水温25℃,水深40cm),进行4天的适应性游泳训练,每天1次,每次30min;第5~8天训练时间为90 min,第9~14天训练时间为120min。训练过程中发现力竭的情况,及时捞起,休息5min后,继续进行游泳训练。正常对照组进行常规饲养,不加任何干预。Gen组分别于每次游泳运动前30min给予浓度为0.05µM或0.15µM的Gen,给药体积为2mL/kg体重皮下注射,模型组于游泳运动前30min给予同体积的DMSO皮下注射,正常对照组给予同体积的生理盐水皮下注射,持续14天。
1.2.2 胸腺指数、脾脏指数、肾脏指数和脑指数测定 末次运动10min后,10%水合氯醛麻醉大鼠,称体重,取胸腺、脾脏、肾脏和脑并称重,计算胸腺、脾脏、肾脏及脑指数。脏器指数=脏器重量(mg)/体重(g)。
1.2.3 血清NO、tNOS、cNos和iNOS含量的测定分别采用NO和NOS分型测试盒,严格按照说明书要求进行操作,检测血清中NO、tNOS、cNOS和iNOS的含量。
1.2.4 统计学处理 采用Prism5.0统计学软件进行统计学分析。计量资料用表示,各组间测定指标的总体比较采用单因素方差分析,组间比较采用SNK检验,P<0.05认为差异有统计学意义。
2 结果
2.1 染料木素对运动疲劳大鼠胸腺指数、脾脏指数、肾脏指数和脑指数的影响 由图1-4可见,与对照组相比,模型组的脾脏指数(P<0.01)和肾脏指数(P<0.05)明显下降,而胸腺指数和脑指数无明显差异。与模型组相比,染料木素组可不同程度上调胸腺指数(P<0.05)、脾脏指数(P<0.001)、肾脏指数(P<0.05)和脑指数(P<0.01)。

图1 染料木素对运动疲劳大鼠胸腺指数的影响

图2 染料木素对运动疲劳大鼠脾脏指数的影响

图3 染料木素对运动疲劳大鼠肾脏指数的影响
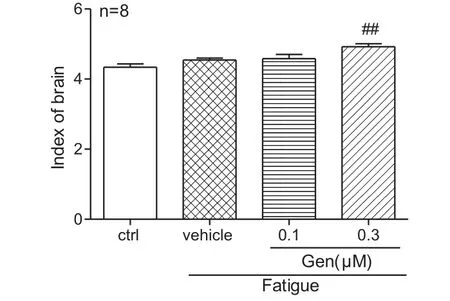
图4 染料木素对运动疲劳大鼠脑指数的影响
2.2 染料木素对运动疲劳大鼠血清NO、tNOS、cNos和iNOS的影响 如图5-8所示,与对照组相比,在模型组,运动疲劳会导致NO(P<0.01)和cNOS(P<0.01)含量显著降低;与模型组相比,Gen组的血清 NO(P<0.001)、tNOS(P<0.01)和 cNOS(P<0.01)含量明显升高,而对iNOS无明显影响。

图5 染料木素对运动疲劳大鼠NO的影响
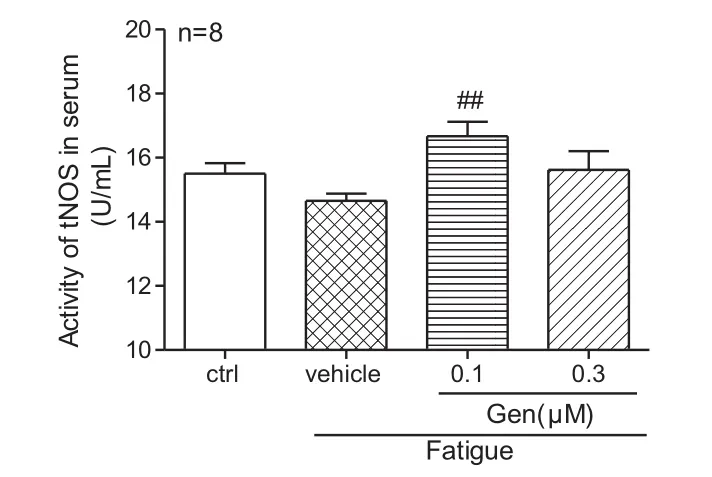
图6 染料木素对运动疲劳大鼠tNOS的影响
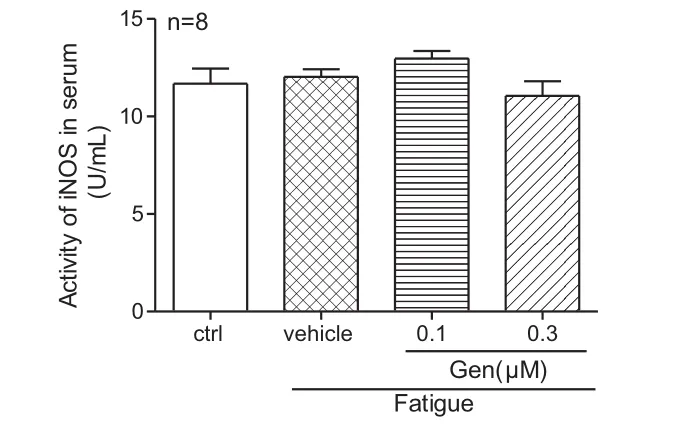
图7 染料木素对运动疲劳大鼠iNOS的影响

图8 染料木素对运动疲劳大鼠cNOS的影响
3 讨论
在竞技体育中,运动员产生运动疲劳是常有的事,极大地影响着运动员的身体健康和运动能力。若运动后能有效地消除疲劳,将有助于运动员训练水平的提高和身体的保护。目前产生运动疲劳的机制主要有能量耗竭学说、代谢产物堆积学说、离子代谢紊乱学说和氧自由基-脂质过氧化学说等多因素的综合[9]。其中氧化应激损伤在运动疲劳发生过程中起重要作用[10]。
运动疲劳发生后,脏器指数是反应脏器是否受损的一个重要指标,有研究表明当动物和人的营养状态出现异常或内脏出现病变的时候,脏器的重量就会发生改变[11]。运动疲劳时机体产生并释放大量的自由基,降低机体的抗氧化能力,并损伤脾、胸腺、肾和大脑等重要组织器官,使之发生结构变化以及器官的重量降低[12-15]。根据文献报道中药对运动疲劳具有一定的缓解作用,为此,我们的研究结果表明运动疲劳大鼠经染料木素干预后,脾、胸腺、肾和大脑的脏器指数均明显上调,提示染料木素可能具有抗运动疲劳的作用。
为进一步揭示染料木素的抗运动疲劳的可能机制,我们选择从血管内皮功能的角度来探讨。有实验报道,作为一种血管舒张因子,NO能明显起到扩血管、降阻力、增加器官血流量的作用,从而增加运动时骨骼肌和心肌等组织的血流量,输送氧和各种营养物质以及带出代谢产物,保证了机体的运动能力[16-17]。另外,NO还可以稳定溶酶体膜,抵抗自由基损伤[18]。运动疲劳时,大量产生的氧自由基可使NO生物活性丧失[19]。NOS是NO合成的关键酶,包括构建型cNOS和诱导型iNOS两种。它们可提高NO的合成能力,特别能明显提高血清和肌组织中NO的含量,有利于在运动后恢复过程中保持有较大的血流量,促进运动后的恢复[20-21]。基于此,如果我们能寻求到一些中药可通过影响NO合成和NOS活性,就对运动后疲劳有改善作用。本研究结果表明,染料木素可显著提高模型大鼠血清中因运动疲劳所致的NO、tNOS和cNOS含量下降,但对iNOS无明显影响。
综上所述,染料木素对运动疲劳大鼠具有一定改善作用,其可能机制是通过抑制运动疲劳导致的脏器损伤以及提高NO含量和NOS活性来实现的。
[1]Gore RK, Webb TS, Hermes ED. Fatigue and stimulant use in military fighter aircrew during combat operations [J]. Aviat Space Envir Med,2010, 81(8):719-727.
[2]刘真,李新录.中药抗运动疲劳的研究综述[J].体育科技文献通报,2011, 11(19):121-122.
[3]邓炳楠,金宏,李培兵,等.大豆异黄酮对游泳小鼠抗疲劳能力的影响[J].营养学报, 2012, 34(1):55-63.
[4]郭雅,习雪峰.葛根素对运动疲劳大鼠海马NO-cGMP信号系统的影响[J].食品科学, 2012, 33(13):276-279.
[5]Li YQ, Xing XH, Wang H, et al. Dose-dependent effects of genistein on bone homeostasis in rats' mandibular subchondral bone[J]. Acta Pharmacol Sin, 2012, 33(1):66-74.
[6]Lin AH, Leung GP, Leung SW, et al. Genistein enhances relaxation of the spontaneously hypertensive rat aorta by transactivation of epidermal growth factor receptor following binding to membrane estrogen receptors-α and activation of a G protein-coupled, endothelial nitric oxide synthasedependent pathway [J]. Pharmacol Res, 2011, 63(3):181-189.
[7]蒙兰兰,吴丽珍,黄虎龙,等.染料木素对运动疲劳大鼠血细胞的影响[J].赣南医学院学报, 2016, 36(6):854-859.
[8]马海峰,吴瑛,杨锐.针刺运动性疲劳模型大鼠不同穴位后心肌和肝脏组织的相关变化[J]. 中国组织工程研究, 2015, 19(27): 4 282-4 287.
[9]You L, Zhao M, Regenstein JM. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1), 188-194.
[10]Power SK, DeRuisseau KC, Quindry J. Dietary antioxidants and exercise[J]. Sports Sci, 2004, 22(1):81-94.
[11]徐晓阳,张爱芳,武桂新,等.扶正力气中药对大强度耐力训练大鼠糖代谢某些指标的影响[J].中国运动医学杂志, 1998, 17(3):221-226.
[12]Tkachuk MG. Changes in the structural components of the thymus gland with different degrees of adaptation of the body to physicalloads [J].Arkh Anal GistolEmbriol, 1984, 86(5):80-84.
[13]Baldwin DR, Wileox ZC, Baylosis RC. Impact of differential housing on humoral immunity following exposure to an acute stressor in rats [J].PhysiolBehav, 1995, 57(4):649-653.
[14]Gruzdera ON, Chikhman UN. The structure of the white pulp of the spleen and peripheral blood indices in rats under increased muscle activity [J]. Mortologia, 1999, 116(6):65-68.
[15]刘斌焰,邢雁霞,郭敏芳,等.松针对运动疲劳小鼠脑组织热休克蛋白70表达的影响[J]. 2017, 33(1):65-67.
[16]Espey MG, Miranda KM, Feelish M, et al. Mechanisms of cell death governed by the blance between it rosative and oxidatives tress [J]. Ann N Y AcadSci, 2000, 899(2-3):209-221.
[17]Hussain, Sabah N. A. et al. Expression of nitric oxide synthase isoforms in normal ventilatoty and limb muscles [J]. ApplPhysiol, 1997, 83(2):348-353.
[18]Flora SJ. Role of free radicals and antioxidants in health and disease.Cell MolBiol (Noisy-le-grand), 2007, 53(1):1-2.
[19]吴晓华,闫金辉,蔡书景,等.通窍活血汤加减对缺血性脑卒中患者NO及tNOS、iNOS寒冷的影响[J].现代中西医结合杂志,2014, 23(22): 2 402-2 404.
[20]Roberts CK. Postexercise increase in nitric oxide in football players with muscle cramps[J]. Pm.J.Sports Med, 1998, 26(6):820-824.
[21]Koizumi T, Hermo CI. Nitric oxide and nitro-glycerin reversal of pulmonary vasoconstriction induced by alpha-activation during exercise[J]. AM J Physiol, 1996, 270(2):875-880.
