黄芩素对阿霉素肾病大鼠肾小管上皮细胞PERK-CHOP凋亡通路的作用*
2018-01-25周昕李芸杨俊易铁钢易无庸深圳市中医院广州中医药大学第四临床医学院肾病科广东深圳518033
★ 周昕 李芸 杨俊 易铁钢 易无庸(深圳市中医院/广州中医药大学第四临床医学院肾病科广东 深圳 518033)
慢性肾脏病(chronic kidney disease,CKD)是一类严重威胁人类健康的疾病,蛋白尿是CKD进展的重要危险因素,蛋白尿引起的肾小管损伤在肾脏疾病进展中扮演了重要角色[1]。蛋白尿导致的肾小管上皮细胞(tubular epithelial cell,TEC)凋亡是肾小管萎缩进而走向小管间质纤维化的重要因素[2]。在各种凋亡通路中,内质网应激相关 PERK-CHOP(PKR-like endoplasmic reticulum kinase,C/EBP-homologous protein) 通 路 在 蛋 白尿肾小管损伤中起到了重要作用[3]。阿霉素肾病(adriamycin nephropathy,AN)动物模型是一种慢性持续性蛋白尿模型,对研究持续性蛋白尿诱导的肾小管损伤具有很好的价值[4-6]。有研究显示黄芩素对肾脏疾病有一定的保护作用[7-9],但其是否通过调节PERK-CHOP凋亡通路起到肾小管保护作用尚未见报道,本研究拟从PERK-CHOP凋亡通路探讨黄芩素对蛋白尿肾小管损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 18只雄性Wistar大鼠,体重170~220 g,购自南方医科大学实验动物中心,实验期间自由饮水、摄食。
1.1.2 实验用药、试剂及主要仪器 阿霉素(Sigma Aldrich,St. Louis,MI,USA),黄芩素(南京崇原生物有限公司),p-PERK一抗(Cell signaling Tec,MA,USA),western blot浓度为1∶500,免疫组化浓度1∶100,CHOP一抗(Cell signaling Tec,MA,USA),western blot浓度为1∶1000,免疫组化浓度为 1∶100,二 抗(Cell signaling Tec,MA,USA),免疫组化试剂盒(Maixin-Bio,Fuzhou,China),TUNEL 检测试剂盒(Merck,Darmstadt,Germany),大鼠代谢笼(Tecniplast,Buguggiate,Italy),荧光显微镜(Nikon Corporation,Tokyo,Japan),垂直电泳仪(Bio-Rad,Hercules,CA,USA),转膜仪(Bio-Rad,Hercules,CA,USA),罗氏全自动生化分析仪。
1.2 方法
1.2.1 动物模型制作及干预 将18只雄性Wistar大鼠随机分为正常对照组(正常组,n=6)、阿霉素肾病组(模型组,n=6)和阿霉素肾病+黄芩素观察组(观察组,n=6),模型组和观察组一次性尾静脉注射阿霉素2.0 mg/kg诱导阿霉素肾病动物模型,正常组注射等量生理盐水。造模后第1d开始,观察组予黄芩素300mg/(kg·d)灌胃,正常组和模型组予等量蒸馏水灌胃,共治疗12周。
1.2.2 标本采集与保存 黄芩素干预12周后,使用大鼠代谢笼收集各组大鼠24h尿液标本。血液和肾脏组织样本采集:10%水合氯醛按35mg/100g腹腔注射麻醉,沿腹正中线剖开腹腔,从腹腔静脉采集血液样本,离心后留取血清,摘除肾脏,切取一半左肾用10%福尔马林固定,经脱水,透明,石蜡包埋,切片4μm,行肾组织细胞凋亡检测(TUNEL试剂盒测定)及免疫组织化学染色(p-PERK及CHOP)。剩余肾组织分离皮髓质后冻存于-80℃冰箱,使用Western blot方法检测肾皮质中p-PERK和CHOP蛋白含量。
1.2.3 标本测定 使用罗氏全自动生化分析仪测定24h尿蛋白定量、血清白蛋白、血清总蛋白、血肌酐、血尿素氮。使用TUNEL试剂盒检测肾组织细胞凋亡情况,计数方法:每个样本随机选取5个高倍镜下视野(HPF,40×物镜),每个视野计数TUNEL阳性TEC个数,计算其平均值。免疫组化方法检测肾组织中p-PERK和CHOP的表达分布,Western blot方法检测肾皮质组织中p-PERK及CHOP蛋白的含量,结果以β-actin作为内参进行比较,使用Bio-Rad全能成像仪(Bio-Rad Laboratories,California,USA)进行统计分析。
2 结果
2.1 各组大鼠24h尿总蛋白定量变化 第12周时,与正常组比较,模型组24h尿总蛋白定量明显升高,黄芩素干预12周后,观察组较模型组有明显降低(图1)。
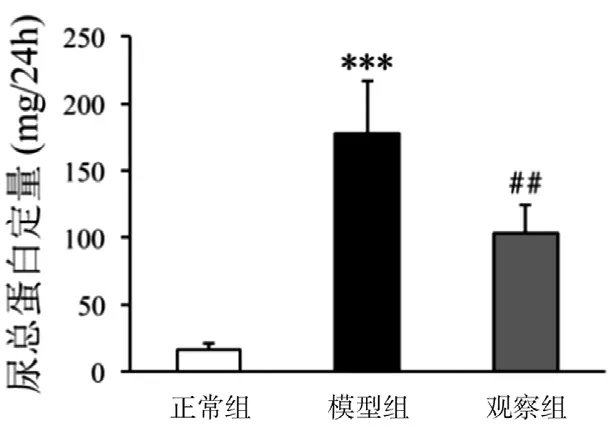
图1 各组大鼠24h尿总蛋白定量变化图
2.2 各组大鼠血清白蛋白、总蛋白、血肌酐、血尿素氮变化 第12周时,与正常组比较,模型组血清白蛋白明显下降(图2a),血清总蛋白、血肌酐、血尿素氮变化无明显统计学意义(图2b,c,d);观察组血清白蛋白较模型组明显升高(图2a),血清总蛋白、血肌酐、血尿素氮变化无统计学意义(图2b,c,d)。

图2 各组大鼠血清白蛋白、总蛋白、血肌酐、血尿素氮变化图
2.3 各组大鼠肾小管上皮细胞凋亡情况 第12周时,与正常组比较,模型组TUNEL阳性TEC数量明显增加,观察组较模型组明显减少(图3)。
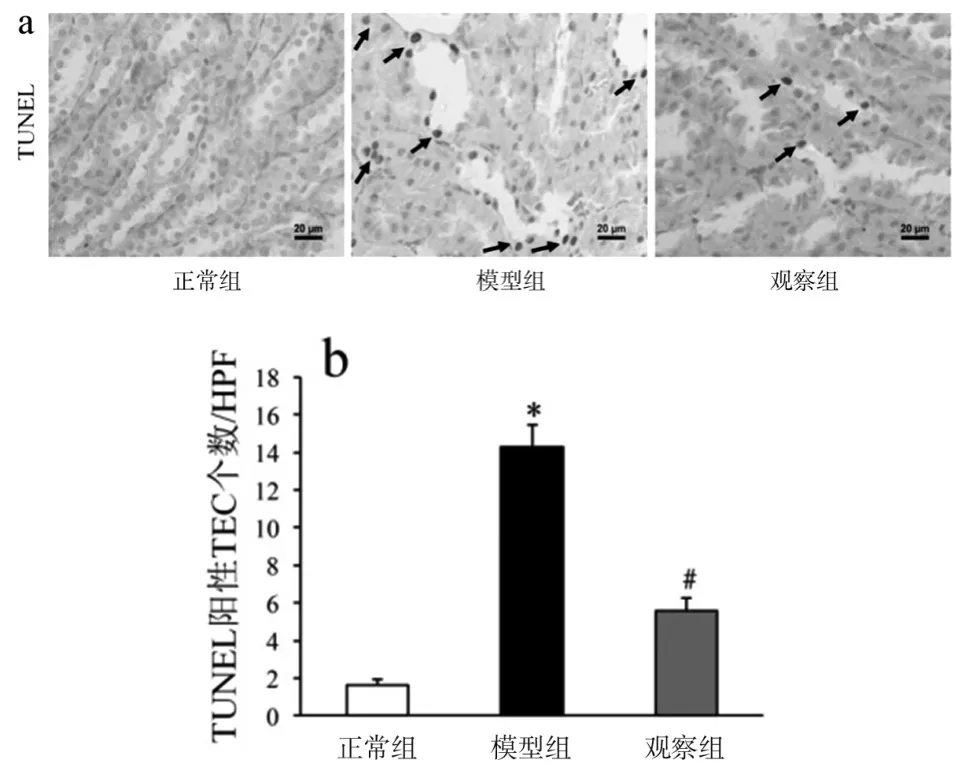
图3 各组大鼠肾小管上皮细胞凋亡情况图
2.4 免疫组化染色显示 p-PERK和CHOP主要表达于肾小管,肾小球可少量表达(图4a)。Western blot结果显示肾皮质组织中,模型组p-PERK、CHOP较正常组明显增多,黄芩素治疗12周后p-PERK、CHOP明显下降(图4b,c,d)。

图4 各组大鼠免疫组化染色比较图
3 讨论
肾小管损伤在CKD进展中起到重要作用,持续大量蛋白尿可通过诱导TEC凋亡促进小管萎缩、间质纤维化的发展[10]。细胞凋亡是细胞在一定信号刺激下出现的自主性、程序性细胞死亡,PERK是定位于内质网膜上的一种跨膜蛋白,p-PERK为其活化状态,很多因素可导致内质网功能的内稳态失衡,形成内质网应激,早期可促进细胞存活,随着内质网应激的延长,PERK则通过诱导CHOP表达促进细胞凋亡[11]。
本研究结果显示AN进展至12周时,模型组24h尿蛋白定量明显增加,血清白蛋白明显降低,这表明动物模型已进入持续性大量蛋白尿期。该状态下,TEC细胞凋亡数量明显增加,Western blot结果显示PERK-CHOP通路显著活化,而免疫组化染色结果显示p-PERK、CHOP主要表达在TEC细胞中,肾小球中仅有少量表达,这表明PERK-CHOP凋亡通路可能参与了TEC细胞的凋亡进展。黄芩素治疗12周后,观察组24h尿蛋白定量显著降低,血清白蛋白明显升高,TEC凋亡数量减少,肾皮质组织中p-PERK和CHOP的蛋白含量也明显下降,表明黄芩素可能通过调节PERKCHOP凋亡通路起到保护AN肾小管损伤的作用,但其制尚需进一步研究。
[1]Burlaka I, Nilsson L M, Scott L, et al. Prevention of apoptosis averts glomerular tubular disconnection and podocyte loss in proteinuric kidney disease [J]. Kidney international, 2016, 90(1):135-148.
[2]Zoja C, Abbate M, Remuzzi G. Progression of renal injury toward interstitial inflammation and glomerular sclerosis is dependent on abnormal protein filtration [J]. Nephrology Dialysis Transplantation,2014, 30(5):706-712.
[3]El Karoui K, Viau A, Dellis O, et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2 [J]. Nature communications, 2016, 7:10 330.
[4]Bertani T, Poggi A, Pozzoni R, et al. Adriamycin-induced nephrotic syndrome in rats: sequence of pathologic events [J]. Laboratory investigation; a journal of technical methods and pathology, 1982, 46(1):16-23.
[5]Bertani T, Rocchi G, Sacchi G, et al. Adriamycin-induced glomerulosclerosis in the rat [J]. American Journal of Kidney Diseases,1986, 7(1):12-19.
[6]Takenaka T, Inoue T, Miyazaki T, et al. Klotho suppresses the reninangiotensin system in adriamycin nephropathy [J]. Nephrology Dialysis Transplantation, 2017, 32(5):791-800.
[7]Wu K, Li H, Tian J, et al. Protective effect of baicalein on renal ischemia/reperfusion injury in the rat [J]. Renal failure, 2015, 37(2):285-291.
[8]Lee E K, Kim J M, Choi J, et al. Modulation of NF-κB and FOXOs by baicalein attenuates the radiation-induced inflammatory process in mouse kidney [J]. Free radical research, 2011, 45(5):507-517.
[9]Wang W, Zhou P, Xu C, et al. Baicalein attenuates renal fibrosis by inhibiting inflammation via down-regulating NF-κB and MAPK signal pathways [J]. Journal of molecular histology, 2015, 46(3):283-290.
[10]Zhu Y, Cui H, Xia Y, et al. RIPK3-mediated necroptosis and apoptosis contributes to renal tubular cell progressive loss and chronic kidney disease progression in rats [J]. PloS one, 2016, 11(6):e0156729.
[11]Gardner B M, Pincus D, Gotthardt K, et al. Endoplasmic reticulum stress sensing in the unfolded protein response [J]. Cold Spring Harbor perspectives in biology, 2013, 5(3):a013169.
