SA溶液浓度对乳液静电纺丝SA/PCL纳米纤维成形的影响
2018-01-24林俊杰许伟鸿邓玲利严玉蓉
林俊杰,许伟鸿,邓玲利,严玉蓉
(华南理工大学 材料科学与工程学院,广州 510640)
乳液静电纺丝可在传统静电纺丝设备上,通过改变乳液中分散相与连续相的成分,制备具有特定组成、结构和功能的复合纳米纤维,无需考虑采用皮-芯静电纺丝技术所涉及的专有设备及皮、芯层聚合物溶剂的相互溶解或反应等问题[1-2],因此该方法可应用于药物缓释、传感器、食品保存、组织工程支架材料等领域[3-4]。
聚己内酯(PCL) 是一种生物相容性良好的生物可降解高分子材料,具有很好的柔韧性和加工性能[5]。但PCL本身为疏水性材料,对细胞的粘附及亲和性较差,可通过表面改性方法提高其细胞亲和性能[6]。而通过乳液静电纺丝,可将水溶性药物、生物亲和性优异的蛋白质等大分子在纤维成形过程中直接附着在疏水性纤维表面,并可通过一定的成形工艺控制,形成具有3D 结构的聚合物网络,为细胞培养提供支架材料[4]。
海藻酸钠(SA)是一种广泛存在于海带等褐藻中的多糖物质,具有优异的抗菌性能、良好的亲水性和生物相容性,通过离子交换作用,可在温和条件下形成凝胶,是敏感性药物、蛋白质、细胞和酶等活性物质的优良载体,在环境保护、临床应用和生物制药等领域有着广泛应用[7-9]。近年来,关于采用SA为原材料制备功能纳米纤维的研究报道越来越多[4,10]。作者以PCL/氯仿溶液作为连续相,SA/水溶液为分散相,失水山梨醇脂肪酸酯(Span80)为乳化剂,制备纺丝乳液并进行静电纺丝;研究乳液配制对所制备SA/PCL复合纳米纤维形貌的影响,并采用Ca2+置换制得海藻酸钙(CA)/PCL复合纤维膜,从而为组织工程支架材料的开发提供新思路。
1 实验
1.1 主要原料
PCL:相对分子质量(Mw)为1.0×105,深圳Esun科技股份有限公司提供;SA:分析纯,阿拉丁科技(中国)有限公司产;Span80、三氯甲烷:分析纯,广州化学试剂厂生产;无水氯化钙(CaCl2):分析纯,上海润捷化学试剂有限公司产;去离子水:实验室自制。
1.2 SA/ PCL乳液的配制
乳液制备有两种方法:(1)两步法,先将分散相配制好,加入到含有表面活性剂的溶剂中,完全分散后再加入连续相高聚物溶解,并再次分散;(2)一步法,先分别将分散相和连续相配制好,然后将分散相加入到含有表面活性剂的连续相中,充分分散。一步法适用于黏度较小的溶液,但由于SA水溶液的黏度比较大,难以分散均匀,因此本实验采用两步法制备SA/PCL乳液。
首先将SA溶于去离子水中配制一定浓度的SA 水溶液,静置脱泡备用。在 FJ200S型均质分散机上按比例将三氯甲烷、SA 水溶液和Span80于7 000 r/min 转速下均质15 min,随后加入一定质量的PCL(PCL质量与SA水溶液的体积之比为1 g:1 mL,Span80相对于PCL的质量分数为60%),置于恒温摇床连续均化12 h,待 PCL完全溶解,均质分散机再以转速7 000 r/min均质15 min后,得到所需纺丝乳液。
1.3 乳液静电纺丝制备SA/PCL复合纤维膜
采用华南理工大学自制ESF-Y1静电纺丝成型仪器对上述溶液或乳液进行静电纺丝[11]制备SA/PCL复合纤维膜。纺丝液流量0.65 mL/h,纺丝电压10.5 kV,接收距离10 cm,纺丝环境温度(25±5)℃,相对湿度(60±5)%。
1.4 CA/PCL复合纤维膜的制备
将SA/PCL复合纤维膜浸泡于0.02 g/mL CaCl2溶液中,25 ℃恒温摇床震荡4 h,实现SA与Ca2+交换,制得CA/PCL复合纤维膜,用去离子水冲洗3次,除去纤维膜表面残留的无机盐,于40 ℃下真空干燥24 h,密封备用。
1.5 测试与表征
乳液黏度:采用NDJ-79 型旋转黏度计 (上海昌吉地质仪器有限公司制)在25 ℃条件下测定SA溶液、PCL溶液以及SA/PCL乳液的黏度,每个待测试样平行测定5次,结果取平均值。
表面张力:采用最大气泡法测定液体在空气中的表面张力[4],每个待测试样平行测定5次,结果取平均值。
表面形貌:采用荷兰FEI 公司NavaNano430场发射扫描电子显微镜(SEM)观察SA/PCL和CA/PCL复合纳米纤维的表面形貌,并采用Digimizer 图形软件对纤维直径进行统计分析。
傅里叶变换红外光谱(FTIR):采用德国Bruker 公司Vector33傅里叶变换红外光谱仪对复合纤维膜进行红外表征,应用衰减全反射附件,扫描波数500~4 000 cm-1,每个试样扫描 30 次。
2 结果与讨论
2.1 SA浓度对SA/PCL乳液物理性质的影响
Span80的亲水亲油平衡值(HLB)为4.3,是良好的油包水(W/O)体系乳液的乳化剂[12]。当Span80的含量超过其临界胶囊浓度时,Span80分子自聚集形成的反胶囊会有效减少水油两相的接触。对于SA/PCL乳液,SA与PCL界面完全由Span80两亲性分子隔开,SA以胶囊的形式稳定分布在连续相PCL溶液中。
由图1可知,在固定分散相体积的前提下,SA水溶液浓度的上升对SA/PCL乳液黏度无明显影响;而且实验测得10 g/L的SA水溶液黏度为862.0 mPa·s,远大于不同配比乳液的黏度,这表明SA水溶液以胶囊的形式存在乳液体系中,对乳液黏度起主要作用的是连续相PCL溶液。

图1 分散相SA浓度对SA/PCL乳液黏度的影响Fig.1 Effect of dispersed phase SA concentration on viscosity of SA/PCL emulsion
由图2可见,SA/PCL的W/O体系的表面张力随SA溶液浓度的升高有小幅度下降。这是由于SA被Span80包在胶囊内,SA溶液本身的表面张力对乳液体系的贡献有限。
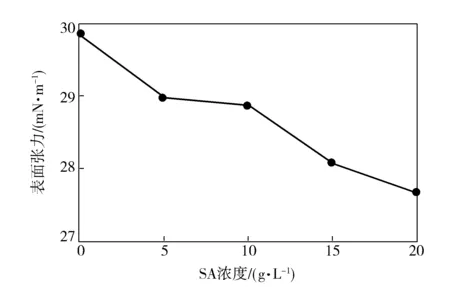
图2 分散相SA浓度对SA/PCL乳液表面张力的影响Fig.2 Effect of dispersed phase SA concentration on surface tension of SA/PCL emulsion
根据J.W.Goodwin等[13]给出的分散相粒子粒径的相关因素,见式(1)。在一定均质速度和均质时间下,可认为各组输入能量相同,决定乳液体系中分散相粒径的因素为两相间的界面张力。
D~E-0.4γ120.6ρ2-0.2
(1)
式中:D表示分散相粒径;E表示输入乳液体系能量;γ12表示两相界面张力;ρ2为连续相密度。
随着SA水溶液浓度的提高,SA分子链相互缠结的趋势增加,对应SA/PCL乳液体系的分散相粒径越大,SA/水-PCL/三氯甲烷溶液两相界面张力增加,对于乳化剂含量一定的情况下,位于两相界面起桥键作用的Span80分子越少,连续相溶液中游离及自成胶囊的Span80分子越多,也表现在乳液与空气交界处的Span80分子越多,一定程度上降低了乳液体系的表面张力。
2.2 SA浓度对SA/PCL乳液静电纺丝成形的影响
从图3可以看出:当PCL/三氯甲烷溶液浓度较低且未加Span80时,由于PCL分子链之间的缠结不足,三氯甲烷极快的挥发速度使得静电纺丝射流无法在电场力的作用下得到充分的拉伸, PCL纤维中含有很多串珠,且串珠大小不均匀;当PCL溶液中加入Span80后,PCL纤维中串珠状结构消失,这与Span80减少溶液的表面张力有关[14],从而改善了PCL溶液静电纺丝纤维形貌。

图3 PCL溶液添加表面活性剂前后静电纺丝纤维形貌Fig.3 Morphology of electrospun fiber from PCL solution before and after surfactant addition
由表1可知,随着纺丝乳液中SA浓度的增加,所得复合纤维的直径出现极大值,且所有纤维的直径均小于仅添加Span80的PCL溶液体系所得纤维。SA水溶液存在于Span80胶囊中,因此,SA水溶液对静电纺丝过程不产生直接的影响,且随着SA浓度的增加,SA水相的尺寸增加,Span80胶囊的数量有所改变,乳液体系表面张力降低,聚合物乳液在静电力的作用下克服表面张力作用实现纤维的拉伸和细化的可能性增加,更利于静电纺丝中细小纤维结构的形成,但是,所得纤维直径还与乳液体系中作为基体聚合物油相黏度和溶剂挥发性能的影响有关。综合以上因素,随着SA浓度的增加,所得SA/PCL复合纳米纤维的直径表现出极大值。

表1 SA浓度对SA/PCL复合纳米纤维直径的影响Tab.1 Effect of SA concentration on diameter of SA/PCL composite nanofiber
注: 1)无分散相,添加Span80(含量均相同)的PCL溶液体系。
2)SA/PCL体系中SA溶液以等体积的水代替。
2.3 SA在SA/PCL复合纳米纤维中的分布
SA水溶液的导电性很好(导电率为0.876 S/m),在高压静电场的作用下,推进器针头处乳液中的SA胶囊会因为极化而变形成椭球形[15];大量存在于SA分子中的—COO—会由于正向高压静电场的作用,使椭球形液滴远离电场的那一端带正电,电荷大量集中在椭球形液滴的两侧,液滴之间的界面分子会在液滴之间的电荷吸引力达到一定程度的时候被挤掉,这时候溶液的表面自由能达到最小,促使大液滴的形成;在外加正向静电场的作用下,极化的大液滴向针头的内表面移动[16],在静电场的拉伸下大液滴发生挤压和兼并,并且由于三氯甲烷的快速挥发而产生的两相相对黏度梯度,使得带电的SA分子和Span80分子向纤维表面迁移,最终导致SA分子出现在纳米纤维的表面。这从SA/PCL复合纳米纤维膜的FTIR图也可以得到证实,见图4。
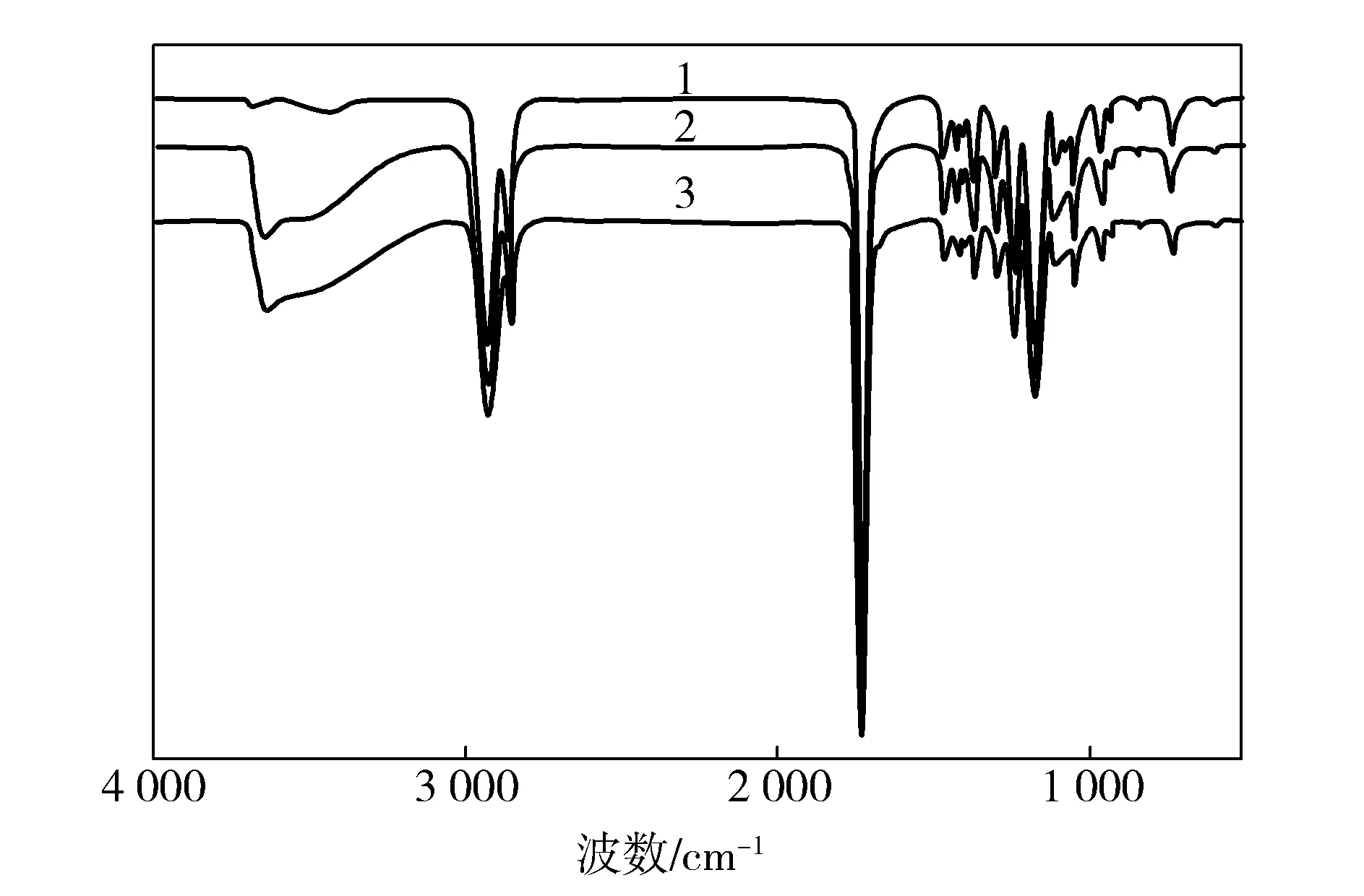
图4 不同SA浓度SA/PCL复合纳米纤维膜的FTIRFig.4 FTIR of SA/PCL composite nanofiber membrane at different SA concentration1—0,2—10 g/L;3—20 g/L
从图4可以看出,PCL在1 722 cm-1处有一个羰基(CO)特征吸收峰,而SA的特征吸收峰在1 612 cm-1附近(SA的C—O—C伸缩振动峰),随着SA浓度的提高,该峰出现并趋于明显,但出峰强度极弱,这也说明SA存在于复合纳米纤维的表面。
由图5可知,当采用Ca2+置换Na+制备CA/PCL时,CA/PCL复合纳米纤维膜的表面出现部分粘连。这与部分海藻酸根通过Ca2+的桥键作用形成一定的交联结构有关,在微观上表现为纤维间的粘连,该粘连作用也导致纤维膜本身机械强度的提升[4]。

图5 不同SA浓度时SA/PCL和CA/PCL复合纳米纤维膜的微观形貌Fig.5 Micromorphology of SA/PCL and CA/PCL composite nanofiber membrane at different SA concentration
3 结论
a. 通过乳液静电纺丝,制备SA/PCL复合纳米纤维膜,然后采用Ca2+置换,可制得CA/PCL复合纤维膜。
b. 表面活性剂Span80可改善PCL溶液的静电纺丝性能;在SA/PCL乳液体系中,当SA溶液体积一定时,SA溶液浓度对SA/PCL乳液的黏度没有显著影响,但SA溶液浓度的增加会降低SA/PCL乳液体系的表面张力,所得SA/PCL复合纳米纤维的直径出现极大值,且均小于仅添加Span80的PCL溶液体系所得纳米纤维。
c. 在乳液静电纺丝过程中,SA有向纤维表面迁移的趋势,FTIR谱图显示在高浓度SA溶液添加体系,所得SA/PCL复合纳米纤维谱图上出现极小的SA的特征C—O—C伸缩振动吸收峰,且该迁移的SA可有效实现SA/PCL与Ca2+交换,从而形成具有凝胶结构的CA/PCL复合纳米纤维膜,为生物支架材料提供新的制备途径。
参 考 文 献
[1] Sanders E H,Kloefkorn R, Bowlin G L,et al. Two-phase electrospinning from a single electrified jet:Microencapsulation of aqueous reservoirs in poly(ethylene-co-vinyl acetate) fibers[J]. Macromolecules, 2003,36(11):3803-3805.
[2] 洪舒寒,吴伟旋, 严玉蓉. PVP/PLA 乳液静电纺丝成形及纤维毡亲水性能研究[J]. 合成纤维工业,2014,37(6):28-30.
Hong Shuhan,Wu Weixuan,Yan Yurong. Emulsion electrospinning process and hydrophilic property of PVP/PLA fiber[J]. Chin Syn Fiber Ind, 2014,37(6):28-30.
[3] Spano F, Quarta A, Martelli C, et al. Fibrous scaffolds fabricated by emulsion electrospinning: from hosting capacity to in vivo biocompatibility[J]. Nanoscale, 2016,8(17):9293-9303.
[4] Xu Weihong, Shen Renzhe, Yan Yurong, et al. Preparation and characterization of electrospun alginate/PLA nanofibers as tissue engineering material by emulsion eletrospinning[J]. J Mech Behav Biomed Mater,2017,65:428-438.
[5] 黄琼瑜, 佘厚德, 肖秀峰,等. 羟基磷灰石/聚己内酯-壳聚糖复合材料的制备与表征[J]. 复合材料学报, 2009,26(1):24-30.
Huang Qiongyu, She Houde, Xiao Xiufeng, et al. Preparation and characterization of hydroxyapatite/polycaprolacton-chitosan composites[J]. Acta Mater Comp Sin, 2009,26(1):24-30.
[6] 张一. 聚己内酯的表面改性及其对细胞行为的影响[D]. 上海:华东理工大学,2012.
Zhang Yi. Surface modification of polycaprolacton and its effect on cell behavior[D].Shanghai:East China University of Science and Technology,2012.
[7] Mchugh D J. Production and utilization of products from commercial seaweeds[J]. J Bacteriol,1987,176(2):460-468.
[8] Lee K Y, Mooney D J. Alginate: properties and biomedical applications.[J]. Prog Polym Sci,2012,37(1):106.
[9] 谭利文,姚田田,夏延致,等.海藻酸钙/纳米TiO2共混纤维的制备与表征[J].合成纤维工业,2013,36(2):6-8,12.
Tan Liwen,Yao Tiantian,Xia Yanzhi, et al. Preparation and characterization of calcium alginate/nano-TiO2blend fiber[J]. Chin Syn Fiber Ind,2013,36(2):6-8,12.
[10] 崔莉, 刘好花, 饶元元, 等. 海藻酸钠/聚乙烯醇溶液的性能及静电纺丝[J]. 合成纤维工业, 2011,34(3):5-7.
Cui Li, Liu Haohua,Rao Yuanyuan,et al. Electrospinning process and properties of sodium alginate/polyvinyl alcohol solution[J]. Chin Syn Fiber Ind, 2011,34(3):5-7.
[11] Cheng Wei, Yu Qi, Qiu Zhiming, et al. Effects of different ionic liquids on the electrospinning of a polyacrylonitrile polymer solution[J]. J Appl Polym Sci,2013,130(4):2359-2368.
[12] 田静, 李辉. 液体表面张力系数测量中的影响因素分析[J]. 大学物理, 2012,31(10):28.
Tian Jing, Li Hui. Analysis on the factors that influence the measurement of the liquid surface tension coefficient[J].Coll Phys,2012,31(10):28.
[13] Goodwin J W. Colloids and interfaces with surfactants and polymers:an introduction[M]. New York:John Wiley & Sons, 2004:179.
[14] 朱锐钿, 严玉蓉, 赵耀明, 等. 十二烷基硫酸钠和乙醇对明胶超细纤维成型的影响[J]. 产业用纺织品,2011,29(9):20-24.
Zhu Ruitian,Yan Yurong,Zhao Yaoming,et al. Influence of SDS and ethanol on forming process of gelatin ultrafine fiber[J]. Tech Text,2011,29(9):20-24.
[15] 王亮, 冯永训, 董守平,等. 电场破乳分散相液滴行为研究[J]. 实验流体力学, 2010,24(2):28-33.
Wang Liang,Feng Yongxun, Dong Shouping, et al. Investigation on behavior of dispersed phase droplets for the electric demulsification[J]. J Exp Fluid Mech, 2010, 24(2):28-33.
[16] 黄万抚. 乳状液膜静电破乳器破乳机理研究[J]. 化学工程, 2003,31(3):58-61.
Huang Wanfu. Principle of electrostatic broken emulsion in emulsion liquid membrane separation[J]. Chem Eng, 2003,31(3):58-61.
