胰酶消化时长对GFP转基因小鼠BMSC传代生长特性的影响
2018-01-24和法莲白盈盈陈慧芬李自安杨建勇潘兴华刘高米洋
和法莲,白盈盈,陈慧芬,李自安,杨建勇,潘兴华,刘高米洋
绿色荧光蛋白(GFP)转基因小鼠的骨髓间充质干细胞(GFP-BMSC)具有自我更新和多向分化潜能,同时又能稳定表达GFP,可作为骨髓间充质干细胞(BMSC)体内示踪及分化研究的良好工具。笔者的前期研究发现,体外分离培养中小鼠GFP-BMSC的培养不同于人及大鼠,其培养扩增难度高,细胞活性保持时间短,传代过程中BMSC消化时间长短难以控制,严重影响小鼠GFP-BMSC的体外扩增效率。本研究通过比较不同胰酶消化时间对消化过程的影响,优化小鼠BMSC消化时间,为小鼠BMSC的后续研究奠定基础。
1 材料与方法
1.1 实验动物与材料 4~8周龄雄性绿色荧光蛋白转基因小鼠,由医院动物中心提供,实验方案经动物实验伦理委员会批准;DMEM/F12培养基(美国BI公司)、胎牛血清(Hyclone公司)、SW-CL-2F 型百万层级层流超净工作台(苏州佳宝净化工程设备有限公司)、二氧化碳培养箱(美国Thermo公司)、倒置相差显微镜(日本奥林巴斯公司)、0.25% 胰酶(美国BI公司),成脂、成骨、成软骨诱导试剂盒(GIBCO公司)。
1.2 实验方法
1.2.1 BMSC的提取和培养 脱颈处死绿色荧光蛋白转基因小鼠,75%乙醇皮肤消毒,无菌条件下取股骨及胫骨,浸泡在PBS中,移至超净工作台,移除PBS,再用含双抗1∶100的PBS清洗3遍。用无菌剪剪掉两侧的骨骺端,暴露骨髓腔,放于10 mm培养皿中,用1 ml一次性注射器吸取细胞培养基(含10%FBS的DMEM/F-12)冲洗骨髓腔。冲洗数次直至将绝大部分骨髓冲出,骨髓腔由红色变成白色为准。用5 ml一次性无菌巴氏滴管,反复在培养皿中吹吸细胞悬液3~5次,尽量使细胞呈单个状态;再全部转移到新的10 cm2培养皿中,置于培养箱中培养,此时细胞悬液约5 ml,24 h后补液至10 ml。待细胞融合率约80%~90%时传代。
1.2.2 胰酶最佳消化时间确定 取P2代纯化的含相同细胞量的小鼠BMSC悬液接种于6孔细胞培养板中,待细胞生长融合度达到80%~90%时,用0.25%的胰酶消化 5、10、15和 20 mins,观察细胞消化程度、细胞形态、死亡细胞碎片的数量,比较不同时间点胰酶对小鼠BMSCs的消化能力。
1.2.3 BMSC诱导分化潜能鉴定
1.2.3.1 成脂诱导 取消化10~15 mins后再次贴壁的P3代小鼠BMSC,按2×104个/cm2的密度接种6孔板中,加入20%FBS的DMEM/F12完全培养基2 ml/孔。将细胞置于5%CO2培养箱中培养,每隔3 d换液,直到细胞融合度达到100%或者过融合。弃上清,加入成脂诱导液,每3 d换1次液。成脂诱导分化结束后,4%中性甲醛溶液固定,油红O染色,观察成脂染色效果。
1.2.3.2 成骨诱导 取消化10~15 min后再次贴壁的P3代小鼠BMSC,按2×104个/cm2的密度接种在6孔板中,将细胞置于5%CO2培养箱中培养。每隔3 d换液,直到细胞融合度达到60%,弃上清,加入成骨诱导液,每3 d换1次液;培养至21 d后,4%中性甲醛溶液固定,茜素红染色,用1×PBS冲洗3次。将培养板置于显微镜下观察成骨染色效果。1.2.3.3 成软骨诱导 取消化10~15 min后再次贴壁的P3代小鼠BMSC,按5×105个/cm2的密度接种在6孔板中,将细胞置于5%CO2培养箱中培养,贴壁2 h后,弃上清,加入成软骨诱导液,每3 d换1次液,培养诱导14~28 d后,对软骨球进行福尔马林固定和石蜡包埋,进行阿辛蓝染色,显微镜下观察。
2 结果
2.1 BMSC分离培养结果 采用全骨髓贴壁培养法分离的小鼠BMSC,接种3 d后,可见大量贴壁细胞生长,呈梭形,上层培养基中悬浮大量的杂细胞;弃上层培养后,并用PBS缓冲液冲洗2遍后,自然光与绿色激发光下,可见形态均一的细胞增殖集落(图 1a、b);继续培养 2~3 d,75%以上细胞融合。 经胰酶消化后1:2传代,自然光与绿色激发光下,细胞贴壁后呈典型的成纤维细胞形态(图1c、d),分布均匀,大小一致。
2.2 不同时间点胰酶消化结果 胰酶消化5 min后,大量细胞仍处于贴壁状态,无法传代(图2a);胰酶消化10~15 min后,50%~80%细胞缩成圆形,不再贴壁,可用于传代,显微镜下细胞呈单个状态,死亡碎片较少,且二次贴壁后细胞呈长梭形,表面光滑,具有多向分化潜能(图2b、c);胰酶消化20 min后,细胞大部分悬浮,传代再贴壁后细胞呈宽大扁平状,表面粗糙,状态较差(图2d)。
2.3 BMSC诱导分化能力 体外成脂分化诱导14~21 d后,细胞由长梭形开始收缩、变圆,形态不规则,有脂肪小滴,经油红O染色后,脂滴明显红染(图3a);体外成骨分化诱导 14~21 d后,经茜素红染色后,出现明显红染的钙结节(图3b);体外成软骨分化诱导14~28 d后,石蜡包埋切片,可见软骨胶原基质中酸性粘多糖经阿利新蓝染成蓝色(图3c)。
3 讨论

图1 倒置显微镜观察小鼠荧光BMSC的形态(40×)
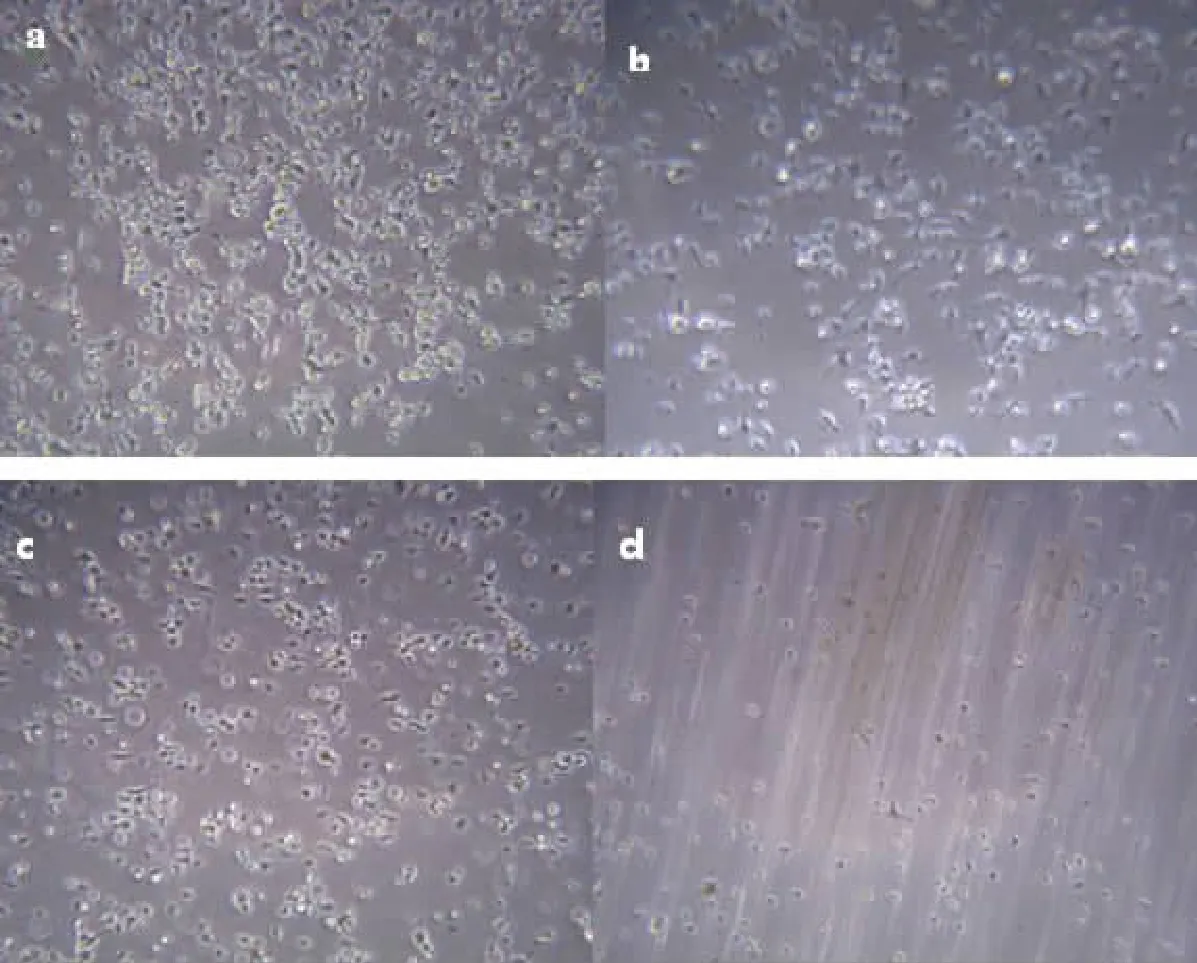
图2 荧光小鼠BMSC的胰酶消化后的贴壁形态(40×)
BMSC是干细胞研究中的一个重点和热点,因其含量相对较多又易于获得,体外生长能力强,已被广泛用于人类疾病动物模型治疗研究,但在体内示踪其迁移、分布、定位及分化困难。绿色荧光蛋白标记技术是近年来细胞标记的主要技术[2],但GFP慢病毒转染标记的细胞,其GFP表达存在实效性极不稳定、易荧光淬灭的缺陷,而GFP-BMSC具有绿色荧光蛋白表达稳定、免疫原性较低等特性,为干细胞体内示踪提供了良好的条件[3-4]。建立完善的GFP转基因小鼠BMSC的培养体系,是获得GFPBMSC并用于相关研究的前提和基础。

图3 小鼠BMSC诱导潜能结果
人类和大鼠BMSC在传代过程中,可以用0.25%胰酶消化2 min左右便可使细胞脱落[5-6],而GFP小鼠的BMSC胰酶消化时间尚不确定,胰酶消化时间过短,GFP-BMSC难以自动脱落;而消化时间过长,胰酶过度与细胞接触,可破坏细胞表面蛋白和细胞双层膜,导致细胞破坏、甚至死亡。本实验结果发现,在胰酶消化5 min时,大部分细胞处于贴壁状态,只有少量细胞悬浮,不符合细胞传代要求;在胰酶消化时间为20 min时,细胞全部脱落,但是二次贴壁后,细胞死亡碎片较多且细胞形态不一,不成梭形,不满足干细胞的形态;而在胰酶消化时间为10、15 min时,大部分细胞变成圆形、脱落,符合传代要求,且二次贴壁后,细胞状态良好、呈梭形,具有BMSC的基本形态,诱导分化结果显示具有成脂、成骨、成软骨的诱导分化能力。结果说明,用胰酶消化10~15 min不会破坏 GFP-BMSC的细胞形态、传代生长特性及分化能力。
综上所述,0.25%胰酶与底物GFP-BMSC的最佳消化时间是10~15 min。相比于人和大鼠消化只需要2 min而言,GFP-BMSC的消化时间是其5~8倍,这一现象可能与其种属遗传特性及转GFP基因有关,但详细机制有待于进一步研究。
[1] Lee K,Majumdar M K,Buyaner D,et al.Human mesenchymal stem cells maintain transgene expression during expansion and differentiation[J].Molecular Therapy the Journal of the American Society of Gene Therapy,2001,3(6):857-866.
[2] Mizuno H,Zuk PA,Zhu M,et al.Myogenic differentiation by human processed lipoaspirate cells[J].Plastic&Reconstructive Surgery,2002,109(1):199.
[3] Stephens DJ,Allan VJ.Light microscopy techniques for live cell imaging[J].Journal of the Graduates Sun Yat-Sen University,2008,300(5616):82-86.
[4] Englund U,Fricker-Gates RA,Lundberg C,et al.Transplantation of human neural progenitor cells into the neonatal rat brain:Extensive migration and differentiation with long-distance axonal projections[J].Experimental Neurology,2002,173(1):1.
[5] 庞荣清,何洁,李福兵,等.一种简单的人脐带间充质干细胞分离培养方法 [J].中华细胞与干细胞杂志 (电子版),2011,1(2):30-33.
[6] Jia GQ,Zhang MM,Yang P,et al.Effects of the different culture and isolation methods on the growth,proliferation and biology characteristics of rat bone marrow mesenchymal stem cells[J].Journal of Sichuan University,2009,40(4):719-723.
