白介素17受体mRNA在恒河猴中的分布①
2018-01-24王凤杰崔艳芳叶华虎法云智杨贵波
王凤杰 李 冬 余 磊 崔艳芳 叶华虎 法云智③ 杨贵波
(中国疾病预防控制中心性病艾滋病预防控制中心,北京 102206)
白介素17受体(Interleukin 17 receptor,IL- 17R)是表达在IL- 17家族细胞因子靶细胞表面的跨膜分子。IL- 17受体家族包括IL- 17RA、B、C、D、E五个成员,其中IL- 17RA是首个被发现的哺乳动物IL- 17受体,与IL- 17RC形成复合体,是IL- 17A、IL- 17A- IL- 17F、IL- 17F信号通路中必不可少的成分[1,2]。IL- 17R家族成员包含一个保守的SEFIR结构域,在与IL- 17A结合后, IL- 17RA/IL- 17RC的SEFIR与下游的ACT1相互作用激活下游信号,最终激活NF- κB信号通路[3- 5]。目前已经发现的能够被IL- 17A激活的转录因子还有AP- 1、C/EBP- δ和C/EBP- β等[6]。此外,IL- 17A还参与MAPK、JNK、ERK及P38等信号通路的活化[6],并可能参与PI3K信号的激活[3]。激活IL- 17R通路可刺激多种细胞因子 (IL- 6、G- CSF、GM- CSF)、趋化因子(CCL2、CCL7、CCL20、CXCL1、CXCL5)、抗菌肽(β- defensin- 2、S100A7、S100A8、S100A9)、黏蛋白(MUC5B、MUC5AC)和基质金属蛋白酶(MMP1、MMP3、MMP9、MMP12、MMP13)的形成[7],一方面抑制上皮细胞周围细菌的繁殖,维持肠道上皮屏障功能,增强肠道上皮的紧密连接结构,阻止肠内细菌或内毒素移位到其他组织器官;另一方面参与机体免疫反应的调节[8],在自身免疫性疾病、宿主防御和肿瘤的发生发展中发挥重要作用。
已知IL- 17R在人和小鼠体内广泛分布,造血组织中表达水平相对较高。Northern blot分析表明,小鼠的脾脏和肾脏IL- 17RA表达水平较高,其次为肺脏和肝脏,而在脑、心脏、骨骼肌和睾丸组织中的表达水平较低;IL- 17RA在鼠肠道上皮细胞、胸腺细胞、B淋巴细胞、T淋巴细胞、肥大细胞以及淋巴瘤细胞中均有高水平的表达,而在胚胎肝脏上皮细胞和成纤维细胞中的表达水平较低[9]。利用定量PCR对小鼠组织中IL- 17R转录水平的分析表明,胸腺中IL- 17RA水平最高,分别为脾脏和肺中的1.5倍和4倍,在淋巴结、大肠和小肠中IL- 17RA低水平表达;而IL- 17RC在大肠和小肠中表达水平最高,为肺中的1.5倍,胸腺和脾脏中IL- 17RC水平也显著低于肠道,淋巴结中几乎不表达IL- 17RC。在免疫细胞中IL- 17RA和IL- 17RC的水平也存在差异,IL- 17RA在巨噬细胞中水平最高,其次为T淋巴细胞,而在B淋巴细胞和树突状细胞中水平相对较低;IL- 17RC在巨噬细胞和T淋巴细胞中低水平表达,B淋巴细胞、树突状细胞几乎不表达[10]。
恒河猴与人类亲缘关系较近,被广泛用于建立人类疾病研究的动物模型,在艾滋病、肠道炎症性疾病、肝炎等多种疾病的研究中具有不可替代的作用。目前已知IL- 17/IL- 17R通路与免疫系统、消化系统和呼吸系统相关疾病密切相关[11- 13],而恒河猴可在这些疾病的研究中发挥重要作用,但对恒河猴IL- 17/IL- 17R通路的研究甚少。本研究组曾对恒河猴Th17细胞、IL- 17A及其在猴艾滋病中的作用进行过研究[14,15],但IL- 17R在恒河猴体内的表达及分布情况至今尚无报道。本文建立定量PCR方法观察了恒河猴中IL- 17RA mRNA的分布,并比较了恒河猴、食蟹猴和非洲绿猴PBMC中IL- 17RA和IL- 17RC mRNA的表达水平。
1 材料与方法
1.1材料
1.1.1试剂 反转录试剂盒(Promega),凝胶回收试剂盒(Qiagen),质粒小量提取试剂盒(Omega),RiboMAXTMLarge Scale RNA Production System- SP6 and T7(Promega),One Step PrimeScriptTMRT- PCR Kit(TaKaRa),淋巴细胞分层液(GE),组织RNA提取试剂盒(天根生物科技)。
1.1.2组织和细胞 本研究使用了-80℃保存的脾脏、胰脏等36种组织(详见结果),来自5只正常中国恒河猴(3只为雌性,2只为雄性,年龄1~2周岁)。PBMC分别来自恒河猴、非洲绿猴、食蟹猴(各10只),通过外周血淋巴细胞分层液梯度离心法获取。
1.2实验方法
1.2.1RNA提取 根据组织RNA提取试剂盒说明书提取组织及PBMC中的RNA,加100 μl RNase Free H2O洗脱RNA产物,分装后于-80℃储存备用。
1.2.2IL- 17R标准品的构建
1.2.2.1目的片段扩增 使用恒河猴正常组织中提取的RNA进行RT- PCR 扩增,IL- 17RA基因扩增片段长414 bp,上下游引物序列分别为5′- CTC CCA GCC GGG GCT AAA CTG- 3′,5′- AGG AAA TTC TTG GAC TGG TGG- 3′;IL- 17RC基因扩增片段长582 bp,上下游引物序列分别为5′- TAG AAG ATG CCT GTG CCC TGG TT- 3′, 5′- AGG CAG CTG CTG TGT GAG GTT GA- 3′。
1.2.2.2RT- PCR产物回收和克隆 对PCR产物进行琼脂糖凝胶电泳,按照凝胶回收试剂盒说明书回收目的片段并鉴定浓度及纯度。将回收产物与pGEM- T Easy Vector连接。
1.2.2.3质粒重组转化及阳性克隆的筛选 连接产物转化入DH5α感受态细胞,并于Amp抗性的LB琼脂平板上37℃过夜培养,挑取单一菌落扩大培养并提取质粒,对质粒进行测序及序列分析,保存测序正确的质粒。
1.2.2.4质粒线性化和体外转录 用限制性核酸内切酶NcoⅠ对质粒进行酶切,回收线性化质粒。按照RiboMAXTMLarge Scale RNA Production System- SP6试剂盒说明书对线性化的质粒进行体外转录。
1.2.2.5RNA标准品的定量和稀释 测定体外转录并纯化后的RNA样品浓度及纯度,用RNase Free H2O对RNA 进行10倍连续稀释,分装后存于-80℃备用。
1.2.3荧光定量PCR检测 用One Step Prime ScriptTMRT- PCR Kit对样品进行荧光定量分析,选用GAPDH作为内参基因,反应程序如下:第一步反应为42℃ 5 min,95℃ 10 s;第二步反应为95℃ 5 s,60℃ 34 s,循环数为40。荧光定量PCR数据分析软件为ABI7500,检测基因及内参基因的引物和探针序列见表1。
1.3统计学处理 用GraphPad Prism 5.0软件进行数据处理和分析,两组数据间用t检验法进行差异分析,P<0.05为差异具有统计学意义。
2 结果
2.1恒河猴各组织中IL- 17RA基因的表达水平 为了解免疫系统中IL- 17R的分布,本研究检测了中枢淋巴组织(骨髓、胸腺)和外周淋巴组织(淋巴结、脾脏、扁桃体等)中IL- 17RA的表达水平。总体而言,IL- 17RA在免疫相关组织中表达量相对较高,其中仅髂淋巴结、骶淋巴结、胸腺和扁桃体中表达量略低于50 000 copies/106GAPDH,其余组织均高于50 000 copies/106GAPDH,腹股沟淋巴结的表达量最高,其次为腋窝淋巴结,扁桃体中表达量最低,IL- 17RA基因的表达量仅在腹股沟淋巴结和扁桃体中存在明显的统计学差异(P=0.044 2),见图1A。
与免疫系统相比,消化道中IL- 17RA的表达水平普遍偏低,口腔黏膜IL- 17RA表达量最低,仅为2 810 copies/106GAPDH。大肠的表达水平高于小肠,大肠中盲肠IL- 17RA表达水平最高,结肠近端表达水平最低,小肠中十二指肠近端水平最高,空肠中部表达水平最低。 IL- 17RA在十二指肠近端、空肠近端、空回肠中部和回肠末端这四个部位的表达水平均与盲肠存在明显的差异,具有统计学意义(P=0.025 7,P=0.018 9,P=0.013 3,P=0.020 6),见图1B。
本试验所选取的5只恒河猴中有三只为雌性,两只为雄性。本研究检测了雌性动物的子宫颈、子宫体、卵巢、阴道以及雄性动物的睾丸和包皮中IL- 17RA的表达情况,在雌性恒河猴的子宫颈和雄性恒河猴的睾丸中IL- 17RA表达水平较高。但生殖器官中IL- 17RA水平均不存在统计学差异,且不存在明显的性别差异,见图1C。
除上述组织外,本研究还对胰脏、肺脏、肝脏、肾脏、心脏等内脏器官及大脑、主动脉、气管、皮肤、肌肉等组织进行了检测,其中胰脏IL- 17RA的水平最高,其次依次为肺脏、肝脏、肾脏、皮肤、主动脉和气管,大脑、心脏和肌肉中表达量均低于10 000 copies/106GAPDH,在所有检测的组织中,肌肉IL- 17RA表达水平最低,仅为370 copies/106GAPDH,见图1D。
对免疫系统、消化系统及生殖系统相关组织中IL- 17RA的表达水平进行对比发现, IL- 17RA在各系统中的表达水平不一致,在免疫系统、消化系统及生殖系统中的表达两两之间差异存在显著统计学意义(P<0.05),见图1E。
2.2恒河猴肠道组织中IL- 17RC基因的表达水平 IL- 17RC在消化道组织中广泛表达,大肠中IL- 17RC的表达水平略高于小肠,大肠中直肠含量最高,其次是结肠和盲肠。但与IL- 17RA相比,IL- 17RC在大肠中的含量偏低。小肠中空肠近端表达水平最高,十二指肠近端和回肠末端含量相当,IL- 17RC在十二指肠近端和回肠末端的表达水平均与直肠存在明显的统计学差异(P=0.023 1,P=0.011 5),见图2。
表1基因引物和探针序列
Tab.1Primerandprobesequenceofgenes
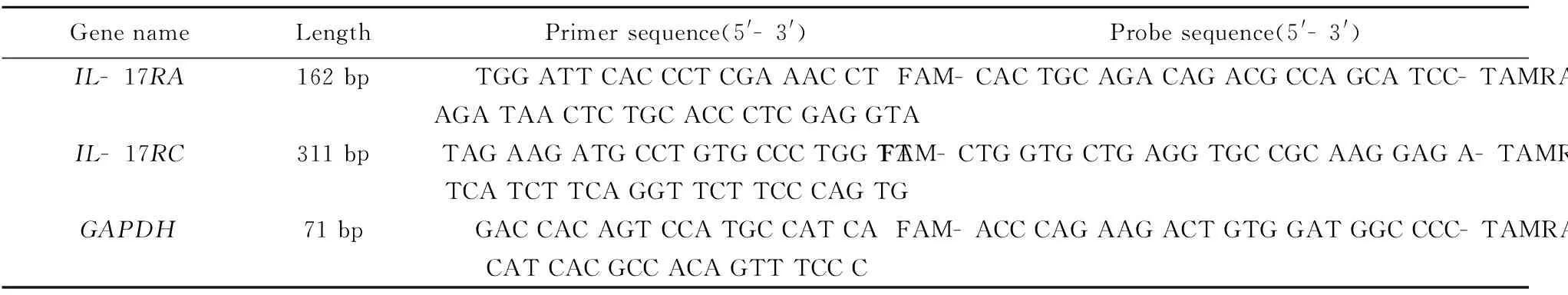
GenenameLengthPrimersequence(5'-3')Probesequence(5'-3')IL-17RA162bpTGGATTCACCCTCGAAACCTFAM-CACTGCAGACAGACGCCAGCATCC-TAMRAAGATAACTCTGCACCCTCGAGGTAIL-17RC311bpTAGAAGATGCCTGTGCCCTGGTTFAM-CTGGTGCTGAGGTGCCGCAAGGAGA-TAMRATCATCTTCAGGTTCTTCCCAGTGGAPDH71bpGACCACAGTCCATGCCATCAFAM-ACCCAGAAGACTGTGGATGGCCCC-TAMRACATCACGCCACAGTTTCCC

图1 IL- 17RA mRNA在恒河猴不同组织中的分布Fig.1 Distribution of IL- 17RA mRNA in different tissues of rhesus macaquesNote: A.Distribution of IL- 17RA in lymphoid tissues;BM.Bone marrow;Thy.Thymus;Spl.Spleen;Axi LN.Axillary lymph node;Mes LN.Mesentery lymph node;Lum LN.Lumbar lymph node;Sac LN.Sacral lymph node;Ili LN.Iliac lymph node;Ing LN.Inguinal lymph node;Ton.Tonsil;B.Distribution of IL- 17RA in digestive tract;Ora.Oral cavity;Sto.Stomach fundic;Duo- p.Duodenum proximal;Jei- p.Jejunum proximal;Ji- m.Jejunoileum middle;Ile- d.Ileum distal;Cae.Caecum;Col- p.Colon proximal;Col- m.Colon middle;Rec.Rectum;* showed statistically significance between Cae and Duo- p,Cae and Jej- p,Cae and Ji- m,Cae and Ile- d,Cae and Col- p,P<0.05;C.Distribution of IL- 17RA in genital tissues;D.Distribution of IL- 17RA in other tissues;E.Difference in IL- 17RA mRNA levels between the lymphoid ,digestive and genital systems;*.P<0.05,**.P<0.01,***.P<0.001.
2.3恒河猴、非洲绿猴、食蟹猴PBMC中IL- 17RA和IL- 17RC mRNA水平比较 对三种猴PBMC中IL- 17RA的水平进行比较发现,恒河猴PBMC中IL- 17RA的水平最高,略高于其在小肠中的表达水平,食蟹猴PBMC中的IL- 17RA的水平约为恒河猴的1/3,而非洲绿猴PBMC中的IL- 17RA的水平最低,约为恒河猴的1/5,食蟹猴与非洲绿猴PBMC中的IL- 17RA水平没有统计学差异,但二者与恒河猴的差异具有统计学意义(P<0.01),见图3。另外,三种猴PBMC中均未检测到IL- 17RC的表达。
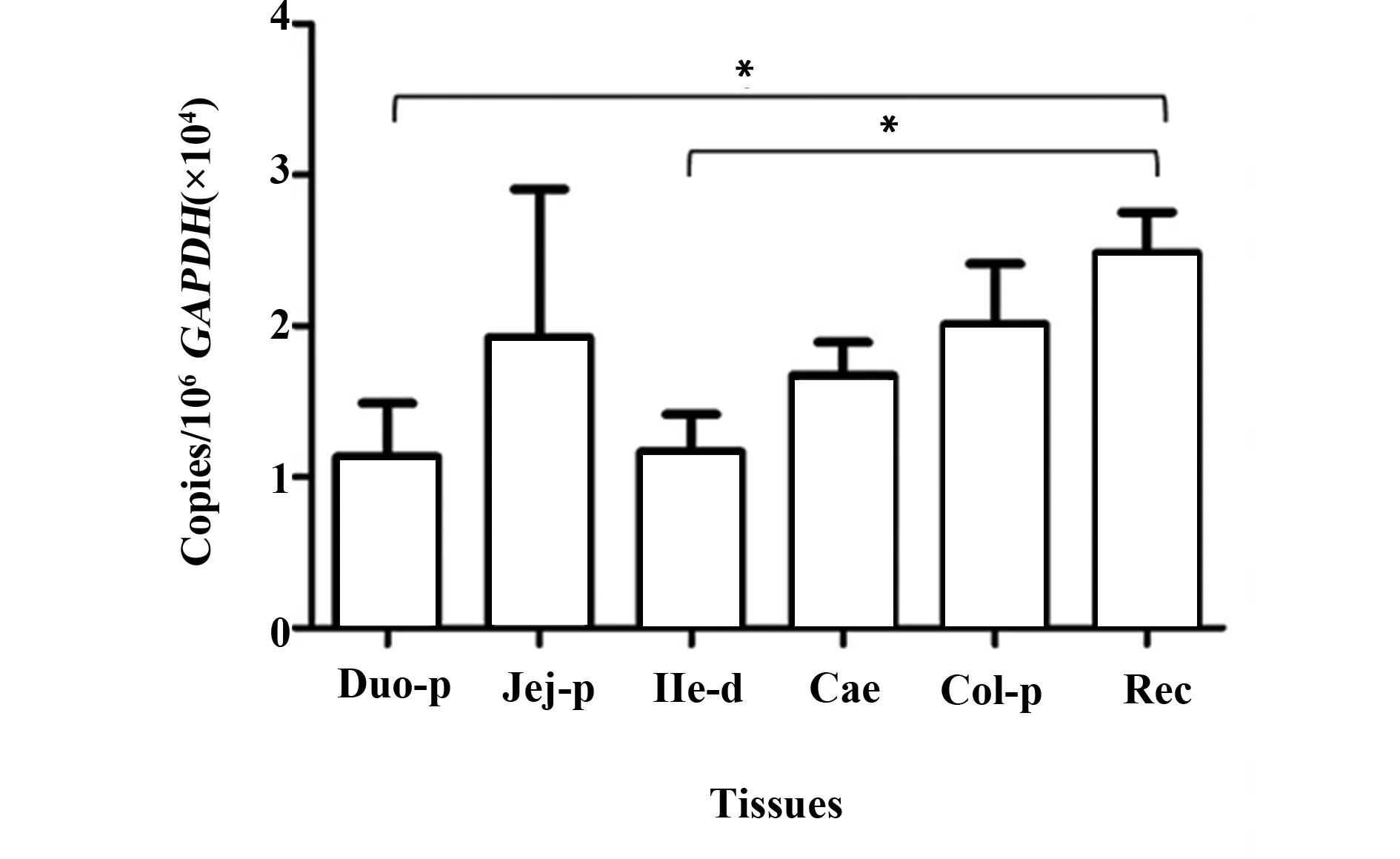
图2 IL- 17RC mRNA在恒河猴肠道组织中的分布Fig.2 Distribution of IL- 17RC mRNA in digestive tract of rhesus macaquesNote: Duo- p.Duodenum proximal;Jei- p.Jejunum proximal;Ile- d.Ileum distal;Cae.Caecum;Col- p.Colon proximal;Rec.Rectum;*.P<0.05.
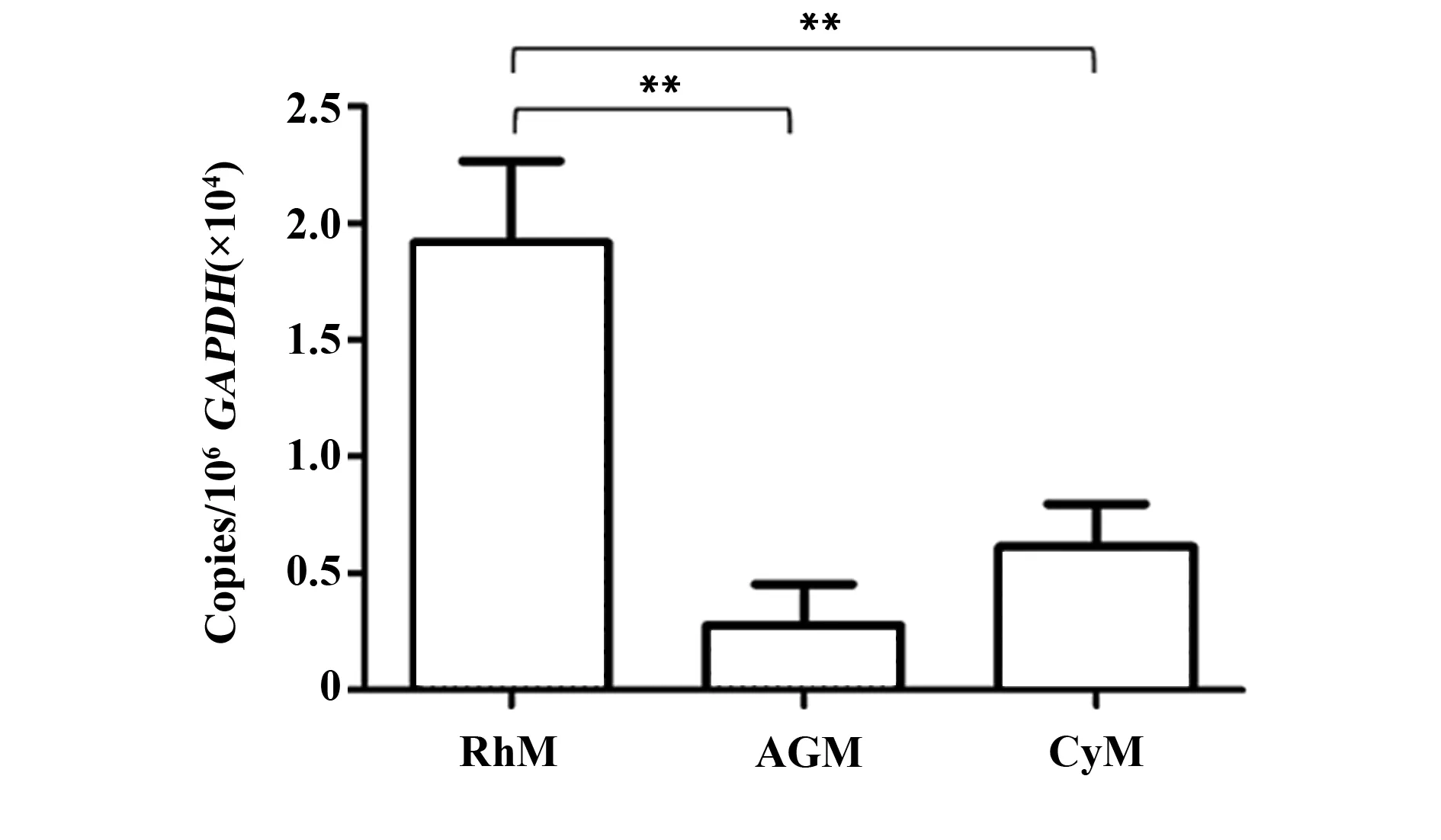
图3 恒河猴、非洲绿猴、食蟹猴PBMC中IL- 17RA mRNA水平的比较Fig.3 Comparison of IL- 17RA mRNA levels in PBMCs of rhesus macaque,African green monkey and cynomolgus monkeyNote: RhM.Rhesus macaque;AGM.African green monkey;CyM.Cynomolgus monkey;**.P<0.01.
3 讨论
为阐明IL- 17RA在恒河猴中的分布特征,本研究检测了包括免疫系统、消化系统、生殖系统等在内的多种组织中IL- 17RA mRNA的表达情况,发现IL- 17RA mRNA在所检测的组织中均有分布。在小鼠和人IL- 17R的研究中发现,IL- 17A可表达于T淋巴细胞、B淋巴细胞、嗜中性粒细胞等多种免疫细胞和上皮细胞、成纤维细胞和肝细胞等多种非造血系统细胞。由于这些细胞类型的分布大多没有组织特异性,因此在不同组织均能检测到IL- 17RA mRNA与预期结果相符。事实上,已有报道表明人和小鼠中IL- 17RA 的mRNA也具有广泛的组织分布[9]。因此本研究表明恒河猴各组织中均有IL- 17A的表达,这与人和小鼠相似。
虽然在恒河猴的各器官系统中均有IL- 17RA的表达,但IL- 17RA mRNA的表达水平在各系统之间存在明显的差异。与小鼠体内的分布相似,IL- 17RA在恒河猴体内主要分布在淋巴结、胸腺、骨髓、脾脏等造血器官,而在肠道、睾丸、心脏、肌肉等组织中水平较低。与小鼠体内分布不同,恒河猴体内IL- 17RA表达量最高的组织为淋巴结,其次为脾脏和胸腺,而小鼠体内胸腺IL- 17RA表达水平最高,其次为脾脏,且这两个组织中IL- 17RA的水平均在淋巴结的3倍以上[10],表明IL- 17RA的组织分布在不同种属之间可能存在差异。目前关于IL- 17RA在人体内的分布情况研究较少, IL- 17RA能够在原发性胶质母细胞瘤和皮肤成纤维细胞等人源细胞中表达,且在胃癌患者的癌组织中,IL- 17RA的表达水平是正常水平的4.8倍[13],提示IL- 17RA的表达水平与机体病理生理状态有关。
虽然各种动物之间IL- 17RA的分布存在差异,但各种动物中淋巴组织的IL- 17RA表达水平总体上都高于其他组织,这可能是因为淋巴组织是免疫细胞最集中(密度最高)的组织,而大多数类型的免疫细胞都表达IL- 17RA[9]。IL- 17/IL- 17R通路在消化道和呼吸道黏膜抗感染免疫和物理屏障维持中具有重要作用[16]。虽然恒河猴IL- 17RA mRNA在消化道中的平均水平低于淋巴组织,但由于肠道相关淋巴组织的免疫细胞超过其他所有淋巴组织的总和,因此肠道相关淋巴组织中表达的总的IL- 17RA仍然可能是最多的。
在恒河猴肠道黏膜中,大肠IL- 17RA和IL- 17RC mRNA水平均高于小肠。肠道黏膜中Th17细胞及其所分泌的IL- 17A、IL- 17F和IL- 22在抵抗病原菌侵袭中发挥了重要作用。研究表明,小鼠肠道内存在的共生菌群可将未完全分化成熟的Th17细胞吸引到回肠末端,所以正常情况下体内初始Th17细胞主要集中在大肠[17],并在肠道微生物菌群的诱导下进一步分化,这可能与IL- 17R在大肠和小肠中分布差异有一定关系。IL- 17RA在胰脏、肺脏及肝脏等内脏器官也都有较高水平的表达,可能原因是IL- 17参与这些组织有关的疾病发展过程[18,19]。在肌肉中IL- 17R几乎不表达,说明肌肉组织并非IL- 17发挥其生物学作用的主要场所。在生殖器官中,由于动物数量有限及个体差异,导致某些组织样本量单一,在分析过程中可能造成误差。
中国恒河猴和食蟹猴PBMC中IL- 17RA水平均明显高于非洲绿猴。当非洲绿猴感染猴免疫缺陷病毒(Simian immuondeficiency virus,SIV)后,机体在免疫应答过程中产生了抗病毒核心蛋白gag蛋白的抗体,导致系统免疫活化水平较低,病毒被控制在较低水平,感染个体并没有明显的临床症状[20],非洲绿猴在SIV感染后系统免疫活化水平低可能与IL- 17RA在PBMC中的低水平分布有关。三种猴PBMC中均未检测到IL- 17RC,提示在正常生理条件下, PBMC中IL- 17RC可能处在一个极低的水平,当受到IL- 6和IL- 23等炎性因子刺激后,IL- 17RC会在外周血中性粒细胞中迅速表达,与IL- 17RA共同介导炎症反应过程[21]。
本文对恒河猴正常组织中IL- 17R的分布进行了研究,发现IL- 17RA在免疫系统中表达量最高,其次为生殖系统和消化系统;IL- 17RC在大肠中的分布高于小肠;中国恒河猴和食蟹猴PBMC中IL- 17RA水平均明显高于非洲绿猴。本研究为IL- 17相关人类疾病研究中动物模型的选择提供了依据,为疾病过程中IL- 17R在组织中分布的变化及IL- 17相关生物学功能研究提供了基础。
[1] Toy D,Kugler D,Wolfson M,etal.Cutting edge:interleukin 17 signals through a heteromeric receptor complex[J].J Immunol,2006,177(1):36- 39.
[2] Hymowitz SG,Filvaroff EH,Yin JP,etal.IL- 17s adopt a cystine knot fold:structure and activity of a novel cytokine,IL- 17F,and implications for receptor binding[J].Embo J,2001,20(19):5332- 5341.
[3] Gaffen SL.Structure and signalling in the IL- 17 receptor family[J].Nat Rev Immunol,2009,9(11):556- 567.
[4] Cortez DM,Feldman MD,Mummidi S,etal.IL- 17 stimulates MMP- 1 expression in primary human cardiac fibroblasts via p38 MAPK- and ERK1/2- dependent C/EBP- beta,NF- kappaB,and AP- 1 activation[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3356- 3365.
[5] Kao CY,Huang F,Chen Y,etal.Up- regulation of CC chemokine ligand 20 expression in human airway epithelium by IL- 17 through a JAK- independent but MEK/NF- kappaB- dependent signaling pathway [J].J Immunol,2005,175(10):6676- 6685.
[6] Tsai HC,Velichko S,Hung LY,etal.IL- 17A and Th17 cells in lung inflammation:an update on the role of Th17 cell differentiation and IL- 17R signaling in host defense against infection [J].Clin Developmental Immunol,2013,2013(5):267971.
[7] Mcaleer JP,Kolls JK.Directing traffic:IL- 17 and IL- 22 coordinate pulmonary immune defense[J].Immunol Rev,2014,260(1):129- 144.
[8] Yu JJ,Gaffen SL.Interleukin- 17:a novel inflammatory cytokine that bridges innate and adaptive immunity[J].Front Biosci,2008,13(13):170- 177.
[9] Yao Z,Fanslow WC,Seldin MF,etal.Herpesvirus Saimiri encodes a new cytokine,IL- 17,which binds to a novel cytokine receptor [J].Immunity,2011,187(9):4392- 4402.
[10] Ishigame H,Kakuta S,Nagai T,etal.Differential roles of interleukin- 17A and- 17F in host defense against mucoepithelial bacterial infection and allergic responses[J].Immunity,2009,30(1):108- 119.
[11] Crowe CR,Chen K,Pociask DA.Critical role of IL- 17RA in immunopathology of influenza infection[J].J Immunol,2009,183(8):5301- 5310.
[12] Rafa H,Saoula H,Belkhelfa M,etal.IL- 23/IL- 17A axis correlates with the nitric oxide pathway in inflammatory bowel disease:immunomodulatory effect of retinoic acid [J].J Interferon Cytokine Res,2013,33(7):355- 368.
[13] Jiang YX,Li PA,Yang SW,etal.Increased chemokine receptor IL- 17RA expression is associated with poor survival in gastric cancer patients [J].Intern J Clin Exp Pathol,2015,8(6):7002- 7008.
[14] Zhang WJ,Wang Y,Yu K,etal.Associated changes in the transcription levels of IL- 17A and tight junction- associated genes in the duodenal mucosa of rhesus macaques repeatedly exposed to simian/human immunodeficiency virus [J].Exp Mole Pathol,2014,97(2):225- 233.
[15] 邱趁丽,赵 辉,杨贵波.中国恒河猴(Macaca mulatta)外周血Th17细胞及其在SHIV感染后的变化[J].细胞与分子免疫学杂志,2008,24(3):217- 220.
Qiu CL,Zhao H,Yang GB.Th17 lymphocytes in the peripheral bolld of Chinese rhesus macaques (Macaca mulatta) with or without SHIV infection[J].J Cell Mole Immunol,2008,24(3):217- 220.
[16] Lee JS,Tato CM,Joyce- shaikh B,etal.Interleukin- 23- independent IL- 17 production regulates intestinal epithelial permeability [J].Immunity,2015,43(4):727- 738.
[17] Beagley KW,Fujihashi K,Lagoo AS,etal.Differences in intraepithelial lymphocyte T cell subsets isolated from murine small versus large intestine [J].J Immunol,1995,154(11):5611- 5619.
[18] Lombard R,Doz E,Carreras F,etal.IL- 17RA in non- hematopoietic cells controls CXCL- 1 and 5 critical to recruit neutrophils to the lung of mycobacteria- infected mice during the adaptive immune response[J].PLoS One,2016,11(2):e0149455.
[19] Giles DA,Moreno- Fernandez ME,Stankiewicz TE,etal.Regulation of inflammation by IL- 17A and IL- 17F modulates non- alcoholic fatty liver disease pathogenesis [J].PLoS One,2016,11(2):e0149783.
[20] Norley S,Kurth R.The role of the immune response during SIVagm infection of the African green monkey natural host[J].Front Biosci,2004,9(71):550- 564.
[21] Taylor PR,Roy S,Leal SM Jr,etal.Activation of neutrophils by autocrine IL- 17A- IL- 17RC interactions during fungal infection is regulated by IL- 6,IL- 23,RORγt and dectin- 2 [J].Nat Immunol,2014,15(2):143- 151.