下调SLP- 2基因表达抑制脑胶质瘤细胞增殖及诱导凋亡的机制研究
2018-01-24陈小忠谢明祥赵洪新吴海涛
陈小忠 王 培 谢明祥 赵洪新 吴海涛
(遵义医学院附属医院神经外科,遵义 563003)
脑胶质瘤是常见的起源于神经外胚层的中枢神经系统恶性肿瘤,约占颅内肿瘤的45%,具有复发率高、病死率高及治愈率低等特性,手术治疗无法根治且对常规使用的化放疗药物不敏感,预后很差[1]。肿瘤的发生是一个多阶段、多因素的过程,包括抑癌基因、癌基因、DNA损伤修复基因的表观遗传变异及突变。研究胶质瘤发生及发展的生物学特性、分子机制对该病的诊断及治疗具有重要意义。人的 Stomatin like protein 2(SLP- 2)基因定位于9p13.1,是2000年首次发现并命名的一个新基因,SLP- 2蛋白被认为是一种细胞膜相关蛋白[2]。已有研究显示,SLP- 2基因在前列腺癌、胃癌等恶性肿瘤中存在高表达[3,4],将SLP- 2的反义基因导入甲状腺癌、食管鳞癌等肿瘤可促进癌细胞的恶性生长及增殖,并参与癌症的转移[5,6]。有研究显示SLP- 2基因在脑胶质瘤也有高表达,但对脑胶质瘤细胞的生物学特性研究尚未清楚。本研究中通过RNA干扰技术沉默脑胶质瘤细胞中SLP- 2基因表达,观察细胞增殖和凋亡变化,并研究其作用机制。
1 材料与方法
1.1材料 人脑胶质瘤SHG44细胞株购自上海生命科学研究院细胞库;胎牛血清、RPMI1640培养基均购自美国Gibco公司;LipofectamineTM2000转染试剂盒购自大连TaKaRa公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、CCK8试剂盒、膜联蛋白V- FITC(Annexin V- FITC)/碘化丙锭(PI)试剂盒均购自碧云天生物技术研究所;SLP- 2、B细胞淋巴瘤/白血病- 2(B cell lymphoma/leukemia- 2,Bcl- 2)、Bcl- 2相关X蛋白(Bcl- 2 associated X protein,Bax)、Notch1、Hes1、GAPDH抗体均购自美国Abcam公司;酶标仪、流式细胞仪均购自美国Bio- Rad公司;荧光定量PCR仪购自美国Bioneer。
1.2方法
1.2.1细胞培养及转染 人脑胶质瘤U251细胞在37℃,体积分数为5%CO2,95%饱和湿度的培养箱中用含有10%胎牛血清的RPMI1640细胞培养基(100 μg/ml链霉素和100 U/ml青霉素)传代培养。取对数生长期的细胞用于实验研究。细胞分为空白组(细胞未做任何处理)、阴性对照组(细胞转染无义siRNA序列)和SLP- 2敲低组(细胞中转染SLP- 2的靶向siRNA序列)。转染前1天以1×106个/孔浓度接种于6孔细胞培养板中,每孔加入2 ml,细胞生长达到80%融合度以上时进行转染,转染参照LipofectamineTM2000转染说明进行操作。
1.2.2蛋白质印迹(Western blot) 取上述转染48 h 的细胞,加入适量的细胞裂解液提取细胞中的蛋白,BCA试剂盒检测提取的蛋白浓度,蛋白样品与上样缓冲液按照1∶5比例充分混匀,100℃变性5 min,每泳道30 μg蛋白样品,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS- PAGE)分离,电泳后转移至硝酸纤维素膜上,5%的脱脂奶粉溶液封闭过夜,加入一抗(SLP- 2、Bcl- 2、Bax、Notch1、Hes1抗体均按照1∶500稀释,GAPDH按照1∶1 000稀释),4℃过夜,洗膜后加入1∶1 000稀释的辣根过氧化物酶标记的羊抗鼠IgG作为二抗,37℃孵育2 h,增强型化学法(ECL)发光显色,X线片曝光,显影,定影。
1.2.3细胞增殖检测 U251细胞以每孔2×104个细胞(100 μl)接种于96孔细胞培养板上,置于37℃,体积分数5%CO2的培养箱中培养24 h进行同步化处理,按照上述分组进行转染,收集转染48 h的各组细胞,每孔细胞中加入CCK8溶液10 μl,培养板置于培养箱内孵育2 h,以不加细胞只加培养液的空白对照孔调零,酶标仪检测570 nm吸光度(A),记录结果,实验重复3次。计算细胞增殖率。细胞增殖率=(转染组细胞A/对照组细胞A)×100%。
1.2.4细胞凋亡检测 采用Annexin V- FITC/PI双染法检测细胞凋亡。取转染后培养48 h的上述三组细胞,胰蛋白酶消化细胞,预冷的磷酸缓冲液洗涤细胞2次,细胞浓度调整为1×106个/ml,Binding Buffer悬浮细胞,按照细胞凋亡试剂盒的操作说明检测各组细胞的凋亡情况。
1.2.5IL- 6、TNF- α的mRNA表达检测 RNA提取试剂盒提取转染48 h的三组细胞中的总RNA,逆转录成cDNA,以GAPDH作为内参基因,cDNA为模板,按照试剂盒的操作说明扩增IL- 6、TNF- α基因。IL- 6、TNF- α的引物序列如下:IL- 6 F:5′- AGTTGTGCAATGGCAATTCTG- 3′,R:5′- AGGACTCTGGCTTTGTCTTTC- 3′。TNF- α F:5′- ACTGGCGTGTTCATCC- GTTCT- 3′,R:5′- CGCAATCCAGGCCACTACTTC- 3′。GAPDH F:5′- ATGACCCCTTCATTGACC- 3′,R:5′- GAAGATGGTGATGGGATTTC- 3′。所有引物由上海生工合成。实验数据(Ct值)采用2-ΔΔCt法进行统计。

2 结果
2.1下调 SLP- 2表达的效果 空白组、阴性对照组、SLP- 2敲低组SLP- 2的蛋白表达分别为(0.622±0.047)、(0.628±0.046)、(0.087±0.011),阴性对照组SLP- 2的蛋白表达与空白组差异无统计学意义(t=0.158,P=0.882),而SLP- 2敲低组SLP- 2的蛋白表达显著低于空白组(t=19.197,P=0.000)。见图1。
2.2下调 SLP- 2表达抑制细胞增殖 空白组、阴性对照组、SLP- 2敲低组细胞存活率分别为(100.00±2.23)%、(95.86±2.12)%、(70.54±3.98)%,阴性对照组细胞存活率与空白组差异无统计学意义(t=2.331,P=0.080),SLP- 2敲低组细胞存活率显著低于空白组(t=11.185,P=0.000)。见图2。
2.3下调 SLP- 2表达促进细胞凋亡 空白组、阴性对照组、SLP- 2敲低组细胞凋亡率分别为(1.72±0.48)%、 (1.74±0.50)%、 (17.13±1.32)%,阴性对照组细胞凋亡率与空白组差异无统计学意义(t=0.050,P=0.963),SLP- 2敲低组细胞凋亡率显著高于空白组(t=19.003,P=0.000)。见图3。

图1 下调 SLP- 2表达的效果Fig.1 Effect of SLP- 2 down expressionNote: A.Western blot was used to detect the expression of SLP- 2 protein after transfection;B.The relative expression of SLP- 2 protein in each group cells;compared with the blank group,*.P<0.05.
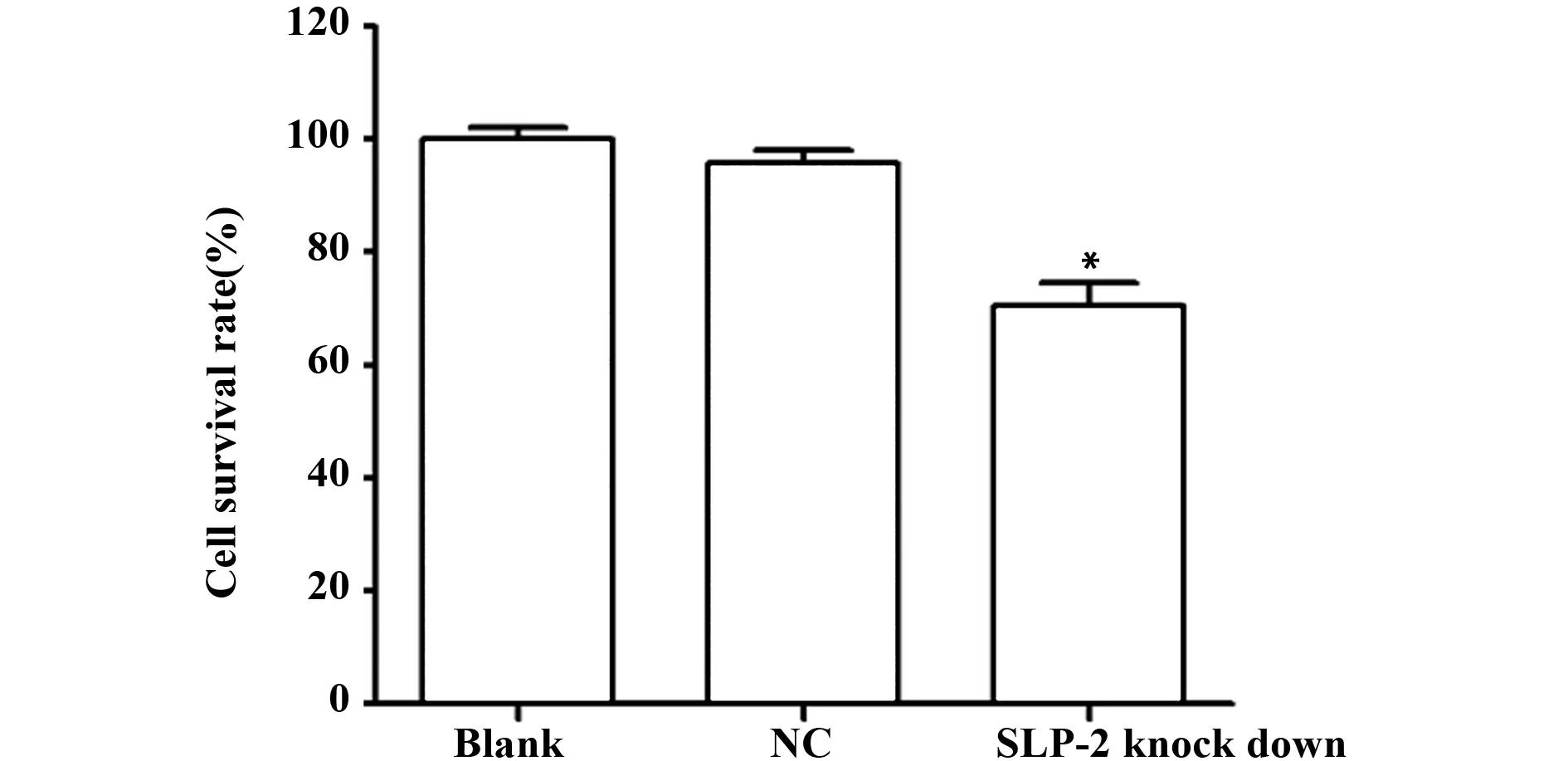
图2 下调 SLP- 2表达对细胞增殖的影响Fig.2 Effect of SLP- 2 down expression on cell proliferationNote: Compared with the blank group,*.P<0.05.
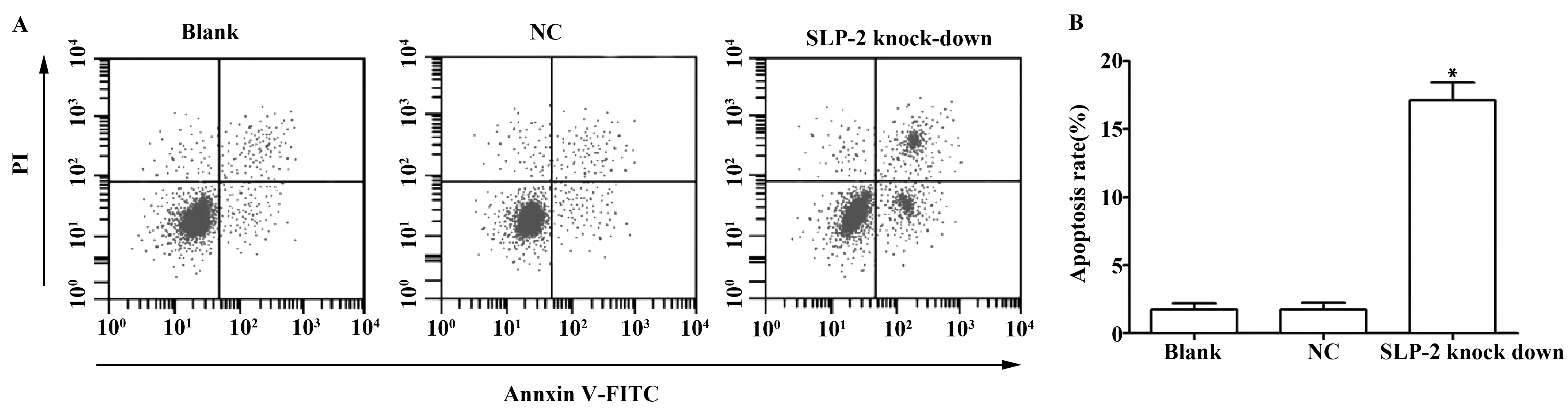
图3 下调 SLP- 2表达对细胞凋亡的影响Fig.3 Effect of SLP- 2 down expression on cell apoptosisNote: A.The apoptosis of each group cell was detected by flow cytometry;B.The apoptosis rate in each group;compared with the blank group,*.P<0.05.
2.4下调 SLP- 2表达对IL- 6、TNF- α表达的影响 RT- PCR检测IL- 6、TNF- α的mRNA表达,结果显示,阴性对照组IL- 6、TNF- α的mRNA表达与空白组差异无统计学意义(IL- 6t=0.312,P=0.770;TNF- αt=0.076,P=0.943),SLP- 2敲低组IL- 6、TNF- α的mRNA表达均显著低于空白组(IL- 6t=10.808,P=0.000;TNF- αt=10.072,P=0.001)。见表1。
2.5下调 SLP- 2表达对Bcl- 2、Bax、Notch1、Hes1蛋白表达的影响 Western blot检测凋亡相关蛋白Bcl- 2、Bax及Notch1和靶基因Hes1的蛋白表达,结果显示,空白组、阴性对照组、SLP- 2敲低组Bax的蛋白表达分别为(0.072±0.009)、(0.063±0.009)、(0.282±0.031),Bcl- 2蛋白表达分别为(0.315±0.032)、(0.309±0.031)、(0.192±0.027),Notch1的蛋白表达分别为(0.711±0.048)、(0.704±0.051)、(0.112±0.014),Hes1的蛋白表达分别为(0.342±0.028)、(0.350±0.026)、(0.047±0.007),阴性对照组Bax、Bcl- 2、Notch1、Hes1蛋白表达与空白组差异无统计学意义(Baxt=0.817,P=0.460;Bcl- 2t=0.233,P=0.827;Notch1t=0.173,P=0.871;Hes1t=0.363,P=0.735),SLP- 2敲低组Bcl- 2、Notch1、Hes1蛋白表达显著低于空白组,Bax蛋白表达显著高于空白组(Bcl- 2t=5.088,P=0.007;Notch1t=20.75,P=0.000;Hes1t=17.704,P=0.000;Baxt=17.331,P=0.000)。见图4。
表1下调SLP-2表达对IL-6、TNF-α表达的影响
Tab.1EffectofSLP-2downexpressiononIL-6andTNF-αexpression

GroupsmRNArelativeexpressionIL-6TNF-αBlankgroup1.000±0.1221.000±0.105NCgroup0.972±0.0961.006±0.089SLP-2knockdowngroup0.213±0.0321)0.365±0.0301)
Note:Compared with the blank group,1)P<0.05.
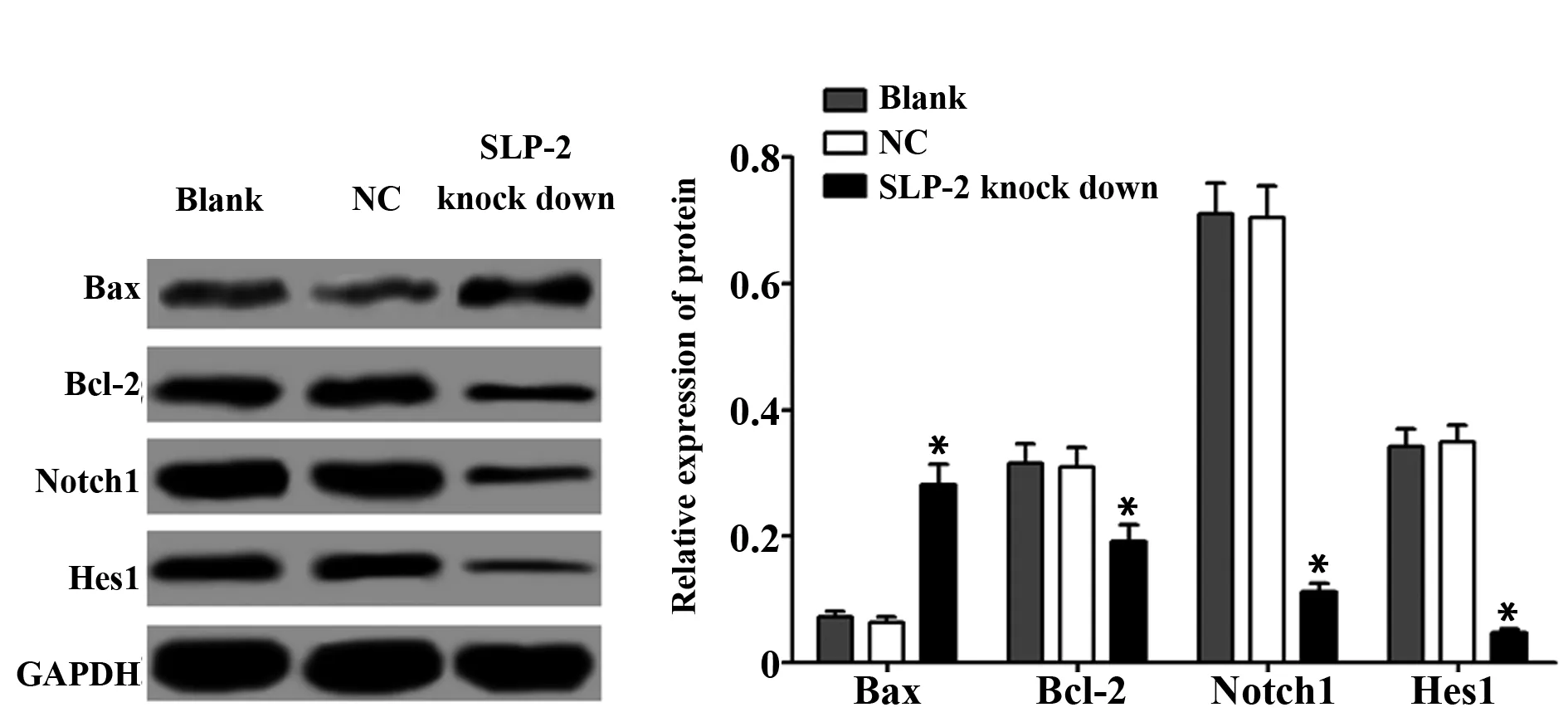
图4 下调 SLP- 2表达对Bcl- 2、Bax、Notch1、Hes1蛋白表达的影响Fig.4 Effect of SLP- 2 down expression on Bcl- 2,Bax,Notch1,Hes1 protein expressionNote: A.Western blot test result diagram;B.The relative expression of protein;compared with the blank group,*.P<0.05.
3 讨论
脑胶质瘤具有易复发及侵袭性的特性,由于其生长部位的特殊性,手术及放化疗药物均很难达到预期效果,而使脑胶质瘤成为神经系统难以治疗的疾病之一[7]。随着分子生物学的不断发展,多种肿瘤的生物标记物在肿瘤防治中被应用。SLP- 2基因属于Stomatin基因超家族成员,在人类的多种组织中都有表达,近些年来,通过蛋白组学和基因组学发现SLP- 2在多种肿瘤中表达上调,影响癌细胞的增殖、凋亡、迁移等生物学过程,被认为是一种新的肿瘤相关基因[8,9]。但关于SLP- 2对恶性肿瘤关系的报道较少。有研究显示,RNA干扰抑制胃癌细胞中SLP- 2基因的表达可降低癌细胞的增殖及阻滞细胞于G1期[10]。
RNA干扰(RNA interference,RNAi)是由双链RNA诱导的能使特异mRNA序列降解的现象,具有高效性、特异性等特点,是近些年来发现和发展起来的基因阻断技术,该技术可有效地沉默肿瘤相关基因表达、促进癌细胞凋亡、抗血管生成等,且与传统的放化疗结合,更具抗癌潜力[11,12]。本研究结果显示,RNA干扰抑制脑胶质瘤细胞中SLP- 2表达后细胞增殖显著降低,凋亡增加,炎症细胞因子IL- 6和TNF- α表达下调。Bcl- 2蛋白显著下调表达,Bax蛋白显著上调表达。细胞的凋亡是由多个因子和因素控制的,Bcl- 2家族在细胞凋亡过程中发挥重要作用。Bcl- 2是Bcl- 2家族的抑凋亡基因,Bax是Bcl- 2家族的促凋亡基因,两者之间可形成同源二聚体和异源二聚体[13,14]。有研究指出,细胞的凋亡取决于Bax和Bcl- 2的比率,Bcl- 2的表达下降,而同时Bax的表达上升,发挥促细胞凋亡的作用,反之则抑制细胞的凋亡[15]。
Notch信号通路由Notch受体和配体、下游效应物、DNA结合蛋白组成,在进化上非常保守,可从多个方面对细胞的增殖、凋亡、机体发育等进行调控,影响细胞命运[16]。Notch1是Notch的一个受体,大量研究显示,在多种肿瘤中Notch1信号通路处于异常激活状态,如肺癌、脑胶质瘤等,其异常表达可通过直接或间接的作用诱导肿瘤的发生[17,18]。有研究指出,抑制脑胶质瘤细胞中Notch1信号通路可降低癌细胞的增殖及诱导细胞的凋亡[19]。Hes1是Notch1信号通路下游重要的效应分子,是其是否激活的标志。本研究检测Notch1、Hes1的蛋白表达,结果显示,抑制SLP- 2基因的表达后脑胶质瘤细胞中Notch1、Hes1蛋白显著下调表达。这说明抑制SLP- 2基因的表达可通过下调Notch1信号通路降低脑胶质瘤的发生发展。
综上所述,抑制脑胶质瘤细胞中SLP- 2基因的表达后可通过下调Notch1信号通路降低癌细胞的增殖及诱导凋亡,降低炎症细胞因子IL- 6和TNF- α表达。本研究初步证实了SLP- 2基因在脑胶质瘤发生及发展中的作用,为寻找脑胶质瘤的基因治疗靶点提供了一定的理论基础。
[1] Li XY,Zhao Y,Sun MG,etal.Multifunctional liposomes loaded with paclitaxel and artemether for treatment of invasive brain glioma[J].Biomaterials,2014,35(21):5591- 5604.
[2] Wang Y,Morrow JS.Identification and characterization of human SLP- 2,a novel homologue of stomatin (band 7.2 b)present in erythrocytes and other tissues[J].J Biol Chem,2000,275(11):8062- 8071.
[3] Bartolome A,Boskovic S,Paunovic I,etal.Stomatin- like protein 2 overexpression in papillary thyroid carcinoma is significantly associated with high- risk clinicopathological parameters and BRAFV600E mutation[J].Apmis,2016,124(4):271- 277.
[4] Liu D,Zhang L,Shen Z,etal.Increased levels of SLP- 2 correlate with poor prognosis in gastric cancer[J].Gastric Cancer,2013,16(4):498- 504.
[5] Liu Z,Yang Y,Zhang Y,etal.Stomatin- like protein 2 is associated with the clinicopathological features of human papillary thyroid cancer and is regulated by TGF- β in thyroid cancer cells[J].Oncol Reports,2014,31(1):153- 160.
[6] Yang X,Zang W,Xuan X,etal.miRNA- 1207- 5p is associated with cancer progression by targeting stomatin- like protein 2 in esophageal carcinoma[J].Intern J Oncol,2015,46(5):2163- 2171.
[7] Cui Y,Xu Q,Chow PKH,etal.Transferrin- conjugated magnetic silica PLGA nanoparticles loaded with doxorubicin and paclitaxel for brain glioma treatment[J].Biomaterials,2013,34(33):8511- 8520.
[8] Cao W,Zhang B,Ding F,etal.Expression of SLP- 2 was associated with invasion of esophageal squamous cell carcinoma[J].PLoS One,2013,8(5):e63890.
[9] Morozov YM,Dominguez MH,Varela L,etal.Antibodies to cannabinoid type 1 receptor co- react with stomatin- like protein 2 in mouse brain mitochondria[J].Eur J Neuroscience,2013,38(3):2341- 2348.
[10] Cheng N,Hui D,Liu Y,etal.Is gastric lymphoepithelioma- like carcinoma a special subtype of EBV- associated gastric carcinoma? New insight based on clinicopathological features and EBV genome polymorphisms[J].Gastric Cancer,2015,18(2):246- 255.
[11] 李培栋,王新军,单 峤,等. RNA 干扰 Fascin1 表达抑制胶质瘤细胞 U87MG 的侵袭,转移能力[J].中国免疫学杂志,2015,31(6):764- 768.
Li PD,Wang XJ,Shan Q,etal.Reversal effect of RNA interference targeting Fascin1 on migration and invasion of glioma cell line U87 MG[J].Chin J Immunol,2015,31(6):764- 768.
[12] Herrera- Abreu MT,Pearson A,Campbell J,etal.Parallel RNA interference screens identify EGFR activation as an escape mechanism in FGFR3- mutant cancer[J].Cancer Discovery,2013,3(9):1058- 1071.
[13] 李素婷,王 琳,许 倩,等. 山楂叶总黄酮对急性酒精性肝损伤小鼠肝细胞凋亡及 Bcl- 2,Bax 蛋白表达的影响[J].中国老年学杂志,2016,36(14):3375- 3377.
Li S T,Wang L,Xu Q,etal.Effects of total flavonoids of hawthorn leaves on hepatocyte apoptosis and expression of Bcl- 2 and Bax protein in mice with acute alcoholic liver injury[J].Chin J Gerontol,2016,36(14):3375- 3377.
[14] Sharifi S,Barar J,Hejazi MS,etal.Roles of the Bcl- 2/Bax ratio,caspase- 8 and 9 in resistance of breast cancer cells to paclitaxel[J].Asian Pac J Cancer Prev,2014,15(20):8617- 8622.
[15] 刘 芳,赵世敏,张 威,等. 沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对 BCL- 2/Bax 和 PPAR- γ 的调控[J].中国免疫学杂志,2016,32(3):358- 361.
Liu F,Zhao SM,Zhang W,etal.Inhibitory effects of seabuckthorn polysaccharide on oxidative stress in mice with actue liver injury and modulatory effect on BCL- 2/Bax and PPAR- γexpression[J].Chin J Immunol,2016,32(3):358- 361.
[16] Capaccione KM,Pine SR.The Notch signaling pathway as a mediator of tumor survival[J].Carcinogenesis,2013,34(7):1420- 1430.
[17] Baumgart A,Mazur PK,Anton M,etal.Opposing role of Notch1 and Notch2 in a KrasG12D- driven murine non- small cell lung cancer model[J].Oncogene,2015,34(5):578- 588.
[18] Guichet PO,Guelfi S,Teigell M,etal.Notch1 stimulation induces a vascularization switch with pericyte- like cell differentiation of glioblastoma stem Cells[J].Stem Cells,2015,33(1):21- 34.
[19] Lu X,Tong L,Ji X,etal.Inhibition of HIF- 1 decreased notch 1 expression and increased radiosensitivity of glioma cells with CD133 enrichment by hypoxia[J].Gene and Gene Editing,2015,1(1):47- 52.