BANCR对肝癌细胞HepG2增殖、侵袭和血管新生的促进作用①
2018-01-24张婧婧王向鹏杨晓煜姬颖华狄文玉张清琴于海川
张婧婧 王向鹏 杨晓煜 姬颖华 狄文玉 张清琴 申 威 于海川 路 平
(新乡医学院医学检验学院和河南省分子诊断与医学检验技术协同创新中心,新乡 453003)
肝癌严重威胁着人类的健康,2012年全球范围内就有74.5万人死于肝癌,就发病率而言在恶性肿瘤中排名第六,且呈现上升趋势[1,2]。长链非编码RNA(long non- coding RNA,lncRNA)是一类不具蛋白质编码功能的RNA,长度大于200 nt。越来越多的报道显示大量异常表达的lncRNAs在癌症中起着重要作用。Li等[3]发现胃癌肿瘤组织中存在多种异常表达的lncRNAs,其中有135种lncRNAs的表达量是正常组织的2倍以上。在肝癌中,微阵列分析也发现了许多异常表达的lncRNAs[4]。且这些lncRNAs与肿瘤发生、迁移、预后及诊断等存在着密切联系[5,6]。BRAF 基因激活的非编码 RNA(BRAF- activated non- coding RNA,BANCR)作为lncRNAs的一种,在恶性黑色素瘤、肺癌、胃癌等多种癌症中都是异常表达,且与这些癌症的细胞增殖、迁移和侵袭相关[7]。有研究表明在109例肝细胞癌组织中,BANCR表达上调[8]。但运用siRNA干扰BANCR对人肝癌细胞HepG2生物学功能的影响还鲜有报道。本文将对人肝癌细胞HepG2中siRNA干扰BANCR后在细胞增殖、迁移和血管新生方面的影响进行探讨,为寻找新的肝癌治疗方法奠定基础。
1 材料与方法
1.1细胞株和主要试剂 人肝癌细胞HepG2购自四川大学华西医院再生医学研究中心卫生部移植工程和移植免疫重点实验室,由实验室保种。人脐静脉内皮细胞HUVEC购自美国典型培养物保藏中心 (American Type Culture Collection,ATCC)。培养基DMEM和胎牛血清购于美国Invitrogen英骏公司。Cell Counting Kit- 8 (CCK- 8)购自日本同仁化学公司。细胞凋亡检测试剂盒Annexin V Apoptosis Detection Kit和Transwell小室及人工基底膜均购自美国BD公司。
1.2方法
1.2.1细胞培养 细胞培养基为添加了10%胎牛血清和1%青- 链霉素的DMEM培养基,并置于37℃,5%CO2的恒温培养箱中培养。当细胞增殖到约80%时,PBS洗一次,胰酶消化2 min,加入细胞培养液终止消化,23℃ 1 500 r/min离心5 min,收集细胞,立即重悬细胞,1∶5 传代继续培养。
1.2.2CCK- 8检测细胞增殖 BANCR siRNA和Scramble分别转染HepG2细胞,转染0、1、2、3、4 d后,用CCK- 8试剂盒对转染BANCR siRNA、Scramble和未转染的三组细胞的增殖进行检测。CCK- 8溶液预先用正常的培养基稀释到10%,细胞重悬于上述稀释液中,于37℃培养1~4 h,450 nm处检测吸光值,计算细胞增殖倍数。
1.2.3流式细胞术分析细胞凋亡 转染48~72 h后,收集三组细胞,并重悬于1×Binding buffer中,使细胞量达到1×106ml-1。然后利用Annexin V- fluorescein isothiocyanate (FITC),碘化丙啶(Propidium iodide,PI)染色15 min,利用流式细胞仪对染色的细胞进行检测,统计细胞凋亡率。
1.2.4Transwell检测细胞侵袭能力 首先细胞悬浮于含1%胎牛血清的DMEM培养基中至细胞密度为1 × 106ml-1,然后将细胞悬液加入铺有人工基底膜的Transwell的上室中,在下室中加入含20%胎牛血清的DMEM培养基。37℃培养24 h后,用0.5%的结晶紫对上室底部细胞进行染色,并用棉签将上室内侧的细胞除去。显微镜下观察细胞形态并统计细胞数量。
1.2.5管腔形成实验 收集各组细胞不换液培养的连续培养3 d的培养基,离心取上清。将上清与培养基等比例混合加入到铺有Matrigel基质胶的孔板中。然后取5 × 105ml-1的HUVEC细胞加入上述孔板中,共培养72 h后倒置显微镜下观察。
1.2.6免疫印迹分析蛋白质的表达 收集细胞,PBS洗3次,然后加入已添加PMSF、DTT和蛋白酶抑制剂的细胞裂解液进行裂解,后提取总蛋白。等量的蛋白进行SDS- PAGE凝胶电泳分离,然后转至PVDF膜。用5%的BSA进行封闭后,依次孵育一抗和二抗,最后进行显色。
1.3统计学分析 利用SPSS16.0对实验数据进行统计学分析。两两比较采用独立的t检验。P<0.05为差异具有统计学意义。
2 结果
2.1CCK- 8检测HepG2的细胞增殖 利用qRT- PCR检测人肝癌细胞HepG2和正常肝细胞L02中BANCR的表达,如图1A所示,BANCR在HepG2中的表达明显高于L02(P<0.05)。运用BANCR siRNA对人肝癌细胞HepG2的BANCR进行干扰,转染Scramble作为干扰对照组,未转染细胞HepG2作为阴性对照组,检测了HepG2中BANCR的表达情况。图1B结果显示转入BANCR siRNA后BANCR的相对表达量明显低于对照组(P<0.05)。可见,BANCR确实被沉默了。另外检测BANCR siRNA转染不同天数下,细胞的增殖倍数。图1C的结果表明,转染BANCR siRNA 3 d以后,HepG2的细胞增殖倍数明显低于对照组(P<0.05)。由此可见,BANCR在HepG2中高表达,用BANCR siRNA干扰BANCR后,HepG2的细胞增殖能力明显受到抑制。
2.2流式细胞术分析HepG2的细胞凋亡 用Annexin V- FITC和PI对3组细胞进行双染后,从图2A的散点图可以看出,与对照组相比,BANCR siRNA干扰BANCR后,HepG2的细胞凋亡显著升高了。进一步对细胞凋亡率进行统计分析,图2B结果显示,BANCR siRNA组的细胞凋亡率明显增加了,约大于对照组的2倍(P<0.05)。从这些结果可以看出,BANCR siRNA干扰HepG2的BANCR后促进了细胞凋亡。
2.3HepG2细胞侵袭能力检测 运用铺有人工基底膜Matrigel的Transwell小室对3组细胞的侵袭能力进行分析。结晶紫染色后显微镜观察,与对照组相比,BANCR siRNA组穿过Transwell上室的细胞明显少于对照组(图3A)。为了进行定量分析,随机选取5个视野,统计每个视野下的细胞数量。从图3B的统计结果不难看出,BANCR siRNA组平均每个视野的细胞数量明显低于对照组,约为对照组的三分之一(P<0.05)。可见,利用siRNA对HepG2细胞的BANCR进行干扰后,HepG2细胞的侵袭能力受到了严重影响。
2.4免疫印迹检测细胞增殖、凋亡和侵袭标记蛋白的表达 为了进一步验证BANCR siRNA对肝癌细胞HepG2细胞增殖、凋亡和侵袭方面的影响,利用免疫印迹技术对细胞增殖标记蛋白PCNA、凋亡标记蛋白Caspase- 3和侵袭标记蛋白MMP- 9、Fn、Vimentin进行了表达分析,GAPDH作为内参。由图4A的免疫印迹结果图可以看出,BANCR siRNA组细胞增殖标记蛋白PCNA和侵袭标记蛋白MMP- 9的表达都明显低于对照组;而BANCR siRNA组细胞凋亡标记蛋白Caspase- 3的表达明显高于对照组。进一步对免疫印迹的结果进行统计分析,结果显示,与对照组相比,细胞增殖标记蛋白PCNA在BANCR siRNA组的相对表达量显著降低,约为对照组的六分之一;细胞凋亡标记蛋白Caspase- 3在BANCR siRNA组的相对表达量明显高于对照组,约为对照组的六倍;侵袭标记蛋白MMP- 9、Fn和Vimentin在BANCR siRNA组的相对表达量则低于对照组(P<0.05,图4B~F)。综上所述,BANCR siRNA对人肝癌细胞HepG2的增殖和侵袭具有抑制作用,并促进细胞凋亡。
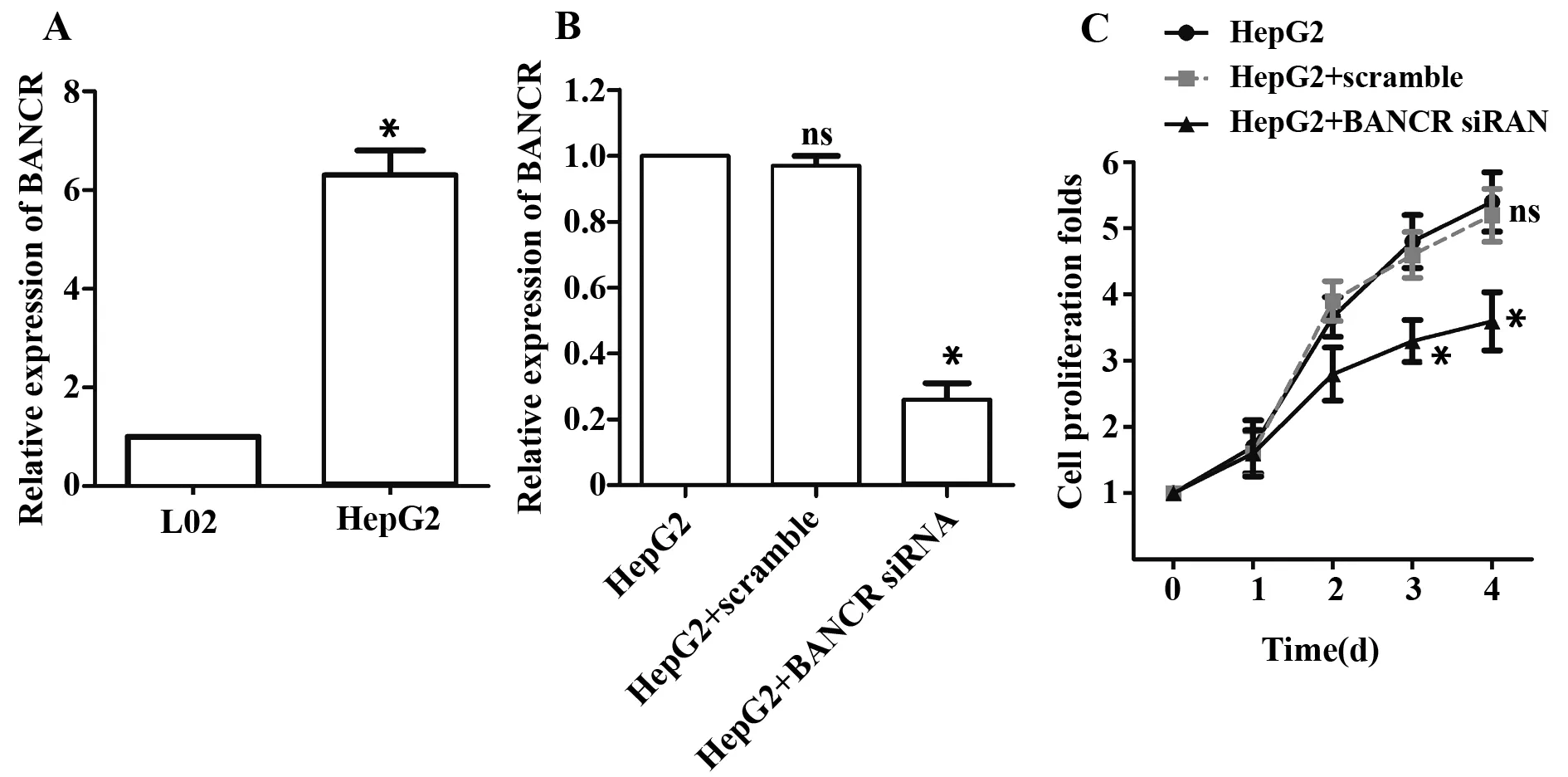
图1 qRT- PCR检测BANCR表达(A、B)和CCK- 8检测HepG2细胞增殖(C)Fig.1 Expression of BANCR was detected by qRT- PCR (A,B) and cell proliferation of HepG2 was tested by CCK- 8 (C)Note: A.The expression of BANCR in hepatocarcinoma cell line HepG2,*.P<0.05 versus normal hepatocyte L02;B.The expression of BANCR in hepatocarcinoma cell line HepG2 transfected with BANCR siRNA;C.Cell proliferation of HepG2 transfected with BANCR siRNA,*.P<0.05 versus HepG2 group.

图2 流式细胞分析HepG2细胞凋亡Fig.2 Cell apoptosis of HepG2 was measured by flow cytometryNote: A.Scatter diagram of flow cytometry;B.Histogram represents the statistical analysis of flow cytometry.*.P<0.05 versus HepG2 group.
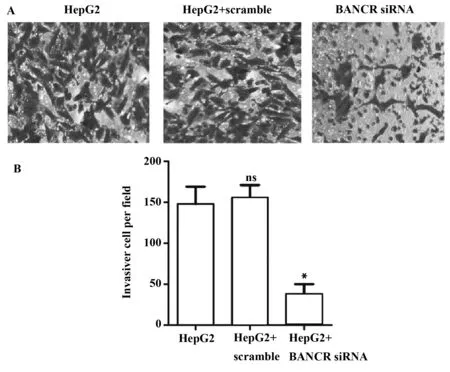
图3 Transwell分析HepG2细胞侵袭(结晶紫染色,×100)Fig.3 Invasion of HepG2 was detected by transwell(invasion crystal violet staining,×100)Note: A.Invasion of HepG2 was detected by transwell invasion;B.Histogram represents the statistical analysis of transwell invasion.*.P<0.05 versus HepG2 group.

图4 免疫印迹检测细胞增殖、凋亡和侵袭标记蛋白的表达Fig.4 Expression of cell proliferation,apoptosis and invasion marker proteins was tested by Western blot Note: A.Expression of PCNA,Caspase- 3,MMP- 9,Fn,Vimentin was measured by Western blot;B-F.Histogram represents the statistical analysis of Western blot.*.P<0.05 versus HepG2 group.
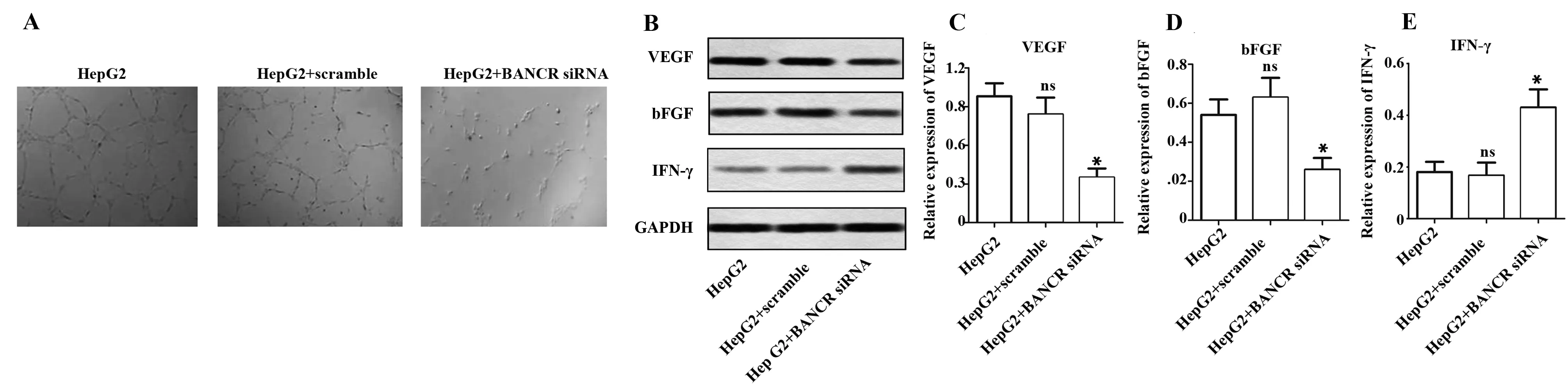
图5 管腔形成实验及免疫印迹检测血管新生因子的蛋白表达Fig.5 Tube formation assay and expression of angiogenic factors was measured by Western blotNote: A.Tube formation assay.B.Expression of VEGF,bFGF and IFN- γ was detected by by Western blot;C-E.Histogram represents the statistical analysis of Western blot.*.P<0.05 versus HepG2 group.
2.5管腔形成分析及促血管新生因子血管内皮细胞生长因子(VEGF)、酸性成纤维细胞生长因子(bFGF)以及血管新生抑制因子γ干扰素(IFN- γ)的蛋白表达分析 利用管腔形成实验分析BANCR对血管新生的影响。图5A显示,转染BANCR siRNA后,血管新生能力明显减弱。免疫印迹对促血管新生相关因子VEGF、bFGF和IFN- γ的蛋白表达进行分析,GAPDH作为内参。免疫印迹结果图显示,促血管新生因子VEGF和 bFGF在BANCR siRNA组中 的蛋白表达都明显低于对照组,血管新生抑制因子IFN- γ在BANCR siRNA组中 的蛋白表达明显高于对照组(图5B)。从图5C~E的统计结果不难看出,BANCR siRNA组VEGF的相对表达量约为对照组的三分之一;bFGF的相对表达量约为对照组的一半;IFN- γ的相对表达量约为对照组的两倍(P<0.05)。由此可见,siRNA干扰BANCR后会抑制人肝癌细胞HepG2的促血管新生因子VEGF、bFGF表达,促进血管新生抑制因子IFN- γ的蛋白表达而影响血管新生。
3 讨论
中国的肝癌病例约占全世界的50%,目前较为普遍的治疗方法包括外科切除、肝脏移植、射频消融治疗等[1,2]。但是当肝癌发展到晚期后仅有15%的癌症患者适合外科手术,且只有33%~50%的患者可以存活5年[9]。因此,寻找有效的肝癌治疗手段就显得十分紧迫。
LncRNAs具有多种生物学功能,在信使RNA前体剪切、基因表达调控以及染色质修饰等方面都起着重要的作用[10- 12]。越来越多的研究表明,LncRNAs与癌症存在紧密联系,多种癌症中都出现了大量的LncRNAs异常表达情况。在结肠直肠癌中,有762种LncRNAs的表达与正常组织存在显著差异,其中390种上调表达、372种下调表达[13]。LncRNA MEG3和GHET1的沉默会影响结肠直肠癌细胞的增殖[14,15]。全基因组分析发现肝癌中存在2 736种表达异常的LncRNAs,其中1 757种Lnc RNAs的表达高于正常组织的2倍以上,979种Lnc RNAs表达下调,这揭示了lncRNAs在肝癌中起着重要作用[16]。有研究表明LncRNA TUG1在肝细胞癌组织中高表达,沉默TUG1会抑制细胞增殖和促进细胞凋亡[17]。Xu等[18]发现LncRNA URCH在肝细胞癌组织和肝细胞癌细胞系中都是高表达的,体外实验证实了抑制URCH的表达会降低细胞增殖能力并促进细胞凋亡。
BANCR作为一种长链非编码RNA,其在各种癌症中的功能也受到了广泛关注。BANCR在结肠直肠癌中的表达明显低于正常组织,且过表达BANCR会抑制细胞增殖[19]。有研究还显示,BANCR在膀胱癌和肺癌中均低表达,过表达BANCR会抑制膀胱癌细胞增殖促进细胞凋亡;沉默BANCR会促进肺癌细胞增殖[20,21]。此外,已报道BANCR在肝癌组织和细胞系中过表达,下调BANCR的表达可抑制肝癌细胞系Hep3B细胞增殖,促进细胞凋亡[22]。从前人的研究中可以看出,BANCR在不同癌症中的表达及功能存在一定的差异。一方面这可能是由于不同癌症的微环境造成的[22]。另一方面BANCR在各种癌症中的不同调控机制也会造成BANCR功能的差异。在肺癌中BANCR通过P38和JNK通路实现细胞增殖调控与ERK、Raf- 1无关[21]。但在黑色素瘤中则通过ERK、Raf- 1和JNK通路来实施细胞增殖调控而与P38 通路无关[22]。本研究发现在肝癌细胞HepG2中,siRNA干扰BANCR后,细胞增殖率降低,凋亡率增加,进一步研究检测到增殖标记蛋白表达水平降低,凋亡标记蛋白表达水平升高。这些结果表明BANCR siRNA可以抑制细胞增殖并促进细胞凋亡。
LncRNAs在癌症侵袭方面也发挥着重要作用。LncRNA ANCR表达的下调会抑制结肠直肠癌细胞的侵袭[23]。有数据显示,lncRNA CCAT1可以促进结肠癌细胞侵袭[24]。CCAT1在肝细胞癌中也起着类似的功能,沉默CCAT1后会导致肝癌细胞HepG2和MHCC- 97H侵袭能力的降低[25]。BANCR在结肠直肠癌、膀胱癌和肺癌中都是低表达的,在1型子宫内膜癌却是高表达,而且BANCR表达的下调会导致细胞侵袭受阻[26]。与本研究结果一致,BANCR siNRA可减少肝癌细胞HepG2侵袭细胞数目,降低侵袭标记蛋白的表达水平。本研究结果表明,BANCRsiNRA可抑制肝癌细胞的运动能力。
血管新生在肿瘤的生长过程中起着十分重要的作用,越来越多的癌症治疗策略关注在血管新生相关因子方面[27- 29]。许多LncRNAs都可以调节癌症的血管新生。Huang等[30]发现lncRNA MALAT1可以促进甲状腺癌的血管新生。有研究表明,LncRNA CRNDE的沉默会抑制肝母细胞瘤的血管新生[31]。有数据显示,沉默恶性胶质瘤细胞U87MG和U251MG中lncRNA TUG1的表达,会大大降低促血管新生因子VEGFA的表达[32]。许多文献报道了IFN- γ具有抗肿瘤的作用。有数据显示IFN- γ可以抑制胃癌细胞增殖来起到抗肿瘤的作用[33]。在胆囊癌中,IFN- γ具有抑制血管新生的功能[34]。本研究发现BANCR siNRA干扰HepG2后,会抑制血管新生能力,抑制促血管新生因子VEGF、bFGF表达,促进IFN- γ的表达,提示BANCRsiNRA可抑制肝癌细胞的血管新生。
综上所述,本研究发现BANCR在肝癌细胞HepG2中高表达,BANCR siRNA转染肝癌细胞HepG2后,细胞增殖倍数降低,细胞凋亡率增加,细胞侵袭能力和血管新生能力降低。BANCR siRNA显著抑制肝癌HepG2细胞增殖标记蛋白PCNA、侵袭标记蛋白MMP- 9、Fn和Vimentin和促血管新生因子VEFG、bFGF表达,促进血管抑制因子INF- γ的表达并促进了细胞凋亡标记蛋白Caspase- 3的表达。本文通过siRNA干扰肝癌细胞系HepG2中BANCR的表达促进细胞凋亡,抑制细胞生存能力和运动能力及血管新生,下一步研究计划将建立HepG2肿瘤小鼠模型,在体内研究BANCR对肝癌增殖、迁移和血管新生的影响,并寻找BANCR的作用靶点建立相应的信号通路为寻找有效的生物靶向药物提供新的方向。
[1] Ferlay J,Soerjomataram I,Dikshit R,etal.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359- 86.
[2] Zhu ZX,Huang JW,Liao MH,etal.Treatment strategy for hepatocellular carcinoma in China:radiofrequency ablation versus liver resection[J].Jpn J Clin Oncol,2016,46(12):1075- 1080.
[3] Li PF,Chen SC,Xia T,etal.Non- coding RNAs and gastric cancer[J].World J Gastroenterol,2014,20(18):5411- 5419.
[4] Zhu J,Liu S,Ye F,etal.The long noncoding RNA expression profile of hepatocellular carcinoma identified by microarray analysis[J].PLoS One,2014,9(7):e101707.
[5] He Y,Meng XM,Huang C,etal.Long noncoding RNAs:Novel insights into hepatocelluarcarcinoma[J].Cancer Lett,2014,344(1):20- 27.
[6] Li G,Zhang H,Wan X,etal.Long noncoding RNA plays a key role in metastasis and prognosis of hepatocellular carcinoma[J].Biomed Res Int,2014,2014:780521.
[7] 汤 菁,王朝霞.长非编码RNA BANCR在肿瘤研究中的进展[J].现代肿瘤医学,2017,25(3):478- 482.
Tang Q,Wang ZX.Reasearch progress of long non- coding RNA BANCR in tumor[J].J Modern Oncol,2017,25(3):478- 482.
[8] 赵 冀,周 超,李宏敏,等.长链非编码RNA BANCR在肝细胞癌组织中表达上调及其对患者疾病预后价值探讨 [J].重庆医学,2017,46(2):148- 151.
Zhao Y,Zhou C,Li HM,etal.Expression up- regulation of lncRNA BANCR in hepatocellular carcinoma tissue and its prognostic value on patients′ disease[J].Chongqing Med,2017,46(2):148- 151.
[9] Roxburgh P,Evans TR.Systemic therapy of hepatocellular carcinoma:are we making progress?[J].Adv Ther,2008,25(11):1089- 1104.
[10] Davidovich C,Cech TR.The recruitment of chromatin modifiers by long noncoding RNAs:lessons from PRC2[J].Rna,2015,21(12):2007- 2022.
[11] Engreitz JM,Haines JE,Perez EM,etal.Local regulation of gene expression by lncRNA promoters,transcription and splicing[J].Nature,2016,539(7629):452- 455.
[12] Gonzalez I,Munita R,Agirre E,etal.A lncRNA regulates alternative splicing via establishment of a splicing- specific chromatin signature[J].Nat Struct Mol Biol,2015,22(5):370- 376.
[13] Xue Y,Ma G,Gu D,etal.Genome- wide analysis of long noncoding RNA signature in human colorectal cancer[J].Gene,2015,556(2):227- 234.
[14] Yin DD,Liu ZJ,Zhang E,etal.Decreased expression of long noncoding RNA MEG3 affects cell proliferation and predicts a poor prognosis in patients with colorectal cancer[J].Tumour Biol,2015,36(6):4851- 4859.
[15] Zhou J,Li X,Wu M,etal.Knockdown of long noncoding RNA GHET1 inhibits cell proliferation and invasion of colorectal cancer[J].Oncol Res,2016,23(6):303- 309.
[16] Dong R,Jia D,Xue P,etal.Genome- wide analysis of long noncoding RNA (lncRNA)expression in hepatoblastomatissues[J].PLoS One,2014,9(1):e85599.
[17] Huang MD,Chen WM,Qi FZ,etal.Long non- coding RNA TUG1 is up- regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J].Mol Cancer,2015,14:165.
[18] Xu WH,Zhang JB,Dang Z,etal.Long non- coding RNA URHC regulates cell proliferation and apoptosis via ZAK through the ERK/MAPK signaling pathway in hepatocellular carcinoma[J].Int J Biol Sci,2014,10(7):664- 676.
[19] Shi Y,Liu Y,Wang J,etal.Downregulated long noncoding RNA BANCR promotes the proliferation of colorectal cancer cells via downregualtion of p21 expression[J].PLoS One,2015,10(4):e0122679.
[20] He A,Liu Y,Chen Z,etal.Over- expression of long noncoding RNA BANCR inhibits malignant phenotypes of human bladder cancer[J].J Exp Clin Cancer Res,2016,35(1):125.
[21] Jiang W,Zhang D,Xu B,etal.Long non- coding RNA BANCR promotes proliferation and migration of lung carcinoma via MAPK pathways[J].Biomed Pharmacother,2015,69:90- 95.
[22] Zhou T,Gao Y.Increased expression of LncRNA BANCR and its prognostic significance in human hepatocellular carcinoma[J].World J SurgOncol,2016,14(1):8.
[23] Yang ZY,Yang F,Zhang YL,etal.LncRNA- ANCR down- regulation suppresses invasion and migration of colorectal cancer cells by regulating EZH2 expression[J].Cancer Biomark,2017,18(1):95- 104.
[24] He X,Tan X,Wang X,etal.C- Myc- activated long noncoding RNA CCAT1 promotes colon cancer cell proliferation and invasion[J].Tumour Biol,2014,35(12):12181- 12188.
[25] Zhu H,Zhou X,Chang H,etal.CCAT1 promotes hepatocellular carcinoma cell proliferation and invasion[J].Int J Clin Exp Pathol,2015,8(5):5427- 5434.
[26] Wang D,Wang D,Wang N,etal.Long non- coding RNA BANCR promotes endometrial cancer cell proliferation and invasion by regulating MMP2 and MMP1 via ERK/MAPK signaling pathway[J].Cell Physiol Biochem,2016,40(3- 4):644- 656.
[27] Zhao Y,Adjei AA.Targeting angiogenesis in cancer therapy:moving beyond vascular endothelial growth factor[J].Oncologist,2015,20(6):660- 673.
[28] El- Kenawi AE,El- Remessy AB.Angiogenesis inhibitors in cancer therapy:mechanistic perspective on classification and treatment rationales[J].Br J Pharmacol,2013,170(4):712- 729.
[29] Welti J,Loges S,Dimmeler S,etal.Recent molecular discoveries in angiogenesis and antiangiogenic therapies in cancer[J].J Clin Invest,2013,123(8):3190- 3200.
[30] Huang JK,Song WH,Lu BY,etal.LncRNA- MALAT1 promotes angiogenesis of thyroid cancer by modulating tumor- associated macrophage FGF2 protein secretion[J].J Cell Biochem,2017,118(12):4821- 4830.
[31] Dong R,Liu XQ,Zhang BB,etal.Long non- coding RNA- CRNDE:a novel regulator of tumor growth and angiogenesis in hepatoblastoma[J].Oncotarget,2017,8(26):42087- 42097.
[32] Cai H,Liu X,Zheng J,etal.Long non- coding RNA taurine upregulated 1 enhances tumor- induced angiogenesis through inhibiting microRNA- 299 in human glioblastoma[J].Oncogene,2017,36(3):318- 331.
[33] Zhao YH,Wang T,Yu GF,etal.Anti- proliferation effects of interferon- gamma on gastric cancer cells[J].Asian Pac J Cancer Prev,2013,14(9):5513- 5518.
[34] Sun T,Yang Y,Luo X,etal.Inhibition of tumor angiogenesis by interferon- gamma by suppression of tumor- associated macrophage differentiation[J].Oncol Res,2014,21(5):227- 235.