TIPE2抑制AP- 1蛋白增加人非小细胞肺癌细胞系NCI- H1975化疗敏感性的机制研究
2018-01-24刘英宇张文艳
王 颖 刘英宇 张文艳
(河北省唐山工人医院呼吸内科,唐山 063000)
TIPE2(Tumor necrosis factor- a induced protein 8- like 2,TNFAIP8L2)是2008年新发现的一个维持免疫系统自稳平衡必需的基因之一,属于TIPE家族成员,具有与死亡受体结构域相似的结构域和6个保守的α螺旋结构,TIPE2与TNFAIP8L1(TIPE1)和TNFAIP8L3(TIPE3)同属于TNFAIP8家族,是一种重要的肿瘤抑制分子[1]。
肺癌是世界范围内危害人类健康的主要恶性肿瘤之一,其中80%~85%是非小细胞肺癌。根治手术是肺癌的主要治疗策略,尽管手术有所进展,但肺癌患者的5年生存率仍然不够理想,统计表明中国肺癌的中位生存期仅为22.7个月[2]。因此新型辅助化疗(例如CDDP)仍是非小细胞肺癌治疗的重要手段。尽管靶向治疗效果显著,但EGFR基因突变在吸烟的肺癌患者中发生率偏低,其突变率仅为30%,因此在吸烟患者中运用靶向治疗效果欠佳。同时在临床应用中,顺铂(CDDP)治疗则有肿瘤耐药现象发生,从而导致治疗失败,因此逆转肺癌细胞肿瘤耐药至关重要。有研究表明AP- 1蛋白在肿瘤耐药中发挥重要作用[3],且TIPE2是AP- 1蛋白的直接抑制分子[4,5]。本研究旨在探讨TIPE2是否在逆转肿瘤耐药方面发挥重要功能。
1 材料与方法
1.1材料
1.1.1细胞系和载体 人非小细胞肺癌系NCI- H1975从中国科学院上海细胞生物研究所购买,并在含有10%胎牛血清(FBS)的培养基中培养(Gibco,Australia)。TIPE2慢病毒载体由上海Genechem公司构建。
1.1.2仪器与试剂 流式细胞仪为BD公司产品(FACS Calibur,BD,USA),多功能酶标仪为Thermofisher公司产品(VarioskanFlash,Thermo,USA);CCK8及Annexin5- PI双染凋亡试剂盒购自Dojindo公司(Dojindo,Shanghai,China),CDDP为山东齐鲁制药有限公司产品(QiLu Pharmaceutical,Jinan,China),实时荧光定量试剂盒PrimeScriptTM购自TaKaRa公司(TaKaRa,Dalian,China),TRIzol 购自Invitrogen公司(Invitrogen,California,USA),AP- 1抗体购自CST公司(Cell Signaling Technology,Danvers,MA),TIPE2抗体为Santa Cruz公司产品(Santa Cruz Biotechnology,USA),MDR1抗体为Bio- Legend 公司产品(Bio- Legend,San Diego,CA)。
1.2方法 非小细胞肺癌系NCI- H1975转入TIPE2慢病毒载体后,加入CDDP 10 μg/ml,培养24 h,使用Cell Counting Kit- 8(CCK- 8)测量IC50值。 根据文献报道,细胞毒性指数计算为(1-药物处理细胞OD450/未处理细胞的OD450)×100%,使用GraphPad Prism 5计算CDDP的IC50值。TIPE2转染细胞后,用CDDP(10 μg/ml)处理24 h后,凋亡细胞用AnnexinV/FITC和PI凋亡检测试剂盒进行检测。使用含RIPA的蛋白裂解液提取上述经CDDP作用的细胞总蛋白,按操作说明进行,最后将膜与TIPE2抗体、AP- 1抗体及MDR- 1抗体进行孵育,胶片曝光检测蛋白表达量,GAPDH作为内参。TRIzol处理细胞后,PrimeScriptTM试剂盒提取总RNA并逆转录成cDNA,荧光定量PCR仪检测炎性因子表达水平,18S rRNA作为内参。
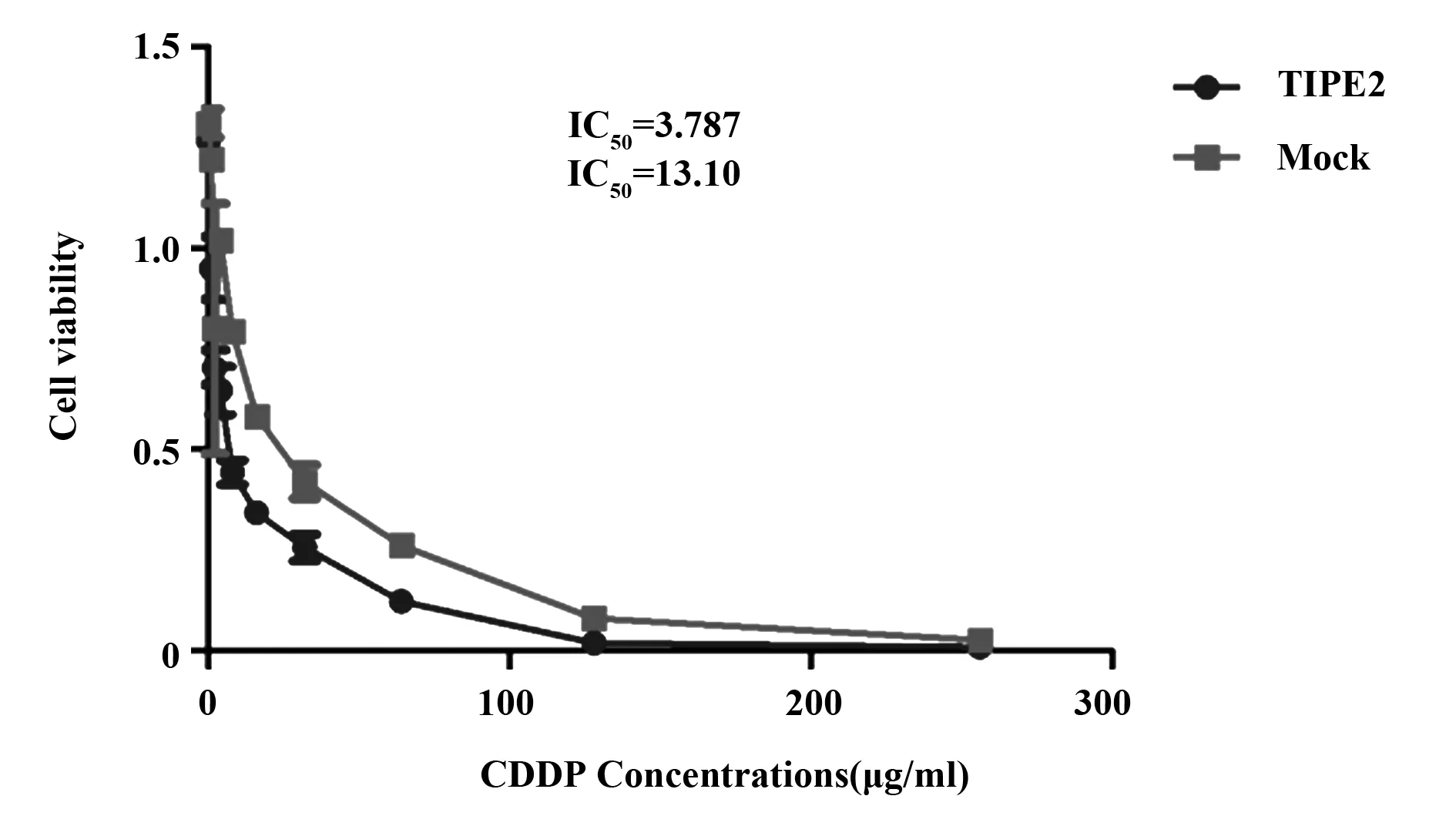
图1 转染TIPE2后IC50值明显降低Fig.1 Decreased IC50 after transfected with TIPE2
1.3统计学方法 采用Graphpad Prism5.0.软件(GraphPad Software,San Diego,CA)进行统计学分析,所有数据皆采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1TIPE2降低非小细胞肺癌系NCI- H1975细胞IC50值 结果表明,用TIPE2过表达慢病毒感染的非小细胞肺癌系NCI- H1975细胞,经CDDP作用24 h后,IC50(半数致死量)测定显示与对照组相比TIPE2过表达显著增加CDDP诱导的细胞毒性(图1,P<0.001)。
2.2TIPE2增加非小细胞肺癌系NCI- H1975细胞对CDDP的凋亡率 为了进一步证实TIPE2的功能,用CDDP处理TIPE2过表达细胞及对照组。 和预期相同,过表达TIPE2组增强CDDP诱导的NCI- H1975细胞凋亡,使用Annexin V和碘化丙啶染色后流式细胞仪判断如图2所示(P<0.05)。
2.3TIPE2降低非小细胞肺癌系NCI- H1975细胞中AP- 1及MDR1的表达量 过表达TIPE2后,NCI- H1975细胞AP- 1及MDR1表达量下调,有研究表明TIPE2是AP- 1的直接作用抑制分子,而AP- 1可以增加肿瘤细胞耐药性。MDR1则是介导肿瘤耐药的主要分子之一。本实验初步表明TIPE2增强CDDP对NCI- H1975细胞的化疗敏感性可能是通过下调AP- 1分子,如图3。
2.4TIPE2降低非小细胞肺癌系NCI- H1975细胞中炎性因子IL- 1、IL- 6及TNF- α mRNA水平 用CDDP处理TIPE2过表达细胞及对照组,过表达TIPE2组中炎性因子IL- 1、IL- 6及TNF- α mRNA水平明显降低,已有研究证实炎性因子比如IL- 6的增多可诱导肿瘤细胞耐药性,本结果表明TIPE2可能通过抑制AP- 1间接降低炎性因子分泌,从而降低肿瘤细胞耐药性。如图4所示(P<0.01)。
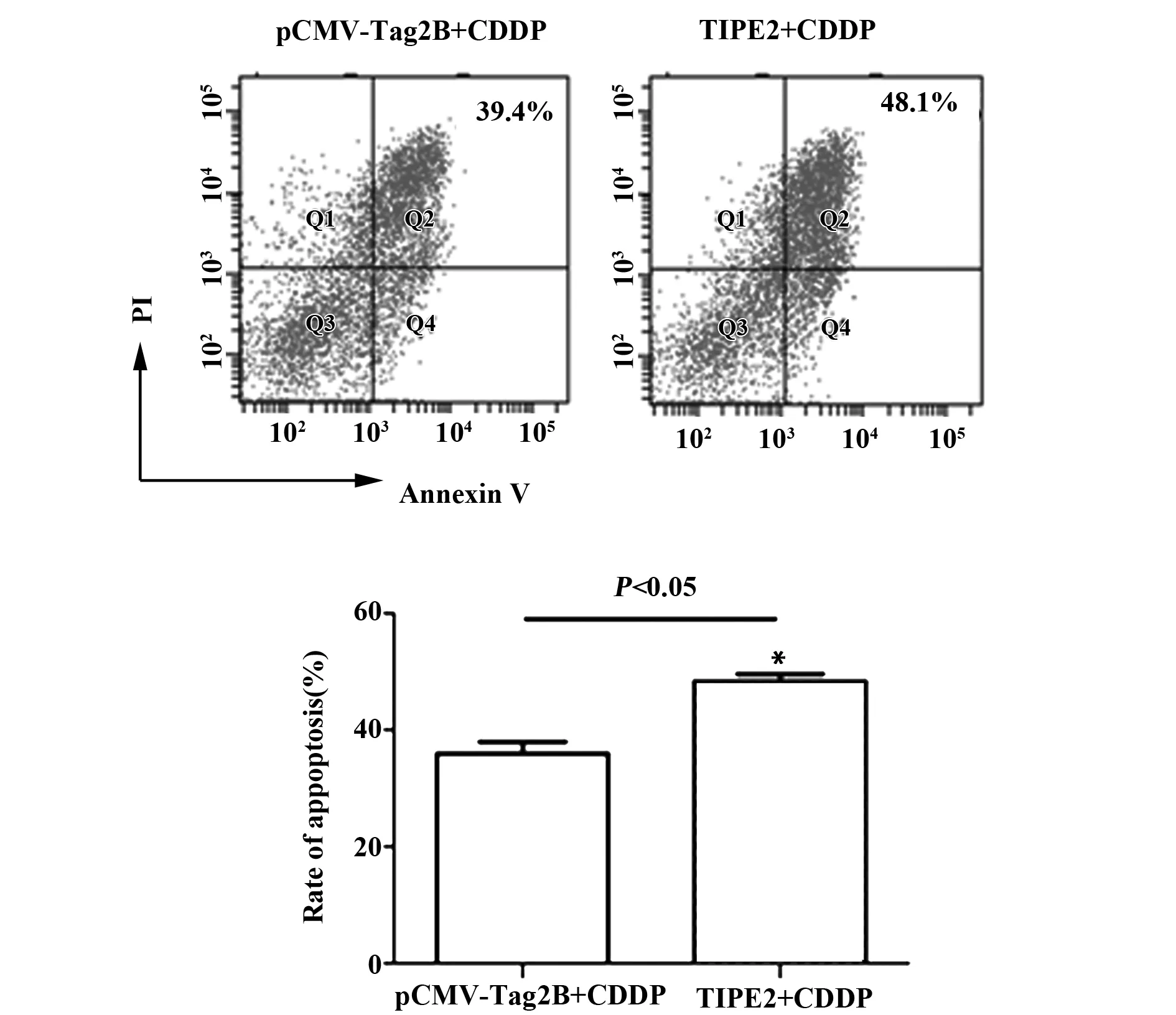
图2 TIPE2增加CDDP诱导的细胞凋亡Fig.2 Increased apoptosis after transfected with TIPE2Note: *.P<0.05.
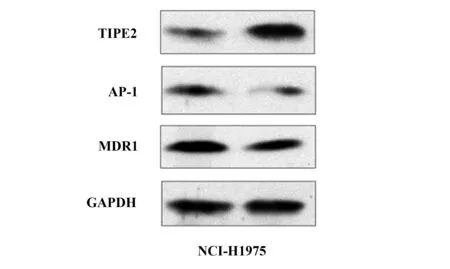
图3 TIPE2 明显降低AP- 1及MDR1蛋白表达水平Fig.3 Decreased expression of AP- 1 and MDR1 after transfected with TIPE2
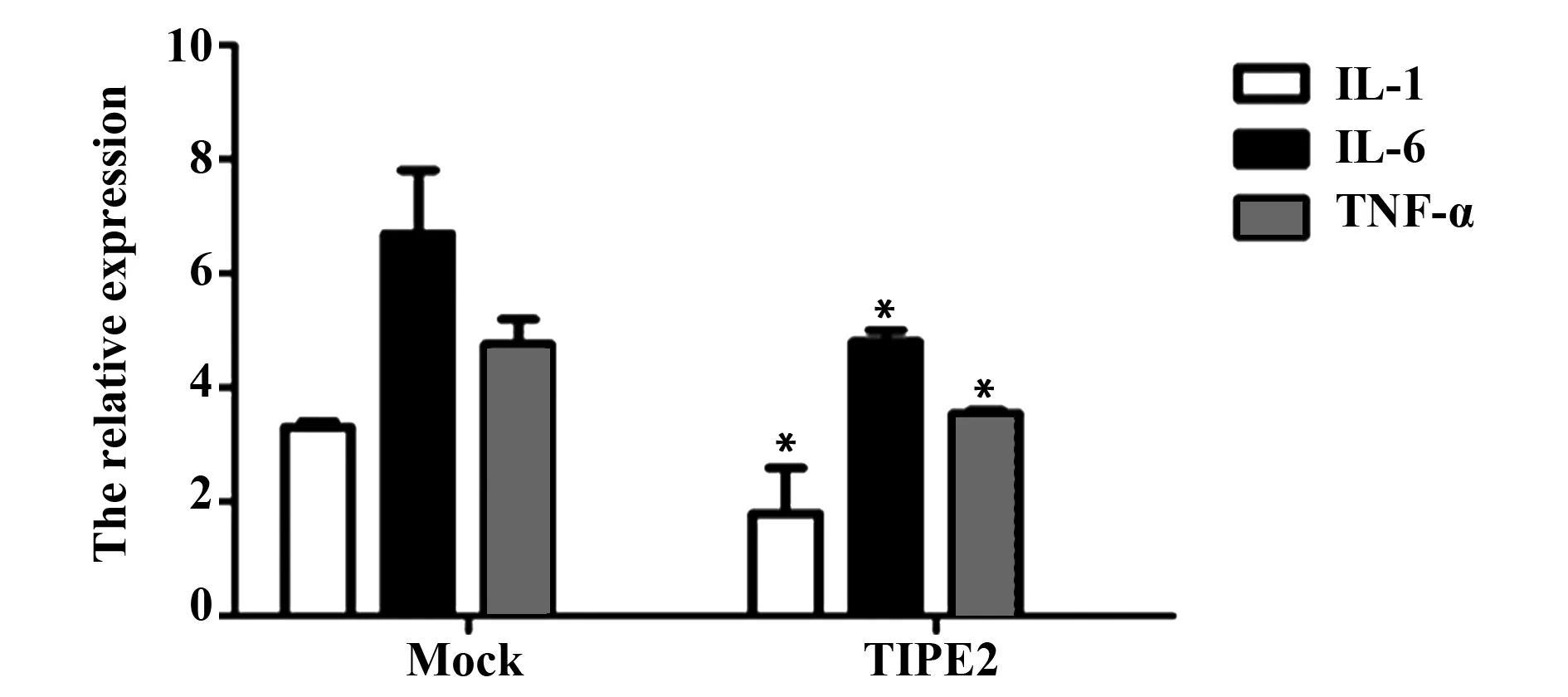
图4 TIPE2 明显降低IL- 1、IL- 6及TNF- α mRNA表达水平Fig.4 Decreased mRNA expression of IL- 1,IL- 6 and TNF- α after transfected with TIPE2Note: *.P<0.01.
3 讨论
对于不适合靶向治疗的非小细胞肺癌患者,肿瘤耐药仍然是治疗失败的重要原因,特别是那些IV期癌症患者。肿瘤耐药机制主要包括ATP结合转运体超家族(例如MDR1)介导的细胞内药物聚积及药物流出增加,p53、Bcl- 2或miRNAs介导的凋亡抑制机制,以及表达上调的错配修复基因等[6]。研究数据显示,MDR1的表达增加与肿瘤细胞耐药密切相关,MDR1编码的蛋白P- gp过表达对肿瘤进展有促进作用,使其有更高的复发率和转移风险[7,8]。因此,调控MDR1被认为是克服肿瘤耐药的主要策略之一。
已有研究证实TIPE家族另一成员TIPE(TNFAIP8)在胃癌肿瘤耐药中发挥重要作用[9]。TIPE2是炎性疾病的负调节因子,一般情况下,TIPE2表达降低与肿瘤转移密切相关,与肿瘤分期呈高度负相关性[1]。研究发现TIPE2通过抑制HCC中AKT和Ral的激活,可以结合并抑制Rac蛋白[10]。此外,TIPE2可抑制TNF介导的Erk1/2和NF- κB通路的活化[11],并通过上调N- ras和p27表达阻止胃癌细胞增殖[12]。然而迄今为止,还没有关于TIPE2在肿瘤耐药机制中的作用研究。本研究首次发现在过表达TIPE2的非小细胞肺癌系NCI- H1975细胞对CDDP敏感性增强,表现为IC50(半数致死量)明显降低,表明转染TIPE2后,只需要更小剂量的化疗药物就可以杀死肿瘤细胞。AnnexinⅤ和PI双染提示转染TIPE2后,在相同剂量的CDDP作用下,肿瘤细胞凋亡率明显增多。TIPE2分子是AP- 1的直接抑制分子,而AP- 1可激活MDR1的转录表达,AP- 1和MDR1的同时下降,表明 TIPE2可能是通过抑制AP- 1从而导致MDR1表达下调。MDR1/P- gp的主要功能是导致肿瘤细胞中抗肿瘤药物外排增加[13],是导致多药耐药(MDR)的关键因素[14]。AP- 1家族主要由原癌基因c- Jun和c- Fos组成,它们位于Ras/Raf途径的下游,对细胞增殖、肿瘤发生、转移和多药耐药至关重要[15,16]。 据我们所知,MDR1表达需要AP- 1与其启动子的结合,其中c- Jun和c- Fos在调节MDR1中起主要作用。蛋白印迹实验发现,转染TIPE2后,AP- 1明显下调,同时对肿瘤耐药起决定性作用的MDR1蛋白亦明显下降,该结果提示TIPE2的过表达抑制AP- 1蛋白表达,导致MDR1表达水平明显降低,从而引起对化疗药物的敏感性更高。炎症因子例如IL- 6及TNF- α等在肿瘤耐药中发挥重要作用[17],提示TIPE2作为炎性负调控分子可能在其中也发挥关键作用,本研究发现转染TIPE2然后用CDDP处理后炎性因子较对照组明显降低。AP- 1在炎性因子产生中起决定性作用,本研究结果表明TIPE2可能通过抑制AP- 1进而抑制炎症因子产生,从而间接参与肿瘤耐药形成。
我们的实验首次证实TIPE2蛋白可以增加肿瘤化疗敏感性,为逆转肿瘤多药耐药及增强化疗药物生物学作用、减少化疗药物毒副作用提供了理论可能。
[1] Goldsmith JR,Chen YH.Regulation of inflammation and tumorigenesis by the TIPE family of phospholipid transfer proteins[J].Cell Mol Immunol,2017,14(6):482- 487.
[2] Fan H,Shao ZY,Xiao YY,etal.Incidence and survival of non- small cell lung cancer in Shanghai:a population- based cohort study[J].BMJ Open,2015,5(12):e009419.
[3] Hsu SI,Cohen D,Kirschner LS,etal.Structural analysis of the mouse mdr1a(P- glycoprotein)promoter reveals the basis for differential transcript heterogeneity in multidrug- resistant J774.2 cells[J].Mol Cell Biol,1990,10(7):3596- 3606.
[4] Sun H,Gong S,Carmody RJ,etal.TIPE2,a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415- 426.
[5] Oho M,Nakano R,Nakayama R,etal.TIPE2(tumor necrosis factor alpha- induced protein 8- like 2)is a novel negative regulator of TAK1 signal[J].J Biol Chem,2016,291(43):22650- 22660.
[6] Li S,Sun W,Wang H,etal.Research progress on the multidrug resistance mechanisms of osteosarcoma chemotherapy and reversal[J].Tumour Biol,2015,36(3):1329- 1338.
[7] Wessler JD,Grip LT,Mendell J,etal.The P- glycoprotein transport system and cardiovascular drugs[J].J Am Coll Cardiol,2013,61(25):2495- 2502.
[8] Gillet JP,Gottesman MM.Mechanisms of multidrug resistance in cancer[J].Methods Mol Biol,2010,596:47- 76.
[9] Gus- Brautbar Y,Johnson D,Zhang L,etal.The anti- inflammatory TIPE2 is an inhibitor of the oncogenic Ras[J].Mol Cell,2012,45(5):610- 618.
[10] 李莉娜,毕志彬,王金胜.TNFAIP8与胃癌耐药关系的初步研究 [J] .中国免疫学杂志,2016,32(7):962- 964 .
Li LN,Bi ZB,Wang JS.Preliminary research in relationship between TNFAIP8 and gastric cancer drug resistance[J].Chin J Immunol,2016,32(7):962- 964.
[11] Zhang YH,Yan HQ,Wang F,etal.TIPE2 inhibits TNF- alpha- induced hepatocellular carcinoma cell metastasis via Erk1/2 downregulation and NF- kappaB activation[J].Int J Oncol,2015,46(1):254- 264.
[12] Zhao Q,Zhao M,Dong T,etal.Tumor necrosis factor- alpha- induced protein- 8 like- 2(TIPE2)upregulates p27 to decrease gastic cancer cell proliferation[J].J Cell Biochem,2015,116(6):1121- 1129.
[13] Gottesman MM,Fojo T,Bates SE.Multidrug resistance in cancer:role of ATP- dependent transporters[J].Nat Rev Cancer,2002,2(1):48- 58.
[14] Requenez- Contreras JL,Lopez- Castillejos ES,Hernandez- Flores R,etal.MiR- 138 indirectly regulates the MDR1 promoter by NF- kappaB/p65 silencing[J].Biochem Biophys Res Commun,2017,484(3):648- 655.
[15] Zhao YY,Yu L,Liu BL,etal.Downregulation of P- gp,Ras and p- ERK1/2 contributes to the arsenic trioxide- induced reduction in drug resistance towards doxorubicin in gastric cancer cell lines[J].Mol Med Rep,2015,12(5):7335- 7343.
[16] Yu Z,Sato S,Trackman PC,etal.Blimp1 activation by AP- 1 in human lung cancer cells promotes a migratory phenotype and is inhibited by the lysyl oxidase propeptide[J].PLoS One,2012,7(3):e33287.
[17] Matassa DS,Amoroso MR,Lu H,etal.Oxidative metabolism drives inflammation- induced platinum resistance in human ovarian cancer[J].Cell Death Differ,2016,23(9):1542- 1554.
