香菇茯苓银耳复合多糖对小鼠巨噬细胞功能的作用研究①
2018-01-24胡明华邓向亮
胡明华 邓向亮 徐 路
(无限极(中国)有限公司,广州 510600)
研究表明中草药多糖具有显著的生物学活性,其中免疫调节作用是报道较多的生物活性之一[1]。中草药多糖能从多个方面调节机体的免疫系统,包括调节巨噬细胞、T细胞、B细胞、NK细胞和树突状细胞等功能以及细胞因子、抗体等免疫分子的分泌水平[2- 4]。多糖的生物学活性与其化学结构、分子量和糖链结构密切相关,不同来源的中草药多糖可能具有不同的免疫调节功能,因此由不同药材来源多糖按一定比例组成的复合多糖,具有更全面的免疫调节作用[5]。本课题组前期研究选用明确具有免疫调节作用的来源于香菇、茯苓和银耳的多糖,按一定比例组成复合多糖,发现该复合多糖可以恢复免疫抑制小鼠T/B细胞比例及细胞因子IL- 2、IL- 6的分泌水平,结果表明复合多糖较单一多糖的作用更明显,显示出复合多糖组分的协同作用[6]。本研究在此基础上,进一步考察该复合多糖对小鼠巨噬细胞功能的调节作用。本研究结果将进一步丰富香菇茯苓银耳复合多糖的免疫调节内涵,为其开发应用提供实验依据。
1 材料与方法
1.1实验材料
1.1.1主要试剂和仪器 香菇茯苓银耳复合多糖溶液(以下简称CP):290 mg CP溶于1 ml 二甲基亚砜(DMSO),用磷酸盐缓冲液(Phosphate buffer,PBS)定容至29 ml,终浓度为10 mg/ml,0.22 μm微孔滤膜过滤,4℃保存。10 mmol/L抗坏血酸储备液;500 μg/ml LPS储备液;一氧化氮(NO)检测试剂盒购于ThermoFisher公司;小鼠流式CD40抗体,CD80抗体和CD86抗体均购于BioLegend公司;罗丹明B,四氢呋喃(THF)均购于Sigma公司。
Leica,DM5000B生物荧光显微镜;湘仪 L535R台式大容量冷冻离心机;BD FACSCantoⅡ型流式细胞仪;Thermo Multiskan Ascent多功能酶标仪;Tghuat- ZD300全自动振荡仪;kq- 5200型超声波清洗仪。
1.1.2巨噬细胞 小鼠巨噬细胞株RAW264.7细胞来源于中国科学院细胞库,用RPMI1640完全培养液(含胎牛血清10%、青霉素100 U/ml、链霉素100 μg/ml)置于37℃、5%CO2、饱和湿度细胞培养箱培养。
1.2实验方法 实验分组:NC组(正常对照组);AscA组(抗坏血酸组);RNP组(纳米微球组);CP组(复合多糖组);Pre- CP组(复合多糖预处理组);Co- CP组(复合多糖同时处理组);CP+RNP组(复合多糖+纳米微球组);LPS组(脂多糖刺激组);Pre- CP+LPS组(复合多糖预处理+脂多糖刺激组);Co- CP+LPS组(复合多糖与脂多糖同时处理组);AscA+LPS组(抗坏血酸与脂多糖同时处理组)。
1.2.1纳米微球的制备 检测巨噬细胞吞噬功能的包被罗丹明B纳米微球(Rhodamine B encapsulated organic nanopart- icles,RNP)的制备流程见图1:①取10 μl罗丹明B的DMSO溶液(20 mmol/L)于1.5 ml EP管中(即0.1 mg罗丹明B);②称取0.1 mg磷脂,用0.2 ml 四氢呋喃(THF)将它们溶解,摇匀至澄清;③混合上述②和②溶液,混匀至澄清,记为A溶液;④在超声条件下将A溶液迅速加入经冰浴15 min的10 ml去离子水中,继续超声1 min;超声后,置于40℃油浴,在吹氮气条件下持续搅拌2 h;⑤四氢呋喃(THF)完全清除后,将混合物溶液置于截留分子量为30 kD的旋转过滤器中,3 500 r/min转速下离心15 min,弃滤液,注入去离子水洗涤3次;⑥将制备好的水溶性罗丹明B荧光微球置塑料小瓶中保存。
1.2.2CP对RAW264.7细胞活性的影响 为了考察CP对RAW264.7细胞活性的影响,取RAW264.7接种于96孔板,每孔5 000个细胞,贴壁培养过夜。试验分为短时毒性试验和长时毒性试验:①短时毒性试验:各组细胞分别加入不同体积的CP溶液,调整使CP终浓度分别为0、50、100、200、400、800、3 200 μg/ml,培养4 h。②长时毒性试验:各组细胞分别加入不同体积的CP溶液,调整使CP终浓度分别为0、200、250、300、350、400、500、1 000 μg/ml,培养24 h。
细胞培养完后,每孔加入20 μl新配制的0.5%的溴化噻唑蓝四氮唑(MTT)继续培养4 h,弃去细胞培养上清,每孔加入150 μl DMSO,用振荡仪振荡10 min,酶标仪检测570 nm及630 nm吸光度(630 nm为参照)。
1.2.3CP对RAW264.7细胞吞噬能力测定 取处于对数生长期的RAW264.7细胞分组及处理如下:①Pre- CP组:细胞与500 μg/ml CP分别共孵1、2、4、8、12 h,然后与RNP共孵2 h。②Co- CP组:细胞与500 μg/ml CP以及RNP分别共孵1、2、4、8、12 h。
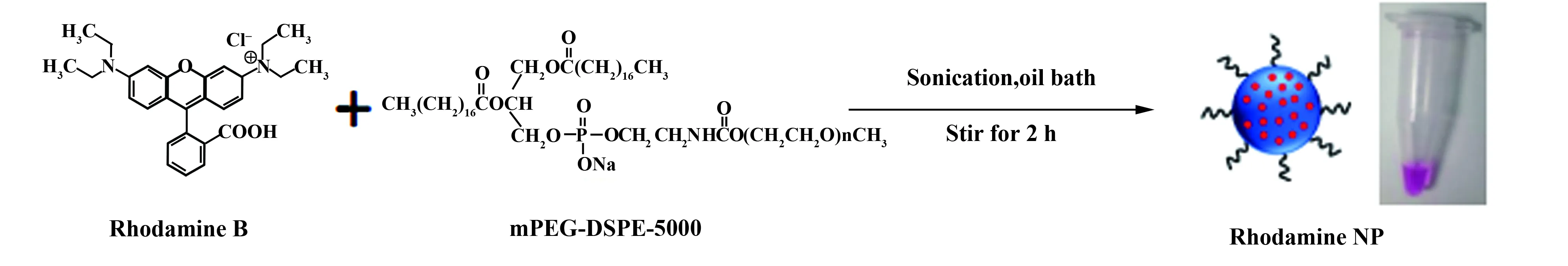
图1 RNP的制作过程示意图Fig.1 Schematically illustration of preparation of RNP
③AscA组:细胞与300 nmol/L抗坏血酸以及RNP分别共孵1、2、4、8、12 h。④NC组:细胞单独与RNP分别共孵1、2、4、8、12 h。采用荧光显微镜成像和流式细胞术(FACS)来测定被吞噬的荧光微球的荧光强度以定量分析纳米球被吞噬情况。
1.2.4CP对RAW264.7细胞分泌NO的影响 RAW264.7细胞(1×105)接种到24孔板,与不同浓度的CP共培养12 h和24 h。孵育结束后,分别收集细胞培养基(110 μl)并离心。在96孔板中分别加培养基上清液(100 μl)、去离子水(180 μl)和Griess试剂(20 μl),然后将混合物在室温下温育30 min 并在紫外- 可见分光光度计548 nm处分析,吸光度值通过标准曲线计算出相对应的NO的含量。
1.2.5CP对RAW264.7细胞CD40、CD80和CD86分子表达的影响 RAW264.7细胞(8×105)接种到6孔板,贴壁过夜,加入CP(500 μg/ml)孵育12 h和24 h。孵育结束后加入冷PBS,收集细胞并用4%多聚甲醛固定细胞。APC标记的CD40抗体、FITC标记的CD80抗体和PE标记的CD86抗体均加入到100 μl的细胞中,室温下温育1 h,细胞用PBS洗3遍,上机检测,检测并记录的细胞数设定为 5 000个。
1.2.6CP对LPS诱导RAW264.7细胞活化的影响 为了考察CP对LPS诱导RAW264.7细胞活化的影响,本研究按以下四种方案处理RAW264.7细胞:①LPS组(阴性对照):RAW264.7细胞与100 ng/ml LPS共孵。②Pre- CP+LPS组:RAW264.7细胞先与浓度为100、200、300、400、500、750、1 000 ng/ml的CP共孵24 h。弃上清,加入浓度为100 ng/ml LPS共孵。③Co- CP+LPS组:RAW264.7细胞与浓度为100、200、300、400、500、750、1 000 ng/ml的CP及浓度为100 ng/ml LPS共孵。④AscA+LPS组(阳性对照):RAW264.7细胞与浓度为0、100、400、500 nmol/L的抗坏血酸方及浓度为100 ng/ml LPS共孵。细胞经上述处理一定时间后,收集细胞用流式细胞术检测CD40、CD80和CD86分子表达。

2 结果
2.1CP对RAW264.7细胞活性的影响 短时毒性试验中,CP对RAW264.7细胞活力没有显著影响,即使CP浓度高达3 200 μg/ml,4 h的共孵也未减弱或增强RAW264.7细胞的活力(图2A)。与之相对的,在长时毒性试验中,浓度低于500 μg/ml的CP对RAW264.7细胞活力无影响;而当CP的浓度达到1 000 μg/ml时,RAW264.7细胞活力有轻微的减弱(图2B)。
2.2CP对RAW264.7细胞吞噬的影响 通过荧光显微镜可以观察到,CP与RNP共孵育随时间增加,CP能明显增强RAW264.7细胞对RNP的吞噬作用(图3A),进一步分析发现与正常组相比,12 h与 24 h 两者间差异具有统计学意义,结果见图3B。本实验条件下CP预处理对巨噬细胞的吞噬作用没有明显影响。
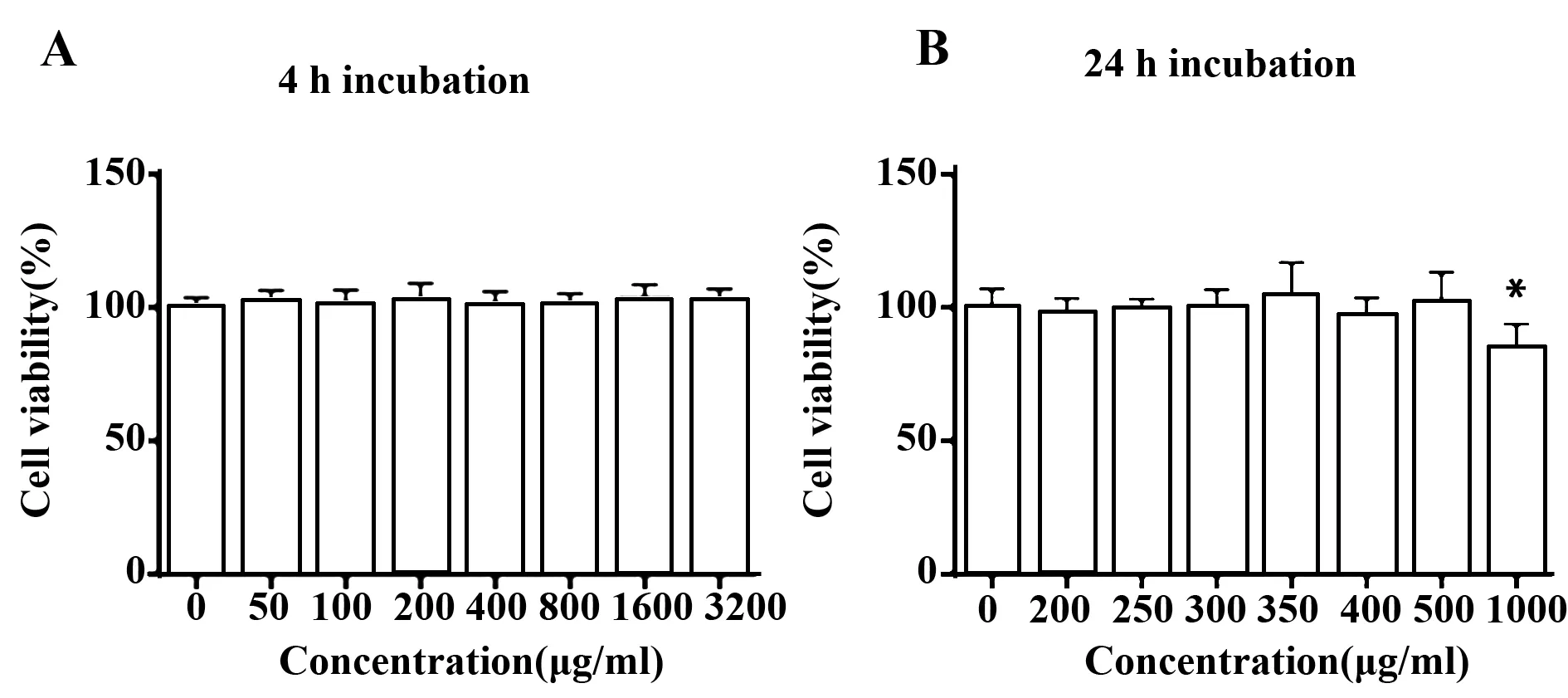
图2 CP对RAW264.7细胞活力的影响(n=5)Fig.2 Effect of CP on RAW264.7 cell viability(n=5)Note: A.Short term (4 h)incubation;B.Long term (24 h)incubation.*.P<0.05.
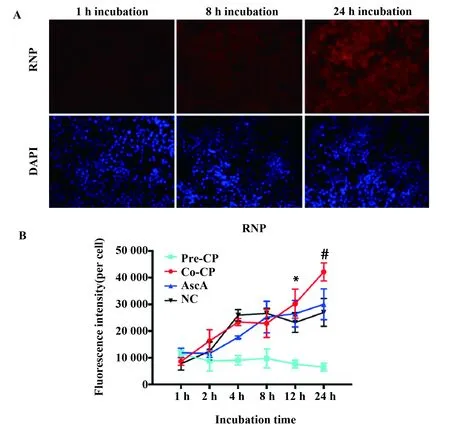
图3 荧光显微镜分析CP对RAW264.7细胞吞噬作用的影响(n=5)Fig.3 Effect of CP on RAW264.7 cells phagocytosis by Fluorescence microscopy analysis(n=5)Note: A.Representative fluorescence images of cells with uptaken RNP at different incubation time points (1,8,and 24 h)co- treatment with CP product;B.Fluorescence intensity quantification analysis obtained from cell images.CP- Pre.CP pretreatment group;CP- Co.CP co- treatment group;AscA.Ascorbic acid treatment group;NC.Negative control group.*.P<0.05;#.P<0.000 1.
为了验证上述结果的可靠性,本研究又采用流式细胞术检测了RAW264.7细胞对荧光微球RNP吞噬情况。结果如图4所示,RAW264.7细胞经CP处理4、8、24 h后荧光信号显著增强,即吞噬RNP能力增强,与RNP比较差异具有统计学意义(P<0.05)。结果提示CP的确可以增强RAW264.7细胞的吞噬功能。
2.3CP对RAW264.7释放NO的影响 结果如图5所示,RAW264.7细胞释放NO的量以CP组与阴性对照的比值表示,即以相对分泌量表示。CP处理12 h时,对RAW264.7细胞分泌的NO的量几乎无影响,在给药浓度为1 000 μg/ml时,细胞NO的产生量略微升高(1.21∶1),差异无统计学意义(P>0.05)。处理24 h后,RAW264.7细胞释放NO的量增加了一倍,与阴性对照组比较,差异具有统计学意义(P<0.05)。

图4 流式细胞术分析CP对RAW264.7细胞的吞噬作用(n=5)Fig.4 Effect of CP on RAW264.7 cells endocytosis by FACS analysed(n=5)Note: A.Representative flow cytometry images of cells with uptaken RNP at different incubation time points (1,4,8,and 24 h);B.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,#.P<0.000 1.
2.4CP对RAW264.7细胞CD40、CD80和CD86分子表达的影响 流式细胞术检测巨噬细胞活化标志分子CD40、CD80和CD86的表达水平,结果如图6所示,巨噬细胞与500 μg/ml的CP共孵12、24 h后,其活化分子标记CD40、CD80和CD86表达增强,而且24 h比12 h的增强更为显著。

图5 CP对RAW264.7细胞NO释放的影响(n=5)Fig.5 Effct of CP on NO production in RAW264.7 cells(n=5)Note: Blank line indicates results for 12 h treatment and red line indicates for 24 h treatment.The NO production without CP treatment at 12 h was regarded as “1” and served as the normalization standard for data obtained from other time points;#.P<0.000 1.

图6 CP对RAW264.7细胞活化的影响(n=5)Fig.6 Effects of CP on RAW264.7 cells activation(n=5)Note: A to C.Markers CD40,CD80,CD86 were detected using FACS analysis;D.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,**.P<0.01,#.P<0.000 1.
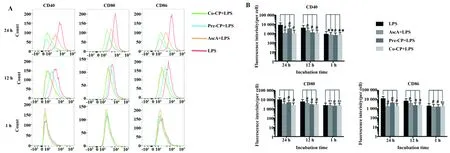
图7 CP对LPS诱导RAW264.7细胞活化的影响(n=5)Fig.7 Effects of CP on activation in LPS- induced RAW264.7 cells(n=5)Note: A.Representative flow cytometry images of cells with CD molecules at different incubation time points (1,12 and 24 h);B.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,**.P<0.01,#.P<0.000 1.
2.5CP对LPS诱导的RAW264.7活化的影响 流式细胞术检测RAW264.7细胞经CP和LPS联合处理后的活化标志分子CD40、CD80和CD86表达水平,结果如图7所示,共孵1 h后,各药物处理组细胞表面CD分子表达与LPS组比较无明显变化;共孵12 h后,各药物处理组细胞的CD分子明显低于LPS组;在24 h时间点,各药物处理组CD分子的变化更加明显,Pre- CP+LPS组与Co- CP+LPS组的抑制效果均优于AscA+LPS组,结果提示CP对LPS诱导的RAW264.7细胞活化具有显著的抑制作用。
3 讨论
巨噬细胞作为机体重要的固有免疫细胞和抗原提呈细胞,是机体免疫防御的第一道防线,同时在多种免疫相关性疾病的发生发展中扮演着重要角色[7]。本课题组前期研究发现由香菇多糖、茯苓多糖和银耳多糖按一定比例组成的复合多糖对免疫抑制小鼠的细胞免疫功能具有更全面的调节作用,然而其对巨噬细胞功能的影响尚未清楚。因此本研究考察了该复合多糖对不同状态下巨噬细胞功能的影响,以进一步加深对其免疫系统调节作用的认识,并为其开发应用提供实验依据。
本研究首先考察了香菇茯苓银耳复合多糖对静息状态巨噬细胞株RAW264.7细胞功能的影响。研究结果发现,RAW264.7细胞与复合多糖共孵育条件下,复合多糖可以增强RAW264.7细胞对荧光微球的吞噬作用,且随着时间的延长愈加明显;复合多糖低浓度对RAW264.7细胞分泌NO无影响,当浓度达1 000 μg/ml时才能促进其显著分泌NO。NO不仅参与巨噬细胞杀伤肿瘤和胞内菌与寄生虫,而且还参与细胞因子的调节,特别是与炎症有关的细胞因子。因此,NO的释放量是观察免疫细胞活性的常见指标[8,9]。CD40、CD80和CD86是巨噬细胞活化的标志分子,巨噬细胞受刺激活化后高表达此类CD分子[10,11]。本研究结果中,复合多糖可以提高静息状态巨噬细胞株RAW264.7细胞CD40、CD80和CD86分子表达水平,在LPS刺激下则抑制其表达,起到了有效的调节作用。结果与相关研究报道,香菇多糖、茯苓多糖和银耳多糖的免疫调节作用研究结果一致[12- 14]。
本研究还考察了香菇茯苓银耳复合多糖对LPS诱导的RAW264.7细胞活化的影响。LPS可以通过TLR4诱导巨噬细胞活化,并分泌多种炎症因子,因此是诱导巨噬细胞活化的常用刺激剂[15]。本研究结果也发现,经LPS刺激后RAW264.7细胞CD分子CD40、CD80和CD86的表达水平显著升高。香菇茯苓银耳复合多糖在预孵育和共孵育条件下,都可以抑制LPS诱导的RAW264.7细胞活化,即抑制CD40、CD80和CD86分子的表达,提示该复合多糖对活化的巨噬细胞功能具有抑制作用。有文献报道,中草药多糖对巨噬细胞功能调节作用可能是双向的[16,17]。张俊等[16]研究了板蓝根多糖对大鼠不同免疫状态的调节作用,结果发现板蓝根多糖能够抑制免疫亢进组大鼠的亢进趋势,提升免疫抑制组大鼠的免疫功能,对环磷酰胺造模大鼠具有双向免疫调节作用。江泽波等[17]研究了猪苓多糖对巨噬细胞RAW264.7的双向免疫调节作用,结果发现猪苓多糖可以极化巨噬细胞为M1型,增加由IFN- γ诱导的M1炎症因子的表达,增加抑炎因子的表达,有着双向的调节作用,但是相关机制有待进一步研究。
综合上述,香菇茯苓银耳复合多糖对不同状态下巨噬细胞功能具有调节作用,即可以促进静息状态下巨噬细胞活化和吞噬作用,而对活化状态的巨噬细胞功能具有抑制作用。
[1] 张继东,王志祥.中草药多糖的免疫调节机制及其应用[J].饲料工业,2006,27(6):1- 4.
Zhang JD,Wang ZX.Immunomodulatory mechanism of Chinese herbal polysaccharides and its application[J].Feed Industry,2006,27(6):1- 4.
[2] Gan L.Regulating effect of fructus schisandrae polysaccharide on tumor growth and immune function of H22 vaccination mice[J].Immunol J,2013,29(10):867- 870.
[3] 张湘东,许定舟,李金华,等.丹参多糖的免疫调节活性研究[J].中药材,2012,35(6):949- 952.
Zhang XD,Xu DZ,Li JH,etal.Study on the immunocompetence of polysaccharide extracted from root of salvia miltiorrhiza[J].J Chin Med Materi,2012,35(6):949- 952.
[4] 邱 波,荆雪宁,武继彪,等.黄芪多糖诱导的树突状细胞疫苗对S180荷瘤小鼠抗肿瘤作用研究[J].南京中医药大学学报,2015,31(1):44- 47.
Qiu B,Jing XN,Wu JB,etal.Anti- tumor effects of dendritic cell vaccines induced byastragalus polysaccharides on S180 tumor- bearing mice[J].J Nanjing Univ Trad Chin Med,2015,31(1):44- 47.
[5] 苏富琴,崔红霞,刘吉成.复合多糖的免疫协同作用[J].中药新药与临床药理,2004,15(5):317- 319.
Su FQ,Cui HX,Liu JH.Synergistic immune action of polysaccharides compound[J].Chin Med New Drugs Clin Pharmacol,2004,15(5):317- 319.
[6] 罗 霞,马忠华,胡明华,等.复合多糖对小鼠细胞免疫功能的影响[J].中国食品卫生杂志,2016,28(2):186- 191.
Luo X,Ma ZH,Hu MH,etal.Effects of compound polysaccharide on cellular immunity in mice [J].Chin J Food Hyginen,2016,28(2):186- 191.
[7] 易 阳,曹 银,张名位.多糖调控巨噬细胞免疫应答机制的研究进展[J].中国细胞生物学学报,2011,33(11):1267- 1277.
Yi Y,Cao Y,Zhang MW.Research progress of polysaccharides regulating macrophage immune responses[J].Chin J Cell Biol,2011,33(11):1267- 1277.
[8] 丁 航,侯 敢,周克元,等.香菇多糖对巨噬细胞一氧化氮和一氧化氮合酶活性的影响[J].广东药学,2003,13(4):32- 33.
Ding H,Hou G,Zhou KY,etal.Effects of lentinan on the nitric oxide production and the inducible nitric oxide synthase in mounse peritoneal macrophages[J].Guangdong Pharmacy,2003,13(4):32- 33.
[9] Iguchi H,Kojo S,Ikeda M.Nitric oxide (NO)synthase activity in the lung and NO synthesis inalveolar macrophages of rats increased on exposure to asbestos.[J].J Applied Toxicol,2015,16(4):309- 315.
[10] Sun Q,Hosoki K,Boldogh I,etal.Allergic extracts require TLR4 to activate and increase expression of CD40,CD80 and CD86 on bone marrow- derived dcs[J].J Allergy Clin Immunol,2015,135(2):AB9.
[11] Laman JD,Claassen E,Noelle RJ.Functions of CD40 and its ligand,gp39 (CD40L)[J].Crit Rev Immunol,1996,16(1):59- 108.
[12] 胡婷婷,孟一鸣,单风平.香菇多糖对小鼠骨髓树突状细胞表型和功能的影响[J].微生物学杂志,2014,34(2):54- 58.
Hu TT,Meng YM,Shan FP.Effects of Xianggu (Lentinus edodes)polysaccharide on phenotype & function of mouse bone marrow- derived dendritic cells[J].J Microbiol,2014,34(2):54- 58.
[13] 袁思霓,张 峰.银耳多糖的提取及其对小鼠免疫功能的影响[J].安徽农业科学,2007,35(26):8090- 8091.
Yuan SN,Zhang F.Extraction of Tremella polysaccharides and its effect on immune function inmice[J].J Anhui Agri,2007,35(26):8090- 8091.
[14] 张秀军,徐 俭,林志彬.羧甲基茯苓多糖对小鼠免疫功能的影响[J].中国药学杂志,2002,37(12):35- 38.
ZHANG XJ,XU J,LIN ZB.The effect of carboxymethylpachymaran(CMP)on immunological function in mice[J].Chin Pharm J,2002,37(12):35- 38.
[15] M Rossol,H Heine,U Meusch,etal.LPS- induced cytokine production in human monocytes and macrophages[J].Crit Rev Immunol,2011,31(5):379.
[16] 张 俊,胡安君,毕亚楠,等.板蓝根多糖对环磷酰胺造模大鼠的双向免疫调节作用[J].药物评价研究,2016,39(4):531- 538.
Zhang J,Hu AJ,Bi YN,etal.Dual- directional immune regulation of Isatidis Radix polysaccharides on rats treated with cytoxan[J].Drug Evaluation Res,2016,39(4):531- 538.
[17] 江泽波,胡金萍,温晓文,等.猪苓多糖对巨噬细胞RAW264.7的双向免疫调节作用[J].免疫学杂志,2014,30(12):1033- 1038.
Jiang ZB,Hu JP,Wen XW,etal.Bidirectional immunomodulatory effects of polyporus polysaccharide on RAW264.7 macrophages[J].Immunol J,2014,30(12):1033- 1038.