未培养微生物木聚糖基因真核表达及产酶条件优化
2018-01-18崔晓亭杨玉焕李秀婷
熊 科 , 崔晓亭 , 杨玉焕 , 李秀婷 *
(1.北京工商大学 食品质量与安全北京实验室,北京 100048;2.北京工商大学 北京市食品添加剂工程技术研究中心,北京 100048;3.北京工商大学 北京市食品风味化学重点实验室,北京 100048)
木聚糖是半纤维素的主要成分,是自然界可再生的丰富的生物资源。木聚糖酶能够降解木聚糖成木糖或木寡糖,在饲料、食品、纺织、造纸等行业有着广泛的应用,是现代酶学研究的热点之一。木聚糖酶是专一降解木聚糖的一类酶的总称,包括内切β-1,4-木聚糖酶、外切 β-1,4-木聚糖酶、β-木糖苷酶,此外,还有一些脱支链酶。狭义上的木聚糖酶仅限于β-1,4-内切木聚糖酶,也是目前人们研究最多、了解最深入的木聚糖降解酶。广义上的木聚糖酶是指能够降解木聚糖或半纤维素的一组酶的总称,它对自然界中存在的半纤维素类物质的降解有着重要作用。
目前,多数的木聚糖酶来源于各类原始菌株的发酵,该方法获得的木聚糖酶多数为复合酶,但优良的菌株来源有限,且酶的表达量低、含杂蛋白质较多,不易纯化。由于自然界中99%以上的微生物不能被纯培养利用,因此该方法得到的产木聚糖酶菌株仅局限于不到1%的微生物基因资源,对自然界中所占比例较大的未培养微生物资源无法利用。随着基因工程技术的发展,人们采用基因技术克隆得到已知菌株的木聚糖酶基因,并将其导入一定宿主细胞中表达,具有改善木聚糖酶的性质,提高木聚糖酶活力,便于后期纯化等优点,在生产上具有很大应用价值,但该方法很难获得与常规木聚糖酶性质差异较大、新颖性较好的木聚糖酶[1-4]。而利用宏基因组学的方法获得某一环境中所有未培养微生物的木聚糖酶基因,可提高寻找和发现新的木聚糖酶基因的概率。由未培养微生物宏基因组学方法获取木聚糖酶基因并转化表达的研究已有一些报道,如利用堆肥以及利用湖羊瘤胃等未培养微生物进行木聚糖酶基因的克隆。从来源上比较,木聚糖酶可以广泛来源于各种环境如海洋、陆地等。而土壤微生物是木聚糖酶的巨大来源库,通常每克土壤中有几亿到几百亿个微生物,虽然土壤宏基因文库构建面临的干扰因素多、难点大,如腐殖酸的去除等,但构建土壤未培养微生物的宏基因组文库能更广泛地获得木聚糖酶优良基因资源。因此作者以土壤环境作为宏基因来源对酶进行发掘,相比其它环境的宏基因来源,可大大提高寻找和发现新木聚糖酶基因的概率,理论意义和潜在的应用价值较大。而毕赤酵母表达系统自开发利用以来,一直被广泛应用于各种外源蛋白质的表达,且外源蛋白质的遗传稳定性高[5],至今已有超过1 000种蛋白质在毕赤酵母中实现了表达[6-8]。因此,将用宏基因组学的方法获取的未培养微生物木聚糖酶基因X1-19导入毕赤酵母中进行高效表达构建重组表达载体pPIC9K-X1-19及转化毕赤酵母GS115。筛选获得木聚糖酶活力较高的转化子,并对产酶条件进行优化,以期获得与常规木聚糖酶性质差异较大的木聚糖酶。本研究为未培养微生物木聚糖酶基因的异源表达工业生产提供理论依据,具有较好的工业应用前景。
1 材料与方法
1.1 试剂及仪器
GS115毕赤酵母宿主菌:中国工业微生物菌种保藏中心;pPIC9K毕赤酵母表达质粒:Invitrogen;未培养微生物木聚糖基因X1-19:来源于土壤宏基组DNA,为作者所在实验室获取;Plasmid Mini Kit(100)、Gel Exraction Kit(200):美国 OMEGA 有限公司;卡那霉素:美国AMRESCO有限公司;TaqTMDNA 聚合酶(with GC buffer)、限制性内切酶EcoR I、Not I、Bgl II、T4 DNA 连接酶、PMD18-T:日本TAKARA公司;琼脂糖:英国OXOID公司;PCR扩增引物:北京奥科鼎盛生物科技有限公司;其余试剂均为国产分析纯。
Scientz-2C基因导入仪:宁波新芝生物科技股份有限公司;0.2 cm电激转化杯:美国伯乐生命医学产品有限公司;水平摇床:北京六一仪器厂;分光光度计:上海棱光技术有限公司;DHZ-DA全温振荡器:太仓培英实验设备厂;ImageQuant 300凝胶成像仪、Multitemp III恒温循环水浴器、EPS 601电泳仪:美国GE公司;恒温培养箱:上海STIK仪器设备有限公司。
1.2 培养基
BMMY (g/L): 酵母提取物10, 胰蛋白胨 20,KH2PO412,K2HPO43,YNB 13.4, 生物素 0.5, 甲醇5;其中YNB、生物素、甲醇为过滤除菌,4℃保存。
BMGY (g/L):酵母提取物10,胰蛋白胨 20,KH2PO412,K2HPO43,YNB 13.4, 生物素 0.5, 甘油10;其中YNB、生物素为过滤除菌,4℃保存。
YPD液体培养基(g/L):酵母提取物10,胰蛋白胨 20,葡萄糖20;4℃保存。
MD(g/L):YNB 13.4,生物素 0.5,葡萄糖 20,琼脂15;4℃保存。
RDB 培养基(g/L):YNB 10,葡萄糖20,生物素0.2,氨基酸0.5;1 mol/L山梨醇。
100×AA (5%各种氨基酸): 分别溶解 500 mg L-谷氨酸,L-蛋氨酸,L-赖氨酸,L-亮氨酸,L-异亮氨酸于 100 mL水中,过滤除菌,存于 4℃,可放 1年。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,添加3 g琼脂粉于200 mL LB即为固体培养基。
1 mol/L山梨醇:18.2 g D-山梨醇溶于100 mL去离子水,过滤除菌,4℃保存。
木聚糖-刚果红筛选平板:0.5 g/dL木聚糖,1.5 g/dL琼脂,0.05 mol/L柠檬酸缓冲液。
刚果红染色液1 g/dL,NaCl洗脱液1 mol/L。
1.3 重组质粒pPIC9K-X1-19的构建
1.3.1 PCR扩增带酶切位点的基因X1-19 综合考虑pPIC9K载体的多克隆位点(MCS)上的限制酶位点和X1-19xynA序列,选择EcoRⅠ和Not I两个限制酶位点。设计引物,在上游引入EcoR I,下游引入Not I,由北京奥科鼎盛生物科技有限公司合成。引物序列见表1。

表1 含EcoRⅠ、NotⅠ酶切位点的引物序列Table 1 Primers with restriction sites
分别用限制性内切酶EcoR I和Not I酶切载体pPIC9K和含EcoR I、Not I酶切位点的基因片段X1-19xynA,37℃反应16 h。反应结束后在1 g/dL琼脂糖凝胶上电泳检测,切胶回收目的片段。用T4 DNA连接酶连接带有粘性末端的基因片段X1-19xynA 和线性化的载体 pPIC9K(摩尔比 3∶l),16 ℃连接12 h。并将连接反应体系热击转化大肠杆菌DH5α,将重组的质粒pPIC9K-xynA转入大肠杆菌DH5α,提取质粒,PCR筛选阳性克隆。
1.3.2 线性化重组质粒pPIC9K-xynA 为了提高重组质粒在毕赤酵母染色体上的整合效率,有利于酵母转化子的表型筛选,可在重组质粒转化毕赤酵母之前,将构建好的重组表达载体线性化处理[9]。选用限制酶Bgl II线性化重组表达载体pPIC9K-xynA,电泳检测,切胶回收线性化重组质粒pPIC9K-xynA,-20℃保存备用。
1.3.3 电击转化重组毕赤酵母 取1~5 μg线性重组质粒与100 μL毕赤酵母感受态细胞轻轻混匀,转入预冷的无菌电击杯(0.2 cm型)中。轻缓敲击电击杯,使混合物沉入电击杯底部,冰上静置5 min。在电击仪(BioRad)进行重组毕赤酵母电击转化操作。调整电击转化仪配置,电压1.5 kV,电容25 μF,电阻400 Ω,充电完成后电击转化毕赤酵母。迅速向电击杯中加入1 mL冰上预冷的1 mol/L山梨醇,混匀后立即涂布于RDB平板。30℃培养箱倒置培养,至转化子出现。将RBD平板上生长的转化子转接到MD培养基中通过组氨酸缺陷筛选阳性转化克隆子,然后将阳性克隆子重新涂布于RDB平板上,于30℃培养箱倒置培养。
1.4 高产木聚糖酶转化子的筛选
将RDB平板上重新培养的阳性转化克隆子用无菌水洗下并稀释至细胞密度为105/mL,涂布在不同质量浓度遗传霉素 G418(0.25、0.50、1.00、1.50、2.00、3.00、4.00、6.00 mg/mL)的 YPD 平板上进行目的基因的高拷贝克隆子逐级筛选。将G418抗性筛选得到的转化子发酵培养,用DNS法测定酶活,筛选出酶活性较高的转化子。通过实验得知转化子3为目的基因的高拷贝克隆子,其所表达的木聚糖酶活性较高。
1.5 重组木聚糖酶产酶优化
为了提高转化子3产木聚糖酶的活力,设计单因素优化实验,对影响毕赤酵母产酶的主要因素:接种量、甲醇终体积分数、初始pH、YNB质量分数和转速条件进行考察,确定最佳的发酵产酶条件。
1.5.1 甲醇添加终体积分数对转化子产酶的影响将转化子3进行诱导产酶,当菌体浓度达到4×108个/mL时,离心除去BMGY菌体富集培养基,然后加入同体积的诱导产酶培养基BMMY,30℃、200 r/min培养,加入诱导产酶培养基BMMY后每隔24小时取样1 mL备用,并同时补加1 mL不同体积分数的甲醇溶液,使发酵体系在9 d中甲醇添加体积分数始终分别保持为0.5%、1%、1.5%、2%、2.5%,以确定最佳的甲醇添加终体积分数。
1.5.2 细胞初始浓度对转化子产酶的影响 对转化子3进行诱导产酶,甲醇终体积分数参考1.5.1得到的最佳条件。用BMGY培养基培养至菌体浓度达 10×108个/mL 时,再进行梯度稀释得到 2×108、4×108、6×108、8×108、10×108个/mL 一系列浓度的菌体,分别离心去除BMGY培养基,然后用相同体积的BMMY培养基重悬不同浓度的菌体,30℃、200 r/min诱导培养9 d,每天取样1 mL测定甲醇体积分数,并补充甲醇的消耗量,确定最佳的细胞初始浓度。
1.5.3 YNB质量分数对转化子产酶的影响 按方法1.5.1和1.5.2确定的最佳甲醇添加量和初始细胞浓度对转化子3进行诱导产酶。YNB终质量分数分别设置为 0.4%、0.8%、1.2%、1.6%、2%,30℃、200 r/min诱导培养9 d,每天取样1 mL测定甲醇体积分数,并补充甲醇的消耗量,确定最佳的YNB质量分数。
1.5.4 转速对转化子产酶的影响 在最佳甲醇添加量、最佳初始细胞浓度和最佳YNB质量分数下,转速分别设置为 180、200、220、240、260 r/min,其他条件相同,30℃诱导培养9 d,每天取样1 mL测定甲醇体积分数,并补充甲醇的消耗量,确定最佳的转速条件。
1.5.5 pH值对转化子产酶的影响 使用前面已确定的最佳发酵条件,用不同比例的KH2PO4和K2HPO4调节诱导培养基BMMY初始pH值分别为4、5、6、7、8,其他条件相同,30 ℃诱导培养 9 d,每天取样1 mL测定甲醇体积分数,并补充甲醇的消耗量,确定最佳的初始诱导pH值。
2 结果与讨论
2.1 PCR扩增带酶切位点的基因xynA
按照1.3.1方法,PCR获得大小约为1 000 bp的片段,与X1-19木聚糖酶基因理论大小1 047 bp大小相同,见图1。
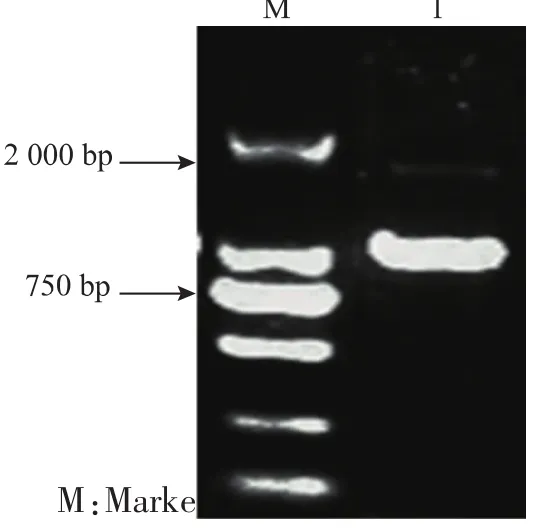
图1 木聚糖酶基因X1-19琼脂糖凝胶电泳Fig.1 X1-19 xynA from soil-derived metagenomic library
2.2 重组质粒pPIC9K-X1-19的构建
重组质粒pPIC9K-X1-19转入大肠杆菌DH5α后进行质粒PCR验证,结果见图2。克隆子1-4均为阳性克隆子。阳性克隆子扩大培养,按照方法1.3.2酶切验证,结果见图 3。 泳道 1、2、3、4分别代表了空载体pPIC9K、重组表达载体pPIC9K-X1-19双酶切后的片段及目的基因X1-19片段。结合图1—3,可知目的基因已成功克隆到表达载体pPIC9K,实现了重组质粒pPIC9K-X1-19的构建。
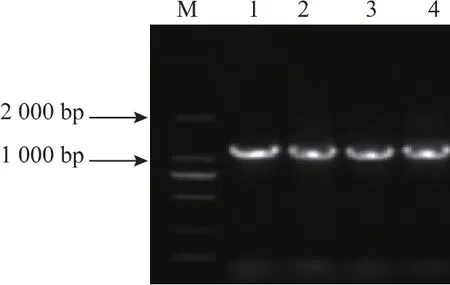
图2 质粒PCR结果Fig.2 Result of plasmid PCR
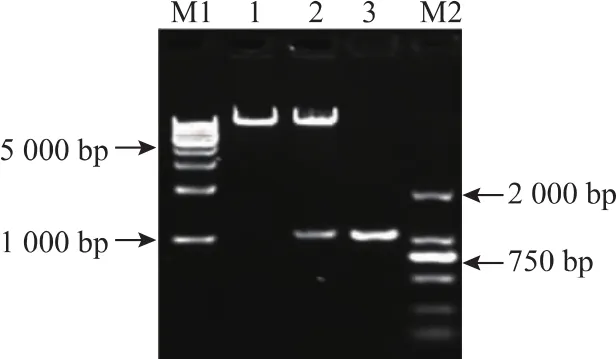
图3 重组质粒pPIC9K-X1-19验证电泳图Fig.3 Result of enzymatic digestion of pPIC9K-X1-19
2.3 毕赤酵母GS115高产菌株筛选
2.3.1 G418抗性筛选 重组表达载体pPIC9KX1-19用Bgl II线性化后含有目的基因X1-19的条带,参考1.3.3方法电击转入毕赤酵母。随后涂布于RDB平板上培养3 d,平板上出现大量His+转化子菌落。转化子的拷贝数与抗G418的能力有关,通过筛选抗G418能力强的酵母即可获得高拷贝转化子。
挑选在含3.0 mg/mL G418的平板上生长的转化子,再依次经含有4.0、6.0 mg/mL G418的平板进一步筛选,最终从含有6.0 mg/mL G418的YPD平板上获得3个转化子,经MM、MD平板鉴定,它们均为甲醇快速利用型(Mut+)。
2.3.2 摇瓶发酵复筛 将初筛得到的3个转化子按照1.2培养基进行培养,每天取样测酶活,发现发酵216 h时酶活最高。经过复筛,3个转化子诱导产酶216 h酶活测定,结果见图4。其中以转化子3产酶能力最高,为(27.9±0.7) U/mL。
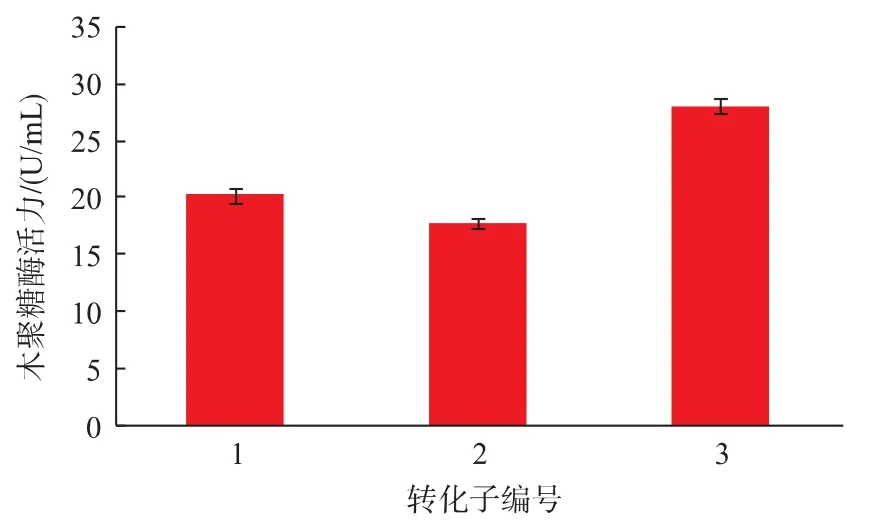
图4 高效产酶转化子筛选结果Fig.4 Transformations of high expression of xylanase
2.4 甲醇添加终体积分数对转化子产酶的影响
甲醇体积分数对工程菌细胞的生长和表达都有影响。一方面,甲醇体积分数过低会使细胞生长所需要的营养物质得不到满足,进而影响生物量的积累和外源蛋白质的表达;另一方面,甲醇体积分数过高会对细胞有毒害作用,不利于菌体的生长和蛋白质的生成,并加速已生成蛋白质的降解[10]。因此,确定最佳的甲醇体积分数有利于工程菌酵母细胞产酶。
作者设置了5个甲醇添加终体积分数梯度,为0.5%~2.5%,在30℃、200 r/min条件下培养并诱导产酶,比较转化子3的产酶能力,结果见图5。当甲醇添加体积分数为1.0%时,转化子3的酶活达到最高,为(40.3±0.9)U/mL。随着甲醇体积分数的提高,产酶能力逐渐下降。
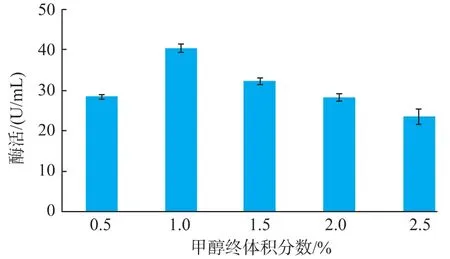
图5 甲醇终体积分数对转化子3产酶的影响Fig.5 Effect of methnol concentration on enzyme yield of transformation 3
2.5 接种密度对转化子产酶的影响
接种密度对重组毕赤酵母产酶的影响也很大。通常较大的接种密度可以缩短生长周期,较快达到产酶高峰期,促使产物的合成提前到来,但如果接种密度过大,会造成前期生长过快,有可能会抑制发酵过程中酶的合成与分泌,同时造成菌体过早衰减,从而影响酶活力。如果接种密度过小,则生长周期延长,不利于快速产酶,因此确定毕赤酵母的最佳接种密度有利于木聚糖酶的高效表达。
不同接种密度对转化子3的产酶影响见图6。最佳的接种密度是8×108个/mL。之后,随着接种密度的增加,木聚糖酶活逐渐降低,这是因为接种密度过大,菌体需要的营养成分不足,导致菌体过早衰减,产酶能力下降[11]。Jun He[12]等人的研究表明,当接种密度为3×108个/mL时,酶活最高。
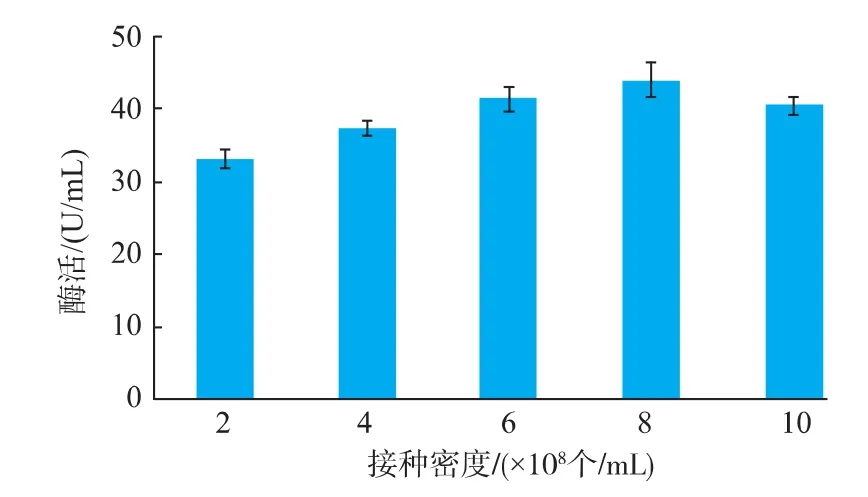
图6 接种密度对转化子3产酶的影响Fig.6 Effect of initial cell concentration on enzyme yield of transformation 3
2.6 YNB质量分数对转化子产酶的影响
培养基中氮源的含量及成分会影响木聚糖酶的合成和分泌。不同菌株来源的木聚糖酶基因在真核工程菌毕赤酵母中异源表达时,对氮源的需求各不相同。无氨基氮源YNB中含有多种维生素、微量元素和部分无机盐,为毕赤酵母生长提供营养成分,是培养基中不可或缺的成分,对细胞的生长代谢影响很大。不同YNB质量分数下毕赤酵母3产酶情况见图7。当YNB的质量分数为1.2%时,发酵液中的酶活达到最高,为(57.4±1.7) U/mL。
2.7 转速对转化子产酶的影响
毕赤酵母在代谢甲醇过程中会消耗大量的氧气,如果转速过低,会导致发酵液中的溶氧过低,则甲醛异化途径将甲醇代谢为甲醛之后,不能有效地将甲醇消耗为二氧化碳和水,而会积累甲醇及其代谢产物过氧化氢和甲醛,对菌体产生毒害作用[13]。如果转速过高,则细胞间的剪切力过大,会导致细胞结构受到损害裂解死亡[14]。因此,选择合适的转速,保证菌体的正常需氧量而又不损害细胞,可以提高工程菌表达外源基因的蛋白质量。
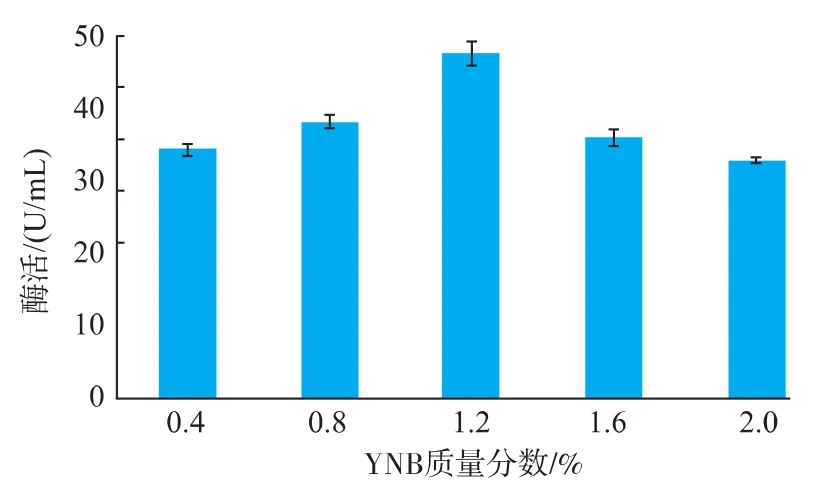
图7 YNB质量分数对转化子3产酶的影响Fig.7 Effect of YNB concentration on enzyme yield of transformation 3
不同转速下转化子3的产酶情况见图8。随着转速的增加,转化子3产酶量显著提高。转速为240 r/min时的酶活最高,之后随着转速的进一步增加,酶活力降低,表明较高的转速和较低的转速均不利于转化子3产酶。Jun He[24]等研究表明,当转速为250 r/min时,曲霉来源的第十一家族木聚糖酶基因在毕赤酵母中产酶最高。
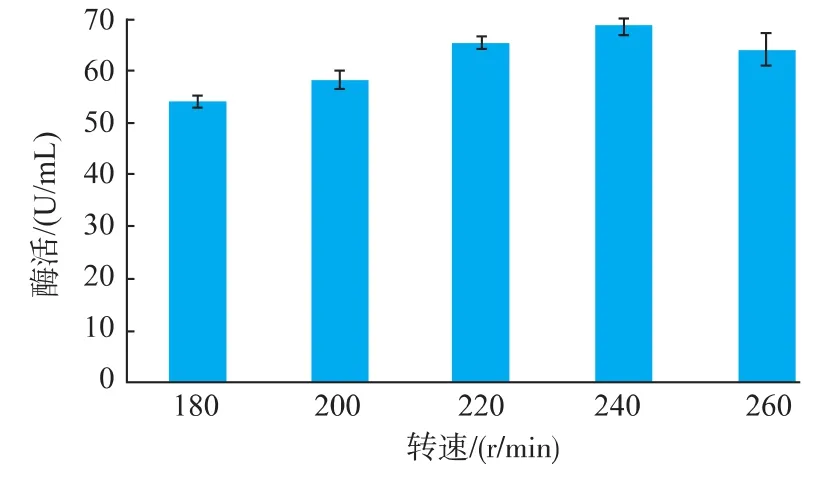
图8 转速对转化子3产酶的影响Fig.8 Effect of rotate speed on enzyme yieldof transformation 3
2.8 pH对转化子产酶的影响
培养基的pH也是影响菌体生长和蛋白质分泌表达的重要因素。不同微生物生长的最适pH不同,同一种微生物在不同pH条件下生长速度和体内代谢产物的生成速度也不同,在不同生长时期所需要的最适pH也有所差异。为了获得最佳的产酶条件,选择适合菌株产酶的最佳pH必不可少。毕赤酵母在弱酸性条件下可以正常生长,但在甲醇诱导阶段培养基的pH对菌株的产酶过程起着重要的作用,因此,本研究中生长培养基的初始pH设置为6,诱导培养基的初始 pH 分别设为 4、5、6、7、8 五个梯度,通过甲醇诱导产酶,结果见图9。当培养基的初始pH为5的时候,转化子的产酶能力最强,为(79.0±2.2)U/mL。过低或者过高的pH都不利于菌株产酶。

图9 pH值对转化子3产酶的影响Fig.9 Effect of pH on enzyme yield of transformation 3
3 结 语
通过未培养的木聚糖酶基因异源构建重组毕赤酵母产木聚糖酶X1-19,筛选得到酶活较高的转化子3并对重组酶进行了产酶条件的优化,其最佳产酶条件为:甲醇添加终体积分数为1.0%,接种体积分数为8×108个/mL,YNB的质量分数为1.2%,转速为240 r/min,初始pH为5时,转化子产酶能最高为(79.0±2.2) U/mL。
[1]BHALLA A,BISCHOFF K M,UPPUGUNDLA N,et al.Novel thermostable endo-xylanase cloned and expressed from bacterium Geobacillus sp.WSUCF1[J].Bioresource Technology,2014,165:314-318.
[2]BAO Yihong,LIU Weifeng,DONG Zhiyang.Studies on the overexpression of alkali-tolerant xylanase in bacillus pumilus[J].Journal of Chinese Institute of Food Science and Technology,2008,8(55):37-43.(in Chinese)
[3]PARACHIN N S,SIQUEIRA S,FARIA F P,et al.Xylanases from Cryptococcus flavus isolate I-11:enzymatic profile,isolation and heterologous expression of CfXYN1 in Saccharomyces cerevisiae[J].Journal of Molecular Catalysis B:Enzymatic,2009,59:52-57.
[4]BIRIJLALL N,MANIMARAN A,KUMAR K S,et al.High level expression of a recombinant xylanase by Pichia pastoris NC38 in a 5 L fermenter and its efficiency in biobleaching of bagasse pulp[J].Bioresource Technology,2011,102(20):9723-9729.
[5]DAMASCENO L M,HUANG C J,BATT CA.Protein secretion in Pichia pastoris and advances in protein production[J].Appl Microbiol Bioethanol,2012,93:31-39.
[6]JAHIC M,ROTTICCI M J C,MARTINELLE M et al.Modeling of growth and energy metabolism of Pichia pastoris producing a fusion protein[J].Bioprocess and Biosystems Engineering,2002,24:385-393.
[7]仲伟麟.里氏木霉木聚糖酶基因的克隆及其在毕赤酵母中高效表达的研究[D].哈尔滨:东北农业大学,2008:21-55.
[8]林小琼.基于iTRAQ技术的高效表达木聚糖酶重组毕赤酵母细胞的蛋白组学研究[D].广州:华南理工大学,2013:31-56.
[9]苏玉春.木聚糖酶的酶学特性及基因克隆表达研究[D].长春:吉林农业大学,2008:48-49.
[10]BOZE H,CELINE L.High-level secretory produciton of recombinant procine follcine follicle-stimulating hormone by Pichia pastoris[J].Process biochemistry,2001,36:907-913.
[11]KAPOOR,NAIR M L,KUHAD R.Cost-effective xylanase production from free and immobilized Bacillus pumilus strain MK001 and its application in saccharification of Prosopis juliflora[J].Biochemical Engineering Journal,2008,38:88,97.
[12]HE Jun,YU Bing,ZHANG Keying,et al.Expression of a Trichoderma reesei b-xylanase gene in Escherichia coli and activity of the enzyme on fiber-bound substrates[J].Protein Expression and Purification,2009,67:1-6.
[13]LIN Junhan.High density fermentation control of Pichia pastoris[J].China Biotechnology,2009,29(5):120-125.(in Chinese)
[14]LI Xiuting,SHE Yuanli,SUN Yun,et al.Optimization of xylanase production by streptomyces F0107 under submerged fermentation[J].Transactions of the Chinese Society for Agricultural Machinery,2009,40(7):175-179.(in Chinese)
