牛血清蛋白磁性壳聚糖微球谷氨酸改性吸附
2018-01-18李林强王瑞琴
万 威, 李林强, 王瑞琴
(陕西师范大学 食品工程与营养科学学院,陕西 西安710119)
我国的动物血资源极其丰富,每年约在2.3×106t以上,除少部分提取物得到利用外,大部分被废弃掉,既浪费资源又污染环境[1-2]。牛血清蛋白(BSA)是牛血浆中最丰富的蛋白质,具有许多重要的生理功能,常用于生物、医药和保健食品等领域,对其进行快速高效的分离纯化广受关注[3-4]。磁性微球分离、富集BSA是一种新兴技术,其易操作、效率高、成本低、易再生等优点[5-6]。壳聚糖是甲壳素脱乙酰基产物,作为碱性多糖其羟基、氨基含量丰富,易于通过化学修饰赋予多种功能[7],由壳聚糖包覆磁性粒子制成的磁性壳聚糖微球兼有壳聚糖无毒与生物相容性好的特点[8],但其对BSA吸附量较小,需对其进行改性以提高其吸附效果。通过在微球上连接羧基使其表面带负电荷,以提高其吸附能力,一直是研究的热点之一[9-14]。L-谷氨酸具有安全无害、廉价易得、不造成污染等优点,已广泛应用于食品行业,其所含氨基基团能够在弱碱条件下通过环氧氯丙烷与壳聚糖上的-NH2、-OH以共价键的方式结合,同时引入两分子的羧基基团。
作者采用反相悬浮法制备磁性壳聚糖微球,并通过环氧氯丙烷交联谷氨酸与磁性壳聚糖微球,探讨溶液pH值、BSA质量浓度、吸附时间等因素对BSA吸附效果的影响,并考察微球的可重用性,以期对磁性分离技术用于牛血清蛋白的分离回收提供一种便捷的新途径。
1 材料与方法
1.1 主要试剂
壳聚糖(脱乙酰率≥90.0%)、L-谷氨酸:购于上海蓝季科技发展有限公司;牛血清蛋白:购于美国Amresco公司;Span-80、液体石蜡:化学纯;其他试剂均为分析纯。
1.2 仪器与设备
Quanta 200环境扫描电子显微镜:FEI公司;Tensor27红外光谱仪:德国Bruker公司;MS2000激光粒度分析仪:英国马尔文仪器公司;TU-1810紫外可见分光光度计:北京普析通用公司;KQ-250DB型数控超声波清洗器:昆山市超声仪器有限公司;雷磁PHS-3C酸度计:上海精密科学仪器公司;D2F-6020型真空干燥箱:上海精宏实验设备有限公司。
1.3 方法
1.3.1 磁性壳聚糖微球的合成及谷氨酸改性 根据文献[15]制备壳聚糖包覆Fe3O4磁性微球的方法并加以改进,采用反相悬浮法制备磁性壳聚糖微球[16-17],并连接谷氨酸[18-19]。用3%的盐酸配置60 mL质量分数3%壳聚糖溶液,加入100 mL FeCl3溶液(0.15 mol/L)超声使其彻底混合均匀,在机械搅拌下加入 30 mL NaHSO3(0.1 mol/L)溶液,当溶液由黄色变为红色再次变成黄色的瞬间用12%的氨水调节pH至11,70℃剧烈搅拌2 h后磁铁吸附收集,用去离子水洗涤多次后加入3%的盐酸使其再次溶解,得到磁性壳聚糖盐酸溶液。
在40℃恒温水浴条件下,加入200 mL液体石蜡和8 mL Span-80于500 mL烧瓶,机械搅拌混匀后,加入40 mL磁性壳聚糖盐酸溶液,剧烈搅拌1 h,加入5 mL 25%戊二醛继续搅拌1 h。将0.4 g谷氨酸、2 mL环氧氯丙烷、适量DMF和5 mL Na2CO3(0.5 mol/L)溶液于40℃搅拌活化1 h后滴加到烧瓶中。60℃剧烈搅拌3 h,产物用去离子水、无水乙醇、石油醚、丙酮反复多次冲洗,用磁铁吸附分离于60℃真空干燥24 h。使用红外光谱仪(IR)检测壳聚糖包覆Fe3O4效果、壳聚糖与谷氨酸的连接效果;使用扫描电子显微镜(SEM)观察GA-CMNs形貌;使用激光粒度仪检测GA-CMNs的粒径分布情况。
1.3.2 GA-CMNs对BSA的吸附容量 准确称量0.010 g GA-CMNs加入一定质量浓度的BSA溶液,25℃恒温水浴振荡(120 r/min)一段时间。通过磁铁吸附分离磁性微球,测定上清液在UV278 nm[13]吸光度值,并利用测定吸光度标准曲线计算BSA的初始和最终质量浓度,利用下式计算吸附容量:

式中,c0为初始BSA质量浓度 (mg/mL);c1为吸附后BSA质量浓度 (mg/mL);V为溶液的体积,mL;m为 GA-CMNs的质量(g);Qe为吸附容量(mg/g)。
1.3.3 不同pH值溶液对BSA吸附量的影响 称取10 mg的GA-CMNs,加入到4 mL pH值分别为4.0、5.0、6.0、7.0、8.0、9.0 质 量 浓 度 为 1 mg/mL 的BSA溶液中,25℃恒温水浴振荡100 min后分离,测定并计算吸附量,采用0.05 mol/L CH3COONa-CH3COOH缓冲液控制pH 4.0~6.0;采用0.05 mol/L Tris-HCl缓冲液控制 pH 7.0~9.0。
1.3.4 NaCl质量分数对BSA吸附量的影响 配置BSA质量浓度为1 mg/mL,称取10 mg的GA-CMNs加入到4 mL含不同NaCl质量分数(分别为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%的 NaCl溶液)的 BSA溶液中,其余操作同上,测量并计算吸附量。
1.3.5 吸附时间对BSA吸附量的影响 称取50 mg GA-CMNs,加入20 mL质量浓度为1 mg/mL BSA溶液中,120 min内每10分钟取上清液测定并计算吸附量。
1.3.6 初始BSA质量浓度对BSA吸附量的影响称取10 mg GA-CMNs,加入4 mL质量浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.5、2.0 mg/mL 的 BSA 溶液中,pH值设置为5.0,吸附时间为100 min,测定并计算吸附量。
1.3.7 GA-CMNs的再生 取10 mg GA-CMNs将其饱和吸附BSA后,分离后用选取的NaCl溶液在室温条件下于120 r/min振荡30 min后,磁铁吸附分离,取上清液在UV278 nm测定并用下式计算洗脱率:
洗脱率(%)=cV2/(c0-ce)V1×100%
式中c为洗脱液中 BSA的质量浓度(mg/mL);V2为洗脱液的体积 (mL);c0为初始BSA质量浓度(mg/mL);ce为吸附后溶液中 BSA的质量浓度(mg/mL);V1表示加入的 BSA的体积(mL)。
2 结果与讨论
2.1 GA-CMNs的表征
图1解析结果表明,壳聚糖(a)中3 455 cm是O-H和N-H的伸缩振动峰,2 923 cm-1和2 853 cm-1的强峰属于CH伸缩聚合物骨架的振动,而在约1 073 cm-1和1 487 cm-1分别是C-O和壳聚糖环贡献的伸缩振动峰。壳聚糖改性微球(b)中588 cm-1峰,属于Fe-O伸缩振动。a中的1 644 cm属于伯胺(-NH2)的变形振动,在b中消失,出现1 618 cm-1仲胺的振动吸收峰;此外在b中可以观察到在1 402 cm-1来自R-CH2-COOH的CH伸缩振动和1 718 cm-1饱和C=O的伸展吸收峰,并且位于3 650~3 200 cm-1O-H伸缩的吸收峰变宽,进一步说明分子中存在羧基。由此红外光谱图可以说明谷氨酸成功交联到磁性壳聚糖微球上。
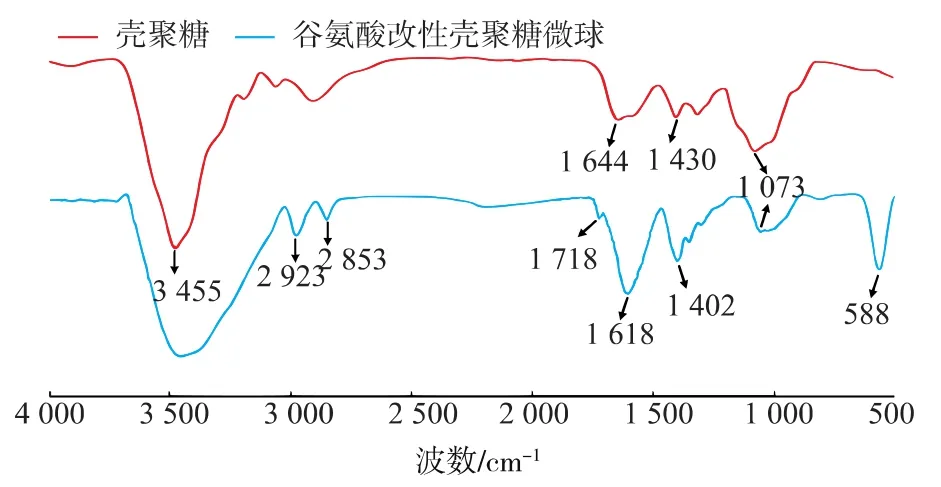
图1 壳聚糖和谷氨酸改性壳聚糖微球的红外光谱Fig.1 FT-IR spectrum of chitosan and GA-CMNs
由图2(a)可见,在扫描电子显微镜下可见GACMNs为类球形结晶,表面较光滑且形状规则,粒径为 5~20 μm;由激光粒度仪测的数据图 2(b)可见,显示有40%的微球粒径小于20 μm,已达到微米级。

图2GA-CMNs的形貌图(a)和GA-CMNS的粒度分布图(b)Fig.2 MicroscopicmorphologyofGA-CMNsand particle size distribution of GA-CMNs
2.2 BSA溶液标准曲线测定
准确称取0.200 g BSA,用pH 5.0的缓冲溶液溶解,配制成2 mg/mL的BSA标准溶液,再稀释成一系列标准浓度,用紫外可见分光光度计扫描,得到最大吸收波长为 278 nm,与文献[11]报道一致。以质量浓度为横坐标,吸光度为纵坐标,绘制得到标准曲线。结果表明,在 0~2.0 mg/mL范围内其吸光度A与质量浓度c线性关系良好,拟合方程为A=0.613 8c+0.012 1,R2=0.999 2。
2.3 溶液pH值对BSA吸附量的影响
由图3可见,未改性微球对BSA吸附量随着pH值的改变化不大,而GA-CMNs对BSA最大吸附量出现在pH 5.0,接近BSA等电点[20]。因为在等电点时,BSA呈电中性,BSA分子间斥力最小[21];pH在5.0以上,GA-CMNs上羧基以COO-形式存在,pH低于 5.0,GA-CMNs和牛血清蛋白的胺基为NH3+,不利于氢键的形成[22]。因此,在 pH 5.0 时,GACMNs对BSA的吸附量达到最大值。

图3 pH对吸附效果的影响Fig.3 Influence of pH on adsorption of BSA
2.4 NaCl质量分数对BSA吸附量的影响
由图4可见,GA-CMNs对BSA的吸附量随着NaCl质量分数的增加逐渐减小。当NaCl质量分数增加到0.5%,BSA的吸附量下降约20%;当NaCl质量分数增加到1%,吸附量下降约50%,表明BSA吸附量受NaCl质量分数影响显著。可能由于NaCl质量分数的增加,溶液离子氛围增强使得蛋白质分子间静电斥力增大,导致迁移速度减慢;并且吸附剂结合空间位阻与静电斥力的增加,影响BSA分子构象,破坏了GA-CMNs与BSA分子间的静电作用,仅靠范德华力与BSA分子结合,导致吸附效果明显下降[22]。
用Lagergren一级吸附速率方程和二级吸附速率方程[23]进行拟合分析,拟合所得方程分别为y=-0.033 5x+2.005 9和y=0.011x+0.065 7,决定系数(R2)分别为0.958 2和0.994 1说明准二级动力学模型更能反映GA-CMNs对BSA的吸附过程。

图4 NaCl质量分数对吸附效果的影响Fig.4 Influence of ionic strength on the adsorption of BSA
2.5 吸附时间对BSA吸附量的影响
由图5可见,在前30分钟内随着时间的延长,GA-CMNs对BSA的吸附量显著增大(p<0.05)。而40 min之后吸附量无显著变化(p>0.05),表明在40 min左右达到吸附平衡。结果表明,GA-CMNs表面结合点在经过一段时间吸附占用后,剩余吸附结合位点较难被利用,表明其对BSA的吸附可能是单层覆盖。

图5 吸附时间对BSA吸附量的影响Fig.5 Influence of adsorption time on the adsorption of BSA
2.6 不同BSA质量浓度对吸附量的影响
由图6可见,GA-CMNs对BSA的吸附量随着BSA溶液质量浓度的增大显著增加(p<0.05),最大平衡吸附量出现在BSA质量浓度为1 mg/mL附近,再增大BSA的质量浓度,吸附量变化不大,最大吸附量为83.5 mg/g。
用 Langmuir方程和Freudlich方程[24]进行拟合分析,所得决定系数(R2)分别为0.997 7和0.975,结果表明单层吸附为主的Langmui模型拟合方程的决定系数比Freundlich模型拟合方程的决定系数高,表明GA-CMNs对BSA的吸附以单分子层为主。

图6 BSA初始质量浓度对吸附量的影响Fig.6 Influence of initial concentration of BSA on its adsorption
2.7 GA-CMNs的再生
当溶液NaCl质量分数为3%时,GA-CMNs对BSA的吸附量下降了约80%,而继续加大NaCl质量分数,吸附量下降不明显,故选取质量分数为3%的NaCl溶液作为洗脱剂。经过5次吸附-洗脱循环,洗脱率仍大于90%,重复吸附量基本不变,表明GA-CMNs具有很好的重复使用性。
3 结语
以廉价易得的试剂为原料[9-10]在温和的条件[11-14]合成谷氨酸改性磁性壳聚糖微球。并以BSA为目标蛋白质,研究了GA-CMNs对BSA的吸附情况,考察pH值、NaCl质量分数、时间、BSA初始质量浓度等条件对其吸附效果的影响,并对GA-CMNs的再生进行了研究。
红外图谱分析结果表明,谷氨酸成功地交联在磁性壳聚糖微球的表面。扫描电子显微镜下观察到GA-CMNs为表面较光滑、形状规则的类球形结晶,粒径为5~20 μm,由激光粒度仪检测结果显示,粒径小于20 μm占总体积的40%左右。在25℃时GA-CMNs对BSA最佳吸附条件:pH值为5,BSA质量浓度为1 mg/mL,饱和吸附时间为40 min,吸附量为83.5 mg/g左右。其对BSA吸附平衡过程符合准二级动力学方程和Langmuir吸附等温线模型。
用3%的NaCl溶液作为洗脱剂,洗脱率为97.2%,经过5次吸附-洗脱循环,洗脱率均大于90%,重复吸附量基本不变,表明GA-CMN吸附洗脱性能良好。该方法制备过程简单、成本低廉、洗脱率高,具有潜在的应用价值,为进一步研究动物血液中血清蛋白回收等方面的应用提供参考。
[1]GUO Ling,LIU Aiguo,HU Zhihe.Research advancesin main proteinsin bovine blood plasma[J].Food Science,2009,30(21):489-492.(in Chinese)
[2]DENG Li,LIU Zhangwu,DU Jinping.Current research and development of animal blood extract activity[J].Food Science,2010,31(21):455-458.(in Chinese)
[3]MARGARSON M P,SONI N.Serum albumin:touchstone or totem[J].Anaesthesia,1998,53(8):789-803(15).
[4]BRAHMA A,MANDAL C,BHATTACHARYYA D.Characterization of a dimeric unfolding intermediate of bovine serum albumin under mildly acidic condition[J].Biochimica Et Biophysica Acta,2005,1751(2):159-169.
[5]WEIT,KAEWTATHIPS,SHINGK.Buffereffectonproteinadsorptionatliquid/solidinterface[J].Journal of Physical Chemistry C,2009,113(6):2053-2062.
[6]SAFARIK I,SAFARIKOVA M.Magnetic techniques for the isolation and purification of proteins and peptides[J].Biomagnetic Research&Technology,2004,2(1):7.
[7]KUMAR M N V R,MUZZARELLI R A A,MUZZARELLI C,et al.Chitosan chemistry and pharmaceutical perspectives[J].Chemical Reviews,2004,104(11):6017-6084.
[8]SONG Yanyan,KONG Weibao,SONG Hao,et al.Reseach progress in magnetic chitosan microspheres[J].Chemical Industryand Engineering Progress,2012,31(2):345-354.(in Chinese)
[9]LI G Y,JIANG H Y R.Preparation and characterization of carboxyl functionalization of chitosan derivative magnetic nanoparticles[J].Biochemical Engineering Journal,2008,40(3):408-414.
[10]MALEKI A,PAJOOTAN E,HAYATI B.Ethyl acrylate grafted chitosan for heavy metal removal from wastewater:equilibrium,kinetic and thermodynamic studies[J].Journal of the Taiwan Institute of Chemical Engineers,2015,51:127-134.
[11]DENG Jun,LI Mingchun,XIN Meihua,et al.Adsorption of bovine serun albumin on chitosan microspheres modified by α-ketoglutaric acid[J].Chemical Industry and Engineering Progress,2008,27(12):1991-1995.(in Chinese)
[12]LEE S Y,AHN C Y,LEE J,et al.Amino acid side chain-like surface modification on magnetic nanoparticles for highly efficient separation of mixed proteins[J].Talanta,2012,93(2):160-165.
[13]ZHOU Y T,NNE H L,BRANFORD W C,et al.Removal of Cu2+from aqueous solution by chitosan-coated magnetic nanoparticles modified with alpha-ketoglutaric acid[J].Journal of Colloid&Interface Science,2009,330(1):29-37.
[14]WU Zhichao,CHEN Guo,SU Pengfei,et a1.Adsorption properties of bovine serum albumin on carboxyl-functioned superparamagnetic nanoparticle[J].Journal of Huaqiao University:Natural Science,2015,51:127-134.(in Chinese)
[15]CAO C,XIAO L,CHEN C,et al.In situ preparation of magnetic Fe3O4/chitosan nanoparticles via a novel reduction-precipitation method and their application in adsorption of reactive azo dye[J].Powder Technology,2014,260(7):90-97.
[16]LIZ.Affinityadsorption oflysozyme with Reactive Red 120 modified magnetic chitosan microspheres[J].Food Chemistry,2014,145(6):749-755.
[17]XIE Yu,WEI Ya,LI Mingjun,et al.Preparation and characterization of magnetic chitosan compound microspheres[J].Materials for Mechanical Engineering,2009,33(12):59-61.(in Chinese)
[18]LIU Manying,PEI Zhene,LI Junliang,et al.Adsorption of chitosan beads modified with phenyl,alanine,tryptophan for cholesterol[J].Ion Exchange and Adsorption,1999,15(1):90-94.(in Chinese)
[19]洪爱真.胺基化壳聚糖微球吸附阴离子偶氮染料的研究[D].福州:福建师范大学,2003.
[20]HE Rui,WANG Yang,CAO Guangqun,et al.Adsorption of bovine serum albuminon polystyrene functional microsphere[J].Petrochemical Technology,2007,36(7):731-734.(in Chinese)
[21]HAN J,SILCOCK P,JAMES McQuillan A,et al.Bovine serum albumin adsorption on N-methyl-d-glucamine modified colloidal silica[J].Colloids&Surfaces A Physicochemical&Engineering Aspects,2009,349(349):207-213.
[22]SU Lizheng,LI Mingchun,XIN Meihua,et al.Study on adsorption of bovine serun albumin on crosslinked hitosan microsphere[J].Technology&Development of Chemical Industry,2008,37(7):4-8.(in Chinese)
[23]YANG W,DING P,ZHOU L,et al.Preparation of diamine modified mesoporous silica on multi-walled carbon nanotubes for the adsorption of heavy metals in aqueous solution[J].Applied Surface Science,2013,282(10):38-45.
[24]ZHOU Y T,NIE H L,BRANFORD W C,et al.Removal of Cu2+from aqueous solution by chitosan-coated magnetic nanoparticles modified with alpha-ketoglutaric acid[J].Journal of Colloid&Interface Science,2009,330(1):29-37.
